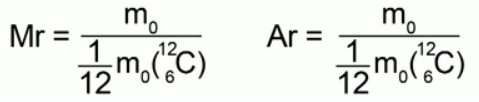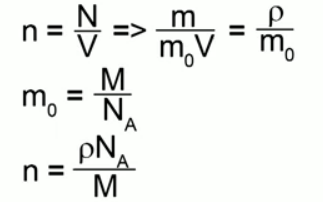Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
- Подробности
- Обновлено 07.10.2018 21:04
- Просмотров: 1193
МКТ — это просто!
«Ничто не существует, кроме атомов и пустого пространства …» — Демокрит
«Любое тело может делиться до бесконечности» — Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ — это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела — это большие тела, состоящие из огромного числа молекул.
Тепловые явления — явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
— механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
— диффузия; броуновское движение частиц в жидкости под ударами молекул;
— плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
— фотографирование, определение размеров частиц.
Броуновское движение
Броуновское движение — это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
— открыто английским ботаником Р. Броуном в 1827 г.
— дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
— экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.
Число молекул в веществе
где V — объем вещества, Vo — объем одной молекулы
Масса одной молекулы
где m — масса вещества,
N — число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина — относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель — это масса молекулы, а знаменатель — 1/12 массы атома углерода
— это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
где числитель — это масса атома, а знаменатель — 1/12 массы атома углерода
— величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.
где N — число молекул в теле, а Na — постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль — это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) — это масса вещества, взятого в одном моле, или иначе — это масса одного моля вещества.
где
— масса молекулы
— постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
и формула для 7 класса
Количество вещества
Число молекул в веществе
Молярная масса
Масса одной молекулы
Связь между относительной молекулярной массой и молярной массой
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Недавно
мы говорили о размерах молекул и выяснили, что они очень малы. Как вы
понимаете, измерять массу молекул в обычных единицах массы, таких как
килограммы или граммы, крайне неудобно. Поэтому люди придумали относительную
молекулярную массу. Относительная молекулярная (или атомная) масса вещества —
это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Дело
в том, что углерод входит в множество веществ, и по международному соглашению
было решено использовать углеродную шкалу атомных масс. Нетрудно догадаться,
что относительная молекулярная масса — это безразмерная величина, поскольку
она показывает во сколько раз масса данной молекулы (или атома) больше массы
одной двенадцатой атома углерода. Тем не менее, молекулярную массу
условились измерять в атомных единицах массы (а. е. м.).
Относительные
массы всех химических элементов измерены с высокой точностью, и их можно найти
в таблице Менделеева.
Например,
относительная атомная масса водорода равна 1, относительная атомная масса гелия
равна 4 и так далее.
Зная
атомные массы можно вычислить и молекулярную массу. Например, относительная
молекулярная масса соляной кислоты равна
Аналогичным
способом можно вычислить массы других молекул. Например, молекула серной кислоты
состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Таким образом, относительная молекулярная масса серной кислоты равна .
Еще
одно понятие, с которым необходимо ознакомиться при изучении
молекулярно-кинетической теории — это количество вещества. Можно,
конечно, определить количество вещества, как количество молекул, содержащихся в
данном теле. Но, как мы уже убедились, это количество просто огромно для любого
макроскопического тела, поэтому нам снова нужно ввести специальную величину.
Эта величина так и называется «количество вещества» и обозначается буквой ν.
Единицей измерения количества вещества является моль: .
1
моль — это количество вещества, в котором содержится столько же молекул или
атомов, сколько содержится атомов в 12 г углерода.
Это
число было определено Амедео Авогадро еще в 19 веке. Один моль любого вещества
содержит 6,02 х 1023 молекул. Это число называется числом
Авогадро или постоянной Авогадро.
Таким
образом, зная число молекул в теле, можно определить количество вещества:
С
постоянной Авогадро связана и другая величина, которая называется молярной
массой — это масса данного вещества, взятого в количестве 1 моль.
Исходя
из этого, можно заключить, что молярная масса вещества равна .
Как
видно из этого уравнения, молярная масса измеряется .
Заметим, что массу любого вещества можно представить, как произведение массы
молекулы этого вещества и количества молекул, содержащегося в данном веществе:
Тогда
можно записать:
Необходимо
отметить, что молярную массу можно также взять из таблицы Менделеева, как и
молекулярную массу. Они численно равны, но следует понимать, что они обозначают
различные величины, а потому измеряются в различных единицах измерения. В
таблице Менделеева молярная масса указана в г/моль, поэтому нельзя забывать
переводить её в кг/моль при решении задач по физике.
Пример
решения задачи.
Задача
1. Определите
массу 3 моль углекислого газа.
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
Масса и размер молекул

4.2
Средняя оценка: 4.2
Всего получено оценок: 78.
4.2
Средняя оценка: 4.2
Всего получено оценок: 78.
Молекулярно-кинетическая теория основывается на положении, что все вещества состоят из мельчайших неделимых частиц — молекул. Важнейшим вопросом при этом является вопрос о размерах и массе одной молекулы. Кратко познакомимся с этой темой.
Доказательства существования молекул
Идея о том, что все тела состоят из мельчайших неделимых частиц, высказывалась еще в античности. В эпоху Возрождения эта точка зрения стала находить все больше подтверждений. При этом появилась разница между понятиями «атом» — неделимая мельчайшая частица элемента, — и «молекула» — мельчайшая частица вещества, сохраняющая свойства всего вещества, которая состоит из одного или нескольких атомов.
Первыми косвенными доказательствами существования молекул являются распространение запахов веществ и явление постепенного смешивания жидкостей.
Более серьезным доказательством молекул является закон постоянных отношений Д. Дальтона, согласно которому отношение масс веществ, участвующих в химических реакциях, всегда имеет постоянные целые пропорции. Это возможно лишь только если допустить, что молекулы всех веществ состоят из определенного целого числа атомов.
Наконец, еще одним доказательством небесконечности делимости веществ является конечное растекание масла по поверхности воды. Если бы вещество делилось неограниченно, капля масла бы всегда растекалась на всю возможную поверхность. А реально такому растеканию есть предел.
Размеры молекул
Из последнего опыта можно оценить средний размер молекулы масла. Исходя из того, что масло перестает растекаться тогда, когда его слой имеет толщину в одну молекулу, и зная объем капли, по площади растекания можно оценить толщину слоя, а значит, и размер молекулы.
Расчеты дают величины порядка $1…3×10^{-9}м$.
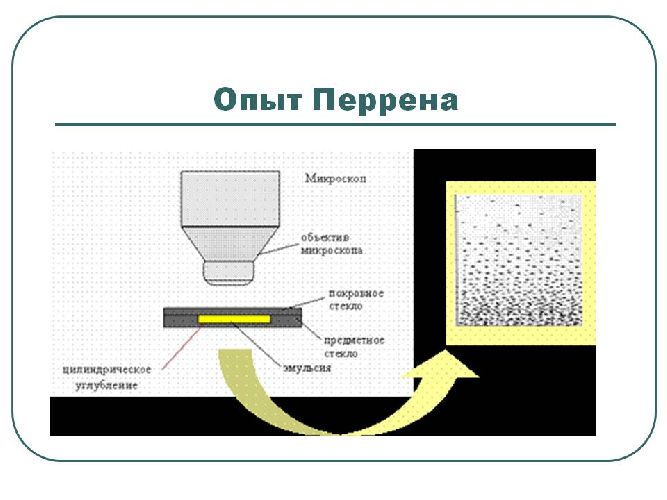
Более точно размер молекул был определен в опыте Ж. Перрена, использующем параметры броуновского движения в 1908 г. Одновременно в этом опыте была определено значение важной физической константы — постоянной Авогадро, то есть количества молекул, содержащихся в одном моле вещества.
Наконец, с изобретением электронного микроскопа стало возможным оценить размеры молекул разных веществ непосредственно. Электронный микроскоп обладает увеличением до $10^8$ раз, поэтому он может различить молекулы и даже отдельные атомы. Например, размер молекулы воды оказался равен примерно $3×10^{-10}$м, и она имеет структуру равнобедренного треугольника с углом в вершине (атоме кислорода) 105⁰.
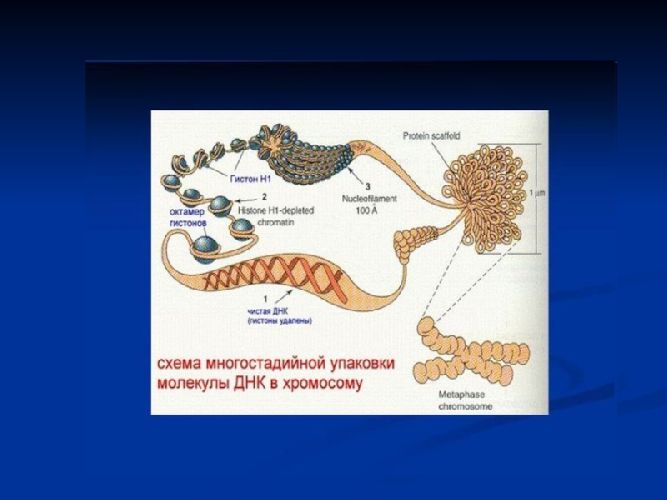
Наименьшие размеры имеют одноатомные молекулы инертных газов. Например, размер молекулы (фактически, одного атома) гелия составляет около $3×10^{-11}$м. Наибольшие размеры имеют молекулы биополимеров: белков и ДНК. Например, молекула ДНК человека представляет собой «клубок», свернутый в несколько «уровней упаковки» и состоящий из спиралевидной нити толщиной $2×10^{-9}$м и длиной несколько сантиметров.
Масса молекул
После того, как в опыте Ж. Перрена было получено значение числа Авогадро (оно равно $6.02×10^{23}$), стало возможным использовать его для определения массы молекулы любого вещества. Она равна отношению молярной массы к числу Авогадро. Например, зная, что молярная масса воды равна $1.8×10^{-2}$ кг, можно вычислить, что масса молекулы воды составляет $3×10^{-26}$ кг.
Молярная масса определялась, исходя из веса веществ химических реакций, с учетом закона постоянных отношений Д. Дальтона.
Что мы узнали?
Размеры молекул начинаются от долей нанометров. Наименьшие размеры у простых молекул, наибольшие — у биополимеров. Впервые достаточно точные цифры были получены в опыте Ж. Перрена в 1908 г. Одновременно было определено значение постоянной Авогадро. По этим же данным стало возможным оценить и массы молекул.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 78.
А какая ваша оценка?
Масса молекул. Количество вещества
У нас есть пластмассовые шарики и гирька, как нам определить, где больше вещества?
Положим шарики и гирьку на весы для сравнения массы (Рис. 1):
Рис. 1. Определение массы
Мы видим, что одна гирька значимо перевешивает семь пластмассовых шариков. Опыт с весами дает нам ответ – больше вещества в железной гирьке, это если мы сравниваем массы – меры инертности железа и пластмассы.
А что если мы сравним не массы, а количество вещества, которое пошло на изготовление шариков и гирьки, фактически количество частиц, из которых они состоят? Взяв в руки шарики и гирьку, мы увидим, что гирька фактически теряется на фоне этих шариков. Если бы мы умели считать количество частиц, которые входят в железо и пластмассу, то мы бы увидели, что количество атомов железа окажется значительно меньше количества молекул во всех пластмассовых шариках. Значит вещества больше в пластмассе.
Правильными являются оба ответа.
Все дело в том, что в первом случае мы сравнивали массу, то есть меру инертности тел, а во втором случае мы сравнивали количество молекул, количество вещества.
Простую аналогию мы можем провести с сахаром в мерном стаканчике. На вопрос, сколько там сахара, можно ответить, посмотрев на деление стаканчика и ориентировочно сказать, сколько там граммов сахара. Можно пересчитать каждую крупинку, находящуюся в стаканчике, и ответить, какое количество их содержит стаканчик. Правильными будут и первый, и второй ответы. Когда же удобнее говорить о массе молекул, а когда удобнее говорить о количестве вещества? Именно это и является темой урока: «Масса молекул, Количество вещества».
Количество молекул. Число Авогадро
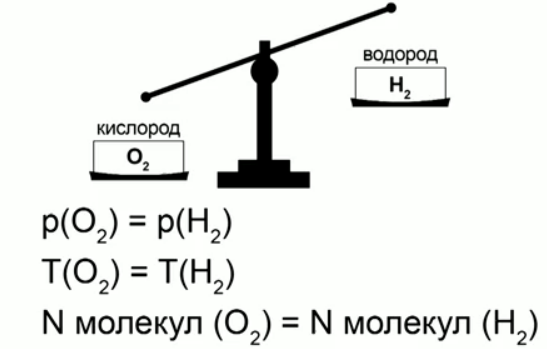
В XIX веке итальянский ученый Авогадро установил интересный факт: если два разных газа, например водород и кислород, находятся в одинаковых сосудах, при одинаковых давлениях и температурах, то в каждом сосуде будет одинаковое количество молекул, хотя массы газов могут отличаться очень сильно, в нашем примере – в 16 раз (рис. 2).
Рис. 2. Опыт Авогадро
Все это обозначает, что некоторые свойства тела определяются именно количеством молекул, а не только массой.
Что же мы понимаем под термином «количество вещества»? Любое вещество состоит из молекул, атом, ионов – значит, имеет смысл под количеством вещества понимать количество молекул.
Физическая величина, которая определяет количество молекул в данном теле, называется количеством вещества. Обозначается греческой буквой ν – ню.
Условились за единицу количества вещества принять такое его количество, в котором содержится столько частиц (атомов, молекул), сколько атомов содержится в 0,012 кг (12 граммах) изотопа углерода с атомной массой 12.
Называется эта единица моль.
Из этого определения выходит, что в одном моле любого вещества будет одинаковое количество молекул. В одном моле любого вещества содержится 6,02·1023 молекул или частиц. Эта величина носит название постоянная Авогадро.
Рис. 3. Определение полного числа молекул
Эта формула позволяет узнать полное число молекул при известном количестве вещества.
Масса молекул
Масса молекулы крайне мала. Определили это физики при помощи так называемого масс-спектрографа. К примеру, значение массы молекулы воды (рис. 4):
Рис. 4. Определение массы молекулы воды
Как мы видим, так же, как и в случаях с количеством вещества, сравнивать массу одной молекулы с эталоном массы, килограммом, не очень удобно. Если в случаях с количеством вещества числа огромны, то в случаях с массой молекул числа очень малы. Именно поэтому в качестве единицы измерения массы молекулы или атома была выбрана особая внесистемная единица – атомная единица массы. Мы будем сравнивать единицу массы не с эталоном, а с массой молекулы какого-то вещества.
Этим веществом стал самый распространенный в природе элемент – углерод, который входит во все органические соединения. Атомная единица массы равна:
1 а.е.м. = 1/12 массы углерода – 12 (изотоп, в котором 12 нуклонов)
1 а.е.м. = 1, 66·10-27 кг
Так как мы будем измерять массу молекул в атомных единицах массы, то мы приходим к новой физической величине – относительная молекулярная масса.
Отношение массы молекулы (атома) данного вещества к 1/12 массы атома углерода называется относительной молекулярной массой (или относительной атомной массой) в случае атомарного строения вещества.
Формулы, выражающие это определение:
Относительная молекулярная масса – это безразмерная величина, она ни в чем не измеряется. Нам ничего не мешает по-прежнему измерять массы атомов и молекул в килограммах тогда, когда нам это будет удобно. Из курса химии мы знаем, что: относительная молекулярная масса вещества равна сумме относительных атомных масс элементов, входящих в него. Например, для воды Н2О относительная молекулярная масса будет:
Мr = 1·2 + 16 = 18
Сумма относительной молекулярной массы кислорода (16) и двух водородов (2•1) даст 18
Как же найти общее между массой в килограммах и количеством вещества в молях? Это величина – молярная масса.
Молярная масса – это масса одного моля вещества.
Обозначается [ М ], измеряется в кг/моль.
Молярная масса равна отношению массы к количеству вещества:
М = 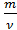
Получим формулы, которые связывают различные характеристики молекул.
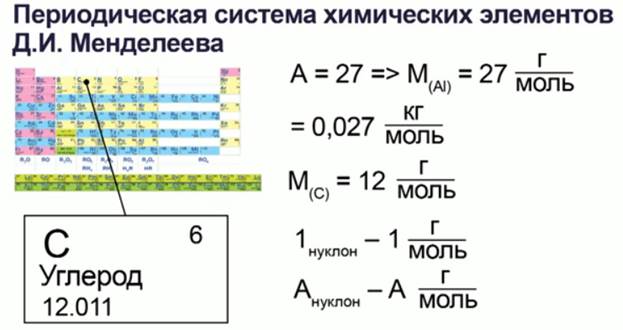
Для определения молярной массы химического элемента обратимся к периодической таблице химических элементов Менделеева – берем просто атомную массу А (число нуклонов необходимого элемента) – это и будет его молярная масса, выраженная в г/моль.
Например, для алюминия (рис. 5):
Рис. 5. Определение молярной массы вещества
Атомная масса алюминия будет равна 27, а молярная масса будет равна 0,027 кг/моль.
Это объясняется тем, что молярная масса углерода равна 12 г/моль по определению, в то же время ядро атома углерода содержит 12 нуклонов – 6 протонов и 6 нейтронов, выходит, что каждый нуклон вносит в молярную массу 1 г/моль, поэтому молярная масса химического элемента с атомной массой А окажется равной А г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием малярных масс, так например (рис. 6):
Рис. 6. Молярная масса углекислого газа
Нужно быть особо внимательными с молярными массами некоторых газов, таких как газообразный водород, азот, кислород – их молекула состоит из двух атомов – H2, N2, O2, а гелий, часто встречающийся в задачах, является одноатомным и имеет молекулярную массу 4 г/моль, предписанную таблицей Менделеева (рис. 7).
Рис. 7. Молярные массы некоторых газов
В одном моле любого вещества содержится число Авогадро молекул, значит, если умножить число Авогадро (число молекул в одном моле) на массу одной молекулы m0, то мы получим молярную массу вещества, то есть массу одного моля вещества:
М = m0 · NА
Если 25 учеников занимаются в классе, площадь которого 50 м2, то на каждого ученика приходится 2 м2. При переходе их на занятие в спортзал, площадь которого 500 м2, на каждого ученика уже будет приходиться 20 м2. Число учеников не изменилось, но они стали реже расположенными, в этом случае говорят: уменьшилась концентрация людей. Точно так же для молекул вводится понятие концентрации в молекулярной кинетической теории.
Концентрацией (n) называется количество молекул, приходящихся на единицу объема вещества. Она равна отношению числа молекул к объему:
n =
[n] = 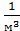
Формулы, связывающие концентрацию с другими характеристиками молекул:
Пользуясь этими формулами, мы можем сравнивать вещества как по количеству молекул, так и по массе.