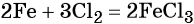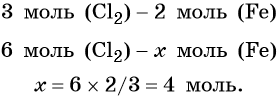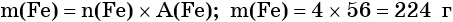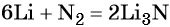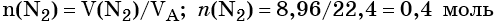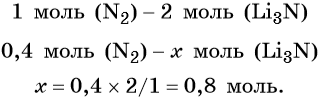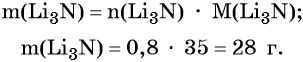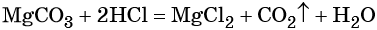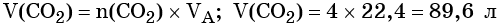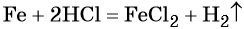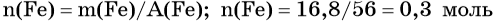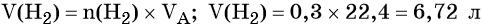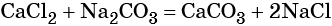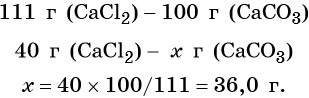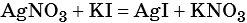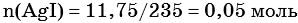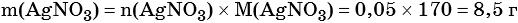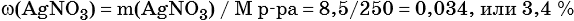Решение расчетных задач на вычисление массы или количества продукта реакции, если один из реагентов взят в избытке
В условиях задач такого типа указаны массы или объёмы двух реагирующих веществ, одно из которых дано в избытке, поэтому при решении таких задач нужно определить, какое вещество взято в избытке. Расчёт массы или объёма продукта реакции ведётся по данным вещества взятого в недостатке.
I. Алгоритм решения задачи: «Вычисление массы или количества продукта реакции, если один из реагентов взят в избытке»
Пример 1. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
|
Последовательность выполнения действий |
Оформление решения задачи |
|
1. Записываем условие задачи |
Дано: m(CaCl2)=33,3г m(Na3PO4)=16,4г _______________ Найти: m(Ca3(PO4)2) =? |
|
2. Вычислим молярные массы для формул, записанных вдано |
M(CaCl2)=111г/моль M(Na3PO4)=164г/моль M(Ca3(PO4)2) =310г/моль |
|
3. Вычислим количества веществ, масса которых дана в условии |
ν(CaCl2)=m/M=33,3г/111г/моль=0,3моль ν(Na3PO4)=16,4г/164г/моль=0,1моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
|
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби. |
CaCl2 – взят в избытке, расчёт ведём по недостатку, т.е. поNa3PO4. |
|
6. Вычислим количество вещества, массу которого нужно найт |
По УХР: ν(Ca3(PO4)2)= (0,1моль∙1моль)/2моль=0,05моль |
|
7.Вычислим искомую массу |
m(Ca3(PO4)2)= ν(Ca3(PO4)2 )∙ M(Ca3(PO4)2) = 0,05моль ∙ 310г/моль =15,5г |
|
8. Запишем ответ |
Ответ: m(Ca3(PO4)2) =15,5г |
Пример 2. Вычислите объём водорода (н.у.), который образуется при взаимодействии 6,5 г цинка с соляной кислотой массой 7,5 г.
|
Последовательность выполнения действий |
Оформление решения задачи |
|
1. Записываем условие задачи |
Дано: m(Zn)=6,5г m(HCl)=7,5г Vm=22,4л/моль _______________ Найти: V(H2) =? |
|
2. Вычислим молярные массы для веществ с известной массой, записанных в дано |
M(Zn)=65г/моль M(HCl)=36,5г/моль |
|
3. Вычислим количества веществ, масса которых дана в условии |
ν(Zn) = m/M= 6,5/65г/моль=0,1моль ν(HCl)=7,5г/36,5г/моль=0,205моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
|
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби. |
НCl – взят в избытке, расчёт ведём по недостатку, т.е. по Zn. |
|
6. Вычислим количество вещества, объём которого нужно найти |
По УХР: ν(H2) = ν(Zn)=0,1моль |
|
7.Вычислим искомый объём |
V(H2)= ν(H2)∙ Vm = 0,1моль ∙ 22,4л/моль =2,24л |
|
8. Запишем ответ |
Ответ: V(H2)= 2,24л |
II. Алгоритм решения задач на «Избыток — недостаток» (в общем виде)
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V, W) реагентов
Найти: m (ν, V, W) продукта
Решение:
1. Составляем уравнение реакции
2. Нахождение количества вещества реагентов ν(А) и ν(В):
ν = m/M;
ν = V/Vm;
Wвещества = (mвещества •100%)/mраствора;
mвещества= (Wвещества• mраствора)/100%
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
Если, ν(А)/a < ν(В)/b, то вещество А в недостатке, расчёт ν(С) ведём по ν(А)
Если, ν(А)/a = ν(В)/b, то расчёт ν(С) ведём по ν(В) или ν(А)
4. Определение ν(С) по УХР путём составления и решения пропорции:
ν(В)/b = ν(С)/с или ν(А)/a = ν(С)/с
5. Нахождение величин, требуемых по условию:
m = ν•M;
V = ν• Vm;
Wвещества = (mвещества •100%)/mраствора
Здесь,
m — масса вещества (г)
ν — количество вещества (моль)
V — объём (л)
W — массовая доля вещества (%)
III. Решите следующие задачи
- Вычислите массу осадка, образующегося при взаимодействии 160 г сульфата железа (III) и 41,6 г хлорида бария.
- Вычислите объем углекислого газа, который можно получить при взаимодействии карбоната кальция массой 7 г с соляной кислоты массой 6 г.
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Определим V(CO2):
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
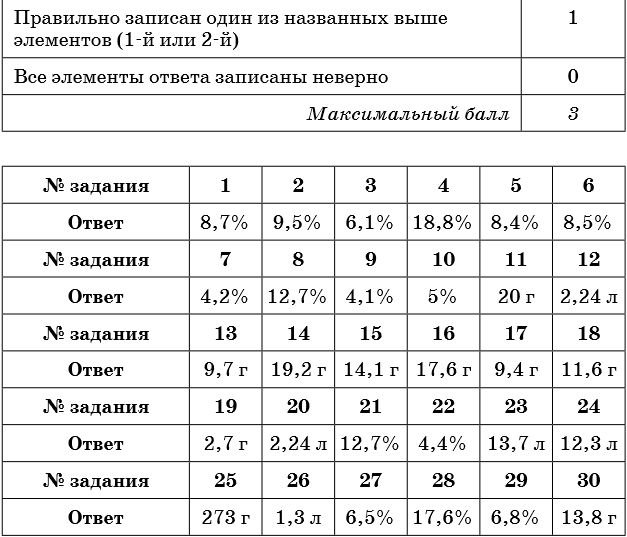
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Ответы
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:
Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.
Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.
Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Решение задач, когда одно из веществ в избытке
(ответы и решения)
Ключевые слова конспекта: расчет массы, объема продукта реакции, если одно из реагирующих веществ дано в избытке; решение задач, когда одно из веществ в избытке.
Вещества реагируют друг с другом в строго определенных количествах. Однако исходные вещества для проведения реакции могут быть взяты в любых количествах. Таким образом, одно из реагирующих веществ может оказаться в избытке, а другое — в недостатке. В этом случае необходимо определить, какое из реагирующих веществ находится в избытке, а какое — в недостатке, и дальнейшие расчеты производить по веществу, находящемуся в недостатке. Это обусловлено тем, что вещество, находящееся в недостатке, прореагирует полностью, таким образом, количество вещества данного реагента нам будет точно известно.
Для того чтобы определить, какое из реагирующих веществ находится в избытке, а какое — в недостатке, необходимо вычислить количества вещества реагентов и сравнить их. Если количества вещества реагентов, участвующих в химической реакции, одинаковы, то в избытке будет то вещество, количество которого больше в соответствии с условиями задачи. Например, если в реакцию, уравнение которой Н2 + Сl2 = 2НСl, взять 0,2 моль водорода и 0,15 моль хлора, то в избытке будет водород, а в недостатке — хлор, так как v(H2) > v(Cl2). Расчет количества образовавшегося водорода в этом случае следует вести по количеству вещества хлора.
Если же вещества реагируют в неравных количествах, то для расчета избытка и недостатка следует учитывать коэффициенты в уравнении реакции. Например, для реакции, уравнение которой 2Н2 + O2 = 2Н2O, отношение количества веществ водорода и кислорода, реагирующих друг с другом, имеет следующий вид:
При использовании количеств веществ, соответствующих условию задачи, это выражение превращается в неравенство, которое и показывает, какое из веществ взято в реакции в избытке. Например, если в рассматриваемой реакции использовать 0,2 моль водорода и 0,15 моль кислорода, в недостатке будет водород, несмотря на то что количество вещества его больше. Это следует из соотношения: 1 • v(H2) < 2 • v(O2), или 1 • 0,2 < 2 • 0,15, учитывающего коэффициенты в уравнении реакции.
Таким образом, расчет количества образовавшейся воды в данном случае следует вести по количеству вещества водорода.
Особые трудности возникают в тех случаях, когда в зависимости от того, какой из реагентов в избытке, образуются различные продукты реакции. Например, если углекислый газ взаимодействует с избытком гидроксида кальция, образуется средняя соль — карбонат кальция:
Са(ОН)2 + СO2 = CaCO3 ↓ + Н2O.
Если же в избытке углекислый газ, то в результате реакции образуется кислая соль — гидрокарбонат кальция:
Са(ОН)2 + 2СO2 = Са(НСO3)2.
Поэтому в ряде случаев определение избытка и недостатка следует проводить еще до составления уравнения химической реакции.
В некоторых случаях вещество, взятое в избытке, взаимодействует с одним из продуктов реакции, например при восстановлении магнием оксида кремния (IV) по реакции:
взятый в избытке магний будет взаимодействовать с образовавшимся кремнием:
Такие превращения нужно также учитывать при решении задач.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Сколько граммов поваренной соли образуется при сливании растворов, содержащих 24 г гидроксида натрия и 14,6 г хлороводорода?
Посмотреть РЕШЕНИЕ

Ответ. m(NaCl) = 23,4 г.
Задача № 2.
Вычислите массу хлорида железа (III), образующегося при взаимодействии 14 г железа и 5,6 л (н. у.) хлора.
Посмотреть РЕШЕНИЕ

О т в е т. m(FeCl3) = 27,08 г.
Задача № 3.
Водород, полученный при разложении 12,6 г гидрида кальция водой, пропустили над 40 г нагретого оксида меди (II). Определите массу образовавшегося металла.
Посмотреть РЕШЕНИЕ

Ответ. m(Cu) = 32 г.
Задача № 4.
Газ, полученный при взаимодействии 19,8 г сульфата аммония и 32 г 25% -ного раствора гидроксида натрия, смешали с газом, полученным при разложении 24,5 г бертолетовой соли. Газовую смесь пропустили через 73г 5%-ного раствора соляной кислоты. Определите состав смеси газов после прохождения через раствор.
Посмотреть РЕШЕНИЕ

Ответ. V(O2) = 6,72 л, V(NH3) = 2,24 л.
Задача № 5.
Каков состав и какова масса соли, которая образуется при пропускании 26,88 л (н. у.) углекислого газа через 210 г раствора с массовой долей гидроксида калия 24% ?
Посмотреть РЕШЕНИЕ

Ответ. m(КНСO3) = 90 г.
Задача № 6.
Смешали 200 г 14% -ного раствора гидроксида натрия и 392 г 10% -ного раствора серной кислоты. Определите массовые доли солей в образовавшемся растворе.
Посмотреть РЕШЕНИЕ

Ответ. ω(NaHSO4) = 2,03%; ω(Na2SO4) = 7,2%.
Задача № 7.
Вычислите массу осадка, который образуется при прибавлении 280 г 20% -ного раствора гидроксида калия к 160,2 г 25%-ного раствора хлорида алюминия.
Посмотреть РЕШЕНИЕ
Ответ. m(А1(ОН)3) = 15,6 г.
ЗАДАЧИ с КРАТКИМ ОТВЕТОМ
- Сколько граммов осадка образуется при взаимодействии 340 г 17,5%-ного раствора нитрата серебра и 109,5 г 20% -ной соляной кислоты?
Ответ. m(AgCl) = 50,2 г.
- 29,12 л аммиака (н. у.) пропустили через 160,17мл раствора 30%-ной азотной кислоты (р = 1,18 г/мл). Определите массу образовавшейся соли.
Ответ. m(NH4NO3) = 72 г.
- Сколько граммов воды образуется при сжигании смеси, содержащей 56 л водорода (н. у.) и 56 г кислорода?
Ответ. m(Н2O) = 45 г.
- Какой объем газа (н. у.) выделится при взаимодействии 24 г смеси алюминия с кремнием, массовая доля алюминия в которой 45%, с 506,1 мл 10% -ного раствора серной кислоты (р = 1,065 г/мл)?
Ответ. V(H2) = 12,32 л.
- К 280 г 10%-ного раствора гидроксида натрия добавили 75 г медного купороса. Выпавший осадок отделили и прокалили. Определите массу образовавшегося продукта и назовите его.
Ответ. m(CuO) = 24 г, оксид меди (II).
- Через 68 г 4%-ного раствора сероводородной кислоты H2S пропустили газ, образовавшийся при сжигании 0,96 г серы в избытке кислорода. Какова масса образовавшегося осадка?
Ответ. m(S) = 2,88 г.
- Нагрели смесь, содержащую 32,5 г цинка и 11,2 г серы. После этого смесь обработали избытком соляной кислоты. Определите объем выделившегося газа (н. у.).
Ответ. V(газа) = 11,2 л.
- Газ, образовавшийся при обработке 19,2 г меди 22,79мл 94%-ной серной кислотой (р = 1,83 г/мл), пропустили через 1200 г бромной воды с массовой долей брома 4% . Будет ли раствор бесцветным после пропускания газа?
Ответ. Раствор останется окрашенным.
- 10,8 г серебра обработали 72,41 мл 30%-ной азотной кислоты (р = 1,48 г/мл). К полученному раствору добавили 18,72 г 25%-ного раствора хлорида натрия. Найдите массу образовавшегося осадка.
Ответ. m(осадка) = 11,48 г.
- Газ, полученный при обработке 26,4 г сульфида железа (II) 73 г 20%-ной соляной кислоты, пропустили через 198,6 г 25% -ного раствора нитрата свинца (II). Определите массу образовавшегося осадка.
Ответ. m(осадка) = 35,85 г.
- Определите массу и состав соли, которая образуется при пропускании 15,68 л аммиака (н. у.) через 61,25 г 40% -ного раствора серной кислоты.
Ответ. m((NH4)2SO4) = 33 г.
- Какая соль образуется при сливании 177 мл 12%-ного раствора гидроксида натрия (р = 1,13 г/мл) и 194,44 мл 14%-ного раствора фосфорной кислоты (р = 1,08 г/мл)? Какова ее масса?
Ответ. m(Na2HPO4) = 42,6 г.
- В 588 г раствора 10%-ной серной кислоты опустили кусочек цинка массой 52 г. Выделившийся водород пропустили при нагревании над 90 г оксида кобальта (II). Найдите массу образовавшегося металла.
Ответ. m(Со) 35,4 г.
- Через 224 г 20%-ного раствора гидроксида калия пропустили 13,44 л (н. у.) оксида серы (IV). Вычислите массы солей в полученном растворе.
Ответ. m(K2SO3) = 31,6 г, m(KHSO3) = 48 г.
- Какова масса осадка, выделившегося при пропускании 5,6 л (н. у.) углекислого газа через известковую воду, содержащую 11,1 г гидроксида кальция?
Ответ. m(осадка) = 5 г.
- В 200 мл воды растворили 56,8 г оксида фосфора (V). К полученному раствору прибавили
76,9 мл раствора с массовой долей NaOH 40% (р = = 1,43 г/мл). Найдите массовые доли солей в полученном растворе.
Ответ. ω(Na2HPO4) — 11,61%, ω(NaH2PO4) = 10,36%.
- Каковы объемные доли газов, образующихся при прокаливании 28,8 г углерода в присутствии 33,6 л кислорода (н. у.)?
Ответ. φ(СО) = 75%, φ(СO2) = 25%.
- После прокаливания смеси, содержащей 32,4 г алюминия и 64 г оксида железа (III), ее обработали избытком соляной кислоты. Определите объем выделившегося при этом газа (н. у.).
Ответ. V(газа) = 31,36 л.
- Какую массу кремния можно получить, прокаливая 21 г оксида кремния (IV) с 32 г кальция?
Ответ. m(Si) = 8,4 г.
- 32,5 г цинка растворили в 240 г 20%-ного раствора гидроксида натрия. К полученному раствору добавили 204,4 г 25% -ной соляной кислоты. Определите массу полученного осадка.
Ответ. m(осадка) = 39,6 г.
Задачи на количества исходных веществ и продуктов реакции (ответы и решения). Выберите дальнейшие действия:
- Перейти к следующей теме:
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.