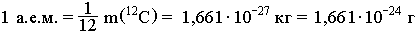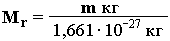Для измерения масс
атомов и молекул в физике и химии принята
единая система измерения. Эти величины
измеряются в относительных единицах.
Атомная
единица массы (а.е.м.) равна 1/12 массы m
атома углерода 12С
(m
одного атома 12С
равна 1,99310-26кг).
Относительная
атомная масса элемента (Ar)
– это безразмерная величина, равная
отношению средней массы атома элемента
к 1/12 массы атома 12С.
При расчете относительной атомной массы
учитывается изотопный состав элемента.
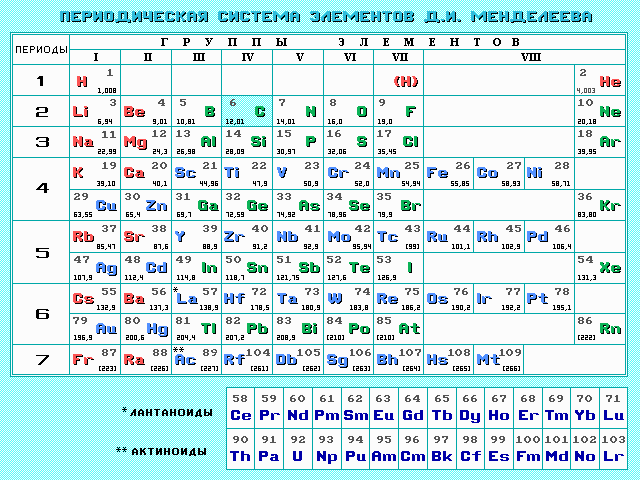
Величины Ar
определяют по таблице
Д.И. Менделеева
Абсолютная
масса атома (m)
равна относительной атомной массе,
умноженной на 1 а.е.м. Например, для атома
водорода абсолютная масса определяется
следующим образом:
m
(H) = 1,0081,66110-27
кг = 1,67410-27
кг
Относительная
молекулярная масса соединения (M
r)
– это безразмерная величина, равная
отношению массы m
молекулы вещества к 1/12 массы атома 12С:
Относительная
молекулярная масса равна сумме
относительных масс атомов, входящих в
состав молекулы. Например:
М
r
(C2H6)
= 2
A
r
(C) + 6A
r
(H) = 212
+ 6 = 30.
Абсолютная масса
молекулы равна относительной молекулярной
массе, умноженной на 1 а.е.м.
2.2. Моль, молярная масса
В
химических процессах участвуют мельчайшие
частицы – молекулы, атомы, ионы, электроны.
Число таких частиц даже в малой порции
вещества очень велико. Поэтому, чтобы
избежать математических операций с
большими числами, для характеристики
количества вещества, участвующего в
химической реакции, используется
специальная единица – моль.
Моль
это такое количество вещества, в котором
содержится определенное число частиц
(молекул, атомов, ионов), равное постоянной
Авогадро (NA=
6,021023
моль—1).
Постоянная
Авогадро NA
определяется как число атомов, содержащееся
в 12 г изотопа 12С:
Таким
образом, 1 моль вещества содержит 6,02
1023
частиц этого вещества.
Исходя
из этого, любое количество вещества
можно выразить определенным числом
молей
(ню). Например, в образце вещества
содержится 12,04
1023
молекул. Следовательно, количество
вещества в этом образце составляет:
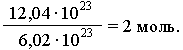
В общем
виде:
где N
— число частиц данного вещества;
NA
— число частиц в одном моле вещества
(постоянная Авогадро).
Молярная
масса вещества (M)
– масса одного моля этого вещества.
По
величине она равна относительной
молекулярной массе Mr
(для веществ атомного строения –
относительной атомной массе Ar).
Молярная масса имеет размерность г/моль.
Например, молярная масса метана CH4
определяется следующим образом:
Мr(CH4)
= Ar(C)
+ 4 Ar(H)
= 12+4 =16
M(CH4)=16
г/моль, т.е. 16 г CH4
содержат 6,021023
молекул.
Молярную массу вещества
можно вычислить, если известны его масса
m
и количество (число молей) ,
по формуле:
Соответственно,
зная массу и молярную массу вещества,
можно рассчитать число его молей:
или найти массу
вещества по числу молей и молярной
массе:
m =
M .
Необходимо
отметить, что значение молярной массы
вещества определяется его качественным
и количественным составом, т.е. зависит
от Mr
и Ar.
Поэтому разные вещества при одинаковом
количестве молей имеют различные массы
m.
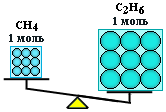
Пример:
Вычислить
массы метана CH4
и этана С2H6,
взятых в количестве
= 2 моль каждого.
Решение:
Молярная
масса метана равна 16 г/моль, а этана С2Н6
– 30 г/моль. Отсюда:
m(CH4)
= 2 моль
16 г/моль = 32
г;
m(С2Н6)
= 2 моль
30 г/моль = 60
г.
Таким образом,
моль — это порция вещества, содержащая
одно и то же число частиц, но имеющая
разную массу для разных веществ, т.к.
частицы вещества (атомы и молекулы) не
одинаковы по массе.
(CH4)
= (С2Н6),
но m(CH4)
< m(С2Н6)
Вычисление
используется практически в каждой
расчетной задаче.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Масса атомов и молекул
Для измерения масс атомов и молекул в физике и химии принята единая система измерения. Эти величины измеряются в относительных единицах – атомных единицах массы.
Атомная единица массы (а.е.м.) равна 1/12 массы m атома углерода 12С (m одного атома 12С равна
1,993 • 10-26 кг).
Относительная атомная масса элемента (Ar) – это безразмерная величина,
равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается изотопный состав элемента. Величины Ar определяют по таблице Д.И. Менделеева.
Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м.
Например, для атома водорода абсолютная масса определяется следующим образом:
m(H) = 1,008 • 1,661 • 10-27 кг = 1,674 • 10-27 кг
Относительная молекулярная масса соединения (Mr) – это безразмерная величина,
равная отношению массы m молекулы вещества к 1/12 массы атома 12С:
Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекулы. Например:
Мr(C2H6) = 2 • Ar(C) + 6 • Ar(H) = 2 • 12 + 6 = 30.
В случае полимеров используется понятие средней молекулярной массы, поскольку при их получении (путем полимеризации или поликонденсации) образуются макромолекулы с разной молекулярной массой (подробнее).
Например, при полимеризации пропилена CH2=CHCH3 получен полипропилен [–CH2–CH(CH3)–]n, который содержит 20% макромолекул с молекулярной массой 84000, и 80% макромолекул с молекулярной массой 126000. Чтобы охарактеризовать молекулярную массу этого полимера, находят ее среднее (числовое) значение:
Mr(ср)(полипропилена) = 84000 • 0,2 + 126000 • 0,8 = 117600.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а.е.м.
m(C2H6) = Mr(C2H6) • 1,661 • 10-27 кг = 49,82 • 10-27 кг.
Как определить массу атома
Для того чтобы определить массу атома, найдите молярную массу одноатомного вещества, используя таблицу Менделеева. Затем эту массу поделите на число Авогадро (6,022•10^(23)). Это и будет масса атома, в тех единицах, в которых измерялась молярная масса. Масса атома газа находится через его объем, который легко измерить.

Вам понадобится
- Для определения массы атома вещества возьмите таблицу Менделеева, рулетку или линейку, манометр, термометр.
Инструкция
Определение массы атома твердого тела или жидкости Для определения массы атома вещества, определите его природу (из каких атомов оно состоит). В таблице Менделеева найдите ячейку, в которой описывается соответствующий элемент. Найдите массу одного моля этого вещества в граммах на моль, которая находится в этой ячейке (это число соответствует массе атома в атомных единицах массы). Поделите молярную массу вещества на 6,022•10^(23) (число Авогадро), результатом будет масса атома данного вещества в граммах. Можно определить массу атома и другим способом. Для этого атомную массу вещества в атомных единицах массы взятую в таблице Менделеева умножьте на число 1,66•10^(-24). Получите массу одного атома в граммах.
Определение массы атома газа В том случае, если в сосуде есть газ неизвестной природы, определите его массу в граммах, взвесив пустой сосуд и сосуд с газом, и найдите разность их масс. После этого измерьте объем сосуда с помощью линейки или рулетки, с последующим произведением расчетов или другими методами. Результат выразите в кубических метрах. Манометром измерьте давление газа внутри сосуда в паскалях, и измерьте его температуру термометром. Если шкала термометра проградуирована в градусах Цельсия, определите значение температуры в Кельвинах. Для этого к значению температуры на шкале термометра прибавьте число 273.
Для определения массы молекулы газа массу данного объема газа умножьте на его температуру и число 8,31. Результат поделите на произведение давления газа, его объема и числа Авогадро 6,022•10^(23) (m0=m•8,31•T/(P•V•NА)). Результатом будет масса молекулы газа в граммах. В том случае, если известно, что молекула газа двухатомная (газ не инертный) получившееся число поделите на 2. Помножив результат на 1,66•10^(-24) можно получить его атомную массу в атомных единицах массы, и определить химическую формулу газа.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
Масса атома обозначается символом
ma
и может выражаться в единицах массы: килограммах или граммах.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24г
, а масса атома углерода —
ma(C)=19,94⋅10−24г
. Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
В качестве атомной единицы массы (а. е. м.) выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u) (от английского «unit» — единица):
.
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
Пример:
в Периодической таблице приведено значение относительной атомной массы магния — (24,305). Округлённое значение — (24). Значение атомной массы углерода — (12,011), а её округлённое значение — (12).
Исключение — относительная атомная масса хлора:
Ar(Cl)=
(35,5).
Значения относительных атомных масс некоторых элементов
| Элемент | H | He | Li | C | N | O | F | Ne | Na | Mg | Al | P | S | Cl | Ar | Ca | Fe | Cu | Zn |
|
Ar |
1 |
4 |
7 |
12 |
14 |
16 |
19 |
20 |
23 |
24 |
27 |
31 |
32 |
35,5 |
40 |
40 |
56 |
64 |
65 |
Относительная молекулярная масса
Mr
— это отношение массы молекулы или формульной единицы к атомной единице массы.
,
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Пример:
относительная молекулярная масса углекислого газа:
.
Относительная молекулярная масса фосфата натрия:
.
Относительная молекулярная масса сульфата алюминия:
.