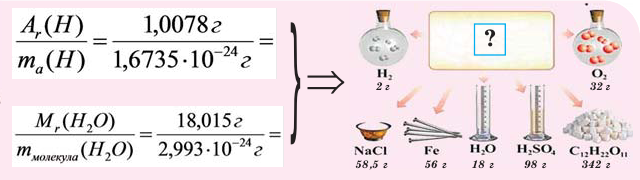
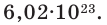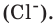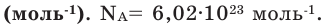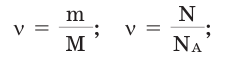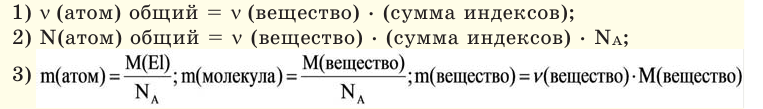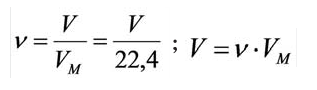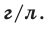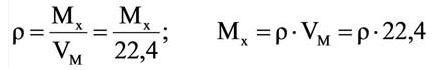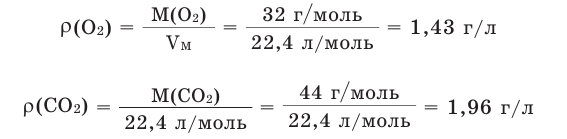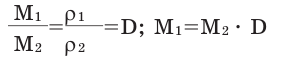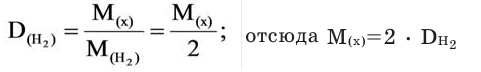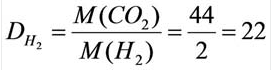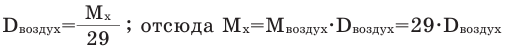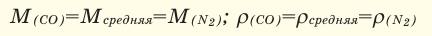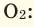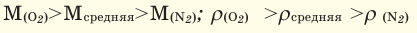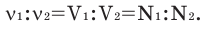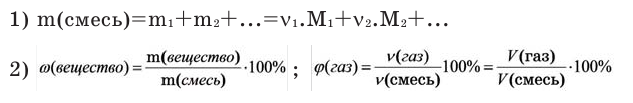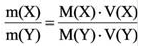Как найти молярную массу смеси газов
Молярная масса – это масса одного моля любого вещества, то есть такого его количества, в котором содержится 6,022*10^23 элементарных частиц. Численно молярная масса совпадает с молекулярной, выраженной в атомных единицах массы (а.е.м.), но размерность у нее другая – грамм/моль.

Инструкция
Если бы вам надо было вычислить молярную массу любого газа, вы бы взяли величину атомной массы азота и умножили ее на индекс 2. В итоге получили бы 28 грамм/моль. Но как вычислить молярную массу смеси газов? Эта задача решается элементарно. Надо лишь знать, какие именно газы и в какой пропорции входят в состав смеси.
Рассмотрите конкретный пример. Предположим, у вас есть газовая смесь, которая состоит из 5% (массовых) водорода, 15% азота, 40% углекислого газа, 35% кислорода и 5% хлора. Какова ее молярная масса? Воспользуйтесь формулой для смеси, состоящей из х компонентов: Мсм = M1N1 + M2N2 + M3N3 +…+ MxNx, где M – молярная масса компонента, а N – его массовая доля (процентная концентрация).
Молярные массы газов вы узнаете, вспомнив величины атомных весов элементов (тут вам понадобится Таблица Менделеева). Их массовые доли известны по условиям задачи. Подставив величины в формулу и произведя вычисления, получите: 2*0,05 + 28*0,15 + 44*0,40 + 32*0,35 + 71*0,05 = 36,56 грамм/моль. Вот такова молярная масса указанной смеси.
Можно ли решить задачу другим способом? Да, конечно. Предположим, у вас точно такая же смесь, заключенная в герметичный сосуд объемом V при комнатной температуре. Как можно лабораторным путем вычислить ее молярную массу? Для этого вам понадобится сначала взвесить этот сосуд на точных весах. Обозначьте его массу как М.
Потом с помощью подсоединенного манометра измерьте давление P внутри сосуда. Затем с помощью шланга, подсоединенного к вакуум-насосу, откачайте немного смеси. Легко можно понять, что давление внутри сосуда уменьшится. Перекрыв вентиль, подождите примерно полчаса для того, чтобы смесь внутри сосуда снова приняла температуру окружающего воздуха. Проверив это с помощью термометра, измерьте давление смеси манометром. Обозначьте его P1. Взвесьте сосуд, обозначьте новую массу как M1.
Ну а дальше вспомните универсальное уравнение Менделеева-Клапейрона. Согласно ему, в обоих случаях:- PV = MRT/m;- P1V = M1RT/m.Немного видоизменив это уравнение, вы получите:- m = MRT/PV;- m = M1RT/P1V.
Отсюда следует, что m = (M – M1)RT/ (P – P1)V. А m – та самая молярная масса смеси газов, которую вам надо узнать. Подставив в формулу известные величины, вы получите ответ.
Источники:
- молекулярная масса смеси
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 


Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 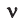
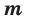
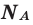
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса — измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
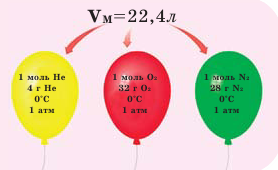
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 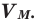
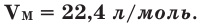
Здесь 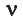
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 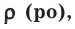
измерения —
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 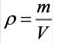
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу — водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 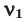
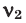
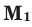
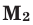

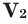
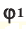
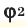
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 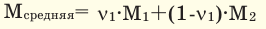
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
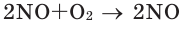
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
Молярная масса в химии — формулы и определения с примерами
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

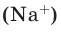

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 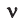
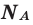
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса — измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 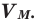
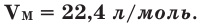
Здесь 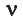
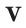
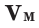
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 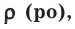
измерения —
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 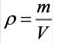
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу — водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 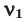
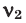
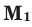
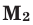

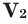
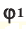
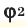
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 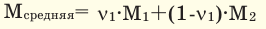
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 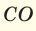
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 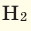
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
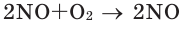
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Как найти молекулярную массу смеси
2.1. Основные понятия и формулы
Количество вещества — число структурных элементов (молекул, атомов, ионов и т. п.), содержащихся в теле или системе. Количество вещества выражается в молях. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в 0,012 кг изотопа углерода 12 C. Количество вещества тела (системы)
,
где N — число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему). Постоянная Авогадро NА=6,0210 23 моль -1 .
Молярная масса вещества ,
где m—масса однородного тела (системы); —количество вещества (число молей) этого тела (системы). Выражается в единицах г/моль (или кг/моль).
Единица массы, равная 1/12 массы атома углерода 12 C, называется атомной единицей массы (а.е.м.). Массы атомов или молекул выраженные в атомных единицах массы называют соответственно относительной атомной или относительной молекулярной массой вещества. Относительная молекулярная масса вещества состоит из относительных атомных масс химических элементов, составляющих молекулу вещества. Относительные атомные массы химических элементов приводятся в таблице Д. И. Менделеева (см. также таблицу 8 приложения данного пособия).
Молярная масса вещества численно равна относительной атомной или молекулярной массе данного вещества, если размерность а.е.м. заменить на размерность г/моль.
Количество вещества смеси n газов
или ,
Уравнение Менделеева — Клапейрона (уравнение состояния идеального газа)
,
где т — масса газа, — молярная масса газа, R — универсальная газовая постоянная, ν — количество вещества, Т — термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями уравнения Менделеева — Клапейрона для изопроцессов:
а) закон Бойля—Мариотта (изотермический процесс: T=const, m=const)
или для двух состояний газа, обозначенных цифрами 1 и 2,
,
б) закон Гей-Люссака (изобарический процесс: р=const, m=const)
или для двух состояний ,
в) закон Шарля (изохорический процесс: V=const, m=const)
или для двух состояний ,
г) объединенный газовый закон (m=const)
или для двух состояний .
Под нормальными условиями понимают давление po=1 атм (1,01310 5 Па), температуру 0 о С (T=273 K).
Закон Дальтона, определяющий давление смеси n газов.
,
где pi — парциальные давления компонентов смеси (i=1,2,…,n). Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молярная масса смеси n газов
.
Массовая доля i-го компонента смеси газа (в долях единицы или процентах)
,
Концентрация молекул
,
где N — число молекул, содержащихся в данной системе; — плотность вещества в системе; V — объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Уравнение Ван-дер-Ваальса для реального газа
,
где a и b — коэффициенты Ван-дер-Ваальса
Для идеального газа уравнение Ван-дер-Ваальса переходит в уравнение Менделеева — Клапейрона.
Основное уравнение молекулярно — кинетической теории газов
,
где п — средняя кинетическая энергия поступательного движения молекулы.
Средняя молекулярная масса представляет собой условную величину и относится к такому однородному газу, у которого число молекул и общая масса равны числу молекул и массе смеси газов.
Если известна величина газовой постоянной смеси, то
(3-7)
Заменяя газовые постоянные R1, R2, . Rn их значениями из уравнения Клапейрона, получаем выражение для средней молекулярной массы, если смесь задана массовыми долями:
(3-8)
Если смесь задана объемными долями, то, как следует из уравнения (3-6),
Поскольку то
(3-9)
Средняя молекулярная масса смеси газов равна сумме произведений объемных долей на молекулярные массы отдельных газов, составляющих смесь.
Парциальные давления
Парциальное давление газа может быть определено через массовые доли из уравнения Клапейрона, если известны основные параметры газа:
(3-10)
Для нахождения парциального давления каждого газа при задании смеси объемными долями можно воспользоваться законом Бойля — Мариотта, из которого следует, что при постоянной температуре
(3-11)
Парциальное давление каждого газа равно произведению общего давления смеси газов на его объемную долю.
Уравнением (3-11) обычно пользуются при технических расчетах и при испытаниях тепловых установок. Объемные доли газов определяют специальными аппаратами — газоанализаторами.
Удельная энтальпия, т. е. энтальпия, отнесенная к 1 кг, обозначается буквой i и представляет собой по определению сложную функцию вида
Дифференциал энтальпии di есть элементарное количество теплоты, участвующее в процессе при постоянном давлении. Вся теплота в процессе при постоянном давлении расходуется на изменение энтальпии:
(5-15)
Из уравнения (5-12) следует, что
(5-16)
Энтальпия больше внешней теплоты на величину работы vdp, которая на рv-диаграмме изображается элементарной площадкой abed (рис. 5-11). Очевидно, вся пл. ABCD определяется выражением
, которое называется располагаемой, или полезной, работой.
Изменение энтальпии полностью определяется начальным и конечным состоянием рабочего тела и не зависит от промежуточных состояний. Изменение энтальпии газа в циклах равно нулю, т. е.
Поскольку энтальпия является функцией основных параметров состояния, то di есть полный дифференциал этой функции при любых независимых переменных, характеризующих состояние газа;
(5-17)
Изменение энтальпии во всех процессах, протекающих между двумя точками А и В, будет одинаковым (рис. 5-12).
Физический смысл энтальпии будет понятен из рассмотрения следующего примера. На перемещающийся поршень в цилиндре с 1 кг газа помещена гиря массой т кг (рис. 5-13). Площадь поршня /; внутренняя энергия рабочего тела и. Потенциальная энергия гири равна произведению массы гири т на высоту S. Так как давление газа р уравновешивается массой гири, то потенциальную энергию ее можно выразить иначе:
Произведение /S есть удельный объем газа. Отсюда
Произведение давления на объем есть работа, которую надо затратить, чтобы ввести газ объемом v во внешнюю среду с давлением р. Таким образом, работа pv есть потенциальная энергия газа, зависящая от сил, действующих на поршень. Чем больше эти внешние силы, тем больше давление р и тем больше потенциальная энергия давления pv.
Если рассматривать газ, находящийся в цилиндре и поршень с грузом как одну систему, которую будем называть расширенной системой, то полная энергия Е этой системы складывается из внутренней энергии газа и и потенциальной энергии поршня с грузом, равной pv:
Отсюда видно, что энтальпия i равна энергии расширенной системы — тела и окружающей среды. В этом и заключается физический смысл энтальпии.
Значения энтальпий для паров, газов и газовых смесей приводятся в технической и справочной литературе. Пользуясь этими данными, можно определять количество теплоты, участвующее в процессе при постоянном давлении. Энтальпия получила большое значение и применение при расчетах тепловых и холодильных установок и, как параметр состояния рабочего тела, значительно упрощает тепловые расчеты. Она позволяет [применять графические методы при исследовании всевозможных термодинамических процессов и циклов.
Энтальпией особенно целесообразно пользоваться тогда, когда в качестве основных параметров принимают р и Т. Это наглядно можно видеть, если энтальпию i сравнить с внутренней энергией и. При v = const уравнение первого закона термодинамики dq = = du + pdv превращается в dqv = du, или qv — u2—u1 а при р = const qp = i3 — i1.
Энтальпия идеального газа,’ так же как и внутренняя энергия, является функцией температуры и не зависит от других параметров. Действительно, для идеального газа
следовательно (поскольку оба слагаемых зависят только от температуры), i = f(T).
Тогда по аналогии с внутренней энергией будем иметь
т. е. в любом процессе изменения состояния идеального газа производная от изменения энтальпии по температуре будет полной производной.
Численные значения энтальпий идеальных газов приведены в приложении, табл. XIII.
Дата добавления: 2018-02-15 ; просмотров: 1423 ; ЗАКАЗАТЬ РАБОТУ
Электронное учебное пособие
Москва 2013
2. Ocновные понятия и законы химии. Атомно-молекулярное учение
2.10. Примеры решения задач
2.10.1. Расчет относительных и абсолютных масс атомов и молекул
Относительные массы атомов и молекул определяются с использованием приведенных в таблице Д.И. Менделеева величин атомных масс. При этом, при проведении расчетов для учебных целей значения атомных масс элементов обычно округляются до целых чисел (за исключением хлора, атомная масса которого принимается равной 35,5).
Пример 1. Относительная атомная масса кальция Аr(Са)=40; относительная атомная масса платины Аr(Pt)=195.
Относительная масса молекулы рассчитывается как сумма относительных атомных масс составляющих данную молекулу атомов с учетом количества их вещества.
Пример 2. Относительная молярная масса серной кислоты:
Величины абсолютных масс атомов и молекул находятся делением массы 1 моль вещества на число Авогадро.
Пример 3. Определите массу одного атома кальция.
Решение. Атомная масса кальция составляет Аr(Са)=40 г/моль. Масса одного атома кальция окажется равной:
m(Ca)= Аr(Ca) : NA =40 : 6,02·10 23 = 6,64·10 -23 г.
Пример 4. Определите массу одной молекулы серной кислоты.
Решение. Молярная масса серной кислоты равна Мr(H2SO4) = 98. Масса одной молекулы m(H2SO4) равна:
2.10.2. Расчет количества вещества и вычисление числа атомных и молекулярных частиц по известным значениям массы и объема
Количество вещества определяется путем деления его массы, выраженной в граммах, на его атомную (молярную) массу. Количество вещества, находящегося в газообразном состоянии при н.у., находится делением его объема на объем 1 моль газа (22,4 л).
Пример 5. Определите количество вещества натрия n(Na), находящегося в 57,5 г металлического натрия.
Решение. Относительная атомная масса натрия равна Аr(Na)=23. Количество вещества находим делением массы металлического натрия на его атомную массу:
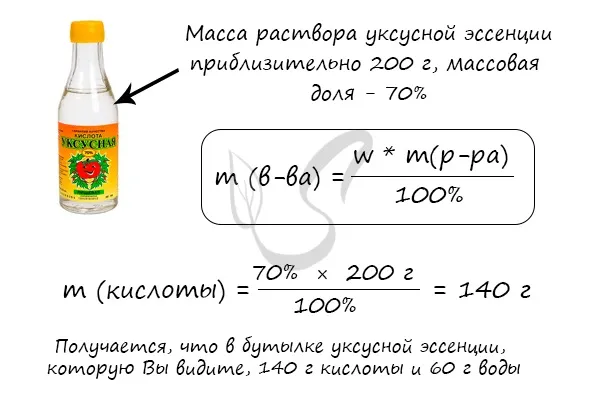
Пример 6 . Определите количество вещества азота, если его объем при н.у. составляет 5,6 л.
Решение. Количество вещества азота n(N 2) находим делением его объема на объем 1 моль газа (22,4 л):
Число атомов и молекул в веществе определяется умножением количества вещества атомов и молекул на число Авогадро.
Пример 7. Определите число молекул, содержащихся в 1 кг воды.
Решение. Количество вещества воды находим делением ее массы (1000 г) на молярную массу (18 г/моль):
Число молекул в 1000 г воды составит:
N(Н2О) = 55,5·6,02·10 23 = 3,34·10 24 .
Пример 8. Определите число атомов, содержащихся в 1 л (н.у.) кислорода.
Решение. Количество вещества кислорода, объем которого при нормальных условиях составляет 1 л равно:
n(О2) = 1 : 22,4 = 4,46·10 -2 моль.
Число молекул кислорода в 1 л (н.у.) составит:
N(О2) = 4,46·10 -2 · 6,02·10 23 = 2,69·10 22 .
Следует отметить, что 26,9·10 22 молекул будет содержаться в 1 л любого газа при н.у. Поскольку молекула кислорода двухатомна, число атомов кислорода в 1 л будет в 2 раза больше, т.е. 5,38·10 22 .
2.10.3. Расчет средней молярной массы газовой смеси и объемной доли
содержащихся в ней газов
Средняя молярная масса газовой смеси рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей.
Пример 9. Полагая, что содержание (в объемных процентах) азота, кислорода и аргона в воздухе соответственно составляет 78, 21 и 1, рассчитайте среднюю молярную массу воздуха.
Решение.
Мвозд = 0,78·Мr(N2)+0,21·Мr (O2)+0,01·Мr(Ar)= 0,78·28+0,21·32+0,01·40 = 21,84+6,72+0,40=28,96
или приблизительно 29 г/моль.
Пример 10. Газовая смесь содержит 12 л NH3, 5 л N2 и 3 л Н2, измеренных при н.у. Рассчитать объемные доли газов в этой смеси и ее среднюю молярную массу.
Решение. Общий объем смеси газов равен V=12+5+3=20 л. Объемные доли j газов окажутся равными:
Средняя молярная масса рассчитывается на основе объемных долей составляющих эту смесь газов и их молекулярных масс:
М=0,6·М(NH3)+0,25·M(N2)+0,15·M(H2) = 0,6·17+0,25·28+0,15·2 = 17,5.
2.10.4. Расчет массовой доли химического элемента в химическом соединении
Массовая доля ω химического элемента определяется как отношение массы атома данного элемента Х, содержащегося в данной массе вещества к массе этого вещества m. Массовая доля – безразмерная величина. Ее выражают в долях от единицы:
ω(X) = m(X)/m (0 Пример 11. Рассчитайте массовую долю марганца в оксиде марганца (VII).
Решение. Молярные массы веществ равны: М(Mn) = 55 г/моль, М(О) = 16 г/моль, M(Mn2O7)=2М(Mn)+7М(О)= 222 г/моль. Следовательно, масса Mn2O7 количеством вещества 1 моль составляет:
Из формулы Mn2O7следует, что количество вещества атомов марганца в два раза больше количества вещества оксида марганца (VII). Значит,
m(Mn)= n(Mn)·M(Mn) = 2·55 = 110 г.
Таким образом, массовая доля марганца в оксиде марганца(VII) равна:
2.10.5. Установление формулы химического соединения по его элементному составу
Простейшая химическая формула вещества определяется на основании известных величин массовых долей входящих в состав этого вещества элементов.
Допустим имеется образец вещества NaxPyOz массой mo г. Рассмотрим как определяется его химическая формула, если известны количества вещества атомов элементов, их массы или массовые доли в известной массе вещества. Формула вещества определяется отношением:
x : y : z = N(Na) : N(P) : N(O).
Это отношение не изменится, если каждый его член разделить на число Авогадро:
Таким образом, для нахождения формулы вещества необходимо знать соотношение между количествами веществ атомов в одной и той же массе вещества:
Если разделить каждый член последнего уравнения на массу образца mo, то получим выражение, позволяющее определить состав вещества:
Пример 12. Вещество содержит 85,71 масс. % углерода и 14,29 масс. % водорода. Молярная его масса равна 28 г/моль. Определите простейшую и истинную химические формулы этого вещества.
Решение. Соотношение между количеством атомов в молекуле СхНу определяется делением массовых долей каждого элемента на его атомную массу:
х : у = 85,71/12 : 14,29/1 = 7,14:14,29 = 1 : 2.
Таким образом простейшая формула вещества — СН2. Простейшая формула вещества не всегда совпадает с его истинной формулой. В данном случае формула СН2 не соответствует валентности атома водорода. Для нахождения истинной химической формулы необходимо знать молярную массу данного вещества. В данном примере молярная масса вещества равна 28 г/моль. Разделив 28 на 14 (сумму атомных масс, отвечающих формульной единице СН2), получаем истинное соотношение между числом атомов в молекуле:
Получаем истинную формулу вещества: С2Н4— этилен.
Вместо молярной массы для газообразных веществ и паров в условии задачи может быть указана плотность по какому-либо газу или по воздуху.
В рассматриваемом случае плотность газа по воздуху составляет 0,9655. На основании этой величины может быть найдена молярная масса газа:
М = Мвозд·Dвозд = 29·0,9655 = 28.
В этом выражении М – молярная масса газа СхНу, Мвозд – средняя молярная масса воздуха, Dвозд — плотность газа СхНу по воздуху. Полученная величина молярной массы используется для определения истинной формулы вещества.
В условии задачи может не указываться массовая доля одного из элементов. Она находится вычитанием из единицы (100%) массовых долей всех остальных элементов.
Пример 13. Органическое соединение содержит 38,71 масс. % углерода, 51,61 масс. % кислорода и 9,68 масс. % водорода. Определить истинную формулу этого вещества, если плотность его паров по кислороду составляет 1,9375.
Решение. Рассчитываем соотношение между количеством атомов в молекуле СхНyОz:
х : у : z = 38,71/12 : 9,68/1 : 51,61/16 = 3,226 : 9,68 : 3,226= 1:3:1.
Молярная масса М вещества равна:
М = М(O2)·D(O2) = 32·1,9375 = 62.
Простейшая формула вещества СН3О. Сумма атомных масс для этой формульной единицы составит 12+3+16=31. Делим 62 на 31 и получаем истинное соотношение между количеством атомов в молекуле:
х : у : z = 2 : 6 : 2.
Таким образом, истинная формула вещества С2Н6О2. Эта формула отвечает составу двухатомного спирта – этиленгликоля: СН2(ОН)-СН2(ОН).
2.10.6. Определение молярной массы вещества
Молярная масса вещества может быть определена на основе величины плотности его паров по газу с известной величиной молярной массы.
Пример 14 . Плотность паров некоторого органического соединения по кислороду равна 1,8125. Определите молярную массу этого соединения.
Решение. Молярная масса неизвестного вещества Мx равна произведению относительной плотности этого вещества D на молярную массу вещества M, по которому определено значение относительной плотности:
Мx = D·M = 1,8125·32 = 58,0.
Веществами с найденным значением молярной массы могут быть ацетон, пропионовый альдегид и аллиловый спирт.
Молярная масса газа может быть рассчитана с использованием величины молярного его объема при н.у.
Пример 15. Масса 5,6 л газа при н.у. составляет 5,046 г. Рассчитайте молярную массу этого газа.
Решение. Молярный объем газа при н.у равен 22,4 л. Следовательно, молярная масса искомого газа равна
М = 5,046·22,4/5,6 = 20,18.
Искомый газ – неон Ne.
Уравнение Клапейрона–Менделеева используется для расчета молярной массы газа, объем которого задан при условиях, отличающихся от нормальных.
Пример 16. При температуре 40 о С и давлении 200 кПа масса 3,0 л газа составляет 6,0 г. Определите молярную массу этого газа.
Решение. Подставляя известные величины в уравнение Клапейрона–Менделеева получаем:
М = mRT/PV = 6,0·8,31·313/(200·3,0)= 26,0.
Рассматриваемый газ – ацетилен С2Н2.
Пример 17. При сгорании 5,6 л (н.у.) углеводорода получено 44,0 г углекислого газа и 22,5 г воды. Относительная плотность углеводорода по кислороду равна 1,8125. Определите истинную химическую формулу углеводорода.
Решение. Уравнение реакции сгорания углеводорода можно представить следующим образом:
Количество углеводорода составляет 5,6:22,4=0,25 моль. В результате реакции образуется 1 моль углекислого газа и 1,25 моль воды, которая содержит 2,5 моль атомов водорода. При сжигании углеводорода количеством вещества 1 моль получается 4 моль углекислого газа и 5 моль воды. Таким образом, 1 моль углеводорода содержит 4 моль атомов углерода и 10 моль атомов водорода, т.е. химическая формула углеводорода С4Н10. Молярная масса этого углеводорода равна М=4·12+10=58. Его относительная плотность по кислороду D=58:32=1,8125 соответствует величине, приведенной в условии задачи, что подтверждает правильность найденной химической формулы.
© Факультет естественных наук РХТУ им. Д.И. Менделеева. 2013 г.
Уравнение молярной масс смеси газов
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
Примеры решения типовых задач
V. Определение средней молярной массы смеси газов
Формулы и понятия, которые используются:
где М(смеси) — средняя молярная масса смеси газов,
М(А), М(Б), М(В) — молярные массы компонентов смеси А, Б и В,
χ(А), χ(B), χ(В) — мольные доли компонентов смеси А, Б и В,
φ(А), φ(B), φ(В) — объемные доли компонентов смеси А, Б и В,
М(пов.) — молярная масса воздуха, г/моль,
М r (пов.) — относительная молекулярная масса воздуха.
Задача 23. Вычислите молярну массу смеси, в которой объемные доли метана и бутана соответственно составляют 85 и 15%.
Молярная масса смеси — это масса всех ее составляющих, взятых в суммарном количестве вещества смеси 1 моль (М(СН 4 ) = 16 г/моль, М(С4Н10) = 58 г/моль). Вычислить среднюю молярну массу смеси можно по формуле:
Ответ: М(смеси) = 22 , 3 г/моль.
Задача 24. Определите плотность газовой смеси с азотом, в которой объемные доли карбон(И V ) оксида, сульфур(И V ) оксида и карбон(II) оксида соответственно составляют 35,25 и 40 %.
1. Вычислим молярну массу смеси (М(С O 2 ) = 44 г/моль, M ( SO 2 ) = 64 г/моль, М(СО) = 28 г/моль):
2. Вычислим относительную плотность смеси с азотом:
Ответ: DN2 (смеси) = 1,52.
Задача 25. Плотность смеси ацетилена и бутену за гелием равна 11. Определите объемную долю ацетилена в смеси.
1. По формуле определим молярну массу смеси (М(Не) = 4 г/моль):
2. Предположим, что мы имеем 1 моль смеси. В ней содержится х моль С2Н2, тогда в соответствии
3. Запишем выражение для вычисления средней молярной массы газовой смеси:
Подставим все известные данные: М(С2Н2) = 26 г/моль, М(С4Н8) = 56 г/моль:
4. Следовательно, 1 моль смеси содержит 0,4 моль С2Н2. Вычислим мольну долю χ(С2Н2):
Для газов φ(Х) = χ(Х). Следовательно, φ(С2Н4) = 40 %.
http://hd01.ru/info/kak-najti-molekuljarnuju-massu-smesi/
http://na-uroke.in.ua/13-111.html
Учебники могут включать следующие вопросы. ‘Найдите массу 0,75 моль азота N2’. Начните с нахождения массы азота. Согласно таблице Менделеева, она составляет 14 г. Поскольку одна молекула состоит из двух лиц, масса молекулы азота как простого вещества равна 28, что дает массу 21 г для молекулы 0,75.
Как правильно рассчитать молярную массу в химии?
Молекулы — это маленькие частицы, массу которых невозможно измерить на обычной шкале. Для удобства ученые ввели термин «молекула». Отсюда происходит термин «молекулярный вес».
Молекулярная масса (m) — это масса моля, выраженная в г/моль. Во многих случаях это то же самое, что и относительный индивидуальный или молекулярный вес.
Как найти молярную массу в химии
- определение массы атома;
- умножение атомной массы на количество атомов;
- в сложных веществах суммирование всех масс атомов, умноженных на число атомов.
Задача. Найдите молекулярную массу фторида. f2.
- Решение. Атомная масса Аr Фторид f равен 19. Фторид — это газ.2 равна 38 г/моль.
Выпуск. Cacl Кальций кальция подошвенной массы2.
Учитывая химическую формулу, молекула хлорида кальция содержит два атома хлора, поэтому относительные индивидуальные веса хлора должны быть умножены на два.
Особенности молярной массы
Выпуск. Найдите молекулярную массу и относительную индивидуальную массу калия.
Решение. Индивидуальные веса элементов можно найти по журналу Дмитрия Ивановича Менделеева.
Поскольку калий К является металлом, а не газом, это означает, что индивидуальный вес не должен умножаться на какой-либо показатель.
Таким образом, относительный индивидуальный и молекулярный вес калия совпадают.
Выпуск. Рассчитайте относительную индивидуальную и молекулярную массу кислорода.
Решение. Рассчитайте относительную индивидуальную массу ar 16 для кислорода. Поскольку кислород является газом, относительную индивидуальную массу необходимо умножить на индекс 2.
Поэтому относительная атомная масса и молекулярный вес кислорода не одинаковы.
Если при постоянном давлении добавляется газ с большей молекулярной массой, плотность газовой смеси увеличивается; если добавляется газ с меньшей молекулярной массой, плотность газовой смеси уменьшается.
Урок 5. Моль и молярная масса
В уроке 5 «Молекулы и молекулярный вес» из цикла «Глупая химия» вы узнаете, как рассматривать молекулу как количественную единицу материи, определять число Авогадро, определять молекулярный вес и решать задачи, связанные с количеством Материя. Поскольку этот урок опирается на основы химии, рассмотренные в предыдущих курсах, рекомендуется временно посмотреть его еще раз, если вы изучаете химию с нуля.
Единица измерения количества вещества
Ранее в этом уроке мы обсуждали только отдельные молекулы и индивидуумы и выражали массу в терминах отдельных единиц массы. В реальной жизни работа с отдельными молекулами ничтожно мала, и поэтому ею невозможно манипулировать. Для этого химики взвешивают вещества, которые не являются A.U.M. Но в граммах.
Для перехода от шкалы молекулярного веса на лабораторные весы используется единица измерения количества вещества, называемая моль. Один моль содержит 6,022-10 23 частиц (индивидуальных или молекулярных) и является безразмерным. Число 6,022-10 23 называется числом Авогадро и определяется как количество частиц в 12 граммах 12 атомов углерода. (10 23).
Как уже упоминалось, термин «молекула» применяется не только к молекулам, но и к индивидуумам. Например, если мы говорим о молекулах соляра (ОН), то 6,022-10 означает, что 23 человека многочисленны. Аналогично, один моль воды (h2(O) 6,022-10 23 точечных количества. Однако чаще всего молекулы называют молекулами.
Молярная масса вещества
Молекулярная масса — это масса одного моля вещества, выраженная в граммах. Молекулярный вес моля любого химического вещества можно легко найти из таблицы Мендели, поскольку молекулярный вес численно равен индивидуальной массе, но имеет другую размерность (молекулярный вес имеет размерность Г/моль). Вычислить и сохранить рассчитанный молекулярный вес, количество вещества и число молекул.
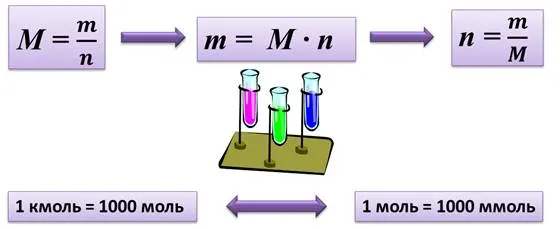
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =Na·n
где m — масса вещества, n — число веществ (число молекул), m — молекулярная масса, n — число молекул и na — Число Авогадро. Благодаря молекулярному весу вещества химики могут измерять лабораторные особи и молекулы, просто взвешивая их. Это удобное использование понятия молекулы.
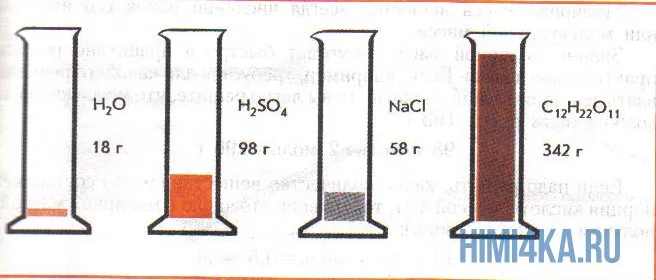
На этой диаграмме показаны четыре различные бутылки с веществом, каждая из которых содержит только один моль вещества. Вышеперечисленные типы можно использовать для повторной проверки.
Доля массы рассчитывается по типу Ω (вещества) = m (вещества) / m (раствора). Полученное число показывает процент массы в виде одного процента, который вы можете умножить на 100 %, если хотите перевести его в проценты. Это показано в примере.
Решение задач по химии
Эта статья относится к базовой химической концепции, которую совершенно невозможно решить. Чтобы разобраться в этом вопросе, попробуйте понять концепцию натуральной величины.
В этой статье мы постараемся привести как можно больше примеров. Во время учебы вы найдете множество примеров на эту тему.
Относительные индивидуальные массы — ar
Масса человека, выраженная в индивидуальных единицах массы. Относительные индивидуальные веса приведены в D.I. Менделеев. Так, атом водорода имеет атомную массу = 1, кислорода = 16 и кальция = 40.
Соответствующая молекулярная масса равна mr
Относительный молекулярный вес — это сумма относительных индивидуальных весов всех элементов, входящих в состав вещества. Например, найдите соответствующие молекулярные веса кислорода, воды, перманганата калия и купоросной меди.
Моль и число Авогадро.
Это единица измерения вещества (в системе единиц СИ), которая определяется как количество вещества. 10 23.
Число Авогадро (постоянная Авогадро, na) — это число частиц (молекул, индивидов и ионов) в молекулах любого вещества.
Прежде всего, я хотел бы понять физическое значение изучаемой вами концепции. Молекула является международной единицей измерения количества вещества и указывает на число индивидов, молекул или ионов, содержащихся в определенной массе или количестве вещества. В молекуле любого вещества содержится 6,02 x 10 23 чел/молекула/ион — это самое важное, что нужно понять сейчас.
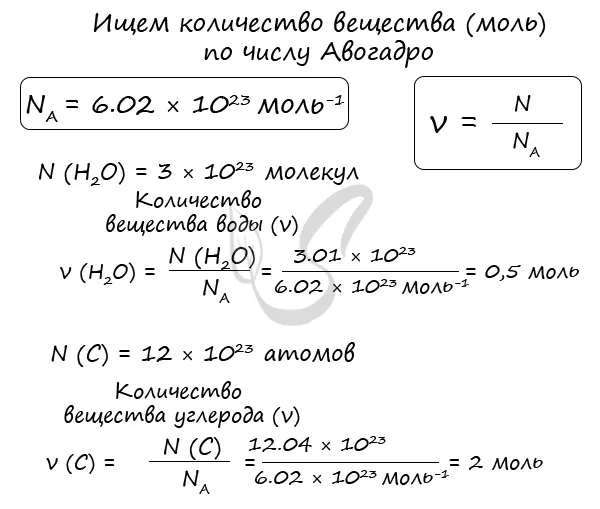
Иногда, если есть проблема, вам дадут число Авогадро и попросят найти количество кротовых нор. Количество вещества в химии символизируется n, n (эллинское «сердце»).
Вычислим, используя тип: n = n/na Это количество вещества из 3,01 x 10 23 молекул воды и 12,04 x 10 23 атомов углерода.
Мы нашли количество воды и углеродного вещества (моль). Это может показаться очень абстрактным, но без знания того, как использовать число Авогадро для нахождения количества вещества, невозможно решить задачу по химии.
Молекулярный вес — m
Молекулярная масса — это масса молекулы вещества, выраженная в «г/моль» (граммах/моль). Численно она совпадает с относительной молекулярной массой, изученной ранее.
Рассчитайте молекулярный вес Caco3, hcl и n2
m(hcl) = ar(h) + ar(cl) = 1 + 35,5 = 36,5 г/моль
м (н)2) = ar(n) x 2 = 14 x 2 = 28 г/моль
Полученные знания должны быть последовательной, а не грубой системой. Примечание: Вы только что рассчитали молекулярную массу, т.е. массу молекулы вещества. Вспомните число Авогадро.
Вы увидите, что хотя в одном моле присутствует одинаковое количество молекул (один моль вещества содержит 6,02 x 10 23 точек), они имеют разный молекулярный вес. Следовательно, 6,02 x 10-23 молекул n2 молекула весит 28 грамм, а такое же количество молекул HCl весит 36,5 грамм.
Это происходит потому, что хотя число молекул одинаково, их массы различны, так как 6,02 x 10 23- они имеют разные лица в своем составе.
Молекулярная масса — это масса молекул вещества. Молекула — это количество вещества, которое содержит определенное число мелких частиц, участвующих в химическом процессе. Число молекул в молекуле называется числом Авогадро. Эта величина постоянна и не изменяется.
Способы вычисления средней молярной массы газовой смеси
Здесь: молекулярное число газа, — молекулярный вес газа, — количество газа в АА (- небольшое количество газа в смеси газов.
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле:
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании и
При смешивании газов с разным молекулярным весом, при одинаковом давлении, средний молекулярный вес (при нулевом давлении) и плотность полученной газовой смеси принимает значение между молекулярным весом и плотностью газовой смеси. Например, во время смешивания
Если при постоянном давлении добавляется газ с большей молекулярной массой, плотность газовой смеси увеличивается; если добавляется газ с меньшей молекулярной массой, плотность газовой смеси уменьшается.
Закон объемных отношений
В химических реакциях отношение количества реагирующего газа к количеству образующегося газа равно отношению коэффициентов. Например:.
Арифметические соотношения опухолей, молекул и молекул равны друг другу.
Следующие расчеты могут быть выполнены для смесей
3) Отношение двух массовых коэффициентов газа:.
Чтобы скопировать материал с сайта evkova.org, посетите www.evkova.orgにアクティブリンクが必要です.
Сайт был создан группой преподавателей некоммерческой организации по дополнительному обучению молодежи.
Сайт написан, поддерживается и управляется группой учителей
Telegram и логотип Telegram являются торговыми марками Telegram Corporation FZ-LLC.
Данный сайт предназначен для информационных целей и ни в коем случае не является публичным тендером, как это определено в статье 437 Гражданского кодекса Российской Федерации. Анна Евкова не оказывает услуг.
Решение: молекулярная масса (индивидуальные единицы массы) веществ, перечисленных в таблице Менделеева. Каждое названное вещество имеет следующие массы.
Что такое молярная масса?
Основателем теории индивидуальных масс был ученый Дальтон, который составил таблицу индивидуальных масс и рассматривал кусок водорода как единицу.
Молекулярная масса — это масса молекул вещества. Молекула — это количество вещества, которое содержит определенное число мелких частиц, участвующих в химическом процессе. Число молекул в молекуле называется числом Авогадро. Эта величина постоянна и не изменяется.
Рисунок 1.Типы чисел Авогадро.
Таким образом, молекулярная масса вещества — это масса молекул, содержащих 6,02*10^23 элементарных частиц.
Число Авогандро названо в честь итальянского ученого Амедео Авагандро. Он показал, что число молекул одного и того же количества газа всегда одинаково.
Молекулярный вес в международной системе СИ измеряется в кг/моль, но обычно выражается в граммах/моль. Это количество обозначается английской буквой М. Формула молекулярного веса такова
где m — масса вещества, а v — количество вещества.
Рисунок 2.Расчет молекулярной массы.
Как найти молярную массу вещества?
Чтобы рассчитать молекулярный вес вещества, используйте таблицу Менделеева. Возьмем такое вещество, как серная кислота, формула которой имеет вид2 Итак.4. Затем перейдите к таблице, чтобы узнать атомный вес каждого компонента кислоты. Серная кислота состоит из трех элементов: водорода, серы и кислорода. Атомные массы этих элементов равны 1, 32 и 16 соответственно.
Видно, что общая молекулярная масса равна атомной массе 98 единиц (1 * 2 + 32 + 16 * 4). Таким образом, масса одной молекулы серной кислоты равна 98 граммам.
Если составными частями вещества являются молекулы, то молекулярный вес вещества численно равен его относительному молекулярному весу. Если составными частями вещества являются атомы, молекулярная масса вещества может быть равна относительной атомной массе.
До 1961 года атом кислорода рассматривался как единица атомной массы, но 1/16 часть атома, а не весь атом. Однако химические и физические единицы массы не были одинаковыми. Химическая масса была на 0,03% выше физической.
Сегодня в физике и химии используется единая система измерений. Стандартная э.м.с. 1/12 часть массы атома углерода.
Рисунок 3.Формула единиц атомной массы углерода.
Молекулярный вес газов и паров можно измерить очень легко. Достаточно использовать контроль. Газообразное вещество того же объема будет иметь ту же массу, что и другое вещество при той же температуре. Известный метод измерения количества пара заключается в определении объема воздуха, который отталкивается. Такая процедура выполняется с помощью бокового выхода, ведущего к измерительному устройству.
Понятие молекулярного веса очень важно в химии. Его расчет необходим для создания макромолекулярных комплексов и многих других реакций. Фармацевты используют молекулярный вес для определения концентрации конкретного вещества внутри вещества. Молекулярный вес также важен для биохимических исследований (элементарный обмен).
Сегодня, благодаря достижениям науки, известен молекулярный вес почти всех компонентов крови, включая гемоглобин.
Вам предлагается самостоятельно решить следующую задачу (решение ниже): «Найти молекулярную массу неизвестного вещества, плотность неизвестного вещества по кислороду равна 3,5».
Молярная масса
Этот видеоклип поможет учащимся узнать, что такое молекулярный вес и как его измеряют. С помощью этого курса нетрудно научиться использовать молекулярный вес для решения задач. Это связано с тем, что подробные объяснения и решения являются проблематичными.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к видеоурокам этого и других комплектов, необходимо приобрести их в каталоге и добавить в личный кабинет.
Конспект урока «Молярная масса»
Масса молекул вещества — это его молекулярный вес. Молекулярная масса — это также физическая величина, равная отношению между массой и количеством вещества. Поэтому молекулярный вес численно равен относительному молекулярному весу, но в отличие от него существует одна единица измерения — г/моль или кг/моль.
Поэтому молекулярный вес может быть определен с помощью следующего уравнения
М =
Поэтому остальные уравнения также применимы.
m = n-M
n =
Количество вещества можно измерить в киломолях и миллимолях, а также в молях. Так, 1 киломоль = 100 0моль — 1 моль = 100 млмоль. молекулярные веса также имеют соответствующие названия. Тысячелетние массы и их единицы — кг/кмоль, а тысячелетние — мг/моль.
Используйте новые типы для решения проблемы.
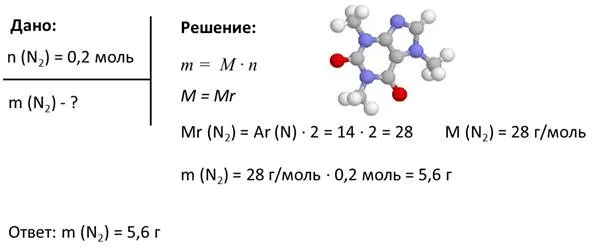
1. найти массу n2 а количество вещества составляет 0,2 моль.
В нашем термине дано количество вещества азота 0,2 моль. Мы должны найти его массу. Чтобы решить эту задачу, мы используем данный тип для нахождения массы количества вещества. Для этого, однако, нам необходимо знать молекулярный вес азота, который равен относительному молекулярному весу. Чтобы найти его, умножьте относительные индивидуальные веса азота на два, так как в молекуле их два. Замените значения и получите результат 28. Это связано с тем, что относительная молекулярная масса равна 28. Таким образом, молекулярная масса составляет 28 г/моль. Поскольку теперь легко найти массу, мы умножаем молекулярную массу на количество вещества, т.е. 28 г/моль х 0,2 моль. Результат — 5,6 г. Таким образом, масса 0,2 моль азота составляет 5,6 г.
2. найти количество вещества SIO2 Масса составляет 120 г.
В нашей постановке задачи дана масса вещества — 120 г. Мы должны найти его количество. Чтобы решить задачу, используйте этот тип для нахождения количества вещества на массу. Однако для этого нам необходимо знать молекулярный вес SIO2. Для этого найдите относительную молекулярную массу. Увеличьте относительный индивидуальный вес кремния в два раза по отношению к относительному атомному весу кислорода. Удалите значение, чтобы получить 60. Таким образом, молекулярная масса составляет 60 г/моль. Теперь вы также можете найти количество вещества. Для этого можно разделить 120 г на 60 г/моль. В результате получается 2 моль. Это означает, что масса 2 моль SIO2 120 g.
Архив уроков › Основные законы химии
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023молекул. Однако чаще всего моль применяют именно к молекулам.
Расчёты в смеси
Задачу можно усложнить, попробовав посчитать этот показатель в смеси, где в разных пропорциях входят различные соединения. Идеальным примером для этого является воздух. В нем можно выделить следующие составляющие:
Искомый параметр будет вычисляться следующим образом: 0,23*32+0,76*28+0,01*40. Результат равен 29,04 г/моль (можно округлить до 29).
Конечно, в воздухе содержатся и другие вещества (углекислый и инертные газы, водород и т. д. ), но их масса составляет менее десятой процента, поэтому для простоты их допускается не учитывать.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Определение в сложных веществах
Для простых веществ, состоящих из одного атома, параметр считается так же, как для элемента. Молярная масса углерода всегда равна 12. Этот показатель справедлив и для натрия. Как простое вещество, этот мягкий серебристо-белый металл содержит в себе 23 г/моль, а купрум (так на латинском обозначается медь) — 63,5 г/моль. Газ также может состоять из одного элемента, например, гелий, искомый параметр которого 4 г/моль.
Но существуют и газы, которые образованы двумя молекулами (водород, азот, кислород, хлор, фтор и другие) или тремя (озон). Для них нужно не забывать умножать атомную массу на число молекул. Для сложных веществ параметр можно рассчитать аналогичным образом:
- В H2O содержится два атома водорода и один кислорода, результат считается как 2 * 1 + 16. Итоговое значение молярной массы воды равно 18. Этот параметр для углекислого газа CO2 равен 44 (сумма массы углерода 12 и двух атомов кислорода 32), а для сернистого газа SO2 — 64 г/моль.
- Органическое вещество метан, формула которого CH4, состоит из одного атома углерода и четырёх водорода, следовательно, ему свойственно значение 16. А у этана, содержащего на одну группу CH2 больше, масса равняется 30 г/моль.
- В аммиаке NH3 — 17 г/моль.
- В соляной кислоте HCl содержится 36,5 г/моль (обычно атомную массу хлора считают как 35,5, тогда как для многих других элементов её чаще округляют до целого значения). В хорошо известной калиевой щёлочи KOH — 56 г/моль.
- В натриевой соли серной кислоты Na2SO4, как следует из химической формулы, находится 142 г/моль, а в алюминиевой (Al2 (SO4)3) — 342 г/моль. В азотнокислом серебре AgNO3 — 170 г/моль, в хлориде калия KCl — 74,5 г/моль.
- В молекуле сахара, как в быту называют сахарозу, содержится 12 атомов углерода, 22 водорода и 11 кислорода, а это значит, что его масса равна 342 г/моль. В глюкозе 6, 12 и 6 атомов углерода, водорода и кислорода соответственно, а параметр равен 180 г/моль.
Исходя из этого, формулу молярной массы можно вывести следующим образом: М (XxYy) = М (Хx) + М (Yy) = x * М (Х) + y * М (Y). Таким образом, вычислить этот параметр для любого органического или неорганического вещества совсем несложно.
Главное, иметь под рукой таблицу Менделеева, тогда никакие онлайн-калькуляторы не потребуются.
Как посчитать вес зная объем и плотность
Задача № 1. Найдите плотность молока, если 206 г молока занимают объем 200 см 3 ?
Задача № 2. Определите объем кирпича, если его масса 5 кг?
Задача № 3. Определите массу стальной детали объёмом 120 см 3
Задача № 4. Размеры двух прямоугольных плиток одинаковы. Какая из них имеет большую массу, если одна плитка чугунная, другая — стальная?
Решение: Из таблицы плотности веществ (см. в конце страницы) определим, что плотность чугуна (ρ2 = 7000 кг/м 3 ) меньше плотности стали (ρ1 = 7800 кг/м 3 ). Следовательно, в единице объема чугуна содержится меньшая масса, чем в единице объема стали, так как чем меньше плотность вещества, тем меньше его масса, если объемы тел одинаковы.
Задача № 5. Определите плотность мела, если масса его куска объемом 20 см 3 равна 48 г. Выразите эту плотность в кг/м 3 и в г/см 3 .
Ответ: Плотность мела 2,4 г/см 3 , или 2400 кг/м 3 .
Задача № 6. Какова масса дубовой балки длиной 5 м и площадью поперечного сечения 0,04 м 2 ?
ОТВЕТ: 160 кг.
РЕШЕНИЕ. Из формулы для плотности получаем m = p • V. С учетом того, что объем балки V = S • l , получаем: m = p • S • l.
Вычисляем: m = 800 кг/м 3 • 0,04 м 2 • 5 м = 160 кг.
Задача № 7. Брусок, масса которого 21,6 г, имеет размеры 4 х 2,5 х 0,8 см. Определить, из какого вещества он сделан.
ОТВЕТ: Брусок сделан из алюминия.
Задача № 8 (повышенной сложности). Полый медный куб с длиной ребра а = 6 см имеет массу m = 810 г. Какова толщина стенок куба?
ОТВЕТ: 5 мм.
РЕШЕНИЕ: Объем кубика VK = а 3 = 216 см 3 . Объем стенок VС можно вычислить, зная массу кубика mК и плотность меди р: VС = mК / р = 91 см 3 . Следовательно, объем полости VП = VK — VC = 125 см 3 . Поскольку 125 см 3 = (5 см) 3 , полость является кубом с длиной ребра b = 5 см. Отсюда следует, что толщина стенок куба равна (а — b)/2 = (6 – 5)/2 = 0,5 см.
Задача № 9 (олимпиадный уровень). Масса пробирки с водой составляет 50 г. Масса этой же пробирки, заполненной водой, но с куском металла в ней массой 12 г составляет 60,5 г. Определите плотность металла, помещенного в пробирку.
ОТВЕТ: 8000 кг/м 3
РЕШЕНИЕ: Если бы часть воды из пробирки не вылилась, то в этом случае общая масса пробирки, воды и куска металла в ней была бы равна 50 г + 12 г = 62 г. По условию задачи масса воды в пробирке с куском металла в ней равна 60,5 г. Следовательно, масса воды, вытесненной металлом, равна 1,5 г, т. е. составляет 1/8 массы куска металла. Таким образом, плотность металла в 8 раз больше плотности воды.
Задачи на плотность, массу и объем с решением. Таблица плотности веществ.
Справочный материал «Задачи на плотность, массу и объем»
Конспект урока «Задачи на плотность, массу и объем с решением».
Источник: uchitel.pro
Концентрации и доли. Как перевести одну концентрацию в другую.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% — 21% — 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Ответ:
Потому что в формуле расчёта молярной концентрации участвует объём раствора, а жидкости, как известно, в большинстве своём расширяются с ростом температуры.
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} | large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | |||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} | = | ||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | |||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | |||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | ||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Похожие записи:
Теоретическая выкладка
Ещё в Древней Греции учёные знали формулу определения объема вещей в зависимости от массы и плотности. Так Архимед открыл закон, названный его именем. Почему же ведро с водой поднять заметно легче, чем с песком? Всё объясняется различной плотностью веществ. В единице объёма песка больше вещества, чем в воде, значит, он плотнее жидкой субстанции.
Структура практически всех окружающих субстанций неравномерна, а значит, и концентрация массы в единице веществ отличается, но незначительно. В задачах этой разницей пренебрегают.
Плотностью называется величина, получаемая вследствие разделения массы объекта на занимаемое им пространство. В физике имеет вид:
ρ = m/V, ρ – читается как «ро».
В системе СИ измеряется в кг/м³, на практике применяются кратные и дольные единицы измерения, например, см/кг3.
В физике существует несколько трактовок или типов плотностей:
- объёмная – рассматриваемая величина;
- поверхностная – отношение веса к площади;
- линейная – указывает на обратную пропорциональность массы к длине, применяется в двухмерных вычислениях;
- плотность электрического заряда.
Относительно к газам формула видоизменяется:
ρ = M / Vm, здесь, M и Vm – молярные масса с объёмом соответственно.