Масса атомов и молекул
Одной из важнейших характеристик атома
является его масса. Массы атомов и
молекул, выраженные в стандартных
единицах массы (г или кг), называются
абсолютными: mA
— абсолютная масса
атома, mM
— абсолютная масса молекулы. Их
значения очень малы, для практических
целей пользоваться ими неудобно.
Принято представлять массу атомов и
молекул в виде относительных величин,
определенных по отношению к массе атома
какого-либо элемента: Аr
— относительная масса атома, Mr
— относительная масса молекулы (от
лат. relativus — относительный).
Исторически первой единицей атомной
массы была масса атома Н — водородная
единица, введенная Дальтоном. С 1860 г. в
научной практике утверждается кислородная
единица атомной массы, предложенная
Берцелиусом. Неточность этих единиц и
неточность вычисленных по ним атомных
масс элементов проявилась, когда было
установлено. что большинство элементов
в природе состоит из атомов разной массы
— изотопов (для природного кислорода
это смесь 16О, 17О, 18О).
В настоящее время принята углеродная
единица измерения атомных масс, которая
равна 1/12 части массы изотопа углерода
12С. Она называется атомной
единицей массы (а.е.м.). Ее значение:
1 а.е.м. = (1,6605655 ± 0,0000086). 10-27
кг. В таблице Менделеева для каждого
элемента приведено значение относительной
атомной массы Аr,
которое показывает, во сколько раз атом
этого элемента тяжелее 1/12 части массы
изотопа углерода 12С. Это безразмерная
величина, но можно сказать, что она
составляет столько а.е.м. (наименование
а.е.м. обычно опускается).
Значения относительных атомных масс
элементов отличаются от целых чисел
(дробные). Это связано с тем, что большинство
элементов существуют в природе в виде
нескольких изотопов, количество которых
неодинаково. Например, в природе ~ 76%
атомов хлора имеют массу 35, а ~ 24% атомов
— массу 37. Отсюда относительная масса
хлора с учетом доли распространенности
каждого изотопа: Аr
(Cl) = 0,76 . 35 + 0,24 .
37 ≈ 35,5 . Кроме того, атомные массы изотопов
не равны точно целым числам из-за отличия
масс нуклонов (протонов и нейтронов в
ядре) от 1 а.е.м. и из-за «дефекта массы».
Относительная молекулярная масса Mr
складывается из относительных масс
атомов, входящих в молекулу: Mr
(Н2О) = 2 . 1 + 16 = 18 . Для
веществ с немолекулярной структурой
(кристаллических) молекулярную массу
рассчитывают для условной молекулы
(формульной единицы): Mr
(NaCl) = 23 + 35,5 = 58,5.
Количество вещества. Моль.
Одна из важнейших физических величин,
часто используемых наряду с массой m
и объемом V веществ в
химических расчетах, — количество
вещества n (встречаются
и другие обозначения). Его единица
измерения в системе СИ — моль (от
лат. moles — количество,
счетное множество).
Моль — это количество вещества (порция
вещества), содержащее 6,02 . 1023
структурных единиц (т.е. любых частиц
вещества: молекул, атомов, ионов,
электронов, ядер).
Постоянная величина NA
= 6,0249 . 1023
моль -1 (для практических
расчетов принимается 6,02 . 1023
моль -1) —постоянная Авогадро
(число Авогадро)— показывает число
частиц в 1 моле любого вещества.
В молях можно измерять количества
вещества любых частиц, т.е. и вещество
в целом, и его составные части. Например:
1) 1 молекула водорода Н2 содержит
2 атома водорода Н
6,02 . 1023 молекул Н2
— 2 . 6,02 . 1023
атомов Н
1 моль Н2 —
2 моль Н
2) 1 моль углекислого газа СО2
содержит 1 моль молекул СО2, 1 моль
атомов С, 2моль атомов О, 3 моль ядер, 22
моль электронов
3) для веществ с немолекулярной структурой
1 моль вещества — это 6,02 . 1023
условных молекул (формульных единиц):
1 моль NaCl содержит 1 моль
ионов Na+, 1 моль ионов
Cl—
1 моль NaCl состоит из 1 моль
ионов Na+ и 1 моль
ионов Cl—
4) 1 моль карбоната натрия Na2CO3
содержит 1 моль групп СО3, 2 моль
ионов Na+, 1 моль ионов
СО3 2-, 1 моль атомов С, 3 моль
атомов О и т.д.
1 моль Na2CO3
состоит из 2 моль ионов Na+
и 1 моль ионов СО3 2-
Количество вещества можно определить
по формуле: n = N
/ NA
, если известно N
— число частиц вещества.
Количество вещества имеет массу. Масса
1 моля вещества называется его молярной
массой М. Молярную массу обычно
выражают в г/моль.
Молярная масса вещества, выраженная в
граммах, численно равна средней массе
структурной единицы вещества, выраженной
в а.е.м. Например:
1) вещество кислород состоит из молекул
О2. Масса 1 молекулы О2.
(молекулярная масса) составляет 32 а.е.м.,
а масса 6,02 . 1023 молекул (т.е.
1 моля кислорода) — 32 г. Это записывается
так: Mr
(О2) = 32 , М (О2) = 32 г/моль.
2) масса иона натрия: Аr
(Na+) = 23 а.е.м.,
масса 1моля ионов Na+:
М (Na+) = 23 г/моль
Количество вещества может быть выражено
и такой формулой: n
= m / M
,
где m — масса вещества
(т.е. число молей равно числу молярных
масс).
В химических расчетах удобно пользоваться
количественными величинами,
пропорциональными 1 молекуле, 1 атому,
1 иону и т.д., т.е. молями. Например, если
необходимо провести реакцию цинка с
соляной кислотой так, чтобы исходные
вещества прореагировали полностью, без
остатка, надо взять их точные количества:
Zn + 2 HCl
→ ZnCl2
+ H2
1 атом Zn реагирует с 2
молекулами HCl
6,02 . 1023 атомов — с 2 . 6,02
. 1023 молекулами, т.е.
1 моль атомов Zn — с 2 молями
молекул HCl, т.е.
1 молярная масса — с 2 молярными массами
(М(Zn) = 65 г/моль, М(HCl)
= 36,5 г/моль) т.е. 65 г — с 2 .
36,5 = 73 г, при этом получится 1 моль, т.е.
2 г H2 .
Через величины, пропорциональные этим,
можно рассчитать массы исходных веществ
для получения любых других количеств
продуктов реакции по данному уравнению:
m(Zn)
/ m(HCl) = 65 / 2
. 36,5
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Если вы хотите узнать точный вес молекулы, мы на этой странице дадим такой ответ. Молекула, по своей сути, есть ничто иное, как нейтральная частица, электрически заряженная. Образована она с помощью атомов, связанных между собою ковалентными связями.
В физике, как правило, к молекулам относят одноатомные молекулы, другими словами, свободные атомы.
Но тем не менее, совмещение таких понятий как “атом” и молекула” будет идти в разрез в соответствии с атомно-молекулярным учением, по которому молекула имеет свое происхождение из атома.
Молекула, соответствуя законом химии, не может происходить из одного атома. Принято считать, что молекулы по-своему состоянию нейтральны, и не могут нести неспаренных электронов. Молекулы, имеющие определенный заряд, получили название ионов. Молекулы, которые имеют мультиплетность, не соответствующую единице, принято называть – радикалами.
Молекулы, к свойствам которых можно отнести, большую молекулярную масса, структурой которой является низкомолекулярные фрагменты, имеют название макромолекул. Если же взглянуть на обычную молекулу, через призму квантовой механики, она представляет собой ничто иное, как совокупность электронов и атомных ядер, находящихся в постоянном взаимодействии друг с другом.
Физические свойства определенного вещества, напрямую зависят от строения молекул. В качестве примера, к веществам, которые сохраняют свойства своего молекулярного строения в твердом состоянии, можно отнести воду и ряд других подобных веществ, в том числе органических. Им присуще иметь следующие параметры, такие как, довольно низкая температура кипения и плавления. Подавляющее множество твердых, неорганических веществ, состоят из других компонентов, таких как, ионы и атомы и находятся в виде макротел. Для того, чтобы выразить состав молекул, входящих в сложное вещество, принято использовать химические формулы.
Массу одной молекулы воды:
1. Находим молекулярную массу воды: 16*1+1*2=18
2. Молярная масса = 18 г/моль
3. Масса 1 моля воды = 18 г
4. В 1 моле вещества содержится число Авогадро молекул 6,022*10 в 23 степени.
5. Чтобы найти массу одной молекулы, надо молярную массу разделить на число Авогадро, приблизительно будет 2,99*10 в минус 23 степени грамма.
Ответ: масса одной молекулы воды 2,99*10 в минус 23 степени грамма.
Видео по теме:
Копирование информации с сайта greednews.su разрешено только при использовании активной гипер ссылки на новость, спасибо за то что цените наши авторские права!
Поделиться ссылкой:
Ещё интересные статьи:
Автор сайта Малов Евгений 1982 г.р.
Закончил КСК КБГУ и СГА Нальчик в 2004
Работал в газете Северный Кавказ визуальным редактором
Занимаюсь разработкой сайтов и пишу тексты
Оценить статью:
Загрузка…
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
Как найти массу одной молекулы вещества
Молекула вещества является одновременно минимально возможной его порцией, а потому именно ее свойства являются определяющими для вещества в целом. Эта частица принадлежит микромиру, поэтому рассмотреть, а тем более взвесить ее, не представляется возможным. Но массу одной молекулы можно рассчитать.
Вам понадобится
- — периодическая таблица химических элементов;
- — понятие о строении молекулы и атома;
- — калькулятор.
Инструкция
Если известна химическая формула вещества, определите его молярную массу. Для этого определите атомы, из которых состоит молекула, и найдите их относительные атомные массы в периодической системе химических элементов. Если один атом встречается в молекуле n раз, умножьте его массу на это число. Затем сложите найденные значения и получите молекулярную массу данного вещества, которая равна его молярной массе в г/моль. Найдите массу одной молекулы, поделив молярную массу вещества M на постоянную Авогадро NА=6,022∙10^23 1/моль, m0=M/ NА.
Пример Найдите массу одной молекулы воды. Молекула воды (Н2О) состоит из двух атомов водорода и одного атома кислорода. Относительная атомная масса водорода равна 1, для двух атомов получим число 2, а относительная атомная масса кислорода равна 16. Тогда молярная масса воды будет равна 2+16=18 г/моль. Определите массу одной молекулы: m0=18/(6,022^23)≈3∙10^(-23) г.
Массу молекулы можно рассчитать, если известно количество молекул в данном веществе. Для этого поделите общую массу вещества m на количество частиц N (m0=m/N). Например, если известно, что в 240 г вещества содержится 6∙10^24 молекул, то масса одной молекулы составит m0=240/(6∙10^24)=4∙10^(-23) г.
Определите массу одной молекулы вещества с достаточной точностью, узнав количество протонов и нейтронов, которые входят в состав ее ядер атомов, из которых она состоит. Массой электронной оболочки и дефектом масс в данном случае следует пренебречь. Массу протона и нейтрона берите равной 1,67∙10^(-24) г. Например, если известно, если молекула состоит из двух атомов кислорода, какова ее масса? Ядро атома кислорода имеет в своем составе 8 протонов и 8 нейтронов. Общее количество нуклонов 8+8=16. Тогда масса атома равна 16∙1,67∙10^(-24)=2,672∙10^(-23) г. Поскольку молекула состоит из двух атомов, то ее масса равна 2∙2,672∙10^(-23)=5,344∙10^(-23) г.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Основные положения МКТ и их опытное обоснование
Согласно молекулярно-кинетической теории (МКТ) все вещества состоят из мельчайших частиц — молекул. Молекулы находятся в непрерывном движении и взаимодействуют между собой.
МКТ обосновывается многочисленными опытами и огромным количеством физических явлений. Рассмотрим ее три основных положения.
Содержание
-
1 Основные положения МКТ и их опытное обоснование
-
1.1 Все вещества состоят из частиц
- 1.1.1 *Закон кратных отношений
- 1.1.2 Масса молекул
- 1.1.3 Количество вещества. Постоянная Авогадро
- 1.1.4 Размеры молекул
- 1.1.5 См. также
-
1.2 Молекулы беспорядочно движутся
- 1.2.1 Диффузия
- 1.2.2 Броуновское движение
- 1.2.3 См. также
-
1.3 Частицы взаимодействуют
- 1.3.1 *График проекции сил взаимодействия
- 1.3.2 См. также
-
1.1 Все вещества состоят из частиц
-
2 Различие в строении газов, жидкостей и твердых тел
- 2.1 См. также
- 2.2 Литература
Все вещества состоят из частиц
1) Все вещества состоят из мельчайших частиц: молекул, атомов, ионов и др., разделенных между собой промежутками.
Молекула — мельчайшая устойчивая частица вещества, сохраняющая его основные химические свойства.
Молекулы, образующие данное вещество, совершенно одинаковы; различные вещества состоят из различных молекул. В природе существует чрезвычайно большое количество различных молекул.
Молекулы состоят из более мелких частиц — атомов.
Атомы — мельчайшие частицы химического элемента, сохраняющие его химические свойства.
Число различных атомов сравнительно невелико и равно числу химических элементов (116) и их изотопов (около 1500).
Атомы представляют собой весьма сложные образования, но классическая MKT использует модель атомов в виде твердых неделимых частичек сферической формы.
Наличие промежутков между молекулами следует, например, из опытов смещения различных жидкостей: объем смеси всегда меньше суммы объемов смешанных жидкостей. Явления проницаемости, сжимаемости и растворимости веществ также свидетельствуют о том, что они не сплошные, а состоят из отдельных, разделенных промежутками частиц.
С помощью современных методов исследования (электронный и зондовый микроскопы) удалось получить изображения молекул.
*Закон кратных отношений
Существование молекул блестяще подтверждается законом кратных отношений. Он гласит: «при образовании из двух элементов различных соединений (веществ) массы одного из элементов в разных соединениях относятся как целые числа, т.е. находятся в кратных отношениях». Например, азот и кислород дают пять соединений: N2O, N2O2, N2O3, N2O4, N2O5. В них с одним и тем же количеством азота кислород вступает в соединение в количествах, находящихся между собой в кратных отношениях 1:2:3:4:5. Закон кратных отношений легко объяснить. Всякое вещество состоит из одинаковых молекул, имеющих соответствующий атомный состав. Так как все молекулы данного вещества одинаковы, то отношение весовых количеств простых элементов, входящих в состав всего тела, такое же, как и в отдельной молекуле, и, значит, является кратным атомных весов, что и подтверждается опытом.
Масса молекул
Определить массу молекулы обычным путем, т.е. взвешиванием, конечно, невозможно. Она для этого слишком мала. В настоящее время существует много методов определения масс молекул, в частности, с помощью масс-спектрографа определены массы m0 всех атомов таблицы Менделеева.
Так, для изотопа углерода (~^{12}_6C) m0 = 1,995·10-26 кг. Поскольку массы атомов и молекул чрезвычайно малы, то при расчетах обычно используют не абсолютные, а относительные значения масс, получаемые путем сравнения масс атомов и молекул с атомной единицей массы, в качестве которой выбрана (~dfrac{1}{12}) часть массы атома изотопа углерода (~^{12}_6C):
1 а.е.м. = 1/12 m0C = 1,660·10-27 кг.
Относительной молекулярной (или атомной) массой Mr называют величину, показывающую, во сколько раз масса молекулы (или атома) больше атомной единицы массы:
(~M_r = dfrac{m_0}{dfrac{1}{12} cdot m_{0C}} . qquad (1))
Относительная молекулярная (атомная) масса является безразмерной величиной.
Относительные атомные массы всех химических элементов указаны в таблице Менделеева. Так, у водорода она равна 1,008, у гелия — 4,0026. При расчетах относительную атомную массу округляют до ближайшего целого числа. Например, у водорода до 1, у гелия до 4.
Относительная молекулярная масса данного вещества равна сумме относительных атомных масс элементов, входящих в состав молекулы данного вещества. Ее рассчитывают, пользуясь таблицей Менделеева и химической формулой вещества.
Так, для воды Н2O относительная молекулярная масса равна Mr = 1·2 + 16 = 18.
Количество вещества. Постоянная Авогадро
Количество вещества, содержащегося в теле, определяется числом молекул (или атомов) в этом теле. Поскольку число молекул в макроскопических телах очень велико, для определения количества вещества в теле сравнивают число молекул в нем с числом атомов в 0,012 кг изотопа углерода (~^{12}_6C).
Количество вещества ν — величина, равная отношению числа молекул (атомов) N в данном теле к числу атомов NA в 0,012 кг изотопа углерода (~^{12}_6C):
(~nu = dfrac{N}{N_A} . qquad (2))
В СИ единицей количества вещества является моль. 1 моль — количество вещества, в котором содержится столько же структурных элементов (атомов, молекул, ионов), сколько атомов в 0,012 кг изотопа углерода (~^{12}_6C).
Число частиц в одном моле вещества называется постоянной Авогадро.
(~N_A = dfrac{0,012}{m_{0C}}= dfrac{0,012}{1,995 cdot 10^{-26}}) = 6,02·1023 моль-1. (3)
Таким образом, 1 моль любого вещества содержит одно и то же число частиц — NA частиц. Так как масса m0 частицы у разных веществ различна, то и масса NA частиц у различных веществ различна.
Массу вещества, взятого в количестве 1 моль, называют молярной массой М:
(~M = m_0 N_A . qquad (4))
В СИ единицей молярной массы является килограмм на моль (кг/моль).
Между молярной массой Μ и относительной молекулярной массой Mr существует следующая связь:
(~M = M_r cdot 10^{-3} .)
Так, молекулярная масса углекислого газа 44, молярная 44·10-3 кг/моль.
Зная массу вещества и его молярную массу М, можно найти число молей (количество вещества) в теле[~nu = dfrac{m}{M}].
Тогда из формулы (2) число частиц в теле
(~N = nu N_A = dfrac{m}{M} N_A .)
Зная молярную массу и постоянную Авогадро, можно рассчитать массу одной молекулы:
(~m_0 = dfrac{M}{N_A} = dfrac{m}{N} .)
Размеры молекул
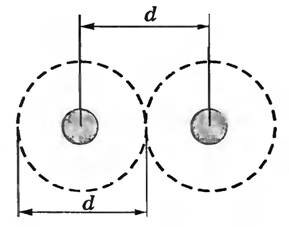
Размер молекулы является величиной условной. Его оценивают так. Между молекулами наряду с силами притяжения действуют и силы отталкивания, поэтому молекулы могут сближаться лишь до некоторого расстояния d (рис. 1).
Рис. 1
Расстояние предельного сближения центров двух молекул называют эффективным диаметром молекулы d (при этом считают, что молекулы имеют сферическую форму).
Размеры молекул различных веществ неодинаковы, но все они порядка 10-10 м, т.е. очень малы.
См. также
- Кикоин А.К. Масса и количество вещества, или Об одной «ошибке» Ньютона //Квант. — 1984. — № 10. — С. 26-27
- Кикоин А.К. Простой способ определения размеров молекул // Квант. — 1983. — № 9. — C.29-30
Молекулы беспорядочно движутся
2) Молекулы находятся в непрерывном беспорядочном (тепловом) движении.
Вид теплового движения (поступательное, колебательное, вращательное) молекул зависит от характера их взаимодействия и изменяется при переходе вещества из одного агрегатного состояния в другое. Интенсивность теплового движения зависит и от температуры тела.
Приведем некоторые из доказательств беспорядочного (хаотического) движения молекул: а) стремление газа занять весь предоставленный ему объем; б) диффузия; в) броуновское движение.
Диффузия
Диффузия — самопроизвольное взаимное проникновение молекул соприкасающихся веществ, приводящее к выравниванию концентрации вещества по всему объему. При диффузии молекулы граничащих между собой тел, находясь в непрерывном движении, проникают в межмолекулярные промежутки друг друга и распределяются между ними.
Диффузия проявляется во всех телах — в газах, жидкостях, твердых телах, но в разной степени.
Диффузию в газах можно обнаружить, если, например, сосуд с пахучим газом открыть в помещении. Через некоторое время газ распространится по всему помещению.
Диффузия в жидкостях происходит значительно медленнее, чем в газах. Например, если в стакан налить сначала слой раствора медного купороса, а затем очень осторожно добавить слой воды и оставить стакан в помещении с неизменной температурой, то через некоторое время исчезнет резкая граница между раствором медного купороса и водой, а через несколько дней жидкости перемешаются.
Диффузия в твердых телах происходит еще медленнее, чем в жидкостях (от нескольких часов до нескольких лет). Она может наблюдаться только в хорошо отшлифованных телах, когда расстояния между поверхностями отшлифованных тел близки к межмолекулярному расстоянию (10-8 см). При этом скорость диффузии увеличивается при повышении температуры и давления.
Диффузия играет большую роль в природе и технике. В природе благодаря диффузии, например, осуществляется питание растений из почвы. Организм человека и животных всасывает через стенки пищеварительного тракта питательные вещества. В технике с помощью диффузии, например, поверхностный слой металлических изделий насыщается углеродом (цементация) и т.д.
- Разновидностью диффузии является осмос — проникновение жидкостей и растворов через пористую полупроницаемую перегородку.
Броуновское движение
Броуновское движение открыто в 1827 г. английским ботаником Р. Броуном, теоретическое обоснование с точки зрения MKT дано в 1905 г. А. Эйнштейном и М. Смолуховским.
Броуновское движение — это беспорядочное движение мельчайших твердых частиц, «взвешенных» в жидкостях (газах).
«Взвешенные» частицы — это частицы, плотность вещества которых сравнима с плотностью среды, в которой они находятся. Такие частицы находятся в равновесии, и малейшее внешнее воздействие на нее приводит к их движению.
Для броуновского движения характерно следующее:
- броуновские частицы совершают непрерывное хаотическое движение, интенсивность которого зависит от температуры и от размеров броуновской частицы;
- траектория движения броуновской частицы очень сложная, не зависит от природы вещества частиц и внешних условий.
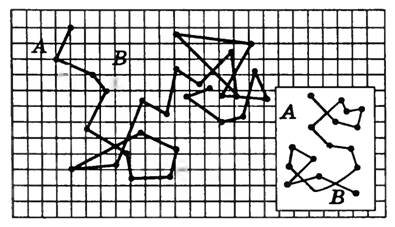
Рис. 2
На рисунке 2 показаны положения броуновской частицы через каждые 30 с, а на врезке — положения этой частицы на участке АВ, зафиксированные через каждую секунду. Эти положения соединены прямыми линиями. Траектория же частицы еще более сложная;
- броуновское движение наблюдается в жидкостях и газах.
Причинами броуновского движения являются:
- тепловое хаотическое движение молекул среды, в которой находится броуновская частица;
- отсутствие полной компенсации ударов молекул среды об эту частицу с различных сторон, так как движение молекул носит случайный характер.
Движущиеся молекулы жидкости при столкновении с какими-либо твердыми частицами передают им некоторое количество движения. Случайно с одной стороны о частицу ударит заметно большее число молекул, чем с другой, и частица придет в движение.
- Если частица достаточно велика, то число молекул, налетающих на нее со всех сторон, чрезвычайно велико, их удары в каждый данный момент компенсируются, и такая частица практически остается неподвижной.
См. также
- Бронштейн М.П. Как был взвешен атом //Квант. — 1970. — № 2. — С. 26-35
Частицы взаимодействуют
3) Частицы в веществе связаны друг с другом силами молекулярного взаимодействия — притяжения и отталкивания.
Между молекулами вещества действуют одновременно силы притяжения и силы отталкивания. Эти силы в большой степени зависят от расстояний между молекулами. Согласно экспериментальным и теоретическим исследованиям межмолекулярные силы взаимодействия обратно пропорциональны n-й степени расстояния между молекулами:
(~F_r sim pm dfrac{1}{r^n},)
где для сил притяжения n = 7, а для сил отталкивания n = 9 ÷ 15. Таким образом, сила отталкивания сильнее изменяется при изменении расстояния.
Между молекулами существуют одновременно и силы притяжения, и силы отталкивания. Существует некоторое расстояние r0 между молекулами, на котором силы отталкивания по модулю равны силам притяжения. Это расстояние соответствует устойчивому равновесному положению молекул.
При увеличении расстояния r между молекулами как силы притяжения, так и силы отталкивания уменьшаются, причем силы отталкивания уменьшаются быстрее и становятся меньше сил притяжения. Равнодействующая сила (притяжения и отталкивания) стремится сблизить молекулы в исходное состояние. Но, начиная с некоторого расстояния rm, взаимодействие молекул становится настолько мало, что им можно пренебречь. Наибольшее расстояние rm, на котором молекулы еще взаимодействуют, называется радиусом молекулярного действия (rm ~ 1,57·10-9 м).
При уменьшении расстояния r между молекулами как силы притяжения, так и силы отталкивания увеличиваются, и силы отталкивания увеличиваются быстрее и становятся больше сил притяжения. Равнодействующая сила теперь стремится оттолкнуть молекулы друг от друга.
Доказательства силового взаимодействия молекул:
а) деформация тел под влиянием силового воздействия;
б) сохранение формы твердыми телами (силы притяжения);
в) наличие промежутков между молекул (силы отталкивания).
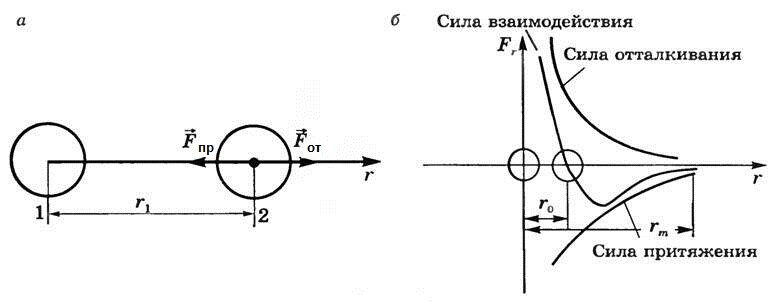
*График проекции сил взаимодействия
Взаимодействие двух молекул можно описать при помощи графика зависимости проекции равнодействующей Fr сил притяжения и отталкивания молекул от расстояния r между их центрами. Направим ось r от молекулы 2, центр которой совпадает с началом координат, к находящемуся от него на расстоянии r1 центру молекулы 2 (рис. 3, а).
Рис. 3
Будем считать, что молекула 1 неподвижна, а молекула 2 изменяет свое положение относительно молекулы 1.
Тогда проекция силы отталкивания молекулы 2 от молекулы 1 на ось r будет положительной. Проекция силы притяжения молекулы 2 к молекуле 1 будет отрицательной.
Силы отталкивания (рис. 3, б) гораздо больше сил притяжения на малых расстояниях (r < r0), но гораздо быстрее убывают с увеличением r. Начиная с некоторого расстояния rm, взаимодействием молекул можно пренебречь.
См. также
- Городецкий Е.Е. Силы молекулярного взаимодействия //Квант. — 1987. — № 1. — С. 31, 34
Различие в строении газов, жидкостей и твердых тел
В различных агрегатных состояниях вещества расстояние между его молекулами различно. Отсюда и различие в силовом взаимодействии молекул и существенное различие в характере движения молекул газов, жидкостей и твердых тел.
В газах расстояния между молекулами в несколько раз превышают размеры самих молекул. Вследствие этого силы взаимодействия между молекулами газа малы и кинетическая энергия теплового движения молекул намного превышает потенциальную энергию их взаимодействия. Каждая молекула движется свободно от других молекул с огромными скоростями (сотни метров в секунду), меняя направление и модуль скорости при столкновениях с другими молекулами. Длина свободного пробега λ молекул газа зависит от давления и температуры газа. При нормальных условиях λ ~ 10-7 м.
В твердых телах силы взаимодействия между молекулами настолько велики, что кинетическая энергия движения молекул намного меньше потенциальной энергии их взаимодействия. Молекулы совершают непрерывные колебания с малой амплитудой около некоторого постоянного положения равновесия — узла кристаллической решетки.
Время, в течение которого частица колеблется около одного положения равновесия, — время «оседлой жизни» частицы — в твердых телах очень велико. Поэтому твердые тела сохраняют свою форму, и они не текут в обычных условиях. Время «оседлой жизни» молекулы зависит от температуры. Вблизи температуры плавления оно порядка 10–1 – 10–3 c, при более низких температурах может составлять часы, сутки, месяцы.
В жидкостях расстояние между молекулами значительно меньше, чем в газах, и примерно такое же, как в твердых телах. Поэтому силы взаимодействия между молекулами велики. Молекулы жидкости, как и молекулы твердого тела, совершают колебания около некоторого положения равновесия. Но кинетическая энергия движения частиц соизмерима с потенциальной энергией их взаимодействия, и молекулы чаще переходят в новые положения равновесия (время «оседлой жизни» 10–10 – 10–12 с). Это позволяет объяснить текучесть жидкость.
См. также
- Кикоин А.К. Об агрегатных состояниях вещества //Квант. — 1984. — № 9. — С. 20-21
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 119-126.