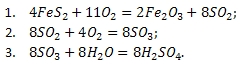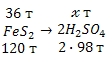Решение
1) 4FeS2+11O2= 2Fe2O3+8SO2
2) 2SO2+O2= 2SO3
3) SO3+H2O = H2SO4
M(H2O) = 18 г/моль; M(SO3) = 80 г/моль; M(H2SO4) = 98 г/моль;
M(FeS2) = 120 г/моль.
Масса воды в 100 г раствора серной кислоты (ω= 91 %) составит 100 — 91 = 9,0 г или 9/18 = 0,5 моль. Из уравнения реакции (3) следует, что 1 моль SO3 →1 моль H2O →1 моль H2SO4 или 0,5 моль Н2О прореагирует с 0,5 моль SO3 или 0,5•80 = 40 г и образуется 0,5 моль H2SO4 или 0,5•98 = 49 г. Тогда общая масса H2SO4 составит 91 + 49 = 140 г. Для получения олеума (ω= 12,5 %) на140 г потребуется:
12,5•140/87,5 = 20 г.
Таким образом, всего SO3 расходуется (40 + 20) = 60 г или 60/80 = 0,75 моль. Из уравнений реакций (2, 3) следует, что на образование 0,75 моль SO3 расходуется FeS2 0,75/2 = 0,375 моль или 0,375•120 = 45 г.
Светило науки — 2204 ответа — 28869 раз оказано помощи
4FeS2+11O2=8SO2+2Fe2O3
2SO2+O2=2SO3
SO3+H2SO4=SO3*H2SO4
m(H2SO4)=54,95*1,82=100г; m(H2SO4)=100*0,91=91г; m(H2O)=100-91=9г;
n(H2O)=9:18=0,5моль; Тогда,следуя из уравнения: SO3+H2O=H2SO4
n(SO3)=0,5; m(SO3)=0,5*80=40; n(H2SO4)=0,5; m(H2SO4)=0,5*98=49;
Общая масса( H2SO4) =91+49=140;
Теперь определим,сколько потребуется SO3 для получения 12,5% олеума:
m(SO3):[m(SO3)+m(H2SO4)]=12,5
m(SO3):[m(SO3)+140]=12,5;
m(SO3)=20г;
m(SO3)всего=40+20=60г; n(SO3)=60:80=0,75моль(практ.);
0,75 — 75%
x — 100%
x=1моль(теор.);
Итак,n(SO3)=1моль,тогда n(FeS2)=0,5моль; m(FeS2)=0,5*120=60г.
Получение серной кислоты из пирита
Сколько серной кислоты (H2SO4) (в т) может быть получено из 36 т пирита FeS2.
Решение задачи
Процесс получения серной кислоты (H2SO4) из пирита (FeS2) протекает по следующим стадиям:
Запишем суммарное уравнение реакции:
Хочу обратить ваше внимание на то, что если образование продукта, массу которого необходимо определить, идет через ряд промежуточных стадий, не целесообразно проводить расчет по каждой стадии. В таких случаях для расчета составляем стехиометрическую схему, которая включает исходный и конечный продукты с учетом их стехиометрических коэффициентов.
Решение по стехиометрической схеме нельзя применять в том случае, если исходное вещество расходуется на образование не только основного, но и побочных продуктов реакции.
Итак, вернемся к решению задачи. Из процесса получения серной кислоты, мы видим, что вся содержащаяся в пирите (FeS2) сера расходуется на образование серной кислоты (H2SO4). Из суммарного уравнения реакции следует, что из 1 моль пирита (FeS2) образуется 2 моль серной кислоты (H2SO4), что позволяет составить схему стехиометрического процесса:
Рассчитаем молярные массы пирита (FeS2) и серной кислоты (H2SO4):
M (FeS2) = 56 + 2 ∙ 32 = 120 (г/моль).
M (H2SO4) = 2 + 32 +4 ∙ 16 = 98 (г/моль).
Учитывая, что молярные массы пирита (FeS2) и серной кислоты (H2SO4) соответственно равны 120 и 98 г/моль, воспользуемся стехиометрической схемой для проведения расчета:
из 120 т FeS2 можно получить 196 т H2SO4
из 36 т FeS2 можно получить т H2SO4
Откуда:
Ответ: 58,8 т серной кислоты.
Определите массу пирита, необходимого для получения такого количества SOз, при растворении которого в 54, 95 см3 раствора с w(H2SO4) = 91%, (р = 1, 82 г / см3) получается олеум с w(SOз) = 12, 5%.
Считайте, что выход на стадии окисления серы (VI) равен 75%.
ПОМОГИТЕ ПОЖАЛУЙСТА, СРОЧНО НАДО.
Перед вами страница с вопросом Определите массу пирита, необходимого для получения такого количества SOз, при растворении которого в 54, 95 см3 раствора с w(H2SO4) = 91%, (р = 1, 82 г / см3) получается олеум с w(SOз) = 12, 5%?, который относится к
категории Химия. Уровень сложности соответствует учебной программе для
учащихся 10 — 11 классов. Здесь вы найдете не только правильный ответ, но и
сможете ознакомиться с вариантами пользователей, а также обсудить тему и
выбрать подходящую версию. Если среди найденных ответов не окажется
варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском»,
который откроет все похожие ответы, или создайте собственный вопрос, нажав
кнопку в верхней части страницы.
Выбрать другой вопрос
Смотреть ответ
Перейти к выбору ответа
Вопрос от пользователя
Определите массу пирита, содержащего 80% FeS2, необходимую для получения:
а) 500 г 98%-ного раствора серной кислоты,
б) 272,2 г 90%-ного раствора серной кислоты.
Ответ от эксперта
решение задания по химии