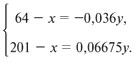Задачи на пластинку в ЕГЭ по химии. Разбираем, как решать задачи на пластину. Основные способы решения задач на пластинку.
Задачи на пластинки
Если в раствор соли металла поместить кусочек (пластинку) из другого металла, возможно протекание химической реакции. Но добавляемый металл должен быть более активным, чем металл в составе соли. При этом добавляемый металл не должен реагировать с водой!
Более активный металл расположен левее в электрохимическом ряду.
Например, сульфат меди реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
При этом железо не реагирует с сульфатом цинка:
ZnSO4 + Fe ≠
Основа решения задач «на пластинку» – материальный баланс. Но составляется он не только для раствора, но и для самой пластинки. Если мы помещаем в раствор соли металла А пластинку из металла В, и металл В вытесняет металл А из соли, то с пластинки уходит часть металла В. При этом на пластику осаждается вытесненный металл А:
АХ + В = ВХ + А↓
Примерная суть материального баланса для пластинки:
Начальная масса пластинки — масса прореагировавшего металла В + масса образовавшегося металла А = конечная масса пластинки.
Например, для реакции сульфата меди с железом:
CuSO4 + Fe = FeSO4 + Cu↓
Обратите внимание! В задачах на пластики чаще всего добавляемый металл вступает в реакцию только частично. Вступает в реакцию некоторая его часть.
Иногда используется сокращенная форма материального баланса:
Масса образовавшегося металла А — масса прореагировавшего металла В = изменение массы пластинки
Задача 1. Медную пластинку массой 50,00 г поместили в раствор хлорида ртути(II). Масса пластинки после реакции оказалась равной 52,74 г. Сколько меди растворилось?
Решение:
Записываем уравнение реакции:
Cu + HgCl2 → Hg + CuCl2
Находим количество меди в пластинке:
ν(Сu) = m(Cu)/M(Cu) = 50,00 г/ 64 г/моль = 0,78 моль
Из условия задачи мы понимаем, что медь вступила в реакцию не полностью, а частично. Обозначим количество прореагировавшей меди, как х моль:
ν(Сu) = x моль,
а масса прореагировавшей меди равна 64х г:
m(Cu)прореаг = ν(Сu)·M(Cu) = х моль · 64 г/моль = 64х г.
Тогда количество образовавшейся ртути также будет равно х моль.
ν(Hg) = x моль.
А масса образовавшейся ртути равна:
m(Hg) = ν(Hg)·M(Hg) = х моль · 201 г/моль = 201х г.
Записываем уравнение материального баланса для пластинки:
mпластинки исх. – m(Cu)прореаг. + m(Hg) = mпластинки конечн.
Составляем уравнение:
50 – 64х + 201х = 52,74
Решаем его, находим х:
137х = 2,74,
х = 0,02 моль
Следовательно, масса прореагировавшей меди равна:
m(Cu)прореаг = ν(Сu)·M(Cu) = 0,02 моль · 64 г/моль = 1,28 г.
Ответ: масса растворившейся меди равна 1,28 г.
Задача 2. Железную пластинку массой 20,4 г поместили в раствор сульфата меди (II), масса раствора 100 г. Через некоторое время масса пластинки оказалась равной 22,0 г. Вычислите массу меди, выделившейся на пластинке, и массовую долю сульфата железа(II) в растворе после реакции.
Ответ: m(Cu) = 12,8 г, ω(FeSO4) = 30,8%.
3. Железную пластинку поместили в 150 мл раствора сульфата меди с ω1(CuSO4) = 16% (плотность раствора 1,18 г/мл). В результате реакции масса пластинки увеличилась на 0,8 г. Вычислите массовую долю CuSO4 в растворе после реакции.
4. После погружения железной пластинки в 200 мл раствора с массовой долей CuSO4 14,5% (плотность раствора 1,16 г/мл) её масса в результате реакции увеличилась на 0,4 г. Определите массовые доли веществ в растворе после реакции.
Ответ: ω(FeSO4) = 3,28%, ω2(CuSO4) = 11,07%.
5. Железную пластинку массой 5 г поместили в раствор сульфата меди с ω1(CuSO4) = 12,5%, масса раствора 64 г. Через некоторое время количество сульфата меди в растворе уменьшилось вдвое. Какой стала масса пластинки? Вычислите массовые доли веществ в полученном растворе.
Ответ: m2 (пласт.) = 5,2 г; ω2(CuSO4) = 6,27%, ω(FeSO4) = 5,96%.
6. Железную пластинку массой 10 г погрузили в раствор с ω1(CuSO4) = 16%, масса раствора 150 г. Определите, какой стала масса пластинки после реакции, в результате которой содержание сульфата меди в растворе уменьшилось до ω2(CuSO4) = 7,5%. Какова массовая доля FeSO4 в полученном растворе?
Ответ: m2 (пласт.) = 10,64 г, ω(FeSO4) = 0,081 (8,1%)
7. Цинковые опилки массой 13 г поместили в раствор сульфата никеля (II) массой 280 г. Через некоторое время металлические опилки отфильтровали, высушили и взвесили. Их масса оказалась равной 11,8 г. Определите массовую долю сульфата цинка в фильтрате.
8. Железную пластинку поместили в раствор сульфата меди (II) массой 150 г. Через некоторое время масса пластинки увеличилась на 0,6 г, а массовая доля CuSO4 в образовавшемся растворе (ω2) стала равной 5%. Определите массовую долю CuSO4 в исходном растворе (ω1).
9. Цинковые опилки массой 15 г поместили в 250 мл 1,2 M раствора нитрата меди (II). Через некоторое время концентрация ионов Cu2+ в растворе уменьшилась в 2 раза. Определите молярную концентрацию ионов Zn2+ в растворе после реакции. Какой стала масса металлических опилок?
Ответ: c(Zn2+) = 0,6 моль/л; m(мет.) = 14,85 г.
10. Медную пластинку на некоторое время погрузили в 125 мл 1,2 M раствора нитрата серебра. В результате концентрация ионов Cu2+ в растворе оказалась равной 0,1 моль/л. Какой стала концентрация нитрата серебра? Какая масса серебра выделилась на пластинке, и как изменилась масса пластинки? Изменением объема раствора можно пренебречь.
Ответ: c2 (AgNO3) = 1,0 моль/л; m(Ag) = 2,7 г; Δm(пласт.) = 1,9 г.
11. Свинцовую пластинку выдерживали некоторое время в 180 г 25 %-ного раствора нитрата меди (II). В результате масса пластинки уменьшилась на 18,6 г. Определите массу меди, выделившейся на пластинке и массовые доли веществ в образовавшемся растворе.
Ответ: m(Cu) = 8,32 г, ω1 = 10,4%, ω2 = 21,7 %
12. Медную пластинку массой 13,2 г поместили в раствор нитрата железа(III) массой 300 г с массовой долей соли 0,112. После некоторого выдерживания пластинки в растворе ее вынули. В результате массовая доля нитрата железа(III) оказалась равной массовой доле соли меди(II). Определите массу пластинки после окончания реакции (когда ее вынули из раствора).
13. Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты. В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора. Найдите массовую долю соли в полученном растворе. Примите Ar(Cu) = 64.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
14. Железную пластинку массой 100 г погрузили в 250 г 20%-ного раствора сульфата меди(II). После того, как пластинку вынули из раствора, ее масса оказалась равной 102 г. Определите массовую долю сульфата меди(II) в оставшемся растворе.
Fe + CuSO4 = Cu + FeSO4
15. В 85 г 10%-ного раствора нитрата серебра опустили медную монетку массой 5 г. После того, как израсходовалось половина нитрата серебра, монетку вынули. Как изменилась масса монетки? Определите массовую долю нитрата меди(II) в полученном растворе.
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
16. Медную монетку массой 10 г опустили в 65 г 5%-ного раствора нитрата ртути(II). Когда монетку вынули, ее масса составила 10,685 г. Определите массовые доли веществ в оставшемся растворе.
Cu + Hg(NO3)2 = Hg + Cu(NO3)2
17. Железную пластину массой 10 г опустили в 100 г раствора сульфата меди, содержащего 10 мас.% СuSО4. Через некоторое время пластину вынули, промыли и высушили. Масса пластины оказалась равной 10,4 г. Сколько граммов меди выделилось на пластине и какова концентрация сульфата меди в образовавшемся после реакции растворе?
18. После погружения цинковой пластины массой 6 г в 100 г раствора сульфата меди, содержащего 2 мас.% СuSО4, количество сульфата меди в растворе уменьшилось в четыре раза. Определите концентрации веществ в полученном растворе и найдите, какой стала масса пластины.
19. Железную пластину массой 15 г опустили в 100 г раствора сульфата меди, содержащего 8 мас.% СuSО4. Через некоторое время пластину вынули, промыли и высушили. Масса пластины оказалась равной 15,3 г. Определите концентрации веществ в образовавшемся после реакции растворе
20. После погружения железной пластины массой 10 г в 100 г раствора сульфата меди, содержащего 5 мас.% СuSО4, количество ионов меди в растворе уменьшилось в десять раз. Определите концентрации веществ в полученном растворе и найдите, какой стала масса пластины.
21. Железную пластинку массой 5 г опустили в стакан, содержащий 200 г 8 мас.% раствора сульфата меди (II). Через некоторое время пластинку вынули, высушили и взвесили. Масса пластинки стала равной 5,2 г. Найдите концентрации веществ в полученном растворе (потерями раствора, оставшегося на пластинке, пренебречь).
22. Железную пластинку опустили в 150 г раствора сульфата меди. Через некоторое время пластинку вынули, промыли и высушили. Масса пластины оказалась на 0,4 г больше, чем до погружения в раствор. Концентрация СuSO4 в образовавшемся растворе стала равной 3 мас.%. Найдите концентрацию исходного раствора сульфата меди.
23. Железную пластинку массой 10 г опустили в раствор нитрата серебра, содержащего 4 мас.% АgNО3. Через некоторое время пластинку вынули, промыли и высушили. Масса пластинки оказалась равной 12,4 г, а концентрация нитрата серебра в растворе уменьшилась в 4 раза. Определите массу исходного раствора.
24. К 200 г раствора хлорида меди, содержащего 5 мас. % СuСl2, добавили цинковую пластинку. Пластинка растворилась полностью. Концентрация хлорида меди уменьшилась в 5 раз. Определите массу растворенной цинковой пластинки

Борисова
Снежана Петровна, учитель химии высшей категории
МАОУ
СОШ №4
г.
Новый Уренгой ЯНАО
Правила к решению задач на «пластинки»
1.Пластинка, как правило, в избытке (но необходимо
проверить!).
2.Фраза в задаче: «Пластинку вынули по окончании
всех реакций» – говорит о том, что соль прореагировала полностью.

вынули через некоторое время» – говорит о том, что и пластинка, и соль в
избытке.
Обратите внимание! В задачах
на пластики чаще всего добавляемый металл вступает в реакцию толькочастично.
Вступает в реакцию некоторая его
часть.
пластинки
составила 24,83 г. Вычислите массу взятого медного купороса и
массовую долю сульфата меди в исходном растворе.
 CuSO4 = ZnSO4
CuSO4 = ZnSO4
+ Cu
1 моль
⧍m=1 г М=65
г/моль
m=64 г


132,23 мл раствора нитрата серебра (ρ = 1,21
г/мл) погрузили медную проволочку и выдерживали до тех
пор, пока ее масса не увеличилась на 6,08 г. Раствор, оставшийся
после удаления проволочки, выпарили, твердый остаток прокалили до прекращения
изменения массы и получили смесь газов объемом 7,62 л (при н. у.). Вычислите
массовую долю нитрата серебра в растворе, полученном после удаления проволочки. 
Насыщенный при 50
С раствор сульфата меди (II) охладили до 20 0С. Выпавший в осадок
кристаллогидрат (CuSO4*5H2O) отделили и в раствор соли ненадолго поместили железную пластину, что
привело к уменьшению массы раствора на
 |
0,96г. Далее в полученный раствор прилили
136,5 г 15%-ного раствора иодоводородной кислоты, после чего в этом растворе не
осталось ни катионов меди, ни иодид-ионов. Вычислите массу кристаллогидрата,
выпавшего в осадок при охлаждении исходного раствора до 20 0С, если
растворимость сульфата меди в пересчете на безводную соль при 50 0С
составляет 34 г, а при 20 0С – 20 г на 100 г воды.
Железную пластинку массой 7 г погрузили в
раствор сульфата меди(II)

1,175 г/мл) 63,5 мл 30% в результате чего количество сульфата уменьшилось в два раза. Определите массу
пластинки после реакции и массу сульфата
меди(II) в оставшемся
пластинки после реакции и
массу сульфата меди(II) в оставшемся растворе.
СuSO4 + Fe = FeSO4 + Cu
1) Рассчитаем
массу сульфата меди(II) в исходном растворе

найти эти количества вещества, рассчитаем массу СuSO4 в исходном
растворе:
4 исх = 0,3 •
1,175 • 63,5 = 22,4 г.
2) После
реакции количество вещества (по условию задачи), а следовательно, и
масса CuSO4 уменьшились вдвое.
Отсюда m(СuSO4)ост.
= 11,2 г.
пластинки после реакции и
массу сульфата меди(II) в оставшемся растворе.
СuSO4 + Fe = FeSO4 + Cu
1) Рассчитаем
массу сульфата меди(II) в исходном растворе

найти эти количества вещества, рассчитаем массу СuSO4 в исходном
растворе:
4 исх = 0,3 •
1,175 • 63,5 = 22,4 г.
2) После
реакции количество вещества (по условию задачи), а следовательно, и
масса CuSO4 уменьшились вдвое.
Отсюда m(СuSO4)ост.
= 11,2 г.
пластинки после реакции и
массу сульфата меди(II) в оставшемся растворе.
СuSO4 + Fe = FeSO4 + Cu
1)
Рассчитаем
массу сульфата меди(II) в исходном растворе
Чтобы найти эти количества
вещества, рассчитаем массу СuSO4 в исходном растворе: = 0,3 • 1,175
• 63,5 = 22,4 г.
2)

а следовательно, и масса CuSO4
4 ост. = 11,2 г.
3) Вычислим
количество веществ сульфата меди(II) и железа, израсходованных в реакции
(СuSO4) = m/М =
11,2/160 = 0,07 моль
(Fe) = nизрас.(СuSO4)
= 0,07 моль
пластинки после реакции и
массу сульфата меди(II) в оставшемся растворе.

+ Cu
1 моль
⧍m=8 г М=64
г/моль
m=64 г
—
масса
пластинки измениться на 8 г
—
масса
пластинки измениться на x г
5) Вычислим массу
пластинки после реакции: 7 + 0,56 = 7,56 г

50 г поместили в 120 г раствора, содержащего 6% сульфата магния и нитрат
серебра. После завершения реакции пластинку вынули, промыли водой, высушили и
взвесили. К оставшемуся раствору добавили 135,14 мл 11,2%-ного раствора
гидроксида калия (плотность 1,11 г/мл). Осадок отделили и взвесили; масса
осадка 10,41 г. Вычислите массу пластинки после реакции.
Цинковую пластинку массой
50 г поместили в 120 г раствора, содержащего 6% сульфата магния и нитрат
серебра. После завершения реакции пластинку вынули, промыли
водой, высушили и взвесили. К оставшемуся раствору добавили 135,14 мл
11,2%-ного раствора гидроксида калия (плотность 1,11 г/мл). Осадок отделили и
взвесили; масса осадка 10,41 г. Вычислите массу пластинки после реакции.

MgSO4=
Zn + 2AgNO3
= Zn(NO3)2 + 2Ag
Находим количество сульфата магния, содержащегося в исходном
растворе:
m(MgSO4) = w(MgSO4) *m(р-ра)=0,06*120= 7,2
г n(MgSO4) = m/M = 7,2/120 = 0,06 моль
(фраза
«После завершения реакции пластинку вынули» означает, что нитрат серебра
прореагировал полностью)
и взвесили. К
оставшемуся раствору добавили 135,14
мл 11,2%-ного раствора
гидроксида калия (плотность 1,11 г/мл). Осадок отделили и
взвесили; масса осадка 10,41 г.
Оставшийся раствор: MgSO4 и
Zn(NO3)2 магния, (3)
MgSO4 + 2KOH = Mg(OH)2↓ + K2SO4
(4) Zn(NO3)2 + 2KOH = Zn(OH)2↓ +
2KNO3

= 135,14*1,11 = 150 г m(KOH) = w(КОН) *m(р-ра) = 0,112*150 = 16,8 г nбыло(KOH)
= m/M = 16,8/56 = 0,3 моль По уравнению (3): n(Mg(OH)2) =
n(MgSO4) = 0,06 моль
М(Mg(OH)2) = 58 г/моль, m(Mg(OH)2) = n*M =
0,06*58 = 3,48 г n3(KOH) = 2n(MgSO4) = 2*0,06 = 0,12 моль
(прореагировало КОН в (3) реакции)
массу пластинки после
реакции.
(1)
Zn + MgSO4=
(2)
Zn
+ 2AgNO3 = Zn(NO3)2 + 2Ag По уравнению (4):
Находим количество сульфата магния,
содержащегося в
исходном растворе: m(Zn(OH)2) =
m(осадка) – m(Mg(OH)2) = 10,41 – 3,48 = 6,93 г m(MgSO4) =
w(MgSO4) *m(р-ра)=0,06*120
= 7,2
г М(Zn(OH)2) = 99
г/моль, n(Zn(OH)2) = m/M = 6,93/99 = 0,07 моль
n(MgSO4) = m/M = 7,2/120 =
0,06 моль n4(KOH) = 2n(Zn(OH)2) = 2*0,07 = 0,14 моль
(прореагировало
Оставшийся
раствор: MgSO4 и Zn(NO3)2
(3)
MgSO4 + 2KOH = Mg(OH)2↓ + K2SO4 КОН в (4) реакции)
(4)
Zn(NO3)2 + 2KOH =
Zn(OH)2↓ + 2KNO3 n4(Zn(NO3))
= n(Zn(OH)2) = 0,07 моль Находим
количество гидроксида калия: Zn → Zn(NO3),
n4(Zn) = n4(Zn(NO3)) = 0,07 моль mр-ра(KOH) = V*ρ = 135,14*1,11 = 150 г
m(KOH)
= w(КОН) *m(р-ра) = 0,112*150 = 16,8 г n3,4(KOH)
= n3(KOH) + n4(KOH) = 0,12 + 0,14 = 0,26 моль nбыло(KOH) = m/M = 16,8/56 = 0,3 моль (прореагировало
КОН в (3,4) реакциях)
По
уравнению (3): ð Гидроксид калия
был в избытке и реагирует с гидроксидом цинка n(Mg(OH)2)
= n(MgSO4) = 0,06 моль
М(Mg(OH)2)
= 58 г/моль, m(Mg(OH)2) = n*M =0,06*58=3,48 г
n3(KOH)
= 2n(MgSO4) = 2*0,06 = 0,12 моль
(прореагировало
КОН в (3) реакции)
массу пластинки после
реакции.
(1)
Zn + MgSO4 =
(2)
Zn
+ 2AgNO3 = Zn(NO3)2 + 2Ag
Находим количество сульфата магния, содержащегося
в исходном растворе: m(MgSO4) = w(MgSO4)
*m(р-ра)=0,06*120
= 7,2 г n(MgSO4) = m/M = 7,2/120 = 0,06 моль
Оставшийся
раствор: MgSO4 и Zn(NO3)2
(3)
MgSO4 + 2KOH = Mg(OH)2↓ + K2SO4 ð
(4)
Zn(NO3)2 + 2KOH = Zn(OH)2↓ +
2KNO3
Находим
количество гидроксида калия: mр-ра(KOH) = V*ρ = 135,14*1,11 = 150 г
m(KOH) = w(КОН) *m(р-ра) = 0,112*150 = 16,8 г
nбыло(KOH)
= m/M = 16,8/56 = 0,3 моль
По уравнению (3):
n(Mg(OH)2)
= n(MgSO4) = 0,06 моль
М(Mg(OH)2)
= 58 г/моль, m(Mg(OH)2) = n*M =0,06*58=3,48 г
n3(KOH)
= 2n(MgSO4) = 2*0,06 = 0,12 моль
(прореагировало
КОН в (3) реакции)
По
уравнению (4): m(Zn(OH)2) =
m(осадка) – m(Mg(OH)2) = 10,41 – 3,48 = 6,93 г
М(Zn(OH)2) = 99 г/моль, n(Zn(OH)2) = m/M =
6,93/99 = 0,07 моль n4(KOH) = 2n(Zn(OH)2) = 2*0,07 = 0,14
моль (прореагировало КОН в (4) реакции)
n4(Zn(NO3))
= n(Zn(OH)2) = 0,07 моль
Zn → Zn(NO3),
n4(Zn) = n4(Zn(NO3)) = 0,07 моль
n3,4(KOH)
= n3(KOH) + n4(KOH)
= 0,12 + 0,14 = 0,26 моль (прореагировало
КОН в (3,4) реакциях)
Гидроксид калия был в
избытке и реагирует с гидроксидом цинка
(5)
Zn(OH)2
+ 2KOH(изб.) = K2[Zn(OH)4] nизб.(KOH) = nбыло(KOH) — n3,4(KOH)
= 0,3 – 0,26 = 0,04 моль По уравнению (5):
n5(Zn(OH)2)
= nизб.(KOH)/2 = 0,04/2 = 0,02 моль Zn → Zn(ОН)2, n5(Zn)
= n4(Zn(ОН)2) = 0,02 моль
массу
пластинки после реакции.
(1)
Zn + MgSO4 =
(2)
Zn
+ 2AgNO3 = Zn(NO3)2 + 2Ag
Находим количество сульфата магния, содержащегося
в исходном растворе: m(MgSO4) = w(MgSO4)
*m(р-ра)=0,06*120
= 7,2 г n(MgSO4) = m/M = 7,2/120 = 0,06 моль
Оставшийся раствор: MgSO4 и
Zn(NO3)2 ð
(3)
MgSO4 + 2KOH = Mg(OH)2↓ + K2SO4
(4)
Zn(NO3)2 + 2KOH = Zn(OH)2↓ +
2KNO3
Находим количество гидроксида калия: mр-ра(KOH) = V*ρ
= 135,14*1,11 = 150 г По уравнению (4):
m(Zn(OH)2)
= m(осадка) – m(Mg(OH)2) = 10,41 – 3,48 = 6,93 г (5)
Zn(OH)nизб.(2KOH+ 2KOH) =
n(былоизб.)(=KOHK2[Zn(OH) — n3,4(KOH)4] ) = 0,3 – 0,26 = 0,04 моль
М(Zn(OH)2)
= 99 г/моль, n(Zn(OH)2) = m/M = 6,93/99 = 0,07 моль По уравнению (5):
n4(KOH) = 2n(Zn(OH)2) = 2*0,07 = 0,14 моль n5(Zn(OH)2) = nизб.(KOH)/2 = 0,04/2 = 0,02 моль
n4(Zn(NO3)) = n(Zn(OH)2) = 0,07 моль Zn → Zn(ОН)2, n5(Zn) = n4(Zn(ОН)2) = 0,02 моль
Zn → Zn(NO3), n4(Zn) = n4(Zn(NO3))
= 0,07 моль n3,4(KOH) = n3(KOH) + n4(KOH)
= 0,12 + 0,14 = 0,26 моль
Гидроксид калия был в
избытке и реагирует с гидроксидом цинка
Находим массу
пластинки после реакции:
nпрореаг.(Zn)
= n4(Zn) + n5(Zn) = 0,07 + 0,02 = 0,09 моль
m(KOH) = w(КОН) *m(р—ра) = 0,112*150 = 16,8 г Zn + 2AgNO3 = Zn(NO3)3
+ 2Ag
nбыло(KOH) = m/M = 16,8/56 =
0,3 моль По уравнению (3): n(Mg(OH)2) = n(MgSO4) =
0,06 моль
М(Mg(OH)2) =
58 г/моль, m(Mg(OH)2) = n*M =0,06*58=3,48 г
n3(KOH) =
2n(MgSO4) = 2*0,06 = 0,12 моль
(прореагировало КОН в
(3) реакции)
|
1 моль |
2 моль |
|
|
М=65 |
⧍m=151 |
|
|
m=65 г |
m=216 г |
|
|
1 моль Zn |
— |
масса пластинки |
|
0,09 моль Zn |
— |
масса пластинки измениться на х г |
х=0,17
моль
⧍⧍m (пластинки) = 13,59 г
Вычислим массу пластинки
после реакции:
m(пластинки после реакции)= 50 +
13,59 = 63,59 г
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Из опыта работы
» В РАСТВОР ПОГРУЖЕНА ПЛАСТИНКА…»
Пучки расчетных задач
Продолжение. См. № 44, 46, 48/2003;
9, 14/2004
К традиционным задачам по определению
массы металла, выделившегося на пластинке или
перешедшего в раствор, добавляются новые. Так,
задачи Г-5, Г-6, Г-8 представляют собой варианты
вывода химической формулы вещества по
количественным характеристикам. Другими
словами, это задачи на распознавание веществ. А
вот в задаче Г-13 потребуется вспомнить формулу
для расчета массовой доли соли в растворе.
Пучок задач Г
Г-1. Железную пластинку массой 100 г
погрузили в раствор медного купороса.
Покрывшуюся медью пластинку промыли, высушили и
снова взвесили. Ее масса оказалась равной 101,3 г.
Сколько граммов меди осадилось на пластинке [1–7]?
Г-2. При погружении в раствор медного
купороса кадмиевой пластинки масса ее
уменьшилась на 3 г. Определите количество
кадмия, перешедшего в раствор [8].
Г-3. В раствор, содержащий 7,32 г хлорида
кадмия, погрузили цинковую пластинку. Масса ее
увеличилась на 1,645 г. Определите степень
вытеснения кадмия и массу солей, содержащихся в
растворе после реакции [9].
Г-4. Медную пластинку массой 13,2 г
поместили в раствор нитрата железа(III) массой 300 г
с массовой долей соли 0,112. После некоторого
выдерживания пластинки в растворе ее вынули. В
результате массовая доля нитрата железа(III)
оказалась равной массовой доле соли меди(II).
Определите массу пластинки после окончания
реакции (когда ее вынули из раствора) [10–13].
Г-5. Две пластинки одинаковой массы из
металла, образующего двухзарядные ионы,
погрузили: одну – в раствор сульфата меди(II),
другую – в раствор сульфата ртути(II). Через
некоторое время масса пластинки, погруженной в
раствор сульфата меди(II), уменьшилась на 3,6%, а
масса пластинки в растворе HgSO4 увеличилась на
6,675%. Уменьшение молярной концентрации обоих
растворов было одинаковым. Определите
эквивалент и название металла [8].
Г-6. В раствор соляной кислоты
погрузили металлическую пластинку массой 50 г.
После того как выделилось 336 мл водорода (н. у.),
масса пластинки уменьшилась на 1,68%. Из какого
металла была изготовлена пластинка, если он
растворяется в соляной кислоте с образованием
двухзарядных катионов [14]?
Г-7. Медный стержень массой 70,4 г
выдержали в растворе нитрата серебра, после чего
его масса составила 85,6 г. Затем стержень
растворили в 32%-м растворе азотной кислоты ( = 1,28 г/мл).
Рассчитайте объем израсходованного раствора
азотной кислоты, считая, что азотная кислота при
реакции восстанавливается до оксида азота(IV) [14,
15].
Г-8. Цинковую пластинку внесли в
раствор нитрата некоторого двухвалентного
металла. В реакцию вступило 0,05 моль нитрата
металла, а масса пластинки увеличилась на 7,1 г.
Определите, нитрат какого металла был в исходном
растворе [16].
Г-9. В раствор, содержащий 10,88 г сулемы,
погрузили медную пластинку. После вытеснения
всей ртути масса пластинки увеличилась на 13,7%.
Определите массу погруженной пластинки [8].
Г-10. Масса медной пластинки,
погруженной на некоторое время в раствор нитрата
ртути(II), после промывания и высушивания
изменилась на 6,8 г. Вычислите массу выделившейся
на пластинке ртути [17].
Г-11. После погружения железной
пластинки в 100 мл 14,5%-го раствора сульфата меди(II)
( = 1,10 г/см3)
масса пластинки увеличилась на 0,391 г. Сколько
граммов железа прореагировало? Какова массовая
доля сульфата меди(II) после завершения реакции
[18]?
Г-12. В раствор нитрата серебра
погрузили медную пластинку массой 80 г. После
полного вытеснения серебра масса пластинки
увеличилась на 3,8%. Сколько нитрата серебра было в
растворе?
Г-13. В раствор сульфата меди(II) массой
248 г поместили порошок магния массой 20 г. Через
некоторое время металлический осадок собрали,
промыли и высушили. Его масса составила 28 г.
Определите массовую долю (%) сульфата магния в
растворе [19].
Решения и ответы
Г-1. m(Cu) = 10,4 г.
Г-2. CuSO4 + Cd = CdSO4 + Cu.
Поскольку масса 1 моль меди меньше массы 1 моль
кадмия, то в результате реакции происходит
уменьшение массы кадмиевой пластинки. При
выделении на пластинке 64 г меди в раствор
одновременно перешло бы 112 г кадмия. При этом
масса пластинки уменьшилась бы на 48 г
(112 – 64 = 48). Запишем соотношение: при уменьшении
массы пластинки на 48 г в раствор переходит 112 г Cd,
а при уменьшении массы пластинки на 3 г в раствор
переходит х г Cd. Решение пропорции дает х =
3•112/48 = 7 г.
Г-3. Степень вытеснения кадмия
составила 87,5%; m(CdCl2) = 0,915 г; m(ZnCl2)
= 4,76 г.
Г-4. Металлическая медь
восстанавливает ионы Fe3+ в ионы Fe2+.
Уравнение реакции:
Обозначим количества веществ меди и нитрата
меди за z моль, тогда количества веществ
нитрата железа(III) и нитрата железа(II) равны по 2z.
Молярные массы солей таковы:
M(Fe(NO3)3) = 242 г/моль,
M(Cu(NO3)2) = 188 г/моль,
M(Fe(NO3)2) = 180 г/моль.
Масса образовавшегося нитрата меди(II) равна 188z,
масса израсходованного нитрата железа(III) равна
484z, а масса оставшегося нитрата железа(III): 33,6
– 484z. По условию задачи:
33,6 – 484z = 188z. Отсюда z = 0,05 моль. Масса
пластинки после реакции равна:
13,2 – 64•0,05 = 10 г.
Г-5.
M + CuSO4 = MSO4 +
Cu, (1)
M + HgSO4 = MSO4 +
Hg. (2)
1-й способ. Пусть m(М) = М(М) = х
г, а масса пластинки – у г:
Решая систему уравнений, получаем:
у = 1336, х = 112.
Отсюда металл – кадмий, эквивалент кадмия
равен 56.
2-й способ. При замещении ионов
меди в CuSO4 на ионы неизвестного металла
масса пластинки уменьшается. Это означает, что
металл пластинки имеет большую молярную массу,
чем медь, но меньшую, чем ртуть (т.к. при замещении
металлом ртути в HgSO4 масса пластинки
возрастает). Увеличение или уменьшение массы
пластинки как раз и связано с этой разницей в
значениях молярных масс веществ.
Запишем изменение массы пластинки следующим
образом: для 1-й пластинки уменьшение массы
1 моль как М – 64, а для 2-й пластинки
увеличение массы 1 моль: 201 – М. При этом
массы пластинок, обозначенные через а1
и а2, составят в первом случае: а1
= (М – 64)•100/3,6 и во втором случае: а2 =
(201 – М)•100/6,675.
Зная из условия, что массы пластинок равны,
приравняем полученные выражения:
(М – 64)•100/3,6 = (201 – М)•100/6,675,
и найдем значение молярной массы металла: М(М)
= 112 г/моль. Это металл – кадмий, эквивалент кадмия
равен 56.
Г-6. М + 2НСl = МСl2 + Н2;
n(Н2) = 0,336/22,4 = 0,015 моль,
n(М) = n(Н2) = 0,015 моль,
m(М) = 50•0,0168 = 0,84 г,
М(М) = 0,84/0,015 = 56 г/моль.
Следовательно, металл – железо.
Г-7. Объем раствора азотной кислоты
составит 677 мл.
Г-8. Zn + M(NO3)2 = Zn(NO3)2
+ M.
Обозначим М(М) за х. Зная, что изменение
массы составляет 7,1 г, составим и решим уравнение:
0,05х – 65•0,05 = 7,1.
Отсюда х = 207 г/моль. Искомый металл – свинец.
Г-9. Cu + HgCl2 = CuCl2 + Hg.
1-й способ. Пользуясь уравнением
реакции, составим следующие пропорции: из 272 г HgCl2
можно вытеснить 201 г ртути, а из 10,88 г HgCl2 – х
г ртути. Отсюда
х = 10,88•201/272 = 8,04 г.
При выделении 201 г ртути в раствор переходит 64 г
меди, а при выделении 8,04 г ртути – у г меди.
Находим
у = 8,04•64/201 = 2,56.
Следовательно, масса пластинки в целом
увеличилась на 5,48 г (8,04 – 2,56 = 5,48), что в
соответствии с условием задачи составляет 13,7% от
первоначальной массы. Массу исходной пластинки
найдем так:
5,48•100/13,7 = 40 г.
2-й способ. n(НgCl2) = 10,88/272 =
0,04 моль. Чтобы найти массу пластинки m, решим
уравнение:
201•0,04 – 64•0,04 = 0,137m.
Отсюда m = 40 г.
Г-10. Масса ртути равна 10 г.
Г-11. Fe + CuSO4 = FeSO4 + Cu.
Обозначим за х количество вещества железа,
вступившего во взаимодействие. (При этом, как
понятно из уравнения реакции, количества веществ
меди и железа равны.) Тогда можно записать
следующее равенство: –56х + 64х = 0,391, т.е.
изменение массы пластинки составит 8х = 0,391.
Отсюда х = 0,05 моль.
Масса железа, вступившего в реакцию, будет равна
2,8 г, масса же прореагировавшей соли CuSO4
равна 8,0 г (160•0,05).
Теперь вычислим массу исходного раствора соли:
100•1,10 = 110 г, а затем массу вещества CuSO4 в
этом растворе: 110•0,145 = 16 г.
Определим массу неизрасходованного сульфата
меди(II): 16 – 8 = 8 г.
Масса раствора после окончания реакции будет
равна: 110 – 0,391 = 109,609 г.
Массовая доля соли после завершения реакции
составит: 8/109,609•100% = 7,3%.
Г-12. Cu + 2AgNO3 = Cu(NO3)2 + 2Ag.
Изменение массы пластинки
m = 0,038•80 = 3,04 г.
Найдем количество вещества меди, участвующей в
реакции:
216n – 64n = 3,04, n = 0,02 моль.
Масса нитрата серебра равна: 0,04•170 = 6,8 г.
Г-13. (MgSO4)
= 16,3%.
ЛИТЕРАТУРА
1. Гольдфарб Я.Л., Сморгонский Л.М. Задачи и
упражнения по химии. М., 1953, 168 с.
2. Гольдфарб Я.Л., Сморгонский Л.М. Задачи и
упражнения по химии. М., 1957, 144 с.
3. Гольдфарб Я.Л., Сморгонский Л.М. Задачи и
упражнения по химии. М., 1963, 144 с.
4. Гольдфарб Я.Л., Ходаков Ю.В. Задачи и
упражнения по химии. М., 1979, 190 с.
5. Гольдфарб Я.Л., Ходаков Ю.В., Додонов Ю.Б.
Задачи и упражнения по химии. М., 1999, 271 с.
6. Смирнова Л.М., Жуков П.А. Сборник задач по
общей и неорганической химии. 8–11 классы.
СПб., 2000, 126 с.
7. Шевалева А.С. Задачник-практикум по
методике решения расчетных задач по химии в
средней школе. М., 1963, 80 с.
8. Середа И.П. Конкурсные задачи по химии. Киев,
1978, 192 с.
9. Сидоров Е.П. Пособие для поступающих в вузы.
Справочник по химии (для решения конкурсных
задач). М., 1992, 139 с.
10. Кузьменко Н.Е., Еремин В.В., Осин С.Б., Чуранов
С.С., Зык Н.В., Путилин Ф.Н. Конкурсный экзамен по
химии. МГУ, 1992–1993. М., 1994, 125 с.
11. Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия.
М., 1999, 542 с.
12. Кузьменко Н.Е., Еремин В.В. Химия. 2400 задач
для школьников и поступающих в вузы.
М., 1999, 560 с.
13. Кузьменко Н.Е., Еремин В.В., Чуранов С.С. Сборник
конкурсных задач по химии. М., 2001, 537 с.
14. Михайлов М.Д., Петрова Г.А., Семенов И.Н.
Тренировочные упражнения по химии.
Л., 1989, 143 с.
15. Кушнарев А.А. Учимся решать задачи по химии.
Руководство для самостоятельной подготовки к
экзамену. М., 1996, 221 с.
16. Шамова М.О. Учимся решать расчетные задачи
по химии: технология и алгоритмы решения.
М., 2001, 95 с.
17. Свиридов В.В., Попкович В.А., Адамович Т.П.,
Васильева Г.И. Сборник задач и упражнений по
неорганической химии. Минск, 1985, 207 с.
18. Бердоносов С.С. Введение в неорганическую
химию. М., 1995, 103 с.
19. Сидельникова В.И. Сборник задач повышенной
трудности и упражнений по химии.
Тюмень, 1994, 151 с.
С.В.ТЕЛЕШОВ,
учитель химии,
И.Кутумов,
(г. Нефтеюганск)
Как я уже говорила, с точки зрения реакции, здесь все просто: магний вытесняет из соли железо.
3Mg + 2FeCl3 = 3MgCl2 + 2Fe
Для начала определим количество веществ магния на пластинке и хлорида железа(III):
n(Mg) = m/M = 4.2 моль
n(FeCl3) = mр-ра*w/M = 162.5*0.1/162.5 = 0.1 моль
Очевидно, что магния больше — он в избытке, значит расчет продуктов будем вести по недостатку — количеству вещества хлорида железа(III).
n(MgCl2) = n(FeCl3)*3/2 = 0.15 моль
n(Fe) = n(FeCl3) = 0.1 моль
— не забывайте, что нужно учитывать коэффициенты. Например, хлорида магния выделилось в 1.5 раза больше, чем было истрачено хлорида железа(III).
Давай сначала разберемся с тем, что случилось с магниевой пластинкой. Магний уходил с пластинки в раствор — т.е. из-за этого пластинка становилась легче. С другой стороны из раствора на пластинку приходило железо — за счет этого пластинка тяжелела. В общем виде матбаланс пластинки можно записать так:
m (разницы) = — m(Me ушедшего) + m(Me пришедшего)
m (разницы) — это изменение массы пластинки, т.е. насколько пластинка стала весить больше (иногда меньше). Для того, чтобы узнать эту разницу, нужно вычесть массу ушедшего металла и прибавить массу пришедшего. Вот так этот процесс можно проиллюстрировать:
В задачах очень важно представлять, что происходит с раствором и веществами в нем, а не стараться заучить формулы и алгоритмы решения задач. Условия постоянно меняются и гораздо эффективнее проработать базу и научиться рассуждать. Думай о пластинке — вот ее загрузили в раствор, вот один металл ушел, другой пришел, поэтому масса изменилась.
Вернемся к нашему примеру и посчитаем изменение массы пластинки.
m (разницы) = — m(Me ушедшего) + m(Me пришедшего) = — n(Mg)*M + n(Fe)*M
Мы уже нашли количество вещества выделившегося железа, сейчас определим количество вещества затраченного магния. Также делаем это по недостатку:
n(Mg) = n(FeCl3)*3/2 = 0.15 моль
Теперь осталось найти изменение массы:
m (разницы) = — n(Mg)*M + n(Fe)*M = — 0.15*24 + 0.1*56 = 2 г
т.е. пластинка потяжелела на 2 г. Это произошло из-за того, что с пластинки в раствор ушел менее тяжелый металл, а пришел более тяжелый (молярная масса магния 24 г/моль, а железа 56 г/моль). Как правило, пластинка тяжелеет, т.к. более активные металлы, которые уходят с пластинки, легче, чем менее активные металлы.
Теперь определим массовую долю соли в растворе. Хлорида железа(III) не осталось, теперь в растворе только хлорид магния. Мы знаем его массу, осталось найти массу раствора. Чтобы это сделать нужно также вычесть из массы раствора то, что из него ушло (ионы железа) и прибавить то, что пришло (ионы магния). Но вообще, мы уже это сделали — если пластинка потяжелела на 2 г, то раствор стал весить меньше на эти же два грамма. Так работает закон сохранения массы — ничто никуда не девается и не образуется из ниоткуда.
m р-ра = m (р-ра начального) — m (разницы пластинки) = 162.5 — 2 = 160.5 г
поэтому w(MgCl2) = m/m р-ра = 0.15*95/ 160.5 = 0.089 (8.9%)
Задача решена. Опять же такой задачи не следует ждать на ЕГЭ, но как часть задачи — вполне может попасться.
_____________
Еще нужно понять, что задачи с пластинкой — это такой случай, когда в раствор вносят активный металл, который вытесняет менее активный из раствора. Не обязательно вам скажут, что в раствор внесли пластинку. Это может быть проволока, стружка, гвозди… В общем металл в твердом виде. При этом суть задачи, конечно, не меняется.
Единственное, если в раствор внесли опилки или металлическую пыль, то менее активный металл будет просто выпадать в осадок (который тоже не является частью раствора), но не оседать на пластинке.
И еще одно замечание на эту тему. Если мы говорим про этот тип задач, то металл с пластинки должен быть активнее металла в растворе. Временами в ЕГЭ встречается такая задача: медную проволоку вносят в раствор сульфата железа(III). Не нужно путаться — медь менее активна, и не может вытеснить железо из раствора. Но она может восстановить железо(III) до железа(II), что и происходит:
Fe2(SO4)3 + 2Cu = 2CuSO4 + FeSO4
Но здесь пластинка просто становится легче, т.к. металл уходит в раствор, но ничего не приходит на пластинку. В общем, это другая задача, которая часто приводит в недоумение учеников (:
Это одна из самых простых задач на избыток и недостаток. Правда она слегка осложнена тем, что сульфат меди дан не просто так, а в виде кристаллогидрата (как в общем он и существует в реальной жизни). В первую очередь запишем уравнение реакции:
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Как обычно, начинаем с того, что расчитываем количества вществ исходных реагентов, определяем что в избытке, что в недостатке.
Чтобы найти количество вещества сульфата меди в медном купоросе, нужно найти количестово вещества этого кристаллогидрата. Это делается также, как и в любом другом случае: массу вещества делим на молярную массу. Молярная масса кристаллогилрата = молярная масса соли + молярная масса нужно количества воды. В нашем случае количество вещества медного купороса:
n(CuSO4*5H2O) = m/M = 250/(160 + 5*18) = 1 моль
теперь давай подумаем вот о чем: если количествово вещества кристаллогидрата 1 моль, а в одной единице кристаллогидрата 1 единица соли, то и колчество вещетсва сульфата меди тоже 1 моль. И это всегда так — количество вещества кристаллогидрата = количеству вещества соли.
А вот воды в нашем примере 5 моль. Т.к. в одной единице кристаллогилдрата 5 молекул воды. В общем, здесь работают простые рассуждения, и не так уж сложна эта тема.
И на этом задча на кристаллогидрат закончилась) Дальше просто разбираемся с избытком и недостатком и находим массы продуктов и раствора. Определяем количество вещества гидроксида натрия:
n(NaOH) = mр-ра*w/M = 400*0.25/40 = 2.5 моль
Гидроксид натрия в избытке — чтобы прореагирвоал весь сульфат меди необходимо 2 моль гидроксидла, а у нас 2.5 моль. Значит расчет продуктов ведем по сульфату меди.
n(Cu(OH)2) = n(CuSO4) = 1 моль
n(Na2SO4) = n(CuSO4) = 1 моль
Нам нужно найти массовую долю соли — сульфата натрия. Для этого осталось найти массу раствора. Давай посмотрим, что происходило. Кристаллогилрат смешали с водой, затем добавили раствор NaOН, т.е. было так:
m р-ра = m(CuSO4*5H2O) + m(Н2О) + m (NaOH р-ра) …
затем в осадок выпал гидроксид меди, он больше не часть раствора, поэтому его массу вычитаем:
m р-ра = m(CuSO4*5H2O) + m(Н2О) + m (NaOH р-ра) — m(Cu(OH)2)
это все, с раствором больше ничего не происходило. Давай подставим числа:
m р-ра = 250 + 500 + 400 — 1*98 = 1052 г
Осталось найти массовую долю сульфата натрия:
w(Na2SO4) = m/m р-ра = 1*142/1052 = 0.135 (13.5%)
____________
Опять же, нужно понять суть этой задачи, а не заучивать решение. В учебнике есть еще несколько примеров задач, также как и в письменном ДЗ 
7 правил к решению задач на «пластинки»
1.Пластинка, как правило, в избытке, но это необходимо проверять.
2. Если в тексте задачи сказано, что пластинку вынули после окончания всех реакций,- это означает ,что соль прореагировала полностью.
3. Если в тексте задачи сказано, что пластинку вынули через некоторое время, — это означает, что и соль и пластинка прореагировали неполностью.
4.Как правило, более активный металл вытесняет менее активный металл из раствора соли. НО:
А) 2FeCI3+ Cu→ CuCI2+ 2FeCI2
Б) FeCI2+ Cu≠
В) 2 FeCI3+ Fe→ 3FeCI2 (и т.п.)
5) mпл.2 = mпл.1 – m(Me1 )прорегир. + m(Me2 )получилась
mр-ра2 = mр-ра1 + mпл.1 -mпл.2
mр-ра2 = mр-ра1 + m(Me.1)прореагир. — m (Me.2)получилась
6)ώ (в-ва)=m(в-ва)/ m(р-ра) →
если вещества находятся в одном и том же растворе,
то при равенстве их массовых долей равны и их массы.
7)Слово «пластинка» не обязательно будет присутствовать в условии задачи. Вместо него могут быть слова «гвоздь», «проволока», «стружки», «порошок» и тому подобное.
ЗАДАЧИ НА ПЛАСТИНКУ.
1.Железную пластинку массой 5 г погрузили в 50 мл 15%-го (по массе) раствора сульфата меди(II) ( = 1,12 г/мл). После того как пластинку вынули, ее масса оказалась равной 5,16 г. Какова концентрация сульфата меди(II) в оставшемся растворе (9,3%).
2. Медную пластинку массой 16 г погрузили в 100 г раствора трихлорида железа с массовой долей 16,3% и вынули в тот момент, когда массовая доля трихлорида железа стала равной массовой доле образовавшейся в растворе соли меди. Определите массу пластинки после окончания реакции (13,733).
3. В раствор, содержащий 4 г сульфата меди(II), погрузили кадмиевую пластинку. После полного вытеснения меди масса пластинки уменьшилась на 30%. Определите массу погруженной в раствор пластинки ( 4г).
4. Цинковая пластинка массой 5 г погружена в раствор сульфата меди(II). После окончания реакции промытая и высушенная пластинка имела массу 4,96 г. Объясните изменение массы пластинки и определите массу сульфата меди(II), находившегося в растворе до начала
реакции (3,35)
5.Железную пластинку массой 6,35 г поместили в 200 г 20%-го (по массе) раствора сульфата меди(II). Через некоторое время масса пластинки увеличилась до 7,1 г. Определите массовую долю сульфата меди(II) и сульфата железа(II) в полученном растворе в процентах (по массе) (12,55; 7,15) .
6. Медный стержень массой 70,4 г выдержали в растворе нитрата серебра, после этого его масса стала 85,6 г. Затем стержень растворили в 400 мл 64%-го раствора азотной кислоты ( = 1,4 г/см3). Рассчитайте, как изменится массовая доля азотной кислоты в растворе, если она восстанавливается до диоксида азота (14,9).
7. Железную пластинку массой 100 г погрузили в 250 г раствора сульфата меди(II) с массовой долей 20%. Через некоторое время пластинку вынули из раствора, промыли, высушили и взвесили. Ее масса оказалась равной 102 г. Определите массовые доли (%) веществ, содержащихся в растворе после удаления из него металлической пластинки [4%;15,3%].
8.К раствору нитрата ртути(I) массой 263 г с массовой долей соли 20% добавили цинковые опилки. Через некоторое время массовая доля нитрата ртути(I) в оставшемся растворе составляла уже 6%. Рассчитайте массу выделившейся ртути [29,2г].
9.Для того чтобы посеребрить медное изделие массой 10 г, его поместили в стакан, содержащий 250 г 4%-го раствора нитрата серебра. Когда изделие вынули, то оказалось, что содержание нитрата серебра в растворе уменьшилось на 16,9%. Определите массу посеребренного изделия [10,76г].
10.В 250 г воды растворили 70 г медного купороса. В полученный раствор погрузили железную пластинку массой 10 г. Через некоторое время промытая и высушенная пластинка имела массу
11,4 г. Определите массовые доли веществ в получившемся растворе [5,27%;8,35%].
11. Цинковую пластинку массой 25 г поместили в раствор, полученый при растворении медного купороса в 130 мл воды. После того, как вся медь выделилась на пластинке, масса пластинки составила 24,83 г. Вычислите массу взятого медного купороса и массовую долю сульфата меди в исходном растворе. (42,5г;15,77%)
12. .Магниевую пластинку внесли в 150 г 17,1%-го раствора сульфата алюминия и выдерживали, пока ее масса не изменилась на 0,45 г. К раствору, полученному после удаления пластинки, прилили избыток раствора карбоната натрия. Вычислите массовые доли веществ в выпавшем при этом осадке. (55,32%,44.68%)
13. Железную пластинку массой 14 г поместили в раствор бромида меди (II) и выдерживали до тех пор, пока ее масса не стала равной 14,4 г. Затем пластинку вынули, высушили и внесли в 400 г подогретого 26%-го раствора хлорида железа (III). Вычислите массовую долю веществ в полученном растворе.(21,45%;1,63%,5,49%)
14. Алюминиевую пластинку массой 18,36 г поместили в раствор нитрата цинка и выдерживали, пока ее масса не увеличилась на 5,64 г. Пластинку вынули, высушили и полностью растворили в 280 г раствора гидроксида натрия. Вычислите массовые доли солей в полученном растворе. (23,45%;7,11%)
15. Медный купорос массой 30 г растворили в воде. К образовавшемуся раствору сначала прилили 48 г 15%-го раствора гидроксида натрия, а затем в него погрузили цинковую пластинку массой 8,45 г и выдерживали до тех пор, пока ее масса не перестала изменяться. После этого пластинку вынули и прокалили в токе кислорода. Определите массовые доли веществ в смеси, полученной после прокаливания.(77,14%;22,86%)
16. Пластинку из магния массой 14,4 г поместили в 8%-ный раствор хлорида марганца объемом 145,83 мл и плотностью 1,08 г/мл. После окончания реакции пластинку вынули и просушили. Вычислите массу 15%-го раствора соляной кислоты, которая потребуется для полного растворения полученной пластинки. (292г)