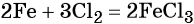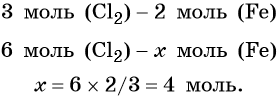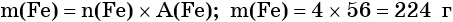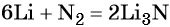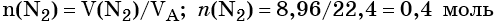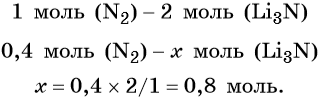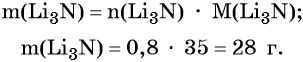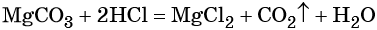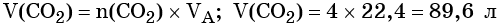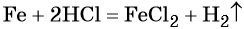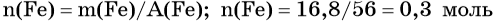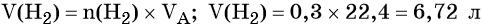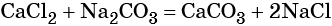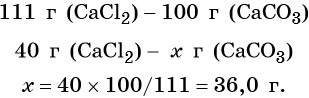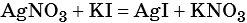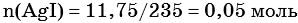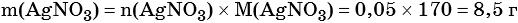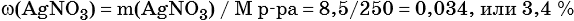Решение расчетных задач на вычисление массы или количества продукта реакции, если один из реагентов взят в избытке
В условиях задач такого типа указаны массы или объёмы двух реагирующих веществ, одно из которых дано в избытке, поэтому при решении таких задач нужно определить, какое вещество взято в избытке. Расчёт массы или объёма продукта реакции ведётся по данным вещества взятого в недостатке.
I. Алгоритм решения задачи: «Вычисление массы или количества продукта реакции, если один из реагентов взят в избытке»
Пример 1. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
|
Последовательность выполнения действий |
Оформление решения задачи |
|
1. Записываем условие задачи |
Дано: m(CaCl2)=33,3г m(Na3PO4)=16,4г _______________ Найти: m(Ca3(PO4)2) =? |
|
2. Вычислим молярные массы для формул, записанных вдано |
M(CaCl2)=111г/моль M(Na3PO4)=164г/моль M(Ca3(PO4)2) =310г/моль |
|
3. Вычислим количества веществ, масса которых дана в условии |
ν(CaCl2)=m/M=33,3г/111г/моль=0,3моль ν(Na3PO4)=16,4г/164г/моль=0,1моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
|
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби. |
CaCl2 – взят в избытке, расчёт ведём по недостатку, т.е. поNa3PO4. |
|
6. Вычислим количество вещества, массу которого нужно найт |
По УХР: ν(Ca3(PO4)2)= (0,1моль∙1моль)/2моль=0,05моль |
|
7.Вычислим искомую массу |
m(Ca3(PO4)2)= ν(Ca3(PO4)2 )∙ M(Ca3(PO4)2) = 0,05моль ∙ 310г/моль =15,5г |
|
8. Запишем ответ |
Ответ: m(Ca3(PO4)2) =15,5г |
Пример 2. Вычислите объём водорода (н.у.), который образуется при взаимодействии 6,5 г цинка с соляной кислотой массой 7,5 г.
|
Последовательность выполнения действий |
Оформление решения задачи |
|
1. Записываем условие задачи |
Дано: m(Zn)=6,5г m(HCl)=7,5г Vm=22,4л/моль _______________ Найти: V(H2) =? |
|
2. Вычислим молярные массы для веществ с известной массой, записанных в дано |
M(Zn)=65г/моль M(HCl)=36,5г/моль |
|
3. Вычислим количества веществ, масса которых дана в условии |
ν(Zn) = m/M= 6,5/65г/моль=0,1моль ν(HCl)=7,5г/36,5г/моль=0,205моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
|
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби. |
НCl – взят в избытке, расчёт ведём по недостатку, т.е. по Zn. |
|
6. Вычислим количество вещества, объём которого нужно найти |
По УХР: ν(H2) = ν(Zn)=0,1моль |
|
7.Вычислим искомый объём |
V(H2)= ν(H2)∙ Vm = 0,1моль ∙ 22,4л/моль =2,24л |
|
8. Запишем ответ |
Ответ: V(H2)= 2,24л |
II. Алгоритм решения задач на «Избыток — недостаток» (в общем виде)
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V, W) реагентов
Найти: m (ν, V, W) продукта
Решение:
1. Составляем уравнение реакции
2. Нахождение количества вещества реагентов ν(А) и ν(В):
ν = m/M;
ν = V/Vm;
Wвещества = (mвещества •100%)/mраствора;
mвещества= (Wвещества• mраствора)/100%
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
Если, ν(А)/a < ν(В)/b, то вещество А в недостатке, расчёт ν(С) ведём по ν(А)
Если, ν(А)/a = ν(В)/b, то расчёт ν(С) ведём по ν(В) или ν(А)
4. Определение ν(С) по УХР путём составления и решения пропорции:
ν(В)/b = ν(С)/с или ν(А)/a = ν(С)/с
5. Нахождение величин, требуемых по условию:
m = ν•M;
V = ν• Vm;
Wвещества = (mвещества •100%)/mраствора
Здесь,
m — масса вещества (г)
ν — количество вещества (моль)
V — объём (л)
W — массовая доля вещества (%)
III. Решите следующие задачи
- Вычислите массу осадка, образующегося при взаимодействии 160 г сульфата железа (III) и 41,6 г хлорида бария.
- Вычислите объем углекислого газа, который можно получить при взаимодействии карбоната кальция массой 7 г с соляной кислоты массой 6 г.
Расчёты по уравнениям химических реакций
Расчёты по уравнениям химических реакций (стехиометрические расчёты) основаны на законе сохранения массы. Уравнение химической реакции показывает:
1) в каких количественных соотношениях реагируют и образуются вещества;
2) в каких отношениях масс реагируют и образуются вещества.
Если в реакции участвуют газообразные и парообразные вещества, то химическое уравнение реакции показывает, в каких объёмных соотношениях они реагируют и образуются.
Пользуясь уравнением химической реакции, можно производить вычисления, имеющие большое значение в лабораторной практике и на производстве. На основе химических уравнений вычисляют количество вещества реагирующих или полученных веществ, массу, объём (для газообразных веществ).
Уравнение химической реакции содержит обычно больше информации, чем нужно для решения задачи. Поэтому, прочитав условие задачи и написав уравнение химической реакции, надо обратить внимание на то, какая величина является данной и какая искомой. Далее надо определить, в каких единицах должен быть дан ответ (в единицах количества вещества, массы или объёма). Необходимо стремиться к наиболее рациональным вычислениям, что может быть достигнуто использованием различных единиц массы и объёма.
Расчёты количественных величин искомого вещества по уравнению химической реакции основываются на данных об известном веществе, которые могут быть указаны с использованием разных величин (массы, объёма, количества вещества).
В задачах данного вида исходное вещество содержится в растворе, поэтому найти массу растворённого вещества можно по формуле:
`m_((«р».»в».))=m_((«р-ва»))*omega_((«р».»в».))`.
Если заданы объём и плотность раствора, то массу растворённого вещества можно найти по формуле:
`m_((«р».»в».))=V*rho*omega_((«р».»в».))`.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Выражают либо в долях единицы, либо в процентах (чаще всего).
$$ {omega }_{mathrm{в}-mathrm{ва}}={displaystyle frac{{m}_{mathrm{в}-mathrm{ва}}}{{m}_{mathrm{раствора}}}}·100%, {omega }_{mathrm{в}-mathrm{ва}}={displaystyle frac{{m}_{mathrm{в}-mathrm{ва}}}{{m}_{mathrm{смеси}}}}·100%$$.
По уравнениям химических реакций можно рассчитывать количество вещества, массу или объём реагирующих веществ и продуктов реакции. Количества вещества соединений, вступающих в химическую реакцию и образующихся в результате реакции, пропорциональны друг другу и относятся как коэффициенты перед формулами этих соединений в уравнении реакции.
Зная количество вещества одного из реагентов, можно найти количества вещества других участников данной реакции, а по количеству вещества достаточно легко выйти на массу или объём.
Вещества реагируют друг с другом в строго определенных количественных соотношениях. Для проведения химической реакции исходные вещества могут быть взяты в любых количествах, причём одно из реагирующих веществ может быть взято в избытке, другое – в недостатке. Главная задача — определить, какое из реагирующих веществ было взято в избытке, а какое в недостатке. Определив это, дальнейший расчёт задачи вести строго по тому веществу, которое было взято в недостатке. Это можно объяснить тем, что вещество, находящееся в недостатке, прореагирует полностью, и количество вещества данного реагента будет точно известно.
Для того чтобы определить, какое из реагирующих веществ будет в избытке, а какое – в недостатке, необходимо вычислить количества вещества реагентов и сравнить их. Если количества вещества реагентов, участвующих в химической реакции, одинаковы, то в избытке будет то вещество, количество которого больше в соответствии с условиями задачи. Если же вещества реагируют в неравных количествах, то для расчёта избытка и недостатка следует учитывать коэффициенты в уравнении реакции.
При проведении расчётов по уравнениям химических реакций полагают, что исходные вещества полностью превратились в продукты реакции и что количества веществ, образующихся в результате реакции, строго соответствуют количествам вступивших в реакцию веществ.
Расчёты по уравнению химической реакции основаны на законе сохранения массы вещества. Осуществляя расчёты по химическому уравнению, мы получаем теоретический `100 %`-ный выход продукта реакции.
На самом деле масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с расчётом по уравнению химической реакции. Это связано, прежде всего, с неполным протеканием реакций в реальных химических процессах и с некоторыми потерями веществ.
Выход продукта реакции – это отношение массы практически полученного продукта к массе вещества, которая должна получиться теоретически:
`eta=m_»практ»/m_»теор»*100%`.
Зная массу исходного вещества и долю выхода продукта реакции, можно рассчитать практическую массу образующегося в результате реакции вещества. Для этого вычисляют теоретические значения этих величин, а затем с использованием формул вычисляют их практические значения:
$$ {m}_{mathrm{практ}}={displaystyle frac{{m}_{mathrm{теор}}·eta }{100%}}$$.
В случае газообразных веществ рассчитывают объёмную долю выхода продукта.
Объёмная доля выхода продукта – это отношение объёма практически полученного газообразного продукта к объёму газообразного вещества, который должен получиться теоретически:
`varphi=V_»практ»/V_»теор»*100%`.
Каждое вещёство наряду с основным компонентом включает то или иное количество примесей. Именно поэтому абсолютно чистых веществ в природе не существует.
Образец (вещество, навеску), содержащий примеси, принято называть техническим (технически чистым). Его массу обозначают mтехн, массу примесей — mприм, а массу основного (чистого) вещества — mчист.
Обрати внимание!
(=) mчист (+)
mприм
.
Содержание примесей в техническом образце обычно указывается с помощью массовой доли, которую выражают в долях от единицы или в процентах:
Сумма массовых долей примесей
ωприм
и основного вещества
ωчист
равна (1) ((100) %):
(+) ωчист (=) (1) ((100) %).
При проведении расчётов по уравнениям химических реакций, если исходное вещество содержит определённую долю примесей, придерживаются алгоритма:
1. если необходимо, записывают уравнение химической реакции.
2. Находят массу чистого вещества.
Её можно рассчитать по формуле:
mчист (=) mтехн (·) ωчист (=) mтехн (·) ((1 -) ωприм )
— либо используя пропорцию. При этом mтехн соответствует (100) %, а mчист — (x) %.
3. Определяют химическое количество чистого вещества по формуле:
n=mM.
4. Подчёркивают формулы интересующих веществ в уравнении реакции.
Под этими формулами записывают химические количества вступивших в реакцию и образовавшихся веществ (коэффициенты перед веществами в уравнении реакции). Над формулами веществ указывают известную величину (найденное по формуле химическое количество чистого вещества), а также неизвестную, которую обозначают за (x) — (химическое количество образующегося продукта реакции или вступившего в реакцию исходного вещества).
5. Составляют пропорцию и находят неизвестную величину.
6. Если необходимо, рассчитывают по формуле массу продукта реакции или массу вступившего в реакцию вещества:
m=n⋅M.
Обрати внимание!
Если необходимо найти объём газообразного вещества ( при н. у.) — используют формулу: V(вещ)=Vm⋅n(вещ); Vm=22,4 л/моль.
Вычисли массу негашёной извести
CaO
, которую получили при обжиге известняка массой (300) г, если массовая доля примесей в нём равна (0,08) ((8) %).
1. Запиши уравнение химической реакции:
2. Определи массовую долю чистого карбоната кальция в известняке и найди массу соли:
ωчист (=) (1) (-) ωприм (= 1 — 0,08 = 0,92).
(0,92) — массовая доля (в долях от единицы) карбоната кальция в известняке.
mчист (=) mтехн (·) ωчист (= 300 · 0,92 = 276) г.
(276) г — масса чистого карбоната кальция в известняке.
3. Определи химическое количество чистого вещества:
моль.
4. (2,76) моль (x) моль
(1) моль (1) моль
5. Составь пропорцию и найди неизвестную величину:
(2,76) моль — химическое количество образовавшейся негашёной извести.
6. Определи массу негашёной извести:
г.
Ответ: (m()CaO()) (=) (154,56) г.
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
Очень часто при проведении реакции между веществами оказывается, что один реагент прореагировал полностью, а другой нет. В таком случае говорят, что вещество, которое полностью израсходовалось, было в недостатке, а то вещество, которое осталось – в избытке. Поскольку избыток реагента не участвует в реакции, количество продукта зависит только от количества вещества, которое было в недостатке.
Предположим, что осуществляется реакция между веществами А и B, которая протекает в соответствии с уравнением:
aA + bB = cC + dD
Для осуществления этой реакции было взято количество вещества A, равное nA, и количество вещества B, равное nB. Определить то, какое вещество в избытке, а какое в недостатке, можно, сравнив выражения:
В зависимости от того, какое выражение окажется меньше, то вещество соответственно и будет в недостатке.
Примечание: распространенной ошибкой является то, что вместо выражений (1) сравнивают просто количества веществ. Так делать категорически не допускается! Если n(A) > n(B), то это еще не значит, что вещество A в избытке!
После того, как будет установлено то, какое вещество было в недостатке, расчеты ведутся по его количеству аналогично рассмотренным в главе 4.3.3.
Пример задачи на избыток и недостаток
Нагрели смесь 54 г алюминия и 80 г серы. Вычислите массу образовавшегося сульфида алюминия.
Решение
Запишем уравнение реакции:
2Al + 3S = Al2S3
Рассчитаем количества веществ алюминия и серы:
n(Al) = m(Al)/M(Al) = 54/27 = 2 моль;
n(S) = m(S)/M(S) = 80/32 = 2,5 моль
Для того чтобы выяснить, какое из исходных веществ в недостатке, разделим количества молей веществ на коэффициенты перед этими веществами в уравнении и сравним рассчитанные выражения:
n(Al)/k(Al) = 2/2 = 1
и n(S)/k(S) = 2,5/3 ≈ 0,833
т.е. n(Al)/k(Al) > n(S)/k(S)
Значит сера в недостатке. Расчеты далее ведем по количеству вещества серы.
Исходя из уравнения реакции
2Al + 3S = Al2S3
следует, что количество прореагировавшей серы и образовавшегося в результате реакции сульфида алюминия связаны выражением:
где 3 и 1 – коэффициенты перед S и Al2S3 соответственно. Отсюда:
n(Al2S3) = n(S)/3 = 2,5/3 ≈ 0,8333 моль
Следовательно, масса сульфида алюминия будет равна:
m(Al2S3) = M(Al2S3) ∙ n(Al2S3) = 150 ∙ 0,8333 = 125 г
Ответ: m(Al2S3) = 125 г
В случае, если в задаче дается масса реагента, содержащего примеси (mр-та с прим.), прежде всего следует рассчитать массу чистого реагента без примесей (mр-та ). Если дается масса реагента с примесями и указана массовая доля этого реагента ωр-та , то масса чистого реагента рассчитывается по формуле:
В случае, если вместо массовой доли чистого вещества дается массовая доля примесей, то учитывая, что:
ωр-та + ωприм. = 100%
мы можем записать, что:
Пример задачи на расчет количества продукта, зная массу реагента с примесями
Какой объем углекислого газа (н.у.) выделится при действии избытка соляной кислоты на технический карбонат кальция массой 150 г, содержащий 10% некарбонатных примесей.
Решение:
Запишем уравнение взаимодействия карбоната кальция с соляной кислотой:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Массовая доля примесей в техническом карбонате кальция составляет 10%, значит массовая доля чистого карбоната кальция будет составлять:
ω(CaCO3) = 100% — ω(прим.) = 100% — 10% = 90%.
Масса чистого карбоната кальция будет равна:
m(CaCO3) = ω(CaCO3) ∙ m(CaCO3 техн.)/100% = 90% ∙ 150 г/100% = 135 г,
Следовательно, количество вещества карбоната кальция равно:
n(CaCO3) = m(CaCO3)/M(CaCO3) = 135 г / 100 г/моль = 1,35 моль
В соответствии с уравнением реакции:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Количества веществ карбоната кальция и углекислого газа равны (одинаковые коэффициенты в уравнении), следовательно:
n(CO2) = n(CaCO3) = 1,35 моль
Тогда, зная, что один моль любого газа при нормальных условиях занимает объем 22,4 л, мы можем рассчитать объем выделившегося CO2:
V(CO2) = n(CO2) ∙ Vm = 1,35 моль ∙ 22,4 л/моль = 30,24 л
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
Расчеты массы вещества по уравнению химической реакции
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
При решении расчетных химических задач необходимо умение производить вычисления по уравнению химической реакции. Урок посвящен изучению алгоритма расчетов массы (объема, количества) одного из участников реакции по известной массе (объему, количеству) другого участника реакции.
http://www.calc.ru/Raschty-Po-Uravneniyam-Khimicheskikh-Reaktsiy.html
http://interneturok.ru/lesson/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii