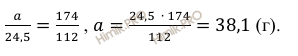Масса образовавшейся соли
К 25 граммам серной кислоты (H2SO4) прилили 25 грамм гидроксида калия (KOH), содержащего 2% примесей. Найдите массу образовавшейся соли.
Решение задачи
Запишем уравнение реакции нейтрализации раствора гидроксида калия (KOH) раствором серной кислоты (H2SO4):
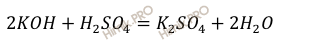
Используя формулу нахождения массовой доли растворенного вещества:
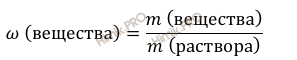
выразим массу вещества:

Найдём массу вещества гидроксида калия (KOH):
m
(вещества KOH) = 25 ∙ 0,98 = 24,5
(г).
Если раствор 98-процентный
(известно, что примеси составляют 2% поэтому: 100% — 2% = 98%), то массовая
доля гидроксида калия (KOH) в нем 0,98.
Учитывая, что молярные массы гидроксида калия (KOH) и серной кислоты (H2SO4) соответственно равны 56 г/моль и 98 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 1,192 г гидроксида калия (KOH):

на
нейтрализацию 112 г KOH
нужно 98 г H2SO4
на
нейтрализацию 24,5 г KOH
нужно х г H2SO4
Откуда:
Это означает, что серная кислота (H2SO4) находится в избытке и
дальнейшие расчеты производим по недостатку, то есть по гидроксиду калия (KOH).
Учитывая, что молярная масса сульфата калия (К2SO4) равна 174 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции найдём массу образовавшейся соли:
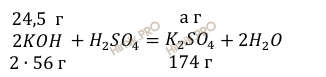
112
г KOH нужно для
образования 174 г соли
24,5
г KOH нужно для
образования а г соли
Откуда масса образовавшейся соли:
Масса образовавшейся соли равна 38,1 грамм.
Ответ:
масса образовавшейся соли равна
38,1 грамм.
Похожие задачи
Расчеты с участием понятия растворимости солей в рамках ЕГЭ
В ходе подготовки к ЕГЭ по химии постоянно приходится сталкиваться с понятием «раствор». Обычно под этим словом подразумевают абсолютно однородную на любом уровне, гомогенную смесь веществ. Растворы бывают самые разные по агрегатному состоянию, но в рамках экзаменов встречаем в основном растворы жидкие. Среда, в которой что-то растворяем, в таком случае будет жидкостью. Давайте введем сразу несколько понятий, которые пригодятся в дальнейшем.
Растворитель – жидкость, которая выполняет роль среды, в которой что-то растворяют. В рамках задач ЕГЭ и ДВИ практически всегда используют воду.
Растворенное вещество – вещество, которое добавили в растворитель, и оно с ним полностью смешалось. Может быть в любом агрегатном состоянии.
Растворимость – способность вещества смешиваться с растворителем. Также под растворимостью понимают массу вещества, которое может раствориться в определенной массе раствора при данных условиях.
Разбавленный раствор – раствор, содержание растворителя в котором значительно превышает содержание растворенного вещества. Например, 0,1%-ный раствор хлорида натрия.
Концентрированный раствор – раствор, содержание растворенного вещества в котором сопоставимо или превышает содержание растворителя. Например, 65%-ный раствор азотной кислоты.
Насыщенный раствор – раствор, в котором больше нельзя растворить такое вещество. Достигнут предел по растворимости.
Пересыщенный раствор – неустойчивая система, в которой содержание растворенного вещества превышает растворимость при данных условиях. На экзаменах не встречается.
В расчетных задачах ЕГЭ или ДВИ часто фигурирует растворимость тех или иных веществ. Она зависит от многих факторов. Например, природы растворителя и растворенного вещества. Очень важным фактором является температура. Для подавляющего большинства солей растворимость в воде больше при высокой температуре и меньше при низкой. Например, у хлорида калия при 80˚С растворимость равна 51,3 г/100 г воды, а при 0˚С уже станет 28 г/100 г воды. Растворимость является индивидуальной физико-химической характеристикой вещества. Итого можно отметить следующие факты, значимые для решения задач:
- Растворимость вещества при определенных условиях является постоянной величиной и приведена в качестве справочного данного.
- Растворимость при заданной температуре обычно приводится в формате массы растворенного вещества в 100 г чистого растворителя (воды). Не раствора, а именно чистого растворителя!
- Горячий насыщенный раствор содержит больше растворенного вещества, чем холодный.
- При охлаждении горячего насыщенного раствора из него начнет выпадать избыток растворенного вещества до достижения значения растворимости при более низкой температуре.
- Избыток растворенного вещества может выпасть как в безводном состоянии, так и в виде кристаллогидрата. Во втором случае он уносит с собой часть растворителя.
Рассмотрим основные расчетные приемы с участием растворимости.
Задача №1
Растворимость хлорида калия при 0˚С равна 28 г/100 г воды. Вычислите массовую долю соли в таком растворе.
Решение:
Пусть было 28 г соли и 100 г воды. Тогда можно найти массу раствора:
m(p-pa) = m(соли) + m(воды) = 28 + 100 = 128 г
Вычислим массовую долю соли в растворе:
ω(соли) = m(соли)/m(p-pa)·100% = 28/128·100% = 21,88%
Ответ: 21,88%
Задача №2
Вычислите растворимость сульфата аммония при 20˚С, если массовая доля соли в его насыщенном растворе при данной температуре равна 42,86%. Плотность раствора равна 1,25 г/мл.
Решение:
Пусть было 100 мл раствора. Тогда можно вычислить его массу:
m(p-pa) = ρ(p-pa)·V(p-pa) = 1,25·100 = 125 г
Далее вычислим массу соли и воды в растворе:
m(соли) = m(p-pa)·ω(соли)/100% = 125·42,86%/100% = 53,58 г
m(воды) = m(p-pa) — m(соли) = 125 – 53,58 = 71,42 г
Растворимость соли на 100 г воды можно найти по пропорции:
53,58 г соли – 71,42 г воды
х г соли – 100 г воды
х = 53,58·100/71,42 = 75 г
Ответ: 75 г/100 г воды.
Задача №3
Насыщенный при 20˚С раствор нитрата бария массой 218 г нагрели до 60˚С. Вычислите массу соли, которую можно дополнительно растворить в горячем растворе, если растворимость нитрата бария при 20˚С равна 9 г/100 г воды, а при 60˚С – 20 г/100 г воды.
Решение:
Вычислим массы соли и воды в изначальном растворе:
9 г соли – 109 г раствора
х г соли – 218 г раствора
х = 18 г
m1(соли) = 18 г
m(воды) = m(p-pa) – m1(соли) = 218 – 18 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 60˚С:
20 г соли – 100 г воды
х г соли – 200 г воды
х = 40 г
m2(соли) = 40 г
Найдем массу соли, которую можно дополнительно растворить в горячем растворе:
Δm = m2(соли) — m1(соли) = 40 – 18 = 22 г
Ответ: 22 г.
Задача №4
Рассчитайте массу безводной соли, которая получится при охлаждении до 10˚С насыщенного при 80˚С раствора дихромата аммония массой 430 г. Растворимость соли при 80˚С равна 115 г/100 г воды, а при 10˚С – 25,5 г/100 г воды.
Решение:
Вычислим массу соли и воды в исходном растворе:
115 г соли – 215 г раствора
х г соли – 430 г раствора
х = 230 г
m1(соли) = 230 г
m(воды) = m(p-pa) – m1(соли) = 430 – 230 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 10˚С:
25,5 г соли – 100 г воды
х г соли – 200 г воды
х = 51 г
m2(соли) = 51 г
Найдем массу соли, которая выпадет при охлаждении горячего раствора:
Δm = m1(соли) – m2(соли) = 230 – 51 = 179 г
Ответ: 179 г.
Задача №5
При охлаждении до 0˚С 31 г горячего насыщенного раствора сульфата меди (II) в осадок выпал медный купорос (CuSO4·5H2O). Определите массу образовавшегося кристаллогидрата, если растворимость сульфата меди (II) при 80˚С равна 55 г/100 г воды, а при 0˚С равна 15 г/100 г воды.
Решение:
Выразим массовую долю сульфата меди в составе медного купороса:
ω(CuSO4) = m(CuSO4)/m(CuSO4·5H2O)·100% = М(CuSO4)/М(CuSO4·5H2O)·100%
ω(CuSO4) = 160/250·100% = 64% или 0,64
Пусть масса осадка была х г. Тогда в его составе оказалось 0,64х г безводной соли. Вычислим массу безводной соли в изначальном растворе:
55 г соли – 155 г раствора
у г соли – 31 г раствора
у = 11
m1(соли) = 11 г
При охлаждении часть безводной соли перешла в состав кристаллогидрата. Охлажденный раствор по растворимости должен соответствовать справочным данным. Можно записать это так:
(11 – 0,64х)/(31 – х) = 15/115
115·(11 – 0,64х) = 15·(31 – х)
1265 – 73,6х = 465 – 15х
800 = 58,6х
х = 13,65 г
Ответ: 13,65 г.
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: «Основные формулы для решения задач по химии»
(Правила комментирования)
Задачи на кислые и средние соли — это разновидность задач на альтернативные реакции, в которых в зависимости от соотношения количества вещества реагентов возможно протекание разных реакций и образование различных продуктов.
При взаимодействии щелочей с кислотными оксидами многоосновных кислот, либо с многоосновными кислотами возможно образование кислых или средних солей.
При избытке щелочи образуется средняя соль. При избытке кислоты или кислотного оксида образуется кислая соль. При этом возможно одновременное образование и кислой, и средней соли.
Рассмотрим взаимодействие углекислого газа и гидроксида натрия. При избытке гидроксида натрия образуется средняя соль и вода:
2NaOH(изб.) + CO2 = Na2CO3 + H2O (1)
При избытке углекислого газа образуется только кислая соль:
NaOH + CO2(изб.) = NaНCO3 (2)
Два варианта химических реакций, но пять возможных ситуаций расчетных задач с этими реакциями.
Отличительная особенность таких задач: при решении зачастую необходимо сравнить количества вещества реагентов, чтобы понять, какая именно (или какие) реакции протекают.
Ситуация 1. Избыток щелочи n(NaOH):n(CO2) > 2:1.
Например. Смешали 8 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 8:3 > 2:1
Количество вещества щелочи более чем в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
Гидроксид натрия в избытке, расчет ведем по недостатку, углекислому газу. В реакцию вступит 3 моль углекислого газа, и 6 моль гидроксида натрия:
nпрореаг.(NaOH) = 2n(CO2) = 6 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(СO2) = 3 моль
При этом остается гидроксид натрия:
nост.(NaOH) = 8 — 6 = 2 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль, n(NaOH) = 2 моль
Ситуация 2. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 2:1
Например. Смешали 6 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 2:1
Количество вещества щелочи ровно в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(H2O) = n(СO2) = 1/2n(NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль
Ситуация 3. Избыток углекислого газа n(NaOH):n(CO2) > 1:1.
Например. Смешали 3 моль гидроксида натрия и 4 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 3:4 > 1:1
Количество вещества углекислого газа больше, чем количество вещества щелочи. Тогда протекает реакция 2:
NaOH + CO2(изб.) = NaHCO3
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 3 моль гидроксида натрия, и 3 моль углекислого газа:
nпрореаг.(СО2) = n(NaOH) = 3 моль
При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(NaOH) = 3 моль
При этом остается углекислый газ:
nост.(СО2) = 4 — 3 = 1 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(NaHCO3) = 3 моль, n(СO2) = 1 моль
Ситуация 4. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 1:1
Например. Смешали 3 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 1:1
Количество вещества щелочи равно количеству вещества углекислого газа. Тогда протекает реакция 2:
NaOH + CO2(изб.)= NaHCO3
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(СO2) = (NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствует:
n(NaHCO3) = 3 моль
Ситуации 1-4 — довольно стандартные. И, по сути, отличаются от обычных расчетных задач на избыток-недостаток только тем, что нужно определить, какая именно из двух реакций протекает. Ситуация 5 принципиально отличается.
Ситуация 5. Соотношение 1:1 < n(NaOH):n(CO2) < 2:1.
Например. Смешали 4 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 4:3, 1:1 < 4:3 < 2:1.
В такой ситуации образуются и карбонат натрия, и гидрокарбонат.
Решить такую задачу можно двумя способами — расчет через последовательно протекающие реакции и расчет через параллельно идущие реакции.
Метод последовательных реакций:
Пусть протекает реакция 1:
2NaOH + CO2 = Na2CO3 + H2O
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 4 моль гидроксида натрия, и 2 моль углекислого газа:
nпрореаг.(СО2) = 1/2n(NaOH) = 2 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = 1/2n(NaOH) = 2 моль
Остается углекислый газ:
nост.(СО2) = 3 — 2 = 1 моль
Таким образом, после полного протекания реакции (1) в системе присутствуют:
n(Na2CO3) = n(H2O) = 2 моль, n(СO2) = 1 моль
Однако, оставшиеся вещества вступают в реакцию с образованием кислой соли:
Na2CO3 + H2O + СО2 = 2NaHCO3
При этом углекислый газ в недостатке, карбонат натрия в избытке. В реакцию вступают карбонат натрия:
nпрореаг.(Na2СО3) = n(CO2) = 1 моль
Образуется гидрокарбонат натрия:
n(NaHCO3) = 2n(CO2) = 2 моль,
Остается карбонат натрия:
nост.(Na2СО3) = 2 — 1 = 1 моль
Таким образом, после полного протекания последней реакции в системе присутствуют:
n(Na2CO3) = 1 моль, n(NaHСO3) = 2 моль
Метод параллельно идущих реакций:
Пусть одновременно протекают реакции (1) и (2):
2NaOH + CO2 = Na2CO3 + H2O (1)
NaOH + CO2 = NaНCO3 (2)
Пусть в первую реакцию вступает х моль СО2, во вторую реакцию у моль СО2.
Тогда в первую реакцию вступают 2х моль гидроксида натрия, во вторую реакцию у моль гидроксида натрия.
Получаем систему уравнений:
2х + y = 4
x + y = 3
Отсюда: x = 1 моль, у = 2 моль
n(Na2CO3) = 1/2n1(NaOH) = n1(CO2) = 1 моль
n(NaHCO3) = n2(NaOH) = n2(CO2) = 2 моль
Как видно, ответ не зависит от выбранного способа решения.
Примеры задач на кислые и средние соли из ЕГЭ по химии.
1. Через 228 г 3%-ного раствора гидроксида бария пропустили 1,21 л углекислого газа (н.у.), при этом углекислый газ поглотился полностью. Выпавший осадок отделили, а к оставшемуся раствору добавили 49 г 5%-ного раствора серной кислоты. Найдите массовую долю кислоты в образовавшемся растворе.
CO2 + Ba(OH)2 = BaCO3 + H2O
BaCO3 + CO2 + H2O = Ba(HCO3)2
Ba(HCO3)2 + H2SO4 = BaSO4 + 2CO2 + 2H2O
Ответ: w(H2SO4) = 0,4%
2. Газ, образовавшийся при гидролизе 36,4 г фосфида кальция, сожгли. К образовавшемуся при этом продукту последовательно добавили 100 мл воды и 50 мл раствора гидроксида натрия с массовой долей 25% и плотностью 1,28 г/см3. Определите состав образовавшейся соли и её массовую долю в растворе.
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
PH3 + 2O2 = H3PO4
H3PO4 + NaOH = NaH2PO4 + H2O
Ответ: w(NaH2PO4) = 23,6%
3. При растворении 9,4 г оксида калия в воде получили раствор с массовой долей вещества 20%. К этому раствору добавили 98 г 20%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
K2O + H2O = 2KOH
KOH + H2SO4 = KHSO4 + H2O
Ответ: w(KHSO4) = 17,66%
4. При растворении 30,6 г оксида бария в воде получили раствор с массовой долей вещества 5%. К этому раствору добавили 98 г 40%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
BaO + H2O = Ba(OH)2
Ba(OH)2 + 2H3PO4 = Ba(H2PO4)2 + 2H2O
Ответ: w(Ba(H2PO4)2) = 8,465%
5. Газ, выделившийся при гидролизе 21 г нитрида лития, поглотили 545 мл 10%-ного раствора серной кислоты (плотностью 1,08 г/мл). Определите массовую долю соли в полученном растворе.
Li3N + 3H2O = 3LiOH + NH3
NH3 + H2SO4 = NH4HSO4
Ответ: w(NH4HSO4) = 11,52%
6. При растворении пероксида лития Li2O2 в тёплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2,3 г пероксида лития в 62 г воды. Какой максимальный объём углекислого газа (н.у.) может быть поглощён получившейся щёлочью?
2Li2O2 + 2H2O = 4LiOH + O2
LiOH + CO2 = LiHCO3
Ответ: w(LiOH) = 3,8%, V(CO2) = 2,24 л
7. В 880 г 4%-ной серной кислоты растворили 16 г оксида серы(VI). К полученному раствору добавили 11,2 г гидроксида калия. Определите массу образовавшейся соли.
SO3 + H2O = H2SO4
H2SO4 + KOH = KHSO4 + H2O
Ответ: m(KHSO4) = 27,2 г
8. Серу массой 6,4 г сожгли в избытке кислорода. Полученный газ пропустили через 138 мл 8%-ного раствора гидроксида натрия (плотностью 1,087 г/мл). Определите массовые доли солей в полученном растворе.
S + O2 = SO2
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
Ответ: w(Na2SO3) = 7,74%, w(NaHSO3) = 6,39%
9. Фосфор массой 1,55 г сожгли в избытке кислорода. Образовавшееся при этом вещество растворили в воде и полученный раствор прокипятили. К полученному раствору добавили 3,7 л 0,1%-ного раствора гидроксида кальция (плотностью 1 г/мл). Определите массу образовавшейся соли.
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O
Ответ: m(CaHPO4) = 6,8 г
10. Технический сульфат аммония массой 2,04 г, содержащий 3% примесей, нагревают с твёрдым гидроксидом натрия массой 1,6 г. Выделившийся в результате газ поглотили 29,4 г раствора с массовой долей фосфорной кислоты 10%. Вычислите массовую долю соли в образовавшемся растворе.
(NH4)2SO4 + 2NaOH = 2NH3 + Na2SO4 + 2H2O
H3PO4 + NH3 = NH4H2PO4
Ответ: w(NH4H2PO4) = 11,53%
11. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
2Na + 2H2O = 2NaOH + H2
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Ответ: w(Na2HPO4) = 13,6%
12. Оксид фосфора(V) массой 2,84 г растворили в 120 г раствора ортофосфорной кислоты с массовой долей 9% и полученный раствор прокипятили. К полученному раствору добавили 30 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
P2O5 + 3H2O = 2H3PO4
H3PO4 + NaOH = NaH2PO4 + H2O
Ответ: w(NaH2PO4) = 11,8%
13. При растворении пероксида лития Li2O2 в тёплой воде образуется гидроксид лития и выделяется газ. Раствором, полученным при действии 2,3 г пероксида лития на 62 г воды, поглотили 2,24 л (н.у.) углекислого газа. Вычислите массовую долю соли в полученном растворе.
2Li2O2 + 2H2O = 4LiOH + O2
LiOH + CO2 = LiHCO3
Ответ: w(LiHCO3) = 10,01%
14. Газ, выделившийся при гидролизе 16 г карбида кальция, сожгли. Газообразный продукт сгорания пропустили через 200 г 7%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
CaC2 + 2H2O = Ca(OH)2 + C2H2
2C2H2 + 5O2 = 4CO2 + 2H2O
CO2 + KOH = KHCO3
Ответ: m(KHCO3) = 25 г
15. 19,6 г оксида углерода(II) сожгли. Продукт сгорания полностью поглотили 420 г 10,5%-ного раствора гидроксида натрия. Найдите массовую долю веществ в полученном растворе.
2CO + O2 = 2CO2
CO2 + 2NaOH = Na2CO3 + H2O
Na2CO3 + CO2 + H2O = 2NaHCO3
Ответ: w(Na2CO3) = 9,4%, w(NaHCO3) = 5,6%
16. Образец натрия массой 0,92 г растворили в воде. Какую массу 10%‑ного раствора ортофосфорной кислоты нужно добавить к образовавшемуся раствору для получения гидроортофосфата натрия?
2Na + 2H2O = 2NaOH + H2
2NaOH + H3PO4 = Na2HPO4 + 2H2O
Ответ: m(раствора H3PO4) = 19,6 г
17. Смешали 120 г 4,1%-ного раствора ортофосфорной кислоты и 28 г 10%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
H3PO4 + KOH = KH2PO4 + H2O
Ответ: m(KH2PO4) = 6,8 г
18. Углекислый газ объёмом 560 мл (н.у.) полностью поглотили 1000 г раствора гидроксида кальция с массовой долей 0,15%. Найдите массу образовавшегося осадка и массовую долю соли в растворе.
Ca(OH)2 + CO2 = CaCO3 + H2O
CaCO3 + H2O + CO2 = Ca(HCO3)2
Ответ: m(CaCO3) = 1,5 г, w(Ca(HCO3)2) = 0,08%
19. В избытке кислорода сожгли 8 г серы. Полученный газ пропустили через 200 г 8%-ного раствора гидроксида натрия. Определите массовые доли солей в полученном растворе.
S + O2 = SO2
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
Ответ: w(NaHSO3) = 4,8%, w(Na2SO3) = 8,75%
Выделить растворённое вещество из раствора можно путём выпаривания воды. В некоторых случаях образуются гидраты в кристаллическом виде или кристаллогидраты. Они содержат молекулы воды, которые называются кристаллизационной водой.
Общее описание
Кристаллогидраты образуются благодаря взаимодействию катионов кристаллической решётки вещества с молекулами воды. Это возможно, если связь между катионами и анионами кристалла более слабая.
К кристаллогидратам в первую очередь относятся соли. Типичными кристаллогидратами являются природные минералы – гипс, карналлит, алебастр, бура. Также кристаллогидраты образуют кислоты и основания.
Рис. 1. Кристаллогидраты.
Название вещества зависит от количества молекул воды. Для этого используют приставки, обозначающие число:
- 1 – моно;
- 2 – ди;
- 3 – три;
- 4 – тетра;
- 5 – пента;
- 6 – гекса;
- 7 – гепта;
- 8 – окта;
- 9 – нона;
- 10 – дека.
Рис. 2. Строение молекулы кристаллогидрата.
Например, кристаллогидрат FeSO4, содержащий одну молекулу воды, называется моногидрат сульфата железа (II). Если в кристаллогидрате семь молекул воды, он называется гептагидрат сульфата железа (II).
Вода из кристаллогидрата в большинстве случаев удаляется ступенчато. Например, при нагревании медного купороса, он переходит в тригидрат, затем в моногидрат. При нагревании до 250°С медный купорос полностью обезвоживается до сульфата меди (II).
Формула кристаллогидрата состоит из двух частей. Сначала записывается формула вещества. Через точку (знак умножения) указывается количество молекул воды. Например, ZnSO4 ∙ 7H2O, CuSO4 ∙ H2O, Na2CO3·10H2O, H2SO4 · H2O.
Рис. 3. Пентагидрат сульфата меди (II) и сульфат меди (II).
Расчёт массы вещества
При прокаливании кристаллогидраты разлагаются на сухое вещество и воду. Чтобы вычислить массовую долю вещества используется следующая формула:
ω(сух. в-ва) = m(сух. в-ва) / m(кр-та).
Для расчёта массовой доли воды применяется схожая формула:
ω(H2O) = m(H2O) / m(кр-та).
Рассмотрим решение задачи с применением формулы.
Необходимо вычислить массовую долю кристаллизационной воды в тригидрате нитрата меди (II) (Cu(NO3)2 ∙ 3H2O).
Решение:
Сначала запишем молярные массы воды и нитрата меди (II):
- M (Cu(NO3)2) = 187,5 г/моль;
- M (H2O) = 18 г/моль.
В 1 моле кристаллогидрата содержится 1 моль нитрата меди (II) и 3 моль воды, поэтому получаем по формуле m = n ∙ M массу воды и массу соли в кристаллогидрате:
- m (H2O) = 3 ∙ 18 = 54 г;
- m (Cu(NO3)2) = 1 ∙ 187,5 = 187,5 г.
Высчитаем общую массу вещества:
m (Cu(NO3)2 ∙ 3H2O) = 187,5 + 54 = 241,5 г.
Остаётся вычислить массовую долю воды:
ω(H2O) = m(H2O) / m(кр-та) = 54 / 241,5 = 0,22 или 22 %.
Ответ: массовая доля воды в тригидрате нитрата меди (II) 22 %.
Некоторые вещества невозможно обезводить без разложения. Например, соединение BeC2O4·H2O устойчиво только в форме кристаллогидрата.
Что мы узнали?
Кристаллогидратами называются вещества, содержащие молекулы воды за счёт их притяжения катионами кристаллической решётки. В формуле кристаллогидратов, а также в названии вещества указывается количество воды. Например, CuSO4 ∙ H2O – моногидрат сульфата меди (II). Если известны массы воды и сухого вещества, можно вычислить их массовую долю.