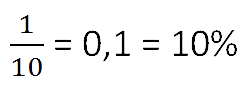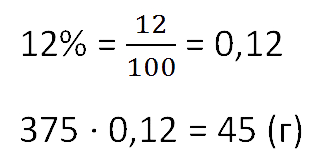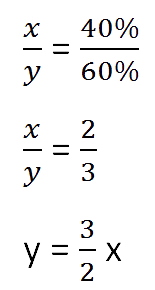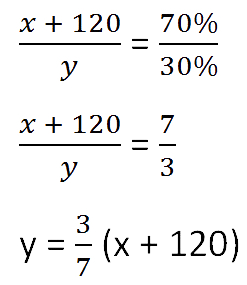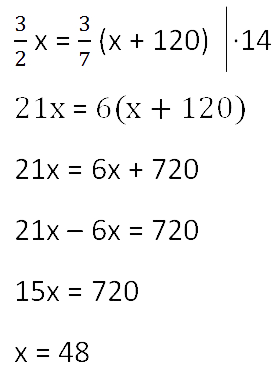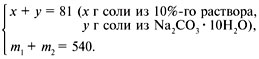Для того, чтобы решать задачи на растворы и концентрацию, необходимо чётко понимать, что
называется концентрацией раствора.
Запомните!
Концентрация раствора — это часть, которую составляет масса растворённого вещества от
массы всего раствора.
- 9%-я концентрация раствора соли — это 9 грамм соли в
100 граммах раствора.
Разбор примера
Килограмм соли растворили в 9 л воды. Чему равна концентрация полученного раствора?
(Масса 1 л воды составляет 1 кг)
Используя определение концентрации данное выше, решим задачу следующим образом.
- 1 кг — масса растворённого вещества (соли)
- 9 кг — масса воды в растворе (не путать с общей массой раствора)
- 9 + 1 = 10 кг — общая масса раствора.
Ответ: 10% — концентрация раствора.
Разбор примера
Теперь решим обратную задачу.
Сколько соли получится при выпаривании 375 граммов 12%-го раствора?
Чтобы найти массу выпаренной соли из раствора, умножим общую массу раствора на процент концентрации.
Не забудем предварительно перевести процент в десятичную дробь.
Ответ: 45 г соли.
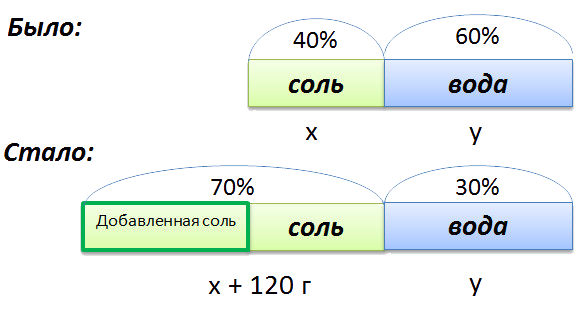
Сложная задача на растворы
В растворе 40% соли. Если добавить 120 г соли,
то процентное содержание соли станет равным 70.
Сколько грамм соли было первоначально в растворе?
Для составления пропорции обозначим за «x» первоначальную массу соли в растворе, а
за «y» массу
воды в растворе. Так как концентрация соли в исходном растворе 40%, то соответственно вода составляет
100% − 40%= 60%
Изобразим графически условия задачи.
Составим пропорцию, связывающую эти величины до добавления соли.
Для решения задачи нам надо определить какая из неизвестных («x» или «y») остаётся неизменной
после добавления соли.
Этой величиной является масса воды в растворе «y».
Выразим её, учитывая изменения в растворе после добавления соли.
- (x + 120) г — масса соли в новом растворе
- (100% − 70% = 30% — процентное содержание воды в новом растворе.
Составим пропорцию аналогично предыдущей, но с учётом изменений произошедших
после добавления соли.
Так как масса воды осталось неизменной после добавления соли, приравняем её значения до и
после добавления соли и решим уравнение.
Ответ: 48 г — масса соли в первоначальном растворе.
Ваши комментарии
Важно!
Чтобы оставить комментарий, вам нужно войти на наш сайт при помощи
«ВКонтакте».

Оставить комментарий:
31 октября 2016 в 18:30
Роман Роршахов
Профиль
Благодарили: 0
Сообщений: 1
Роман Роршахов
Профиль
Благодарили: 0
Сообщений: 1
Сколько граммов 6%-ного раствора соли можно получить из 300 г жидкости содержащей 40% этой соли?
0
Спасибо
Ответить
5 ноября 2016 в 21:36
Ответ для Роман Роршахов
София Деревянко
Профиль
Благодарили: 0
Сообщений: 2
София Деревянко
Профиль
Благодарили: 0
Сообщений: 2
Если соли 40%, то воды — 60%. проценты характеризуют массовые доли, значит в растворе 120 г соли. Для нахождения массы раствора составляем пропорцию, которую можно прочитать так ЕСЛИ 120 Г СОЛИ СОСТАВЛЯЕТ 6 % ОТ ВСЕГО РАСТВОРА, ТО ВЕСЬ РАСТВОР (100%) БУДЕТ ВЕСИТЬ Х г, 120: 6=Х: 100, отсюда находим Х=120: 6 · 100, вес всего раствора 2 кг. проверяем, 2000 г · 0,06 получается 120г. Количество соли не изменилось))))
0
Спасибо
Ответить
6 сентября 2015 в 12:03
Дарья Сидорова
Профиль
Благодарили: 0
Сообщений: 1
Дарья Сидорова
Профиль
Благодарили: 0
Сообщений: 1
0
Спасибо
Ответить
6 сентября 2015 в 13:43
Ответ для Дарья Сидорова
Настюша Кирпичева
Профиль
Благодарили: 0
Сообщений: 1
Настюша Кирпичева
Профиль
Благодарили: 0
Сообщений: 1
1 3-
0
Спасибо
Ответить
2 сентября 2016 в 15:56
Ответ для Дарья Сидорова
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
= ? · = ? = ===8
0
Спасибо
Ответить
22 апреля 2015 в 16:36
Амина Загребельная
Профиль
Благодарили: 0
Сообщений: 1
Амина Загребельная
Профиль
Благодарили: 0
Сообщений: 1
в морской воде содержится 5% соли, какую часть морской воды состовляет соль?
0
Спасибо
Ответить
14 апреля 2016 в 13:37
Ответ для Амина Загребельная
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
В статье подробно описано, как это делается: http://math-prosto.ru/index.php?page=pages/percent/percent1.php
А именно: «Чтобы перевести проценты в дробь, нужно убрать знак % и разделить число на 100.»
5: 100=0,05=
0
Спасибо
Ответить
Расчеты с участием понятия растворимости солей в рамках ЕГЭ
В ходе подготовки к ЕГЭ по химии постоянно приходится сталкиваться с понятием «раствор». Обычно под этим словом подразумевают абсолютно однородную на любом уровне, гомогенную смесь веществ. Растворы бывают самые разные по агрегатному состоянию, но в рамках экзаменов встречаем в основном растворы жидкие. Среда, в которой что-то растворяем, в таком случае будет жидкостью. Давайте введем сразу несколько понятий, которые пригодятся в дальнейшем.
Растворитель – жидкость, которая выполняет роль среды, в которой что-то растворяют. В рамках задач ЕГЭ и ДВИ практически всегда используют воду.
Растворенное вещество – вещество, которое добавили в растворитель, и оно с ним полностью смешалось. Может быть в любом агрегатном состоянии.
Растворимость – способность вещества смешиваться с растворителем. Также под растворимостью понимают массу вещества, которое может раствориться в определенной массе раствора при данных условиях.
Разбавленный раствор – раствор, содержание растворителя в котором значительно превышает содержание растворенного вещества. Например, 0,1%-ный раствор хлорида натрия.
Концентрированный раствор – раствор, содержание растворенного вещества в котором сопоставимо или превышает содержание растворителя. Например, 65%-ный раствор азотной кислоты.
Насыщенный раствор – раствор, в котором больше нельзя растворить такое вещество. Достигнут предел по растворимости.
Пересыщенный раствор – неустойчивая система, в которой содержание растворенного вещества превышает растворимость при данных условиях. На экзаменах не встречается.
В расчетных задачах ЕГЭ или ДВИ часто фигурирует растворимость тех или иных веществ. Она зависит от многих факторов. Например, природы растворителя и растворенного вещества. Очень важным фактором является температура. Для подавляющего большинства солей растворимость в воде больше при высокой температуре и меньше при низкой. Например, у хлорида калия при 80˚С растворимость равна 51,3 г/100 г воды, а при 0˚С уже станет 28 г/100 г воды. Растворимость является индивидуальной физико-химической характеристикой вещества. Итого можно отметить следующие факты, значимые для решения задач:
- Растворимость вещества при определенных условиях является постоянной величиной и приведена в качестве справочного данного.
- Растворимость при заданной температуре обычно приводится в формате массы растворенного вещества в 100 г чистого растворителя (воды). Не раствора, а именно чистого растворителя!
- Горячий насыщенный раствор содержит больше растворенного вещества, чем холодный.
- При охлаждении горячего насыщенного раствора из него начнет выпадать избыток растворенного вещества до достижения значения растворимости при более низкой температуре.
- Избыток растворенного вещества может выпасть как в безводном состоянии, так и в виде кристаллогидрата. Во втором случае он уносит с собой часть растворителя.
Рассмотрим основные расчетные приемы с участием растворимости.
Задача №1
Растворимость хлорида калия при 0˚С равна 28 г/100 г воды. Вычислите массовую долю соли в таком растворе.
Решение:
Пусть было 28 г соли и 100 г воды. Тогда можно найти массу раствора:
m(p-pa) = m(соли) + m(воды) = 28 + 100 = 128 г
Вычислим массовую долю соли в растворе:
ω(соли) = m(соли)/m(p-pa)·100% = 28/128·100% = 21,88%
Ответ: 21,88%
Задача №2
Вычислите растворимость сульфата аммония при 20˚С, если массовая доля соли в его насыщенном растворе при данной температуре равна 42,86%. Плотность раствора равна 1,25 г/мл.
Решение:
Пусть было 100 мл раствора. Тогда можно вычислить его массу:
m(p-pa) = ρ(p-pa)·V(p-pa) = 1,25·100 = 125 г
Далее вычислим массу соли и воды в растворе:
m(соли) = m(p-pa)·ω(соли)/100% = 125·42,86%/100% = 53,58 г
m(воды) = m(p-pa) — m(соли) = 125 – 53,58 = 71,42 г
Растворимость соли на 100 г воды можно найти по пропорции:
53,58 г соли – 71,42 г воды
х г соли – 100 г воды
х = 53,58·100/71,42 = 75 г
Ответ: 75 г/100 г воды.
Задача №3
Насыщенный при 20˚С раствор нитрата бария массой 218 г нагрели до 60˚С. Вычислите массу соли, которую можно дополнительно растворить в горячем растворе, если растворимость нитрата бария при 20˚С равна 9 г/100 г воды, а при 60˚С – 20 г/100 г воды.
Решение:
Вычислим массы соли и воды в изначальном растворе:
9 г соли – 109 г раствора
х г соли – 218 г раствора
х = 18 г
m1(соли) = 18 г
m(воды) = m(p-pa) – m1(соли) = 218 – 18 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 60˚С:
20 г соли – 100 г воды
х г соли – 200 г воды
х = 40 г
m2(соли) = 40 г
Найдем массу соли, которую можно дополнительно растворить в горячем растворе:
Δm = m2(соли) — m1(соли) = 40 – 18 = 22 г
Ответ: 22 г.
Задача №4
Рассчитайте массу безводной соли, которая получится при охлаждении до 10˚С насыщенного при 80˚С раствора дихромата аммония массой 430 г. Растворимость соли при 80˚С равна 115 г/100 г воды, а при 10˚С – 25,5 г/100 г воды.
Решение:
Вычислим массу соли и воды в исходном растворе:
115 г соли – 215 г раствора
х г соли – 430 г раствора
х = 230 г
m1(соли) = 230 г
m(воды) = m(p-pa) – m1(соли) = 430 – 230 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 10˚С:
25,5 г соли – 100 г воды
х г соли – 200 г воды
х = 51 г
m2(соли) = 51 г
Найдем массу соли, которая выпадет при охлаждении горячего раствора:
Δm = m1(соли) – m2(соли) = 230 – 51 = 179 г
Ответ: 179 г.
Задача №5
При охлаждении до 0˚С 31 г горячего насыщенного раствора сульфата меди (II) в осадок выпал медный купорос (CuSO4·5H2O). Определите массу образовавшегося кристаллогидрата, если растворимость сульфата меди (II) при 80˚С равна 55 г/100 г воды, а при 0˚С равна 15 г/100 г воды.
Решение:
Выразим массовую долю сульфата меди в составе медного купороса:
ω(CuSO4) = m(CuSO4)/m(CuSO4·5H2O)·100% = М(CuSO4)/М(CuSO4·5H2O)·100%
ω(CuSO4) = 160/250·100% = 64% или 0,64
Пусть масса осадка была х г. Тогда в его составе оказалось 0,64х г безводной соли. Вычислим массу безводной соли в изначальном растворе:
55 г соли – 155 г раствора
у г соли – 31 г раствора
у = 11
m1(соли) = 11 г
При охлаждении часть безводной соли перешла в состав кристаллогидрата. Охлажденный раствор по растворимости должен соответствовать справочным данным. Можно записать это так:
(11 – 0,64х)/(31 – х) = 15/115
115·(11 – 0,64х) = 15·(31 – х)
1265 – 73,6х = 465 – 15х
800 = 58,6х
х = 13,65 г
Ответ: 13,65 г.
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Методика решения задач
на растворы с применением
правила креста
Многие важные вопросы изучения курса химии по
ряду причин исключены из школьной программы.
Среди них закон эквивалентов, разные способы
выражения концентрации растворов, правило
креста и многие другие. Однако на факультативных
занятиях, при подготовке ребят к олимпиадам без
них не обойтись. Да и в жизни ребятам они
пригодятся, особенно тем, кто свяжет будущую
профессию с химией (заводские лаборатории,
аптеки, научно-исследовательская работа, да и
просто химия в быту).
Особенно трудно в этом отношении молодым
учителям – у них нет той массы дополнительной
литературы, которую накопили старые учителя за
десятки лет работы в школе, а что издает
современная книгопечатная отрасль
промышленности – известно всем. Поэтому
предлагаемая методика решения задач на растворы
с применением правила креста, думается, хоть
сколько-то поможет молодым коллегам в этом деле.
«Конверт Пирсона»
Очень часто в лабораторной практике и при
решении олимпиадных задач приходится
встречаться со случаями приготовления растворов
с определенной массовой долей растворенного
вещества, смешением двух растворов разной
концентрации или разбавлением крепкого раствора
водой. В некоторых случаях можно провести
достаточно сложный арифметический расчет.
Однако это малопродуктивно. Чаще для этого лучше
применить правило смешения (диагональную модель
«конверта Пирсона», или, что то же самое, правило
креста).
Допустим, нужно приготовить раствор
определенной концентрации, имея в распоряжении
два раствора с более высокой и менее высокой
концентрацией, чем нужно нам. Тогда, если
обозначить массу первого раствора через m1,
а второго – через m2, то при смешивании
общая масса смеси будет слагаться из суммы этих
масс. Пусть массовая доля растворенного вещества
в первом растворе – 1, во втором –
2, а в их смеси –
3. Тогда общая масса
растворенного вещества в смеси будет слагаться
из масс растворенного вещества в исходных
растворах:
m1•1 + m2•
2 =
3(m1 + m2).
Отсюда
m1(1 –
3) = m2(
3 –
2),
m1/m2 = (3 –
2)/(
1 –
3).
Видно, что отношение массы первого раствора к
массе второго раствора есть отношение разности
массовых долей растворенного вещества в смеси и
во втором растворе к разности соответствующих
величин в первом растворе и в смеси.
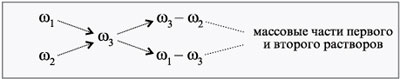
При решении задач на растворы с разными
концентрациями чаще всего применяют
диагональную схему правила смешении. При
расчетах записывают одну над другой массовые
доли растворенного вещества в исходных
растворах, справа между ними – его массовую долю
в растворе, который нужно приготовить, и вычитают
по диагонали из большего меньшее значение.
Разности их вычитаний показывают массовые доли
для первого и второго растворов, необходимые для
приготовления нужного раствора.
Для пояснения этого правила сначала решим
простейшую задачу.
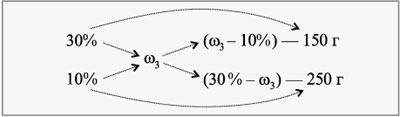
ЗАДАЧА 1
Определите концентрацию раствора,
полученного при слиянии 150 г 30%-го и 250 г 10%-го
растворов какой-либо соли.
Дано:
m1 = 150 г,
m2 = 250 г,
1 = 30%,
2 = 10%.
Найти:
3.
Решение
1-й способ (метод
пропорций).
Общая масса раствора:
m3 = m1 + m2 = 150
+ 250 = 400 г.
Массу вещества в первом растворе находим
методом пропорций, исходя из определения:
процентная концентрация раствора показывает,
сколько граммов растворенного вещества
находится в 100 г раствора:
100 г 30%-го р-ра – 30 г в-ва,
150 г 30%-го р-ра – х г в-ва,
х = 150•30/100 = 45 г.
Для второго раствора составляем аналогичную
пропорцию:
100 г 10%-го р-ра – 10 г в-ва,
250 г 10%-го р-ра – y г в-ва,
y = 250•10/100 = 25 г.
Следовательно, 400 г нового раствора содержит 45 +
25 = 70 г растворенного вещества.
Теперь можно определить концентрацию нового
раствора:
400 г р-ра – 70 г в-ва,
100 г р-ра – z г в-ва,
z = 100•70/400 = 17,5 г, или 17,5%.
2-й способ
(алгебраический).
m1•1 + m2•
2 =
3(m1 + m2).
Отсюда
3
= (m1•1
+ m2•2)/(m1
+ m2).
В результате находим:
3 =
(150•30 + 250•10)/(150 + 250) = 17,5%.
3-й способ (правило
креста).
(3
– 10)/(30 – 3) =
150/250.
Тогда
(30 – 3)•150
= (3 – 10)•250,
4500 – 1503
= 2503 – 2500,
4500 – 2500 = 2503 – 150
3,
7000 = 4003,
3 = 7000/400 = 17,5%.
Ответ. При слиянии взятых
растворов получится новый раствор с
концентрацией 3
= 17,5%.
Теперь решим задачи посложнее.
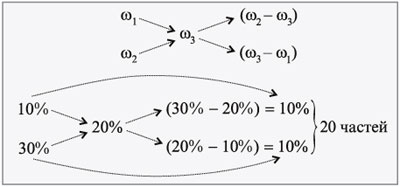
ЗАДАЧА 2
Определите, сколько нужно взять 10%-го раствора
соли и 30%-го раствора этой же соли для
приготовления 500 г 20%-го раствора.
Дано:
1 = 10%,
2 = 30%,
3 = 20%,
m3 = 500 г.
Найти:
m1, m2.
Решение
Используем правило креста.
Для приготовления 500 г 20%-го раствора соли нужно
взять по 10 частей растворов исходных
концентраций.
Проверим правильность нашего решения, учитывая,
что 1 часть равна 500/(10 + 10) = 25 г.
250 г 10%-го р-ра – х г соли,
100 г 10%-го р-ра – 10 г соли,
х = 250•10/100 = 25 г.
250 г 30%-го р-ра – y г соли,
100 г 30%-го р-ра – 30 г соли,
y = 250•30/100 = 75 г.
m(р-ра) = 250 + 250 = 500 г.
m(соли) = 25 + 75 = 100 г.
Отсюда находим 3:
500 г р-ра – 100 г соли,
100 г р-ра – 3 г соли,
3 =
100•100/500 = 20 г, или 20%.
Ответ. Для приготовления 500 г 20%-го
раствора нужно взять исходные растворы по 250 г
(m1 = 250 г, m2 = 250 г).
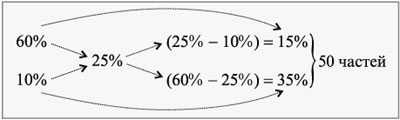
ЗАДАЧА 3
Определите, сколько нужно взять растворов
соли 60%-й и 10%-й концентраций для приготовления 300
г раствора 25%-й концентрации.
Дано:
1 = 60%,
2 = 10%,
3 = 25%,
3 = 300 г.
Найти:
m1, m2.
Решение
Масса одной части: 300/50 = 6 г.
Тогда
m1 = 6•15 = 90 г, m2 = 6•35 =
210 г.
Проверим правильность решения.
100 г 60%-го р-ра – 60 г соли,
90 г 60%-го р-ра – х г соли,
х = 54 г.
100 г 10%-го р-ра – 10 г соли,
210 г 30%-го р-ра – y г соли,
y = 21 г.
m(соли) = 54 + 21 = 75 г.
Находим концентрацию нового раствора:
300 г р-ра – 75 г соли,
100 г р-ра – z г соли,
z = 100•75/300 = 25 г, или 25%.
Ответ. m1 = 90 г, m2
= 210 г.
Теперь перейдем к еще более сложным задачам.
ЗАДАЧА 4
Определите массу раствора Nа2СО3
10%-й концентрации и массу сухого
кристаллогидрата Na2CO3•10H2O,
которые нужно взять для приготовления 540 г
раствора 15%-й концентрации.
Дано:
1 = 10%,
3 = 15%,
m3 = 540 г.
Найти:
m1, m2.
Решение
1-й способ (через систему
уравнений с двумя неизвестными).
Определяем массу соли Na2CO3 в 540 г
15%-го раствора:
100 г 15%-го р-ра – 15 г соли,
540 г 15%-го р-ра – z г соли,
z = 540•15/100 = 81 г.
Cоставляем систему уравнений:
Находим молярную массу:
Избавляемся от лишних неизвестных:
m2 = 286y/106;
100 г 10%-го р-ра – 10 г соли,
m1 г 10%-го р-ра – х г соли,
m1 = 100х/10 = 10х.
Подставляем m2 и m1 в систему
уравнений:
С учетом того, что х = 81 – y, избавляемся
от второго неизвестного:
10(81 – y) + 286y/106 = 540.
Отсюда
y = 270/7,3 = 37 г.
Тогда m2 = 286y/106 = 2,7•37 100 г – это масса необходимого
количества кристаллогидрата Na2СО3•10H2O.
Далее находим: х = 81 – y = 81 – 37 = 44 г – это
масса соли из 10%-го раствора.
Находим массу 10%-го раствора:
100 г 10%-го р-ра – 10 г соли,
m1 г 10%-го р-ра – 44 г соли,
m1 = 100•44/10 = 440 г.
Видно, что так можно решить данную задачу –
способ надежный, но, к сожалению, достаточно
длинный, громоздкий и сложный. Им успешно могут
воспользоваться учащиеся с достаточно развитым
логическим мышлением. Для других он будет
сложноват.
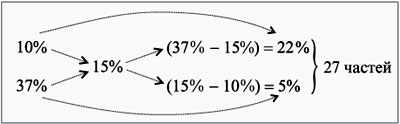
2-й способ (правило
креста).
Допустим, что Na2СО3•10H2O – это
«сухой раствор» (ведь он же содержит воду). Тогда
найдем его «концентрацию»:
286 г – 106 г соли,
100 г – х г соли,
х = 100•106/286 = 37 г, или 37%.
Применяем правило креста.
Находим массу одной части и массы веществ:
540/27 = 20 г,
m1 = 20•22 = 440 г, m2 = 20•5 =
100 г.
Ответ. Для приготовления 540 г
раствора Na2CO3 15%-й концентрации
необходимо взять 440 г 10%-го раствора и 100 г
кристаллогидрата.
Таким образом, применение правила креста удобнее
и проще при решении подобных задач. Этот способ
более экономичен по времени и менее трудоемок.
Правило креста можно применять и в тех случаях,
когда нужно получить раствор меньшей
концентрации путем разбавления водой более
концентрированного раствора или получить более
концентрированный раствор путем добавления к
исходному раствору сухой смеси. Рассмотрим это
на примерах.
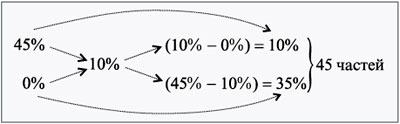
ЗАДАЧА 5
Сколько воды нужно добавить к 250 г раствора
соли для понижения его концентрации с 45% до 10%?
Дано:
1 = 45%,
3 = 10%,
m1 = 250 г.
Найти:
m2.
Решение
Принимаем, что концентрация для добавляемой
воды – 2 = 0%.
Используем правило креста.
Определяем массу одной части через первый
раствор: 250/10 = 25 г.
Тогда масса необходимой воды равна:
m2 = 25•35 = 875 г.
Проверим правильность решения.
Масса нового раствора:
m3 = 250 + 875 = 1125 г.
Масса соли в исходном растворе:
250 г 45%-го р-ра – х г соли,
100 г 45%-го р-ра – 45 г соли,
х = 250•45/100 = 112,5 г.
Находим 3:
1125 г р-ра – 112,5 г соли,
100 г р-ра – y г соли,
y = 100•112,5/1125 = 10 г, или 10%.
Ответ. m2 = 875 г.
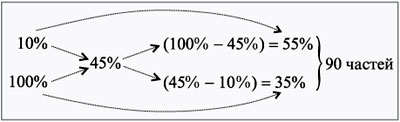
ЗАДАЧА 6
Сколько сухой соли нужно добавить к 250 г
раствора 10%-й концентрации для ее увеличения до
45%?
Дано:
1 = 10%,
m1 = 250 г,
3 = 45%.
Найти:
m(с. с.).
Решение
Принимаем, что сухая соль – это раствор с 2 = 100%.
Используем правило креста.
Определяем массу одной части через первый
раствор: 250/55 = 4,5 г.
Определяем массу сухой соли:
m(с. с.) = 4,5•35 = 158 г.
Проверяем правильность решения.
Масса нового раствора:
m3 = 250 + 158 = 408 г.
Масса соли в исходном растворе:
100 г 10%-го р-ра – 10 г соли,
250 г 10%-го р-ра – х г соли,
х = 250•10/100 = 25 г.
Общая масса соли в новом растворе:
25 + 158 = 183 г.
Концентрация нового раствора:
408 г р-ра – 183 г соли,
100 г р-ра – y г соли,
y = 100•183/408 = 45 г, или 45%.
Ответ. m(с. с.) = 158 г.
Думается, что опытный учитель всегда найдет
несколько способов решения любой задачи. Но как
учила меня моя первая учительница по химии
Клавдия Макаровна в школе № 17 г. Иркутска, так и я
стараюсь учить своих учеников: всегда глубоко
продумывать и понимать химическую сущность
задачи и находить наиболее рациональный способ
ее решения, а не просто подгонять под ответ в
конце учебника.
А.А.ТРУСКОВ,
учитель химии
магистральнинской средней школы № 2
(пос. Магистральный, Казачинско-Ленский р-н,
Иркутская обл.)
Пример 5. Определите массу нитрата
натрия и воды, необходимые для приготовления
800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)·m(р-ра) = 0,12·800 =
96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) – m(NaNO3) = 800 – 96
= 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) =
704 г.
Пример 6. Определите массу
кристаллогидрата CuSO4·5H2O и
воды, необходимые для приготовления
0,4 кг раствора с ω(CuSO4) = 8%.
Решение (см. пример 2):
ω(CuSO4) =
=
m(H2O) = m(р-ра) – m(CuSO4·5H2O)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·M(CuSO4·5H2O)
n(CuSO4·5H2O)·= n(CuSO4) =
Находим
m(CuSO4) = ω(CuSO4)·m(р-ра) = 0,08·400
= 32 г.
n(CuSO4) =
=
0,2 моль.
Отсюда m(CuSO4·5H2O) = 0,2·250 = 50 г
Масса воды m(H2O) = 400 – 50 = 350 г
Ответ: m(CuSO4·5H2O) = 50 г,
m(H2O) = 350 г.
1. 2. Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
Пример 7. Определить массу раствора
с массовой долей K2SO4 10%,
который можно приготовить из 200 г воды
и сульфата калия.
Решение:
m(р-ра) =
Из условия задачи m(K2SO4)
неизвестна, но известна масса воды, а
поскольку вода – один из компонентов
раствора, то:
ω(Н2О) = 100% – ω(K2SO4) =
100 – 10 = 90%
m(р-ра) =
=
= 222,2 г.
Ответ: можно приготовить 222,2 г
раствора.
Пример 8. При растворении в 400 г воды
некоторого количества CuSO4·5H2O
получен раствор с массовой долей CuSO4
5%. Рассчитать массу использованного
кристаллогидрата и массу полученного
раствора.
Решение (см. примеры 2, 6):
m(р-ра) =
=
В этом уравнении неизвестны m(р-ра) и
m(CuSO4), но
m(р-ра) = m(CuSO4·5H2O) + m(H2O)
= m(CuSO4·5H2O) + 400
Таким образом, неизвестны две величины:
m(р-ра) и m(CuSO4·5H2O).
m(CuSO4) = n(CuSO4)·m(CuSO4)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·m(CuSO4·5H2O)
m(CuSO4)
= 160 г/моль, m(CuSO4·5H2O)
= 250 г/моль.
Подставим эти величины в исходную
формулу:
400 + n(CuSO4)·250 =
Решаем уравнение относительно n(CuSO4):
20 + 0,05·250· n(CuSO4) = n(CuSO4)·160,
n(CuSO4) =
= 0,136 моль.
Отсюда
m(CuSO4·5H2O) = 0,136·250 = 34 г,
m(р-ра) = 400 + 34 = 434 г.
Возможны и другие варианты решения этой
задачи:
ω(CuSO4) =
=
В этом уравнении тоже два неизвестных
– m(CuSO4) и m(CuSO4·5H2O), но
величину m(CuSO4) можно представить
в виде m(CuSO4·5H2O)·х.
Здесь х – массовая доля CuSO4 в
кристаллогидрате, она равна:
х =
=
= 0,64
С учетом исходных данных, теперь можно
записать:
0,05 =
Решаем уравнение относительно
m(CuSO4·5H2O):
20 + 0,05 m(CuSO4·5H2O) = 0,66·m(CuSO4·5H2O)
m(CuSO4·5H2O) = 34 г.
Находим m(р-ра) = 400 + 34 = 434 г.
Ответ: для приготовления раствора
используют 34 г CuSO4·5H2O, масса
полученного раствора 434 г.
1. 3. Разбавление и концентрирование растворов
При решении задач, связанных с разбавлением
и концентрированием растворов, следует
помнить, что масса растворенного
вещества остается неизменной, т.е.
m(Х) = const. Изменяется только масса
растворителя и, соответственно, масса
раствора.
Пример 9. К 50 мл раствора H2SO4
(ω1 = 48%, ρ = 1,38 г/мл) добавили 950 мл
воды. Определить массовую долю H2SO4
в полученном растворе.
Решение:
ω2(H2SO4) =
m2(р-ра) = m1(р-ра) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 950·1 =
950 г
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
50·1,38 = 69 г
m1(H2SO4) = m1(р-ра)
ω1(H2SO4) = 69·0,48 = 33,12 г
ω2(H2SO4) =
= 0,032 или 3,2%
Ответ: ω(H2SO4) в новом
растворе 0,032 или 3,2%.
Пример 10. Какой объем воды необходимо
добавить к 100 мл раствора азотной кислоты
(ρ = 1,1 г/мл, ω1 = 20%), чтобы получить
раствор HNO3 с ω2 = 5%?
Решение:
V(H2O) =
m(H2O) = m2(р-ра) – m1(р-ра)
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
100·1,1 = 110 г
Масса искомого раствора определяется
по формуле:
m2(р-ра) =
m(HNO3) = m1(р-ра)·ω1(р-ра)
= 110·0,2 = 22 г.
Отсюда масса нового раствора:
m2(р-ра) =
= 440 г
Масса и объем добавленной воды будут
равны
m(H2O) = 440 – 110 = 330 г V(H2O) =
=
330 мл
Ответ: следует добавить 330 мл воды.
Пример 11. Из 200 мл раствора сульфата
меди (ρ = 1,1 г/мл, ω1 = 8%)
выпарили
100 мл воды. Определить ω(CuSO4)
в полученном растворе.
Решение:
ω2(CuSO4) =
При концентрировании растворов масса
растворенного вещества, как и при
разбавлении, остается неизменной, т.е.
m(CuSO4) = const.
m(CuSO4) = m1(р-ра)·ω1(р-ра)
= 220·0,08 = 17,6 г
Масса раствора после упаривания
уменьшилась на 100 г:
m(H2O) = V(H2O)·ρ(H2O) = 100·1
= 100 г
Масса исходного раствора
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
200·1,1 = 220 г
Следовательно, m2(р-ра) = 220 – 100 =
120 г
Отсюда ω2(CuSO4) =
= 0,147 или 14,7%
Ответ: ω(CuSO4) в полученном
растворе равна 0,147 или 14,7%.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Чему равна масса раствора соли 19-процентного (в граммах), в котором содержится 95 грамм соли?
Решение задачи
Для решения задачи используем формулу нахождения массовой доли растворенного вещества:
выразим массу раствора соли:
Найдем массу раствора соли:
m (раствора) = 95 /0,19 = 500 (г).
Если раствор 19-процентный, то массовая доля соли в нем 0,19.
Ответ:
масса раствора соли 500 грамм.