“Только из союза двоих, работающих
вместе и при помощи друг друга, рождаются великие
вещи.”
Антуан Де Сент-Экзюпери
Математика многообразна и многогранна.
Существует ряд ситуаций в образовательном
процессе, когда при изучении какой-либо темы по
физике, химии, биологии и т.д. затрагиваются
понятия математики, например, существуют задачи,
которые решают как на уроках математики, так и на
уроках химии. Способы решения задач представляют
и учителя химии, и математики, но есть проблема:
математики знают математику, а химики — химию. И
не всегда способы совпадают.
В данной статье приводятся рекомендации по
решению химических задач на смешение растворов
разными способами: с помощью расчетной формулы,
“Правила смешения”, “Правила креста”,
графического метода, алгебраического метода.
Приведены примеры решения задач.
1. Основные химические понятия
Приведем некоторые указания к решению задач на
растворы.
Основными компонентами этого типа задач
являются:
а) массовая доля растворенного вещества в
растворе;
б) масса растворенного вещества в растворе;
в) масса раствора.
Предполагают, что:
а) все получившиеся смеси и сплавы являются
однородными;
б) смешивание различных растворов происходит
мгновенно;
в) объем смеси равен сумме объемов смешиваемых
растворов;
г) объемы растворов и массы сплавов не могут
быть отрицательными.
Определения и обозначения.
Массовая доля растворенного вещества в
растворе — это отношение массы этого вещества к
массе раствора.
где — массовая
доля растворенного вещества в растворе;
— масса
растворенного вещества в растворе;
— масса
раствора.
Следствия формулы (1):
Введем обозначения:
— массовая доля
растворенного вещества в первом растворе;
—
массовая доля растворенного вещества во втором
растворе;
—
массовая доля растворенного вещества в новом
растворе, полученном при смешивании первого и
второго растворов;
m1(в-ва), m2(в-ва), m(в-ва) — массы
растворенных веществ в соответствующих
растворах;
m1(р-ра), m2(р-ра), m(р-ра) — массы
соответствующих растворов.
Основными методами решения задач на смешивание
растворов являются: с помощью расчетной формулы,
“Правило смешения”, “Правило креста”,
графический метод, алгебраический метод.
Приведем описание указанных методов.
1.1. С помощью расчетной формулы
В наших обозначениях, получим формулу для
вычисления массовой доли вещества (?) в смеси.
1. Масса полученного при смешивании раствора
равна:
m(р-ра) = m1(р-ра) + m2(р-ра).
2. Определим массы растворенных веществ в
первом и втором растворах:
m1(в-ва)= •m1(р-ра), m2(в-ва)=
•m2(р-ра).
3. Следовательно, масса растворенного вещества
в полученном растворе вычисляется как сумма масс
веществ в исходных растворах:
m(в-ва) = m1(в-ва) + m2(в-ва) = •m1(р-ра) +
•m2(р-ра).
4. Таким образом, массовая доля растворенного
вещества в полученном растворе равна:
или
или
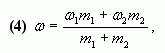
где — массы
соответствующих растворов.
Замечание: При решении задач удобно
составлять следующую таблицу.
|
1-й раствор |
2-й раствор |
Смесь двух растворов |
|
|
Масса растворов |
m1 |
m2 |
m1 + m2 |
|
Массовая доля |
|
|
|
|
Масса вещества в |
|
|
|
1.2. “Правило смешения”
Воспользуемся формулой (4):
тогда 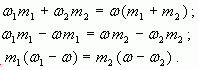
Отсюда
Таким образом, отношение массы первого
раствора к массе второго равно отношению
разности массовых долей смеси и второго раствора
к разности массовых долей первого раствора и
смеси.
Аналогично получаем, что при
Замечание: Формула (5) удобна тем, что на
практике, как правило, массы веществ не
отвешиваются, а берутся в определенном
отношении.
1.3. “Правило креста”
“Правилом креста” называют диагональную
схему правила смешения для случаев с двумя
растворами.
Слева на концах отрезков записывают исходные
массовые доли растворов (обычно слева
вверху-большая), на пересечении отрезков —
заданная, а справа на их концах записываются
разности между исходными и заданной массовыми
долями. Получаемые массовые части показывают в
каком отношении надо слить исходные растворы.
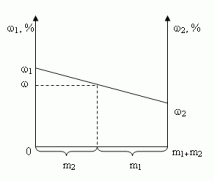
1.4. Графический метод
Отрезок прямой (основание графика)
представляет собой массу смеси, а на осях ординат
откладывают точки, соответствующие массовым
долям растворенного вещества в исходных
растворах. Соединив прямой точки на осях ординат,
получают прямую, которая отображает
функциональную зависимость массовой доли
растворенного вещества в смеси от массы
смешанных растворов в обратной пропорциональной
зависимости
Полученная функциональная прямая позволяет
решать задачи по определению массы смешанных
растворов и обратные, по массе смешанных
растворов находить массовую долю полученной
смеси.
Построим график зависимости массовой доли
растворенного вещества от массы смешанных
растворов. На одной из осей ординат откладывают
точку, соответствующую массовой доли , а на другой —
. Обозначим на оси абсцисс
точки А и В с координатами (0,0) и (m1 + m2,0),
соответственно. На графике точка А(0,0)
показывает, что массовая доля всего раствора
равна , а точка В(m1
+ m2,0) — массовая доля всего раствора равна . В направлении от
точки А к точке В возрастает содержание в
смеси 2-го раствора от 0 до m1+ m2 и
убывает содержание 1-го раствора от m1+ m2
до 0. Таким образом, любая точка на отрезке АВ будет
представлять собой смесь, имеющую одну и ту же
массу с определенным содержанием каждого
раствора, которое влияет на массовую долю
растворенного вещества в смеси.
Замечание: Данный способ является наглядным
и дает приближенное решение. При использовании
миллиметровой бумаги можно получить достаточно
точный ответ.
1.5. Алгебраический метод
Задачи на смешивание растворов решают с
помощью составления уравнения или системы
уравнений.
2. Примеры решения задач
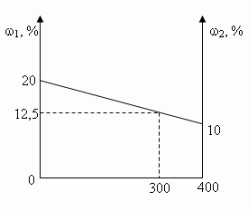
Задача 1. (№1.43, [1])
В 100 г 20%-ного раствора соли добавили 300 г её
10%-ного раствора. Определите процентную
концентрацию раствора.
Решение:
- C помощью расчетной формулы
- Графический
- Путем последовательных вычислений
- Сколько растворенного вещества содержится:
- Сколько вещества содержится в образовавшемся
растворе? - Чему равна масса образовавшегося раствора?
- Какова процентная концентрация полученного
раствора? - Алгебраический
Ответ: 12,5%
а) в 100 г 20%-ного раствора; [100•0,2 = 20(г)]
б) в 300 г 10%-ного раствора? [300•0,1 = 30(г)]
20 г + 30 г = 50 г
100 г + 300 г = 400 г
(50/400)100 = 12,5(%)
Ответ: 12,5%
Пусть х — процентная концентрация
полученного раствора. В первом растворе
содержится 0,2•100(г) соли, а во втором 0,1•300(г), а в
полученном растворе х•(100 + 300)(г) соли.
Составим уравнение:
0,2•100 + 0,1•300 = х•(100 + 300);
х = 0,125 (12,5%)
Ответ: 12,5%
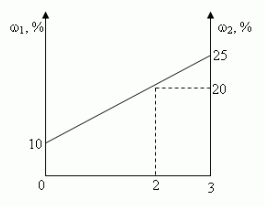
Задача 2. u(№10.26, [1])
Смешали 10%-ный и 25%-ный растворы соли и получили 3
кг 20%-ного раствора. Какое количество каждого
раствора в килограммах было использовано?
Решение:
- Алгебраический
- Графический.
- “Правило смешения”
- “Правило креста”
а) C помощью уравнения:
Пусть х (кг) — масса 1-го раствора, тогда 3-х (кг)
-масса 2-го раствора.
0,1•х (кг) содержится соли в 1-ом растворе,
0,25•(3-х) (кг) содержится соли в 2-ом растворе,
0,2•3 (кг) содержится соли в смеси.
Учитывая, что масса соли в 1-ом и 2-ом растворах
равна массе соли в смеси, составим и решим
уравнение:
0,1•х + 0,25•(3-х) = 0,2•3;
0,15х = 0,15;
х = 1, 1кг-масса 1-го раствора
3 — х = 3 — 1 =2 (кг) — масса 2-го раствора.
Ответ: 1 кг, 2 кг.
б) С помощью системы уравнений
Пусть х (кг) — количество первого раствора, у (кг)
— количество второго раствора. Система уравнений
имеет вид:
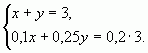
Ответ: 1 кг, 2 кг.
Ответ: 1кг, 2кг.

Составим диагональную схему
Ответ: 1кг, 2кг.
Задача 3 ([2])
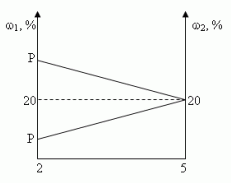
Сосуд емкостью 5 л содержит 2 л р%-ного (по объёму)
раствора соли. Сколько литров 20%-ного раствора
такой же соли надо налить в сосуд, чтобы
процентное содержание соли в сосуде стало
наибольшим?
Решение (графический способ)
Заметим, что по условию, объём второго раствора
не превышает трёх литров.
- Ели р < 20, то для того, чтобы получить
максимальную массовую долю вещества в растворе,
необходимо добавить 3 л 20% — ного раствора соли; - Если р = 20, то при добавлении 2-го раствора,
процентное содержание соли в растворе не
изменится, следовательно, можно прилить от 0 л до 3
л 20% — ного раствора соли; - Если р > 20, то при добавлении 2-го раствора,
процентное содержание соли будет уменьшаться,
т.е. прилить нужно 0 л.
Ответ: 3 л, если 0 < р < 20, [0,3], если р = 20, 0л, если 20
< р 100.
Задача 4 (работа 5, №2, [1])
В двух сосудах по 5л каждый содержится раствор
соли. Первый сосуд содержит 3л р% — ного раствора, а
второй — 4л 2р% — ного раствора одной и той же соли.
Сколько литров надо перелить из второго сосуда в
первый, чтобы получить в нем 10% — ный раствор соли?
При каких значениях р задача имеет решение?
Решение
Найдем, при каких значениях р задача имеет
решение. По условию задачи 5-ти литровый сосуд
содержит 3л первого раствора, следовательно, к
нему можно прилить от 0 до 2л второго раствора.
Имеем, Решая
неравенство, получаем
Ответ:
3. Заключение
Данные рекомендации предназначены учителям
математики, желающим организовать элективные
курсы, как в девятых, так и в десятых и
одиннадцатых классах. Цель создаваемых курсов:
научить учащихся пользоваться математическим
аппаратом при решении химических задач.
Список литературы
- Галицкий и др. Сборник задач по алгебре для 8-9
классов: Учебное пособие для учащихся шк. и
классов с углубл. изуч. математики / М.Л. Галицкий,
А.М. Гольдман, Л.И. Звавич.-2-е изд. — М.:
Просвещение,1994. — 271с. - Сборник задач по математике для поступающих в
вузы: Учебное пособие/ П.Т.Дыбов, А.И.Забоев, А.С.
Иванов и др.; Под ред. А.И. Прилепко. — М.:Высш. школа,
1983. — 239 с. - Ерыгин Д.П., Шишкин Е.А. Методика решения задач по
химии: Учебное пособие для студентов пед. ин-тов
по биол. и хим. спец. — М.: Просвещение,1989. — 176с. - Хомченко Г.П., Хомченко И.Г. Задачи по химии для
поступающих в вузы: Учебное пособие. — 2-е изд..
исправ. и доп. — М.: Высш. школа, 1993. — 302 с.
Масса образовавшейся соли
К 25 граммам серной кислоты (H2SO4) прилили 25 грамм гидроксида калия (KOH), содержащего 2% примесей. Найдите массу образовавшейся соли.
Решение задачи
Запишем уравнение реакции нейтрализации раствора гидроксида калия (KOH) раствором серной кислоты (H2SO4):
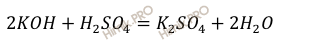
Используя формулу нахождения массовой доли растворенного вещества:
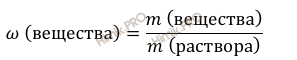
выразим массу вещества:

Найдём массу вещества гидроксида калия (KOH):
m
(вещества KOH) = 25 ∙ 0,98 = 24,5
(г).
Если раствор 98-процентный
(известно, что примеси составляют 2% поэтому: 100% — 2% = 98%), то массовая
доля гидроксида калия (KOH) в нем 0,98.
Учитывая, что молярные массы гидроксида калия (KOH) и серной кислоты (H2SO4) соответственно равны 56 г/моль и 98 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 1,192 г гидроксида калия (KOH):

на
нейтрализацию 112 г KOH
нужно 98 г H2SO4
на
нейтрализацию 24,5 г KOH
нужно х г H2SO4
Откуда:
Это означает, что серная кислота (H2SO4) находится в избытке и
дальнейшие расчеты производим по недостатку, то есть по гидроксиду калия (KOH).
Учитывая, что молярная масса сульфата калия (К2SO4) равна 174 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции найдём массу образовавшейся соли:
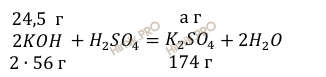
112
г KOH нужно для
образования 174 г соли
24,5
г KOH нужно для
образования а г соли
Откуда масса образовавшейся соли:
Масса образовавшейся соли равна 38,1 грамм.
Ответ:
масса образовавшейся соли равна
38,1 грамм.
Похожие задачи
Задачи на растворы, смеси и сплавы относятся к традиционным арифметическим и алгебраическим задачам, решение которых нередко вызывает трудности. Для решения таких задач нужно уметь рассуждать и уметь решать задачи на проценты и дроби, на составление уравнений и систем уравнений.
Давайте, сначала, определим, что это за задачи на смеси и сплавы. Довольно часто приходится смешивать различные жидкости, порошки, разбавлять что-либо водой или наблюдать испарение воды. В задачах такого типа эти операции приходится проводить мысленно и выполнять расчёты, а для этого надо четко понимать, что:
— масса раствора = масса воды + масса соли;
— масса сплава равна сумме масс металлов, входящих в этот сплав;
— масса смеси равна сумме масс компонентов этой смеси.
При решении задач на смеси, растворы и сплавы, мы используем их общее свойство, которое заключается в том, что масса смеси, раствора или сплава равна сумме масс их компонентов.
Введем понятие концентрации или процентного содержания вещества в растворе (смеси, сплаве).
Концентрация соли или процентное содержание соли в растворе — это отношение массы соли к массе раствора, записанное в виде процентов:
K=(mc/M)*100%,
где mс — масса соли, M – масса всего раствора, К – концентрация (процентное содержание) соли.
Концентрация вещества или процентное содержание вещества в смеси — это отношение массы вещества к массе смеси, записанное в виде процентов: K=(mв/M)*100%, где mв — масса вещества, M – масса всей смеси, К – концентрация (процентное содержание) вещества
Концентрация вещества или процентное содержание вещества в сплаве — это отношение массы вещества к массе сплава, записанное в виде процентов : K=(mв/M)*100%, где mв — масса вещества, M – масса всего сплава, К – концентрация (процентное содержание) вещества.
Пример раствора. Возьмем 180 грамм воды и добавим в воду 20 грамм соли. Получим раствор, его масса равна 180 + 20 = 200 грамм. Определим концентрацию соли (процентное содержание соли) в растворе: К= (20/(180+20))*100%=10% . Тогда процентное содержание воды 90%. (100%-10%=90%). Процентное содержание воды можно определить и так: Кв=(180/(180+20))*100%=90%. Результаты запишем в виде таблицы.
| соль | 20гр | 10% |
| вода | 180гр | 90% |
| раствор | 200гр | 100% |
Пример смеси. Возьмем и перемешаем одно ведро цемента с тремя ведрами песка. Получим смесь цемента с песком, её масса равна 1 + 3 = 4 (единиц массы). Определим концентрацию (процентное содержание) цемента в смеси : К=(1/(1+3))*100%=25%.. Концентрация (процентное содержание) песка в смеси 100%-25%=75%.
Результаты запишем в виде таблицы.
| цемент | 1 ведро | 25% |
| песок | 3ведра | 75% |
| смесь | 4 ведра | 100% |
Пример сплава. Сплав цинка и меди массой 600 гр. содержит 270 гр.меди. Определим концентрацию (процентное содержание) меди в сплаве:
Км= (270/600)*100%= 45%.
Концентрация (процентное содержание) цинка в смеси:
100%-45%=55%. Или Кц=((600-270)/600))*100%= 55%.
Результаты запишем в виде таблицы.
| цинк | 330 | 55% |
| медь | 270 | 45% |
| сплав | 600гр | 100% |
Масса вещества в растворе, смеси, сплаве.
Из формулы K=(m/M)*100%, где m масса вещества, М — масса всего раствора ( смеси, сплава), получим, что масса вещества в растворе находится по формуле: m=(M*K)/100%.
Например: а) Имеется 200 гр 40% раствора соли. Определите массу соли.
Решение : mc = (200*40%)/100 = 80г. Ответ: 80 г
б) Сплав меди и цинка массой 900г содержит 64% меди. Определите массу цинка в сплаве.
Решение: 1 способ. 100% — 64% = 36% цинка в смеси,
mц=(900*36%)/100%=324г.
2 способ. mм= (900*64%)/100%=576г, 900 – 576 = 324 г.
Ответ: 324г.
.
Последнее изменение: Четверг, 24 июля 2014, 21:53
Задачи на растворы.
Задача №1.Смешали 200 г воды и 50 г гидроксида натрия. Определить массовую долю вещества в растворе.
Задача №2.Определить массу соли и объем дистиллированной воды, необходимых для получения 230г 12% поваренной раствора.
Задача №3. 180г 15%-ного раствора хлорида бария выпарили до массы раствора 145г. Какова стала процентная концентрация раствора?
Задача №4. Смешали 250г 30% и 150г 20% растворов серной кислоты. Выразите содержание вещества в процентах в приготовленном растворе.
Задача №5. Определите массу и концентрацию раствора, который нужно добавить к 13г 8% раствора, чтобы получить 40г 14% раствора.
Задача №6. Определить массу 10% раствора карбоната натрия, который нужно добавить к 1020г 2%-ного раствора, чтобы получить 3%-ный раствор.
Задача №7. Определить массу 7%-ного раствора соли, в котором необходимо растворить ещё 20г этой соли, чтобы получить 12 %-ный раствор.
Самостоятельная работа.
Задача 1. Рассчитайте массы 10 и 50%-ных растворов гидроксида калия, необходимых для приготовления 400г 25%-ного раствора.
Задача 2. Определить массу 20%-ного раствора соли, который нужно добавить к 40г 10%-ного раствора той же соли, чтобы получить 17%-ный раствор.
Рассмотрим несколько способов решения задач на приготовление растворов.
Раствор состоит из двух частей: растворенного вещества и растворителя.
Чаще всего растворителем является вода. Массовая доля растворённого вещества зависит от содержания вещества в растворе и может быть выражена в процентах или долях.
; W%любого чистого вещества равна 100%. W% воды равна нулю, то есть, вещества в чистой воде нет. При этом сумма веществ в исходных растворах равна содержанию вещества в конечном растворе.
Первый способ последовательный.
Решается с оформлением данных и использованием формул.
1) ; 2)
; 3)
Если дается объем раствора, его надо пересчитать на массу. m(р-ра)= V×ρ.
Если надо рассчитать объем раствора, сначала рассчитывается масса, а затем объем.
Если не известна масса раствора, и масса вещества, но известна массовая доля, (например она = 20%),
тогда масса раствора выражается через X; m(р-ра) = X;====m(в-ва) = m(р-ра) × W в данном случае m (в-ва) = X× 0,2
Второй способ алгебраический.
Исходим из того, что массы веществ исходных растворов равны массе вещества конечного раствора. При этом масса вещества рассматривается как произведение массы раствора и массовой доли вещества в растворе. (W, удобнее выразить от единицы в долях).
m(р-ра)1×w+ m( р-ра)2×w =m(р-ра)3 ×w
Третий способ диагональный или метод креста.
В данном случае массовые доли располагаются следующим образом: слева сверху самая большая из приведённых в условии, под ней самая маленькая, в центре средняя, по диагонали вычитаем от большей массовой доли меньшую, записываем результат. Параллельно массовым долям на расстоянии от диагонали указываем соответствующие массы растворов.
НАПРИМЕР: в правой части диагонали получились три % отношения, мы выбираем наиболее удобное, так как при расчете любого отношения получим одинаковый результат. W берется в процентах.
|
|
|
10 |
m(р-ра)100% |
|
|
20% |
+ |
|||
|
|
|
|
||
|
10% |
80 |
m(р-ра) 10% |
||
|
90 |
m(ра-ра) 20% |
Примеры решения задач
а) На приготовление растворов
Задача №1.Смешали 200 г воды и 50 г гидроксида натрия. Определить массовую долю вещества в растворе.
1 способ
|
Дано: |
Решение |
|
m(H2O)= 200г m(NaOH)= 50г |
т(р-ра) =m(в-ва) +m(H2O) m(р-ра) = 50+ 200 = 250
|
|
w% =? |
Ответ:ω=20% |
2 способ РЕШЕНИЕ
|
1 |
0 |
Х |
|
|
+ |
= |
50 × 1+200×0=250×Х; 50=250Х; Х= 0,2 или 20%
Дано:
|
m(H2O)200г————0% |
Предполагаем значение Х 0Х |
|
m(в-ва)50г ————-100% |
|
|
m(р-ра)250г————x% |
3 способ РЕШЕНИЕ
|
|
|
Х |
___50г |
|
|
Х% |
+ |
|||
|
|
|
Ответ: ω=20% |
||
|
0% |
100-Х |
___200 |
||
|
100 |
250 |
Задача №2.Определить массу соли и объем дистиллированной воды, необходимых для получения 230г 12% поваренной раствора.
1 способ
|
Дано: |
Решение |
|
m(р-ра)=230г W% =12% |
V= m×ρ; ρ(H2O)=1г⁄л отсюда m(H2O)=V(H2O m(H2O)= m(р-ра) – m(H2O); m(H2O) =230 – 27,6 =202,4г V(H2O) =m(H2O) Ответ. m(в-ва)=27,6г, V(H2O)=202,4мл |
|
m(в-ва)-?, V(H2O)-? |
Ответ: m(в-ва)=27,6г; V(H2O)= 202,4мл |
2 способ. РЕШЕНИЕ
|
1 |
0 |
0,12 |
||
|
|
+ |
|
= |
|
|
В-ВО |
ВОДА |
Р-Р |
x×1+(230-x)×0=230×0,12; x=27,6; m(H2O)= 230-27,6=202,4г
3 способ
Дано:
|
m(р-ра)230г____________12% |
|
|
m(в-ва)x________________100% |
|
|
m(H2O)230-x____________ 0% |
РЕШЕНИЕ
|
|
12 |
___Хг |
||
|
|
||||
|
|
+ |
|||
|
|
Ответ: m(в-ва)=27,6г; V(H2O)= 202,4мл |
|||
|
0% |
88 |
___230-Х |
||
|
100 |
230 |
б) На смешивание растворов
Задача №1. Смешали 250г 30% и 150г 20% растворов серной кислоты. Выразите содержание вещества в процентах в приготовленном растворе.
2 Способ РЕШЕНИЕ
|
0,3 |
0,2 |
Х |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
250×0,3 +150×0,2 = 400×x;
75+30 = 400x; x=0,26 или 26%
Ответ. W% = 26%
3 Способ
|
Дано: |
Предполагаем значение Х 30×20 |
|
m(р-ра №1)250г ———30% |
|
|
m(р-ра №2)150г———-20% |
|
|
m(р-ра №3)400г———-x% |
РЕШЕНИЕ
|
|
|
Х-20 |
______250г |
Ответ. W% = 26% |
|
|
+ |
|||
|
|
||||
|
20% |
30-Х |
______150 |
||
|
10 |
400 |
Задача №2. Определите массу и концентрацию раствора, который нужно добавить к 13г 8% раствора, чтобы получить 40г 14% раствора.
2 способ РЕШЕНИЕ
|
0,08 |
х |
0,14 |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
13×0,08 + 27x =40×0,14; 1,04 + 27x = 5,6; 27x =5,6 – 1,04; 27x =4,56; ×= 0,169 или16,9%
Ответ. W% = 16,9%
3Спосб
Дано:
|
m(р-ра1)13г———8% |
Предполагаем значение Х 148 |
|
m(р-ра2)40-13——x% |
|
|
m(р-ра3)40г——-14% |
РЕШЕНИЕ
|
|
|
6 |
____27г |
(× — 8)×27 =6×40; 27x -216 =240; 27x =240-216; 27x =456; x =16,9% Ответ: W% = 16,9% |
|
|
+ |
|||
|
|
||||
|
8% |
Х-14 |
_____13г |
||
|
Х-8 |
40г |
в) На упаривание
Задача №1. 180г 15%-ного раствора хлорида бария выпарили до массы раствора 145г. Какова стала процентная концентрация раствора?
2Способ РЕШЕНИЕ
|
0,15 |
0 |
Х |
||
|
|
— |
|
= |
|
|
Р-Р |
вода |
Р-Р |
180×0,15 – (35×0) =145×x; 27 =145x; x= 0,186 или 18,6%; Ответ. W% = 18,6%
3 способ
Дано:
|
m(р-ра1)180г—-15% |
Предполагаем значение Х 15 0 |
|
m(воды)180-145г—0% |
|
|
m(р-ра3)145г——-x |
РЕШЕНИЕ
|
|
|
15 |
______145г |
Ответ: ω=18,6% |
|
15% |
+ |
|||
|
|
|
|||
|
0% |
Х-15 |
______35 |
||
|
Х |
180 |
г) Действия с одним известным раствором
Задача №1. Определить массу 10% раствора карбоната натрия, который нужно добавить к 1020г 2%-ного раствора, чтобы получить 3%-ный раствор.
1Способ
|
Дано: |
Решение |
|
m(р-ра) = 1020г W%(1) =2% W%(2) =10% W%(3) =3% |
1.рассчитаем массу вещества в 2-х%-ном растворе m(в-ва) =1020×0,02 = 20,4г 2.выразим массу 10%-ного раствора через х m10%-ного р-ра =х тогда m(в-ва) =Х× 0,1 3.выразим массу 3-х%-ного раствора m 3-х%-ного =1020 + Х m(в-ва) =(1020+Х) × 0,03 ∑m(в-в) исходных растворов = m(в-ва) конечного раствора 20,4 + 0,1Х = (1020+Х)× 0,03; 20,4 +0,1Х = 30,6 +0,03Х; 0,1Х – 0,03Х =30,6- 20,4; 0,07Х =10,2; Х = 145,7(10%) m 3%-ного р-ра = 1020+145,7 = 1165,7г Ответ. m 10% = 145,7г |
|
m 10%-? |
2Способ РЕШЕНИЕ.
|
0,02 |
0,1 |
0,03 |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
1020×0,02 +Х×0,1 =(1020 +Х)×0,03
20,4 + 0,1Х =30,6 + 0,03Х; 0,1Х – 0,03Х =10,2; Х = 145,7г.
3Способ
Дано:
|
m(р-ра1)1020г ———-2% |
Предполагаем значение Х 0Х |
|
m (р-ра2)Хг ————-10% |
|
|
m(р-ра3)1020+Х———3% |
РЕШЕНИЕ
|
|
1 |
____Хг |
||
|
|
||||
|
|
+ |
|||
|
|
Ответ:145г |
|||
|
2% |
7 |
_____1020г |
||
|
8 |
1020+Х |
Задача №2. Определить массу 7%-ного раствора соли, в котором необходимо растворить ещё 20г этой соли, чтобы получить 12 %-ный раствор.
1 Способ
|
Дано: |
Решение |
|
m(в-ва)=20г W%=7% W%=12% |
m 7%=Х тогда m(в-ва)=Х×0,07 m 12% =Х+ 20 тогда m(в-ва) =(Х+ 20) ×0,12 ∑m(в-в) исходных растворов = m(в-ва) конечного раствора 20 + 0,07Х=(Х+20)×0,12 17,6 =0,05Х; Х =352г |
|
m7%- ? |
Ответ:m 7% = 352г |
2 Способ РЕШЕНИЕ.
|
1 |
0,07 |
0,12 |
||
|
|
+ |
|
= |
|
|
В-во |
Р-Р |
Р-Р |
20 + 0,07Х = (20+Х)× 0,12; Х = 352г
3 Способ
Дано:
|
m(в-ва)20г——100% |
|
|
m(р-ра)Хг——— 7% |
|
|
m(р-ра)20+Х——12% |
РЕШЕНИЕ
|
|
5 |
______20г |
||
|
|
||||
|
|
+ |
|||
|
|
Ответ:352г |
|||
|
7% |
88 |
_____Х |
||
|
93 |
20+Х |
Задача №3. Определить массу 20%-ного раствора соли, который нужно добавить к 40г 10%-ного раствора той же соли, чтобы получить 17%-ный раствор.
1Способ
|
Дано: |
Решение |
|
m(р-ра) = 40г W%= 10% W% = 20% W% =17% |
m(в-ва) = 40× 0,1 =4г m(20%) =Х тогда m(в-ва) =Х×0,2 m(17%)= 40 +Х тогда m(в-ва) =(40 + Х) × 0,17 ∑m(в-в) исходного раствора = m(в-в) нового раствора 4 + 0,2Х =(40+Х)× 0,17 4+ 0,2Х =6,8 + 0,17Х; 0,2Х – 0,17Х =6,8 – 4; 0,03Х = 2,8; Х =93,3г |
|
m(20%) = ? |
Ответ: m 20% = 93,3г |
2Способ РЕШЕНИЕ.
|
0,1 |
0,2 |
0,17 |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
40× 0,1 + 0,2Х = (40 +Х) × 0,17; 4 +0,2Х = 6,8 + 0,17Х; 0,03Х =2,8; Х =93,3г
3Способ Дано:
|
m(р-ра)40г——10% |
|
|
m(р-ра)Х ——-20% |
|
|
m(р-ра)40+Х—17% |
РЕШЕНИЕ
|
|
|
7 |
______Хг |
Ответ:93,3г |
|
|
+ |
|||
|
|
||||
|
10% |
3 |
_____40 |
||
|
10 |
40+Х |
Задача №4. Рассчитайте массы 10 и 50%-ных растворов гидроксида калия, необходимых для приготовления 400г 25%-ного раствора.
1Способ РЕШЕНИЕ.
|
Дано: |
Решение |
|
m(р-ра)=400г W% =25% W% =10% W% =50% |
m(в-ва) = 400 ×0,25 =100г m(р-ра 10%) = Х тогда m(в-ва) =0,1Х m(р-ра50%) =400-Х тогда m(в-ва) =(400-Х)× 0,5 = 200 – 0,5Х ∑веществ исходных растворов =массе вещества в новом растворе. 0,1Х+ 200 – 0,5Х = 100 100 = 0,4Х; Х = 250г(это 10%) m(20%) =400 – 250 =150г Ответ: m 10% =250г, m 50% = 150г |
|
m(10%)=? m(50%)=? |
2Способ РЕШЕНИЕ.
|
0,1 |
0,5 |
0,25 |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
0,1Х + (400-Х)× 0,5 = 400 × 0,25; 0,1х + 200 – 0,5х =100; х = 250Г(10%); 400-250=150(50%)
3Способ Дано:
|
m(р-ра)400г—-25% |
|
|
m(р-ра)Хг ——10% |
|
|
m(р-ра)400- Х—50% |
РЕШЕНИЕ
|
|
|
15 |
____400-Х |
400 – 250 = 150(50%) Ответ: m 10% =250г, m 50% = 150г |
|
|
+ |
|||
|
|
||||
|
10% |
25 |
____Хг |
||
|
40 |
400г |
д) Расчёты с использованием кристаллогидратов
Задача №1. К 200г 20%-ного раствора сульфата меди прибавили 50г медного купороса. Определите массовую долю растворённого вещества полученного раствора.
2Способ РЕШЕНИЕ.
|
0,64 |
0,2 |
Х |
||
|
|
+ |
|
= |
|
|
Медный купорос |
Р-Р |
Р-Р |
CuSO4 5H2O
Mr(CuSO4 5H2O)= 160+90= 250
W%(CuSO4)=160/250 =0,64
50 × 0,64 + 200×0,2 =250Х; 32+40=250Х; 72=250Х; Х=0,288 или 28,8%
Ответ. W%(CuSO4)=28,8%
3Способ Дано:
|
m(крист. гид.)50——64% |
Предполагаем значение Х 64 Х 20 |
|
m(р-ра)200г————20% |
|
|
m(р-ра)250г————Х% |
РЕШЕНИЕ
|
|
|
Х-20 |
____50г |
(Х-20)×250=44×50 250Х-5000=2200 250Х =7200; Х=28,8% Ответ:ω=28,8% |
|
|
+ |
|||
|
|
||||
|
20% |
64-Х |
____200 |
||
|
44 |
250 |
е) Расчёты с использованием молярной концентрации
Задача №1.Каким объёмом воды нужно разбавить 500мл 0,5М раствор глюкозы, чтобы получить физиологический 0,1М-ый раствор?
Дано:
|
V(воды)Хл———0М |
|
|
V(р-ра)0,5л——-0,5М |
|
|
V(р-ра)0,5+Х——0,1М |
РЕШЕНИЕ
|
0,5М |
|
0,1 |
____0,5л |
|
|
0,1М |
+ |
|||
|
|
|
Ответ:V(воды)= 2л |
||
|
0М |
0,4 |
____Хл |
||
|
0,5 |
0,5+Х |
Или 0,5М/0М также как 0,1М/0,4М; 0,4 больше 0.1 в 4 раза тогда V(H2O) больше V0,5М раствора тоже в 4 раза отсюда 0,5 × 4 = 2
ж) Не стандартные задачи
Задача №1.Смешали два раствора массой 8кг и 2кг, получили 12%-ный раствор. Потом смешали те же растворы одинаковой массы и получили 15%-ный раствор. Рассчитать концентрации исходных растворов.
Составим математическое выражение. Выразим концентрацию через Х и У
_________________________. ____________________________________.
-6У = -1,2 6Х = 0,6
У =0,2 или 20% Х =0,01 или 10%
Задача №2. В свежих грибах 92% воды, а в сухих 8% воды, сколько сухих грибов можно получить из 23кг свежих?
-
W% грибов в свежих грибах 100 – 92% = 8%
-
W% грибов в сухих грибах100 – 8% =92%
|
0,08 |
0 |
0,92 |
||
|
|
— |
|
= |
|
|
Свежие грибы |
Вода |
Сухие грибы |
23×0,08 -0 =(23-Х)×0,92; 1,84 =21,16 -0,92Х; 0,92Х =19,32; Х= 21кг(это вода)
Масса сухих грибов =23 -21 =2кг.
Ответ m сухих грибов=2кг
Задача №3. В каком отношении надо смешать 5% и70%-ные растворы азотной кислоты, чтобы получить 20%-ный раствор?
|
|
|
15г |
Надо смешать 5% и70%-ные растворы азотной кислоты 50/15 или 5/3 тогда получим 20% раствор. Ответ. 5: 3 |
|
|
|||
|
|
|||
|
5% |
50г |
з) Расчёты, связанные с растворимостью и кристаллизацией Задача
Задача №1.Массовая доля хлорида меди (2) в насыщенном при t=20грС растворе этой соли равна 42,7%. Определите коэффициент растворимости хлорида меди(2), при данной t.
Коэффициент растворимости – это растворимость вещества в 100граммах воды, при данной t. Чтобы его рассчитать, надо определить содержание соли и воды в 42,7%-ном растворе.
1.Рассчитаем содержание воды и вещества в растворе.
100 -42,7 =57,3г(воды)
2.Рассчитаем, сколько соли растворяется в 100г воды.
Ответ. коэффициент растворимости=74,5г
Задача №2. Насыщенный при 60°C раствор соли в количестве 20кг был охлаждён снегом, какое количество соли выпало в осадок, если при 60°C растворимость соли составляет110г, а при 0°C -13,1г. Рассчитайте выход продукта в процентах.
|
60°C к.р.——110г |
0°C к.р.——-13,1г |
|
m(р-ра)20кг=20000г ——- 1.Приготовим стандартный раствор 100+110=210 2.Рассчитаем массу вещества в 20000г р-ра 3.Ррассчитаем массу воды 20000 -10476,2 = 9523,8г |
———↓ ? 4.Рассчитаем массу вещества растворённого в 9523,8г воды при 0°C. 5.Рассчитаем массу осадка 10476,2 – 1247,6 =9228,6г 6.Выразим массу ↓ в %-тах |
Ответ. η = 88,1%
Задача №3. При перекристаллизации соли, растворимость которой при 100°C =48,6г, а при 20°C=16,45г, было получено при охлаждении в интервале указанных температур 0,5кг вещества. Сколько было взято соли и воды для перекристаллизации?
|
100°C К. Р.——-48,6Г |
20°C к.р. ————16,45г |
|
m(в-ва)—?, m(воды)—-? ———— 2.Рассчитаем массу вещества 3.Расчитаем массу воды |
———m↓ 500г 1.Рассчитаеммассу стандартного осадка. m ↓= 48,6 -16,45 =32,15г. |
Ответ m(в-ва)= 755,73г, m(воды)= 1555г.
Задача №4. Растворимость хлората калия при 70°C =30,2г, а при 30°C =10,1г в 100г воды. Сколько граммов вещества выделится из 70г насыщенного при 70°C раствора, если его охладить до 30°C?
|
70°C к.р.———30,2г |
30°C к.р. ————10,1г |
|
m(р-ра)= 70г ————— 1.Рассчитаем массу стандартного раствора 100+30,2=132,2г 2.Рассчитаем массу вещества в 70г раствора 3.Рассчитаем массу воды 70- 16,24 = 53,76г |
———↓ -? 4.Рассчитаем массу вещества для 53,76г воды при 30°C 5.Рассчитаем массу осадка 16,24 – 5,43 = 10,81г |
Или можно массу осадка рассчитать через воду
m↓ = 30,2- 10,1 =20,1
Ответ m(в-ва)= 10,8г
Задача №5. При н.у. в воде массой 100г растворяется хлороводород объёмом 50,5л. При t= 50°C и нормальном давлении коэффициент растворимости хлороводорода равен 59,6г. Насыщенный при t = 0°C раствор соляной кислоты массой 40г нагрет до t=50°C. Определите массу полученного раствора.
|
50°C к.р. ——-59,6г |
0°Cг к.р.———-50,5л |
|
m(р-ра)—-? 5.Рассчитаем массу вещества растворившегося в 22г воды 6.Ррассчитаем массу раствора 22 + 13,1 = 35,1г |
———— m(р-ра)=40г 1.Переведем объём в массу М(НСI)=36,5г/моль 2.Рассчитаем массу стандартного раствора 100+82,3=182,3г 3.Рассчитаем массу воды в 40г раствора 4.Рассчитаем массу вещества 40 – 22 = 18г |
Ответ m(р-ра)= 35,1г
Или можно через стандартные массы растворов
1.Рассчитаем стандартные массы растворов
|
50°C; 100+59,6=159,6г |
0°C; 100+82,3=182,3 |
Алгоритм нахождения массы растворенного вещества и массы воды, необходимые для приготовления раствора.
Задача.
Вычислить
массу соли и воды, необходимые для
приготовления 40 г раствора NаСl
с массовой долей 5%.
1.
Запишите условие задачи с помощью
общепринятых обозначений
Д
m р-ра
= 40г
ω = 5%
m (NаСl)
— ?
m (Н2О)
— ?
Решение:
1. Рассчитайте
массу растворенного вещества по формуле:
m в-ва=
ω ∙
m р-ра/100%
m
(NаСl)
= 5% · 40г/100% = 2г
2. Найдите массу
воды по разности между массой раствора
и массой растворенного вещества:
m р-ля
= m р-ра
– m в-ва
m
(Н2О)
= 40г – 2г = 38 г.
3.
Запишите
ответ.
Ответ: для
приготовления раствора необходимо
взять 2г соли и 38г воды.
Алгоритм нахождения массовой доли растворенного вещества при разбавлении (упаривании) раствора
Задача
К
15% раствору, масса которого 80г, добавили
30г воды. Какой стала массовая доля
растворённого вещества в полученном
растворе?
1. Запишите условие
задачи с помощью общепринятых обозначений.
Д
ω1
= 15%
mр-ра1=80г
m(Н2О)
= 30г
ω2-?
Решение:
1. В результате
разбавления (упаривания) раствора масса
раствора увеличилась (уменьшилась), а
вещества в нём осталось столько же.
Рассчитайте массу
растворённого вещества, преобразуя
формулу:
ω = m в-ва
/m р-ра
∙ 100%
m в-ва
= ω1·
mр-ра1
/100%
m
в-ва
= 15% · 80г = 12г
2. При разбавлении
раствора общая масса его увеличивается
(при упаривании — уменьшается).
Найдите массу
вновь полученного раствора:
m
р-ра2
= m
р-ра1 +
m(H2O)
m р-ра2
= 80г + 30г=110г
3. Рассчитайте
массовую долю растворённого вещества
в новом растворе:
ω2
= m в-ва /
m р-ра2
∙ 100%
ω2
= 12г/ 110г· 100% = 10,9%
4. Запишите ответ
Ответ:
массовая доля растворенного вещества
в растворе при разбавлении равна 10,9%
Алгоритм решения задач по «правилу креста»
Для получения
раствора с заданной массовой долей (%)
растворенного вещества путем смешивания
двух растворов с известной массовой
долей растворенного вещества пользуются
диагональной схемой («правило креста»).
Сущность этого
метода состоит в том, что по диагонали
из большей величины массовой доли
растворенного вещества вычитают меньшую.
|
a с – в / с / в а – с |
где а – большая, |
Разности (с-в) и
(а-с) показывают, в каких соотношениях
нужно взять растворы а и в, чтобы получить
раствор с.
Если
для разбавления в качестве исходного
раствора используют чистый растворитель,
например, Н20,
то концентрация его принимается за 0 и
записывается с левой стороны диагональной
схемы.
Задача
Для
обработки рук хирурга, ран, послеоперационного
поля используется йодная настойка с
массовой долей 5%. В каком массовом
соотношении нужно смешать растворы с
массовыми долями йода 2,5% и 30%, чтобы
получить 330 г йодной настойки с массовой
долей йода 5%?
1. Запишите условие
задачи с помощью общепринятых обозначений.
Д
ω1
= 30%
ω2
= 2,5%
ω3
= 5%
m3
= 330г
m1
= ?
m2
= ?
Решение:
1. Составьте
«диагональную схему». Для этого
запишите массовые доли исходных растворов
друг под другом, по левую сторону креста,
а в центре заданную массовую долю
раствора.
2,5
/
5
/
30
2.
Вычитают из бóльшей массовой доли
меньшую (30–5=25; 5–2,5=2,5) и находят результаты.
Записывают найденные
результаты с правой стороны диагональной
схемы: при возможности сокращают
полученные числа. В данном случае 25 в
десять раз больше, чем 2,5, то есть вместо
25 записывают 10, вместо 2,5 пишут 1.
30 2,5 (1)
/
5
/
2,5 25 (10)
Числа
(в данном случае 25 и 2,5 или 10 и 1)называют
массовыми числами. Массовые числа
показывают, в каком соотношении необходимо
взять исходные растворы, чтобы получить
раствор с массовой долей йода 5%.
3. Определите массу
30% и 2,5% раствора по формуле:
m
р-ра
= число частей · m3/
сумму массовых частей
m1(30%)
= 1· 330г /1+10 = 30г
m2(2,5%)
= 10 · 330г/ 1+10 = 300г
4. Запишите ответ.
Ответ:
для приготовления 330 г раствора с массовой
долей йода 5% необходимо смешать 300 г
раствора с массовой долей 2,5% и 30 г с
массовой долей 30%.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

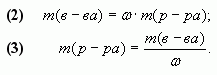
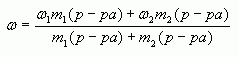
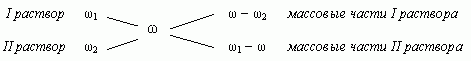
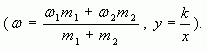

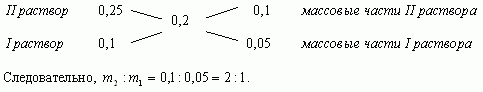
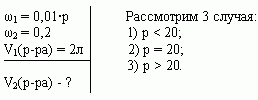
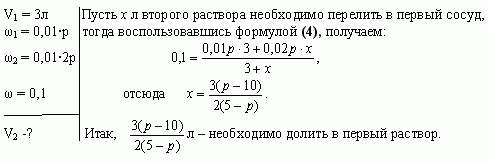

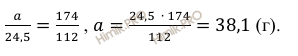
 100%
100%