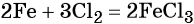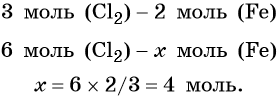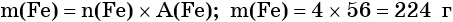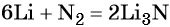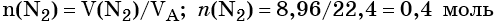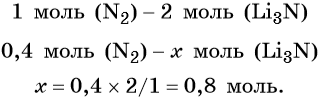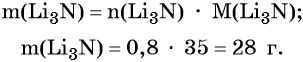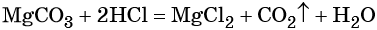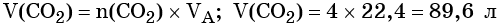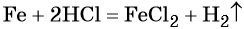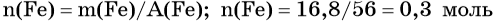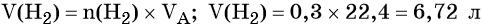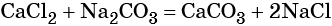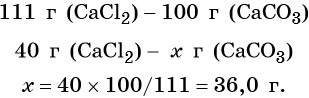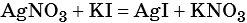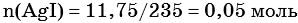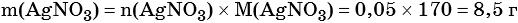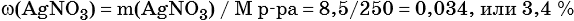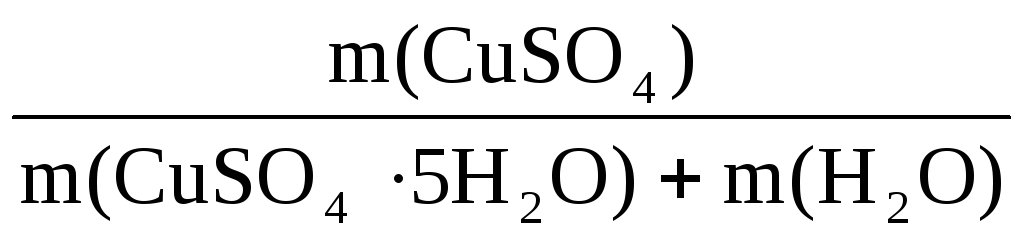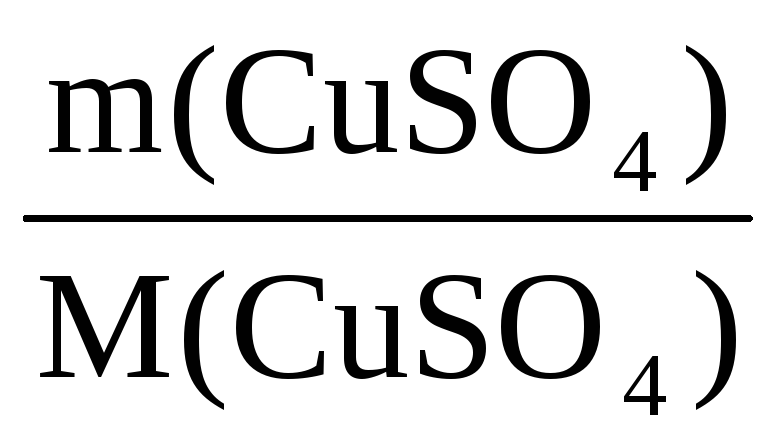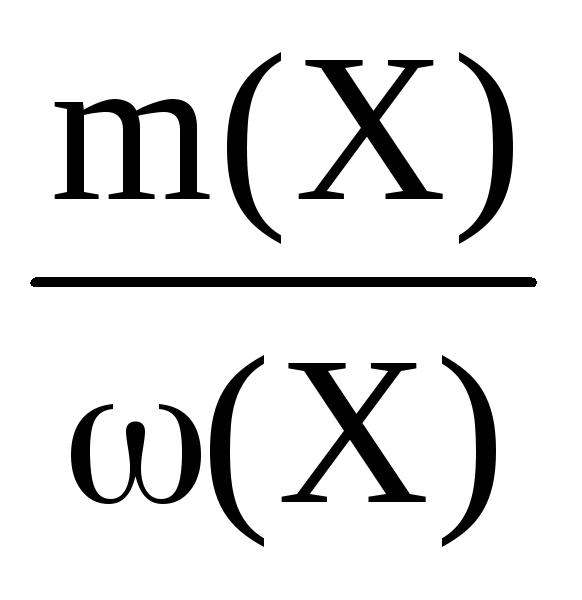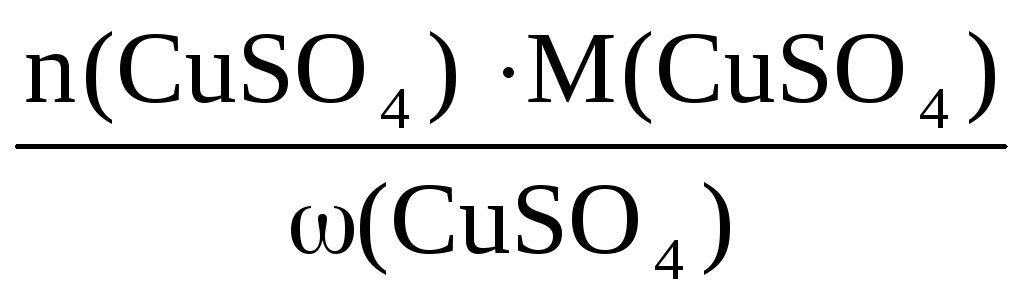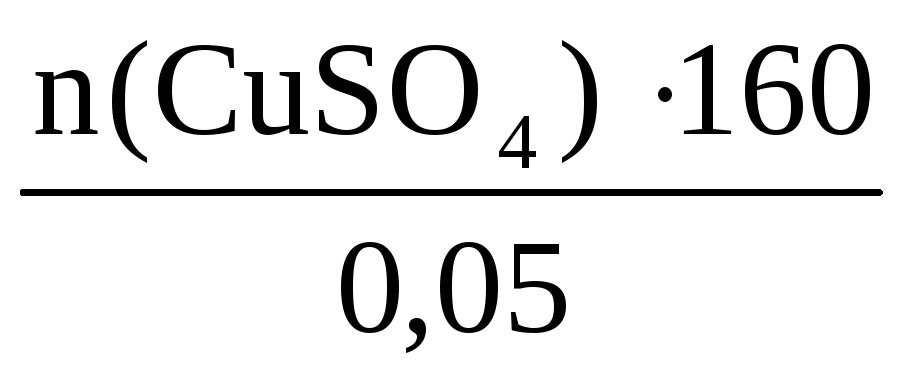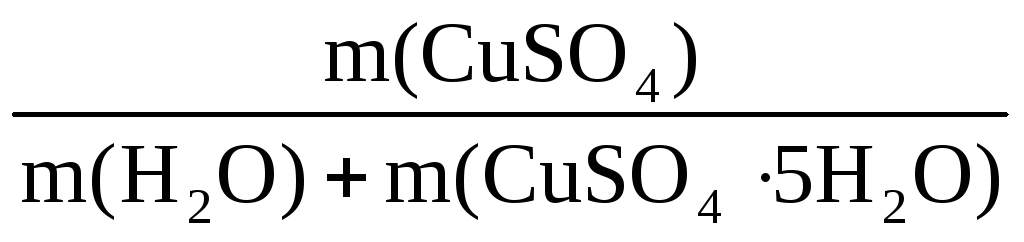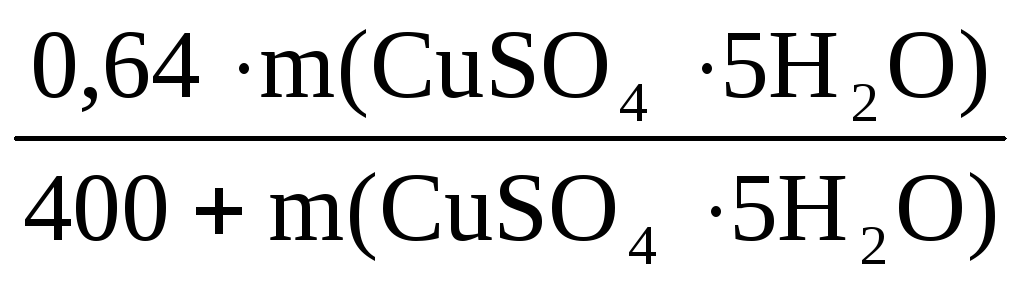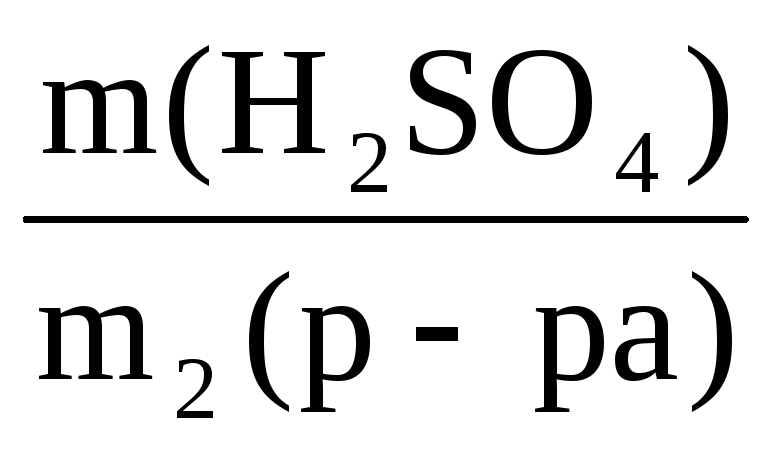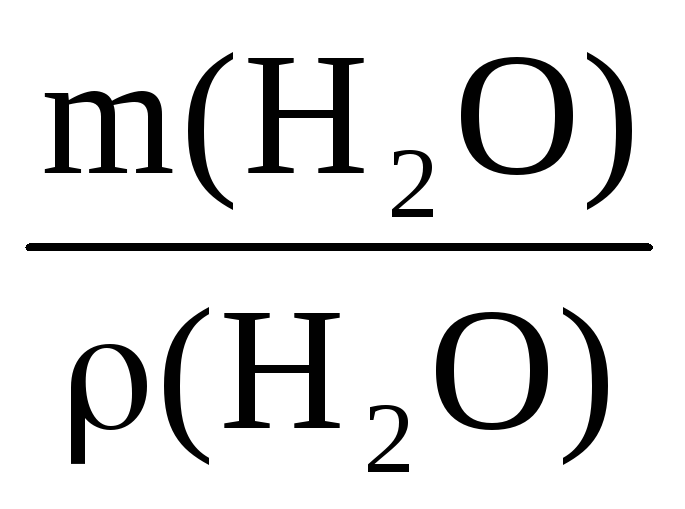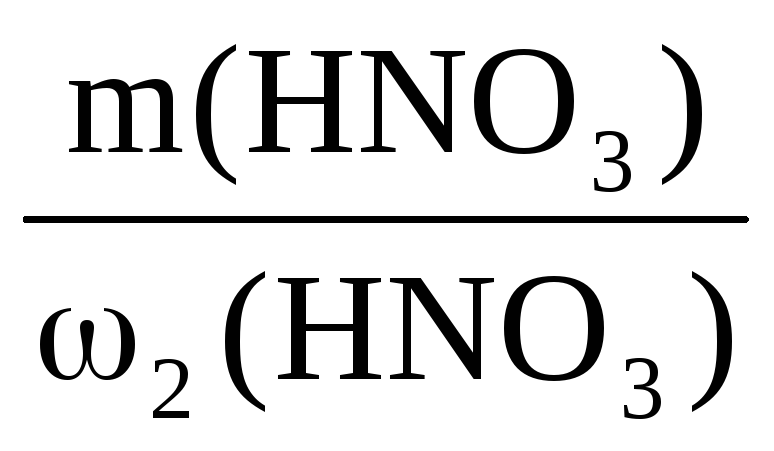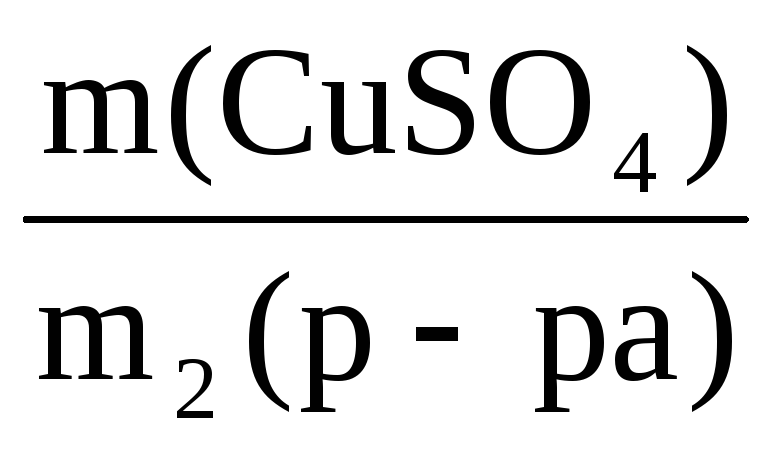Как найти массу осадка
Часто бывает так, что в ходе химической реакции образуется малорастворимое вещество, выпадающее в осадок (к примеру, сульфат бария, фосфат кальция, хлорид серебра и т.д.). Предположим, химику поставлена задача: определить массу этого осадка. Каким образом можно это сделать?

Инструкция
Если вам неизвестны точные количества исходных веществ, то придется действовать опытным путем. То есть сначала отделите осадок от раствора (путем фильтрования или на обычной воронке, или с использованием воронки Бюхнера). После чего тщательно высушите его и взвесьте на аналитических весах. Так вы получите достаточно точный результат.
Ну а если вам известны точные количества веществ, вступавших в реакцию, то все будет гораздо проще. Например, изначально было 28,4 грамма сульфата натрия и 20,8 грамма хлорида бария. Сколько граммов осадка образовалось?
Напишите правильное уравнение химической реакции: Na2SO4 + BaCl2 = BaSO4 + 2NaCl.В результате этой реакции образуется практически нерастворимое вещество – сульфат бария, мгновенно выпадающий в виде плотного белого осадка.
Вычислите, какое из веществ было взято в недостатке, а какое – в избытке. Для этого подсчитайте молярные массы исходных реагентов:46 + 32 + 64 = 142 г/моль – молярная масса сульфата натрия;
137 + 71 = 208 г/моль – молярная масса хлорида бария.То есть в реакцию вступали 0,2 моля сульфата натрия и 0,1 моля хлорида бария. Сульфат натрия был взят в избытке, следовательно, весь хлорид бария прореагировал.
Подсчитайте количество образовавшегося осадка. Для этого разделите молекулярную массу сульфата бария на молекулярную массу хлорида бария и результат умножьте на количество исходного вещества:20,8 * 233/208 = 23,3 грамма.
А если бы сульфат натрия был в недостатке? Предположим, в реакцию вступило бы не 28,4 грамма этой соли, а в 5 раз меньше – всего 5,68 грамма. И тут нет абсолютно ничего сложного. 5,68 грамма сульфата натрия составляют 0,04 моля. Следовательно, в реакцию с таким количеством этой соли могло вступить также всего 0,04 моля хлорида бария, то есть 0,04 х 208 = 8,32 грамма. Прореагировало только 8,32 грамма из исходных 20,8 граммов.
Умножив эту величину на соотношение молярных масс сульфата бария и хлорида бария, получите ответ: 8,32 * 233/208 = 9,32 грамма осадка.
Источники:
- как найти массу осадка в растворе
- Вычисление молярной массы эквивалента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
-
вычислить массу чистой H2SO4:
Определить число молей H2SO4:
Составить уравнение данной реакции:
Исходя из равенства отношений количеств H2SO4 и BaSO4 к своим коэффициентам и преобразовав пропорцию, определить кол-во осаждённого BaSO4 в молях:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
масса выпавшего осадка BaSO4 равна 69,9 г
Источник статьи: http://bingoschool.ru/manual/raschetyi-massyi-obema-kolichestva-veshhestva-produkta-reakczii-esli-odno-iz-veshhestv-dano-v-vide-rastvora-s-opredelennoj-massovoj-dolej-rastvorennogo-veshhestva/
Как пишется масса осадка в химии
В условиях задач такого типа указаны массы или объёмы двух реагирующих веществ, одно из которых дано в избытке, поэтому при решении таких задач нужно определить, какое вещество взято в избытке. Расчёт массы или объёма продукта реакции ведётся по данным вещества взятого в недостатке.
I. Алгоритм решения задачи: «Вычисление массы или количества продукта реакции, если один из реагентов взят в избытке»
Пример 1. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для формул, записанных вдано
3. Вычислим количества веществ, масса которых дана в условии
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
CaCl2 – взят в избытке, расчёт ведём по недостатку, т.е. поNa3PO4.
6. Вычислим количество вещества, массу которого нужно найт
Пример 2. Вычислите объём водорода (н.у.), который образуется при взаимодействии 6,5 г цинка с соляной кислотой массой 7,5 г.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для веществ с известной массой, записанных в дано
3. Вычислим количества веществ, масса которых дана в условии
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
НCl – взят в избытке, расчёт ведём по недостатку, т.е. по Zn.
6. Вычислим количество вещества, объём которого нужно найти
II. Алгоритм решения задач на «Избыток — недостаток» (в общем виде)
Расчёты по уравнению реакции, если один из реагентов взят в избытке
1. Составляем уравнение реакции
2. Нахождение количества вещества реагентов ν(А) и ν(В):
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
© 2017 Персональный сайт учителя химии Кардаевой Татьяны Александровны. Все права защищены.
Hекоторые файлы и информация, находящиеся на данном сайте, были взяты из методической литературы, найдены в сети Интернет, как свободно распространяемые (авторство данных материалов сохранено). Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба сообщить об этом с целью устранения правонарушения.
Источник статьи: http://kardaeva.ru/89-dlya-uchenika/9-klass/144-vychislenie-massy-ili-kolichestva-produkta-reaktsii
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Источник статьи: http://himi4ka.ru/ogje-2018-po-himii/urok-29-vychislenie-kolichestva-veshhestva-massy-ili-obema-veshhestva-po-kolichestvu-veshhestv-masse-ili-obemu-odnogo-iz-reagentov-ili-produktov-reakcii.html
1. 1. Вычисление массы растворенного вещества или растворителя по массе раствора
Пример 5. Определите массу нитрата натрия и воды, необходимые для приготовления 800 г раствора с ω(NaNO3) = 12%.
m(H2O) = m(р-ра) – m(NaNO3) = 800 – 96 = 704 г.
Пример 6. Определите массу кристаллогидрата CuSO4·5H2O и воды, необходимые для приготовления 0,4 кг раствора с ω(CuSO4) = 8%.
ω(CuSO4) = 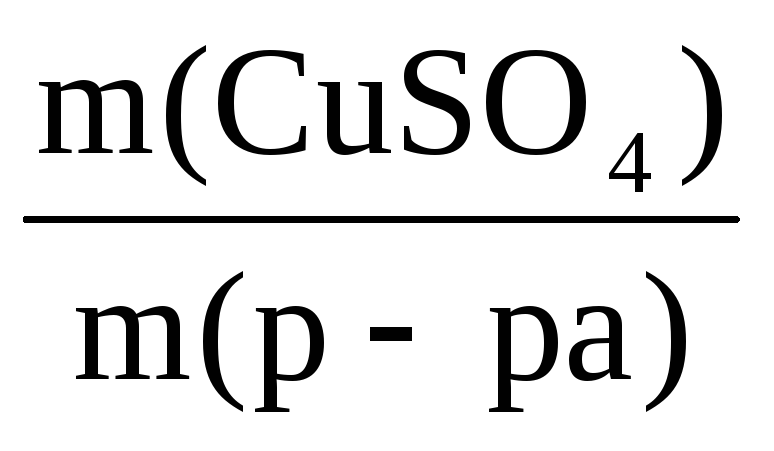
n(CuSO4·5H2O)·= n(CuSO4) =
n(CuSO4) = 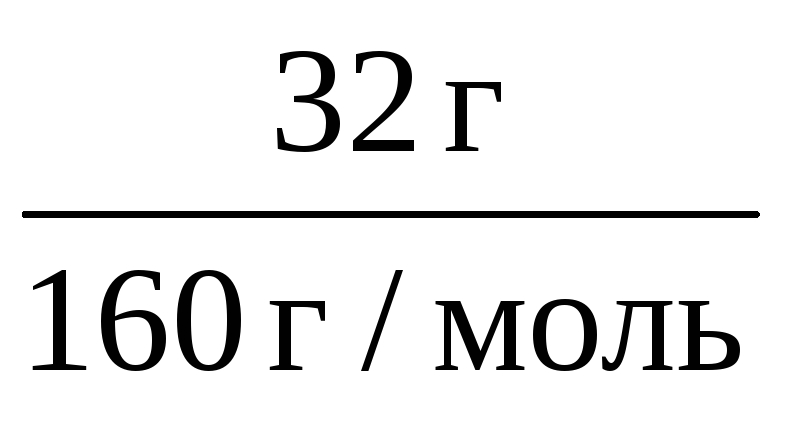
Отсюда m(CuSO4·5H2O) = 0,2·250 = 50 г
Масса воды m(H2O) = 400 – 50 = 350 г
1. 2. Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
Пример 7. Определить массу раствора с массовой долей K2SO4 10%, который можно приготовить из 200 г воды и сульфата калия.
m(р-ра) =
Из условия задачи m(K2SO4) неизвестна, но известна масса воды, а поскольку вода – один из компонентов раствора, то:
m(р-ра) = 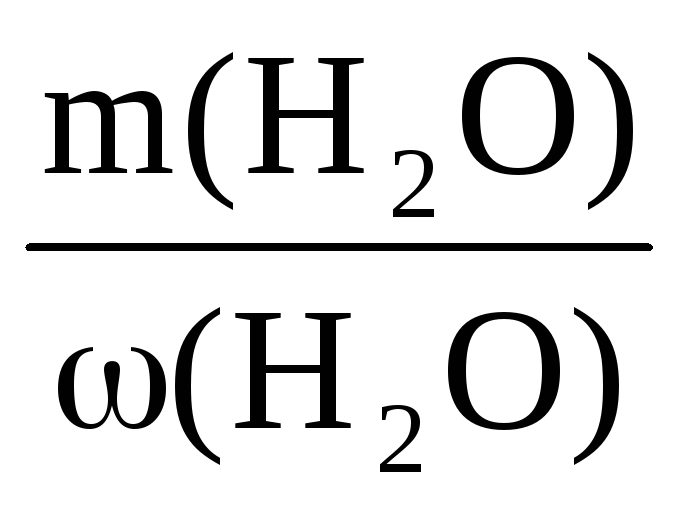
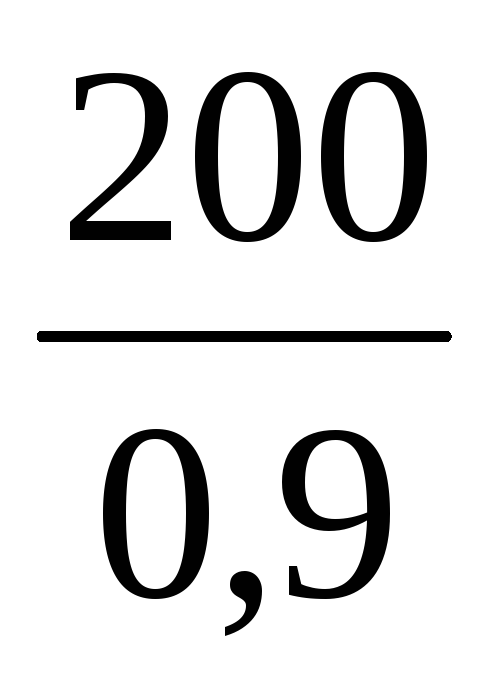
Ответ: можно приготовить 222,2 г раствора.
Пример 8. При растворении в 400 г воды некоторого количества CuSO4·5H2O получен раствор с массовой долей CuSO4 5%. Рассчитать массу использованного кристаллогидрата и массу полученного раствора.
m(р-ра) = 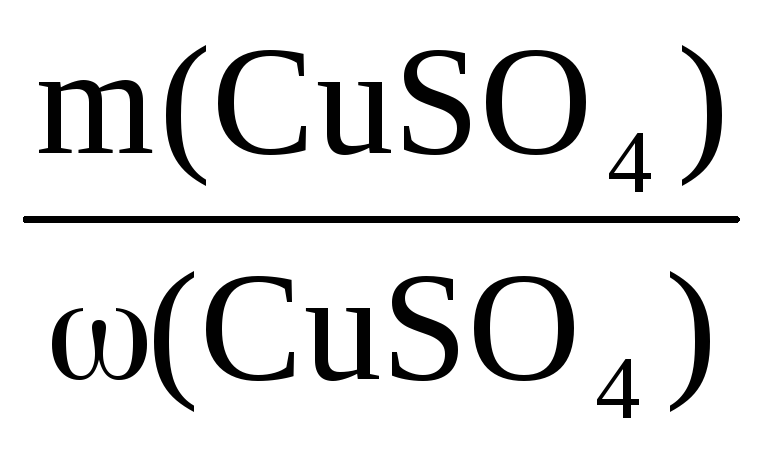
В этом уравнении неизвестны m(р-ра) и m(CuSO4), но
Таким образом, неизвестны две величины: m(р-ра) и m(CuSO4·5H2O).
Подставим эти величины в исходную формулу:
400 + n(CuSO4)·250 =
Решаем уравнение относительно n(CuSO4):
n(CuSO4) = 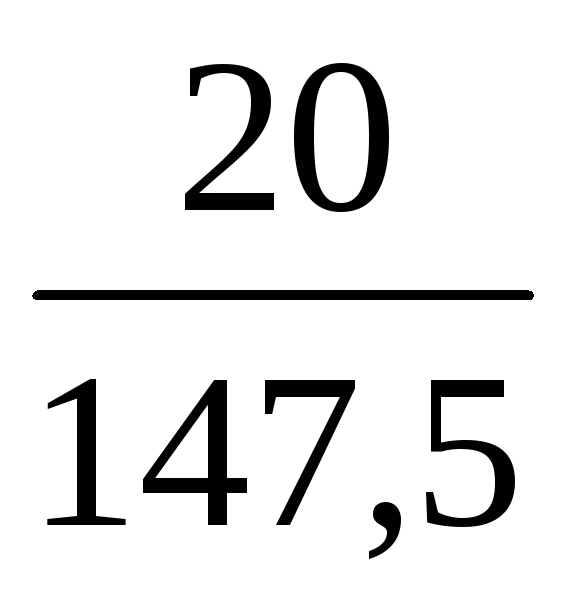
Возможны и другие варианты решения этой задачи:
ω(CuSO4) = 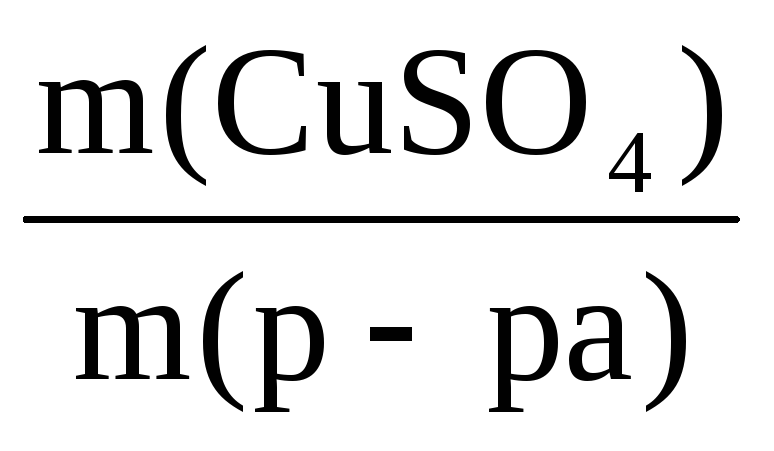
В этом уравнении тоже два неизвестных – m(CuSO4) и m(CuSO4·5H2O), но величину m(CuSO4) можно представить в виде m(CuSO4·5H2O)·х.
Здесь х – массовая доля CuSO4 в кристаллогидрате, она равна:
х = 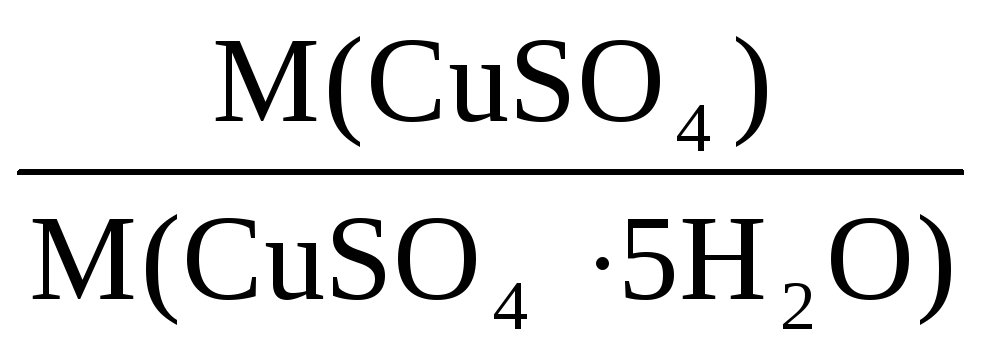
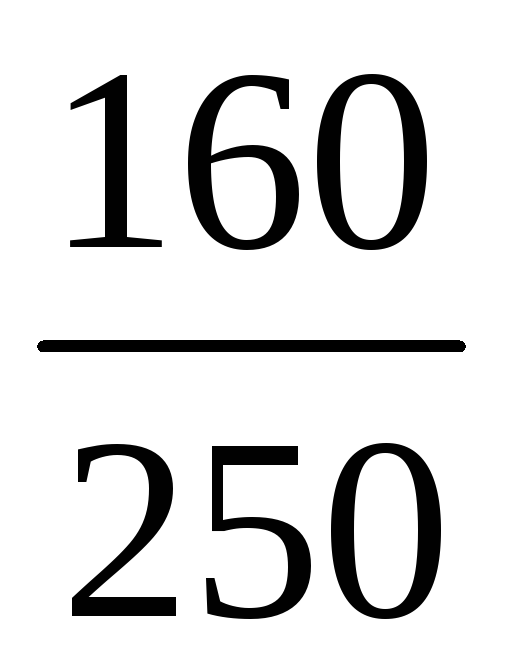
С учетом исходных данных, теперь можно записать:
0,05 =
Решаем уравнение относительно m(CuSO4·5H2O):
Находим m(р-ра) = 400 + 34 = 434 г.
Ответ: для приготовления раствора используют 34 г CuSO4·5H2O, масса полученного раствора 434 г.
1. 3. Разбавление и концентрирование растворов
При решении задач, связанных с разбавлением и концентрированием растворов, следует помнить, что масса растворенного вещества остается неизменной, т.е. m(Х) = const. Изменяется только масса растворителя и, соответственно, масса раствора.
Пример 9. К 50 мл раствора H2SO4 (ω1 = 48%, ρ = 1,38 г/мл) добавили 950 мл воды. Определить массовую долю H2SO4 в полученном растворе.
ω2(H2SO4) =
ω2(H2SO4) = 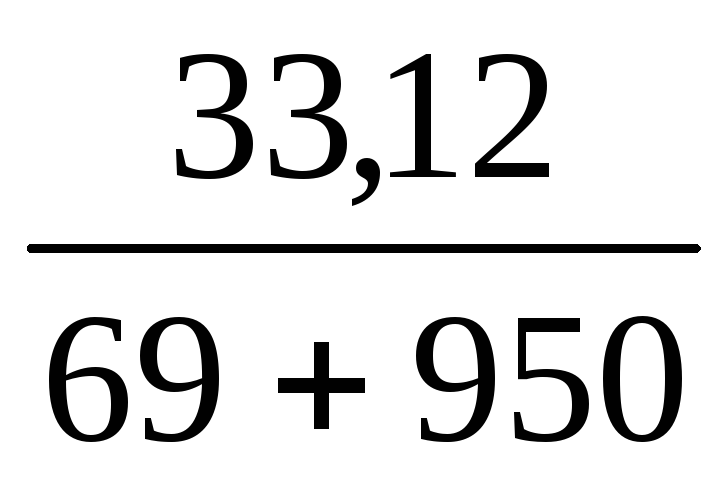
Ответ: ω(H2SO4) в новом растворе 0,032 или 3,2%.
Пример 10. Какой объем воды необходимо добавить к 100 мл раствора азотной кислоты (ρ = 1,1 г/мл, ω1 = 20%), чтобы получить раствор HNO3 с ω2 = 5%?
V(H2O) =
Масса искомого раствора определяется по формуле:
m2(р-ра) =
Отсюда масса нового раствора:
m2(р-ра) = 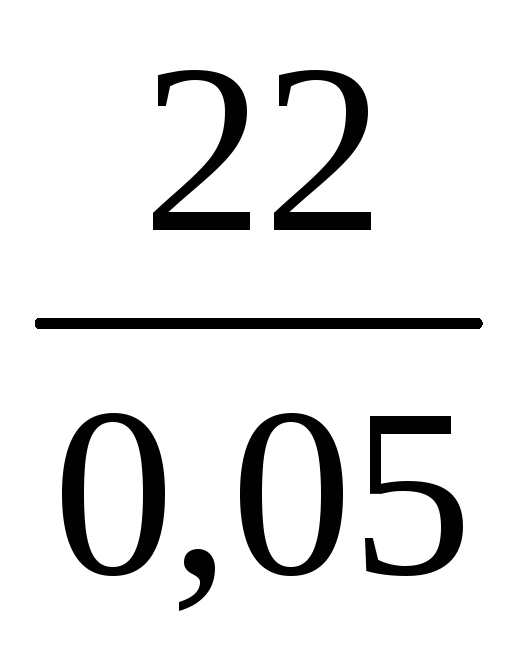
Масса и объем добавленной воды будут равны
m(H2O) = 440 – 110 = 330 г V(H2O) = 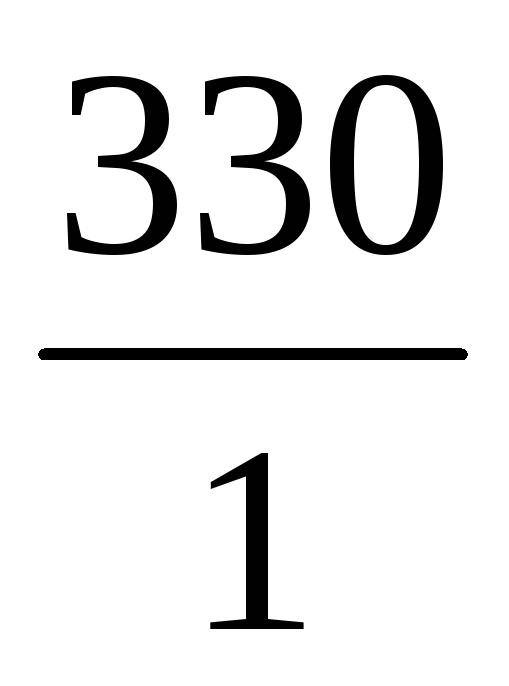
Ответ: следует добавить 330 мл воды.
Пример 11. Из 200 мл раствора сульфата меди (ρ = 1,1 г/мл, ω1 = 8%) выпарили 100 мл воды. Определить ω(CuSO4) в полученном растворе.
ω2(CuSO4) =
При концентрировании растворов масса растворенного вещества, как и при разбавлении, остается неизменной, т.е. m(CuSO4) = const.
Масса раствора после упаривания уменьшилась на 100 г:
Следовательно, m2(р-ра) = 220 – 100 = 120 г
Отсюда ω2(CuSO4) = 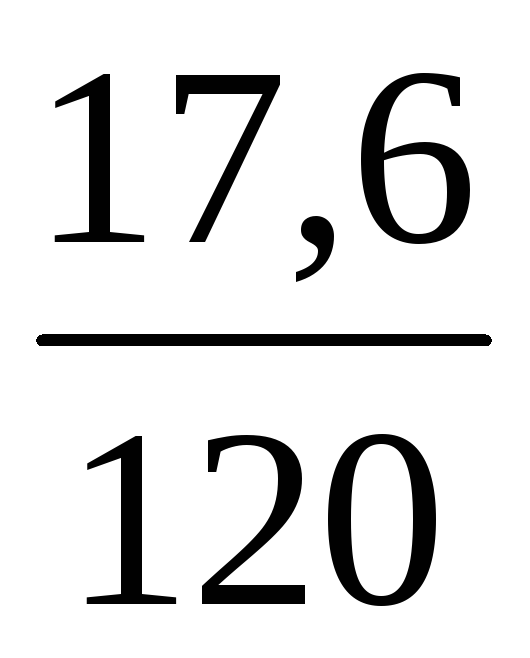
Ответ: ω(CuSO4) в полученном растворе равна 0,147 или 14,7%.
Источник статьи: http://studfile.net/preview/7177524/page:2/
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Источник статьи: http://himi4ka.ru/ogje-2018-po-himii/urok-29-vychislenie-kolichestva-veshhestva-massy-ili-obema-veshhestva-po-kolichestvu-veshhestv-masse-ili-obemu-odnogo-iz-reagentov-ili-produktov-reakcii.html
Расчеты массовой доли химического соединения в смеси (часть С)
Теория к заданию 34 из ЕГЭ по химии
Расчет массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
Задача 1. Какой объем воздуха (н.у.) потребуется для взаимодействия с $270$ г алюминия, содержащего $20%$ примесей? Какое количество вещества оксида алюминия при этом получится?
$<4Al>↖<216г>+<3O_2>↖=<2Al_2O_3>↖$, где $x$ — объем кислорода $V(O_2)$, $y$ — количество вещества оксида алюминия $ν(Al_2O_3)$.
Однако в задаче требуется найти объем не кислорода, а воздуха. В воздухе содержится 21 % кислорода по объему. Преобразуя формулу $ϕ=/$, найдем объем воздуха:
б) $<216>/<108>=/<2>; y=<216·2>/<108>=4$ моль — количество вещества оксида алюминия $n(Al_2O_3)$.
Ответ: $V(возд.)=640$ л; $ν(Al_2O_3)=4$ моль.
Расчет массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Задача 1. Какой объем водорода (н.у.) выделится при взаимодействии $730$ г $30%$-ной соляной кислоты с необходимым по реакции количеством вещества цинка? Какое это количество вещества?
где $x$ — количество вещества цинка $n(Zn)$, $y$ — объем водорода $V(H_2)$.
3. $Mr(HCl)=1+35.5=36.5; M(HCl)=36.5$ г/моль.
Ответ: $V(H_2)=67.2$ л, $ν(Zn)=3$ моль.
Расчет массовой или объемной доли выхода продукта реакции от теоретически возможного
Многие химические реакции являются обратимыми, они происходят не до конца, т.е. не происходит полного превращения исходных веществ в конечный продукт. Даже если реакция необратимая, то все равно при ее осуществлении происходит потеря веществ. В результате практически полученное количество продукта реакции составляет только часть от теоретически возможной массы.
Выход продукта реакции от теоретически возможного ($η$) — это отношение массы (объема, количества) реально полученного вещества к его теоретически возможной массе (объему, количеству), которое рассчитывается по уравнению химической реакции:
Задача 1. Вычислить массовую долю выхода (в процентах) чистого вольфрама от теоретически возможного, если из $10.1$ кг оксида вольфрама (VI) получено после восстановления водородом $7.5$ кг вольфрама.
1) Находим из уравнения реакции теоретическую массу вольфрама:
$M(WO_3)=232$кг/моль; $M(W)=184$ кг/моль
2) Вычисляем массовую долю выхода вольфрама от теоретически возможного.
Практический выход вольфрама дан в условии задачи: $m_<практ.>(W)=7.5$ кг.
Ответ: массовая доля выхода вольфрама от теоретически возможного равна $94%$.
Задача 2. Вычислите массу вступившего в реакцию бензола, если образовалось $9.8$ г нитробензола, а массовая доля выхода продукта равна $80%$ от теоретически возможного.
1) Находим по формуле $η=>/$ теоретическую массу нитробензола:
2) Определяем массу бензола по уравнению реакции:
$М(С_6Н_6)=78$ г/моль; $М(C_6H_5NO_2)=123$ г/моль
Ответ: масса бензола равна $7.7$ г.
Задача 3. Вычислить объем оксида серы (IV), который необходимо взять для реакции с кислородом, чтобы получить $20$г оксида серы (VI), если выход продукта реакции равен $80%$ от теоретически возможного.
1. Находим по формуле $η=>/$ теоретическую массу оксида серы (IV):
2. Определяем количество вещества оксида серы (VI):
3. Из уравнения реакции $2SO_2 + O_2=2SO_3$ следует, что $<ν(SO_2)>/<ν(SO_3)>=<2>/<2>.$
Откуда получим $ν(SO_2)=ν(SO_3)$;
4. Вычислим объем оксида серы (IV): $ν(SO_2)=V_<м>·V(SO_2); V(SO_2)=22.4·0.31=7$ л.
1. Записываем уравнение реакции:
Ответ: объем оксида серы (IV) равен $7$ л.
Расчет массовой доли (массы) химического соединения в смеси
Самыми распространенными среди расчетных задач в химии являются задачи на смеси веществ. Каждая смесь состоит из двух или более компонентов, состав смесей может изменяться в широких пределах. Решение задач на смеси обычно сводится или к определению состава смеси по данным приведенным в условии задачи, или к расчету количества реагентов или продуктов реакции по участию в смеси известного состава.
Состав смеси может выражаться разными способами:
- можно указать массы каждого компонента;
- можно определить количество (число моль) компонентов;
- можно указать массовые доли компонентов. Массовая доля компонента Х в смеси равна:
4) в случае смеси газов можно указать объемы газов, составляющих смесь, или объемные доли этих газов. Объемная доля газа Х в смеси равна:
Определение состава смеси, если все ее компоненты взаимодействуют с данным реагентом
Задача 1. Смесь магния и железа массой $8$ г обработали избытком соляной кислоты. В результате реакции выделилось $4.5$ л водорода (н.у.). Какая масса каждого металла находилась в смеси?
1. Записываем уравнение реакции:
2. Обозначим массу одного компонента, например, магния — $х, m(Mg)=х$ г, тогда $m(Fe)=(8 — x)$ г. Определим количество вещества в смеси:
3. Из уравнений (1) и (2) определим, что количество водорода, выделившегося в реакциях, равно количеству металлов, вступивших в реакцию:
Определим общее количество водорода:
4. Учитывая равенства (3) и (4), составим уравнение:
1. Поскольку количество водорода, выделившегося в реакциях (1) и (2), равно $0.2$ моль и равно общему количеству $Mg$ и $Fe$, можно обозначить через $х$ количество одного из металлов, например магния:
$ν(Mg)=x$ моль, тогда $ν(Fe)=(0.2-x)$ моль.
2. Определим массы металлов:
Ответ: состав смеси $m(Mg)=2.4$ г; $m(Fe)=5.6$ г.
Задача 2. При полном термическом разложении $6.6$ г смеси перманганата калия и нитрата натрия выделилось $0.7$ л кислорода (н. у.). В каком молярном соотношении были взяты исходные компоненты?
Смесь $(KMnO_4$ и $NaNO_3) =6.6$ г
Роль «реагента» в этой задаче выполняет нагревание. Для решения задачи необходимо вспомнить, какие продукты образуются при нагревании $KMnO_4$ и $NaNO_3$.
1. Запишем реакцию разложения:
2. Определим общее количество кислорода:
3. Из уравнений (1) и (2) суммарное количество $KMnO_4$ и $NaNO_3$ в два раза больше, чем количество кислорода:
$ν(KMnO_4) + ν(NaNO_2)=2·ν(O_2)=2·0.03$ моль$=0.06$ моль.
4. Определим массы веществ:
$ν(KMnO_4)=x$ моль, значит, $ν(NaNO_3)=(0.06-x)$ моль
Сумма масс $KMnO_4$ и $NaNO_3$ равна массе смеси:
$158х + 85(0.06-х)=6.6; 73х=1.5; х=0.02$ моль.
6. Определим молярное соотношение исходных компонентов смеси:
$(KMnO_4)=0.02$ моль; $(NaNO_3)=0.06-0.02=0.04$ моль;
Ответ: исходные компоненты смеси находятся в соотношении $<ν(KMnO_4)>/<ν(NaNO_3)>=1:2.$
Определение состава смеси, если ее компоненты выборочно взаимодействуют с указанными реагентами
Задача 1. $10$ г смеси порошков меди и алюминия обработали избытком раствора щелочи, выделилось $3.4$ л газа (н. у.). Определите состав смеси в массовых долях.
1. Запишем уравнение реакции.
Со щелочью взаимодействует только алюминий:
$2Al + 2NaOH + 2H_2O=2NaAlO_2 + 3H_2↑$
Молярное соотношение алюминия и водорода равно 2 : 3.
2.Определим количество водорода:
3. Определим массу алюминия: $m(Al)=ν(Al)·M(Al)=0.1$ моль$·27$ г/моль$=2.7$ г.
4. Определим массовую долю алюминия в смеси:
5. Определим массовую долю меди в смеси:
Ответ: массовые доли металлов в смеси $ω(Al)=27 %, ω(Cu)=73 %$.
Задача 2. $14$ г смеси ароматического углеводорода — гомолога бензола и фенола обработали бромной водой. При этом выпало $33.1$ г осадка. Определите структуру углеводорода, если его количество в исходной смеси равно $0.05$ моль. Вычислите массовые доли компонентов в смеси.
1. С бромной водой в смеси реагирует только фенол:
$C_2H_5OH + 3Br_2→C_6H_2Br_3OH↓ + 3HBr$.
2. Определим количество осадка $(C_6H_2Br_3OH)$:
$M(C_6H_2Br_3OH)=331$ г/моль; $M(C_6H_5OH)=94$ г/моль.
$m(C_6H_5OH)=ν(C_6H_5OH)·M(C_6H_5OH)=0.1$ моль$·94$ г/моль$=9.4$ г.
4. Определим массу ароматического углеводорода, состав которого выражается формулой $С_Н_<2n-6>$:
$m(С_nН_<2n-6>)=m$(смеси)$-m(C_6H_5OH)=14 г-9.4 г=4.6$ г.
5. Вычислим молярную массу углеводорода:
6. Теперь нужно определить значение $n$ в формуле $С_Н_<2n-6>$. Очевидно, что молярная масса равна:
Приравняем правые части равенств (3) и (4):
7. Определим формулу углеводорода и массовые доли компонентов в смеси.
Формула углеводорода С7Н6.
Ответ: массовая доля фенола в смеси $67 %$, ароматического углеводорода — $33 %$.
Определение состава смеси с неизвестной массой
Задача. При обработке смеси гидроксида калия и гидрокарбоната калия избытком соляной кислоты образовалось $59.6$ г хлорида калия и выделилось $4.5$ л газа (н. у.). Определите массовую долю гидрокарбоната калия в исходной смеси.
1. $KOH$ и $KHCO_3$ взаимодействуют с соляной кислотой и образуют $KCl$.
$KHCO_3 + HCl=KCl + H_2O + CO_2↑$ (2)
2. Определяем общее количество $KCl$ в реакциях (1) и (2) и количество $СО_2$, выделившегося в реакции (2):
Из уравнения (2) количество и масса $KHCO_3$ в смеси равны:
$m(KHCO_3)=ν(KHCO_3)·M(KHCO_3)=0.2$ моль$·100$ г/моль$=20$ г.
4. Определим количество $KCl$, образовавшегося в реакциях (2) и (1):
5. Определим количество KOH из уравнения (1) и массу $KOH$:
$m(KOH)=ν(KOH)·M(KOH)=0.6$ моль$·56$ г/моль$=33.6$ г.
6. Вычислим массу смеси: $m$(смеси)$=m(KOH) + m(KHCO_3)=33.6 г + 20 г=53.6$ г.
7. Определим массовую долю $KHCO_3$ в смеси:
Ответ: массовая доля гидрокарбоната калия в смеси равна $37.3%.$
Решение задач на смеси, если их компоненты имеют одинаковые молярные массы
Задача. К смеси карбоната кальция и гидрокарбоната калия массой $20$ г добавили избыток соляной кислоты. Образовавшийся газ пропустили через избыток баритовой воды. Определите массу образовавшегося при этом осадка.
В условии задачи указана общая масса смеси, но не указан ее состав. Обратите внимание на то, что в задаче не требуется определить состав смеси. В данном случае состав смеси не имеет $m$(осадка)-? значения, и по данным, приведенным в условии, не может быть определен. Дело в том, что $СаСО_3$ и $KHCO_3$ имеют одинаковую молярную массу:
1. Определим суммарное количество моль компонентов смеси:
2. Запишем уравнение реакции:
$CaCO_3 + 2HCl=CaCl_2 + H_2O + CO_2↑$ (1)
$KHCO_3 + HCl=KCl + H_2O + CO_2↑$ (2).
Молярные соотношения между $СаСО_3$ и $СО_2$, а также между $KHCO_3$ и $СО_2$ одинаковы:
3. Определим общее количество $СО_2$, выделившегося в первой и во второй реакциях:
$ν(CO_2)=ν(CaCO_3) + ν(KHCO_3)=0.2$ моль.
4. Оксид углерода (IV) при взаимодействии с баритовой водой образует нерастворимый карбонат бария: $CO_2 + Ba(OH)_2=BaCO_3↓ + H_2O$. (3)
5. Определим количество вещества карбоната бария:
$ν(BaCO_3)=ν(CO_2)=0.2$ моль (из уравнения (3)).
6. Вычислим массу осадка: $M(BaCO_3)=197$ г/моль
$m(BaCO_3)=m(BaCO_3)·M(BaCO_3)=0.2$ моль$·197$ г/моль$=39.4$ г.
Ответ: масса образовавшегося осадка равна $39.4$ г.
Источник статьи: http://examer.ru/ege_po_himii/teoriya/raschety_massovoj_doli_ximicheskogo_chast_c
Вычисление массовой доли вещества в растворе.
После пропускания через раствор гидроксида натрия 6,72 л оксида углерода (IV) (н.у.) получили 159 г раствора карбоната натрия. Вычислите массовую долю соли в полученном растворе.
Молярный объём 1 моля любого газа при н.у. = 22,4 л/моль
- Составляем молекулярное уравнение.
- Расставляем коэффициенты в уравнении.
- Подчёркиваем вещества, о которых идёт речь.
- Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.
Молярная масса численно равна относительной молекулярной массе, поэтому её можно найти путём складывания относительных атомных масс элементов с учёт индексов
Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
- Подписываем молярные массы или молярные
объёмы под формулами веществ
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти. Если по условию задачи нужно найти массовую долю, то над веществом пишем массу и находим её.
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Подставляем данные и находим массу
Записываем ответ: w (Na2CO3) = 20%
Вычисление массы раствора.
Массовую долю из процентов переводим в целое число, разделив на 100.
К раствору с массовой долей гидроксида калия 3% добавили избыток раствора сульфата меди(II). При этом образовался осадок массой 5,3 г. Определите массу исходного раствора щёлочи.
- Составляем молекулярное уравнение.
- Расставляем коэффициенты в уравнении.
- Подчёркиваем вещества, о которых идёт речь.
Молярную массу или молярный объём находим с учётом коэффициента перед формулой
Если понять, то задача очень даже легкая
Сначала напишем уравнение
FeCl3- хлорид железа(3)
KOH- гидроксид калия
FeCl3 + 3KOH = Fe(OH)3 + 3KCl
Fe(OH)3 — осадок бурого цвета
Масса- это произведения количества вещества на молярную массу
Молярная масса гидроксида железа 3 равна 56+ 16+ 16+ 16+ 1+1 +1 = 107 г/моль
Количества гидроксида найдем через хлорид железа
Количество хлорида железа равно 300г умножить на 0,06 разделить на 162,5 г/моль(молярная масса хлорида железа) равно 0,11 моль
Количество гидроксида железа по уравнению равно количеству хлорида железа и это 0,11 моль
Получаем, что масса осадка равна 0,11 моль умножить на 107 г/моль равно 11,77 г
Найди верный ответ на вопрос ✅ «Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5% раствора нитрата цинка с избытком раствора сульфида натрия. …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5% раствора нитрата цинка с избытком раствора сульфида натрия.
2022-10-20
Вычислите, какая масса нитрата калия выпадет в осадок, если 100 г насыщенного при температуре $70^{ circ } С$ раствора $KNO_{3}$ охладить до температуры $0^{ circ } С$. Растворимость нитрата калия составляет 138 г при температуре $70^{ circ } С$ и 13,3 г при температуре $0^{ circ } С$.
Решение:
При решении данного типа задач обратите внимание на то, что при охлаждении насыщенного раствора происходит выпадение осадка из-за уменьшения растворимости вещества. Масса воды при этом остается постоянной, если соль не образует кристаллогидрата.
Находим массу соли в насыщенном растворе массой 100 г при $70^{ circ} С$.
По формуле
$s^{70} = frac{m^{70}(KNO_{3})}{m(H_{2}O )} cdot 100 = frac{m^{70}(KNO_{3} )}{m(р-ра) — m^{70}(KNO_{3})} cdot 100 Rightarrow m^{70}(KNO_{3} ) = frac{s^{70} cdot (m(р-ра) — m^{70}(KNO_{3} ) ) }{100} = frac{138 cdot (100 — m^{70}(KNO_{3})}{100}$,
отсюда $m^{70}(KNO_{3}) = 57,98 г$.
Или по формуле
$m^{70} (KNO_{3} ) = frac{s^{70} cdot m(р-ра) }{s^{70} + 100 } = frac{138 cdot 100}{138 + 100} = 57,98 г$.
Находим массу воды в насыщенном растворе массой 100 г:
$m(H_{2}O) = m(р-ра) — m^{70}(KNO_{3}) = 100 — 57,98 = 42,02 г$.
Находим массу соли в растворе при $0^{ circ } С$:
$s^{0} = frac{m^{0}(KNO_{3} )}{m(H_{2}O )} cdot 100 Rightarrow m^{0} (KNO_{3} ) = frac{s^{0} cdot m(H_{2}O ) }{100} = frac{13,3 cdot 42,02}{100} = 5,59 г$.
Находим массу соли, выпавшей в осадок:
$m(осадка : KNO_{3}) = m^{70}(KNO_{3}) — m^{0}(KNO_{3}) = 57,98 — 5,59 = 52,39 г$.
Ответ: $m(осадка : KNO_{3}) = 52,39 г$.