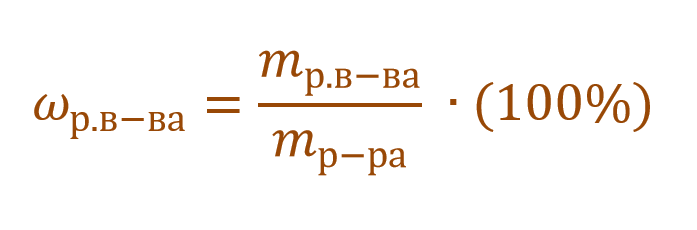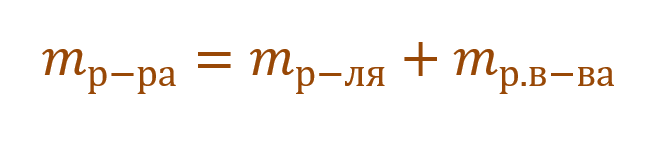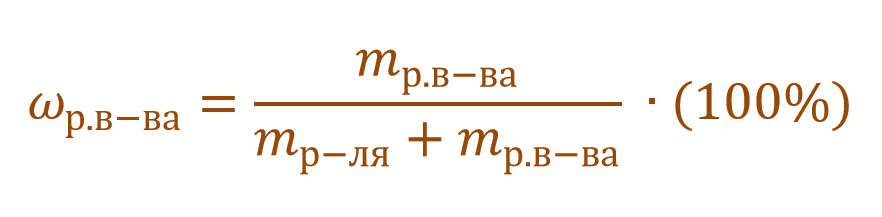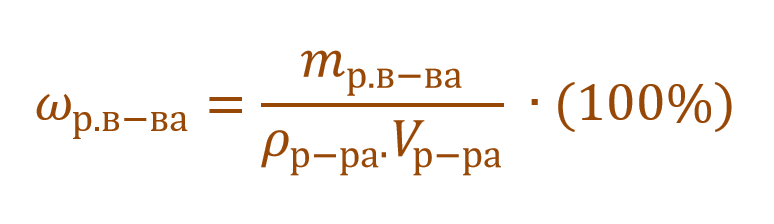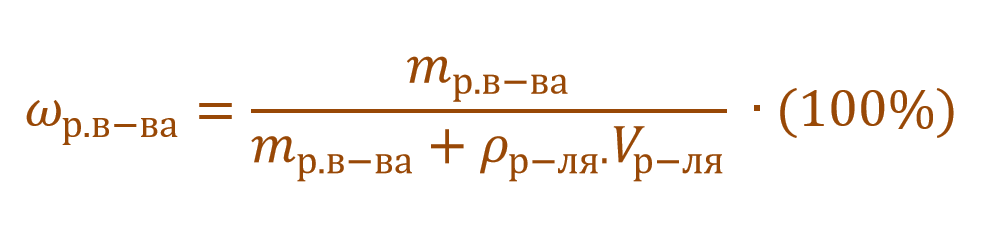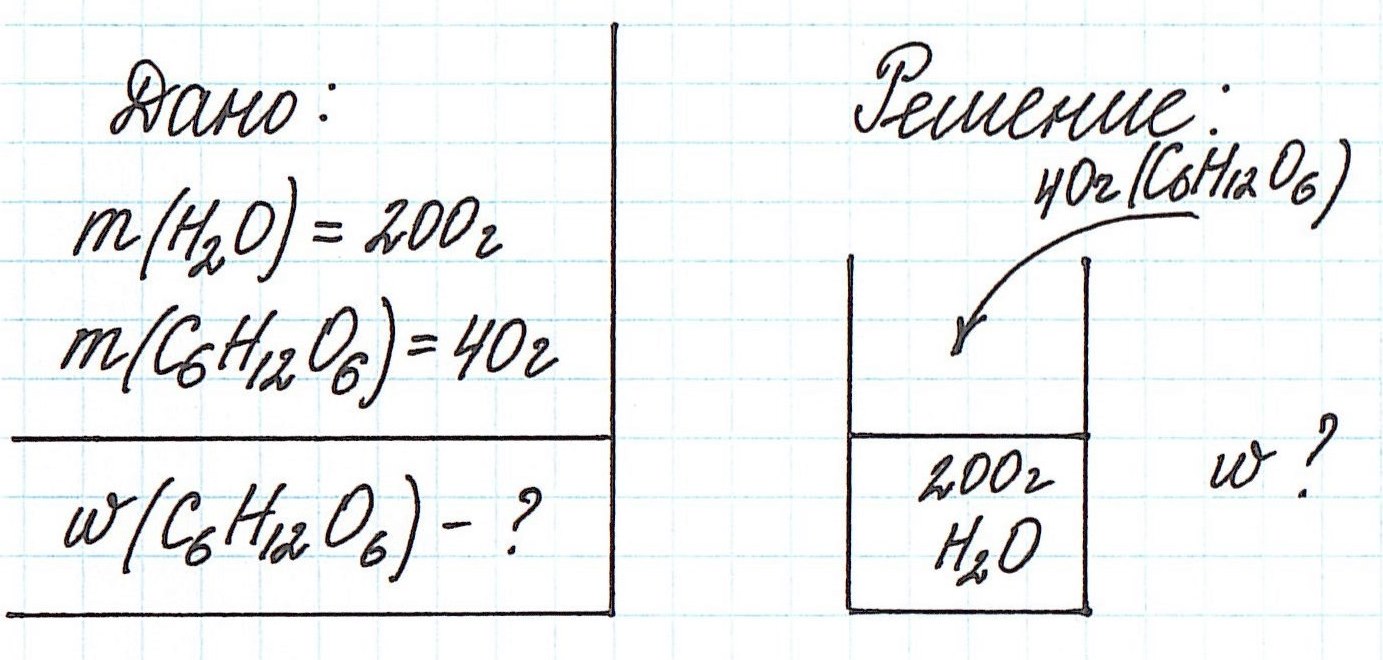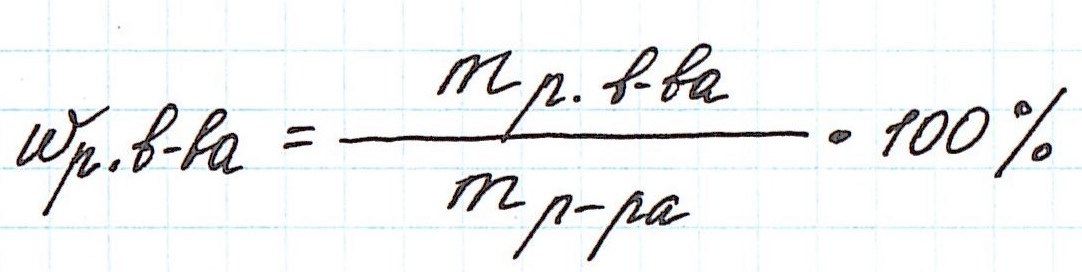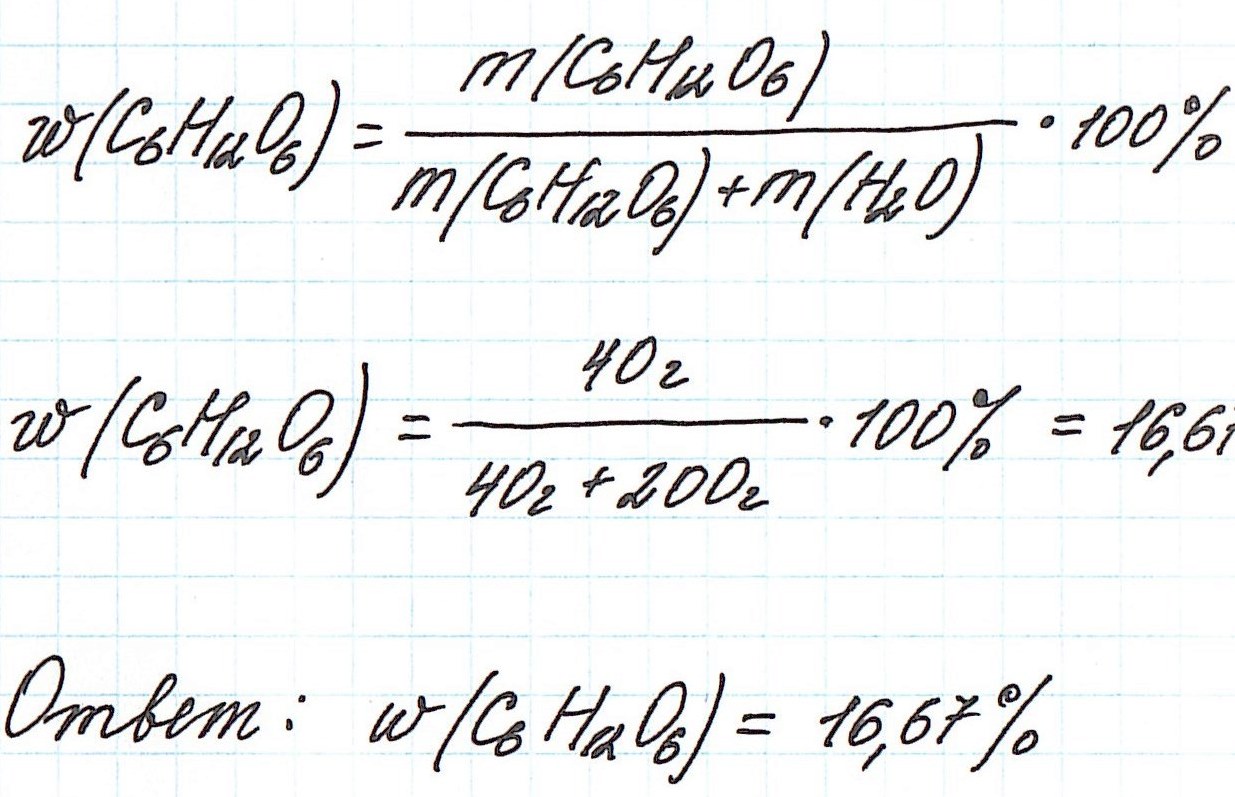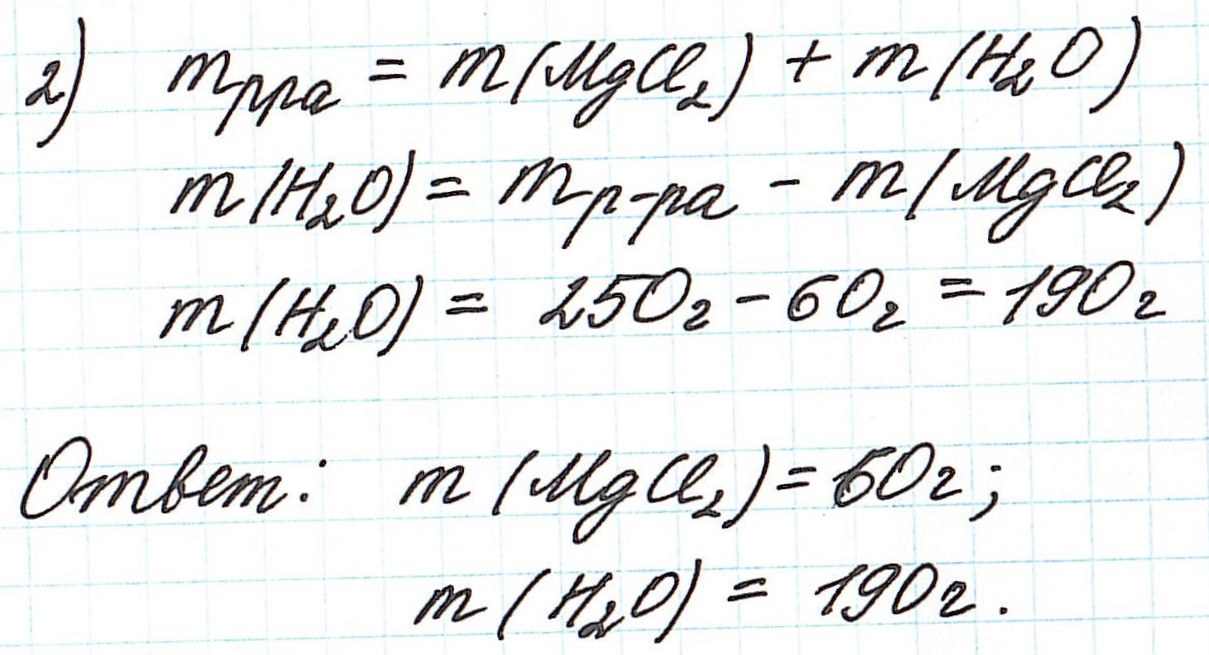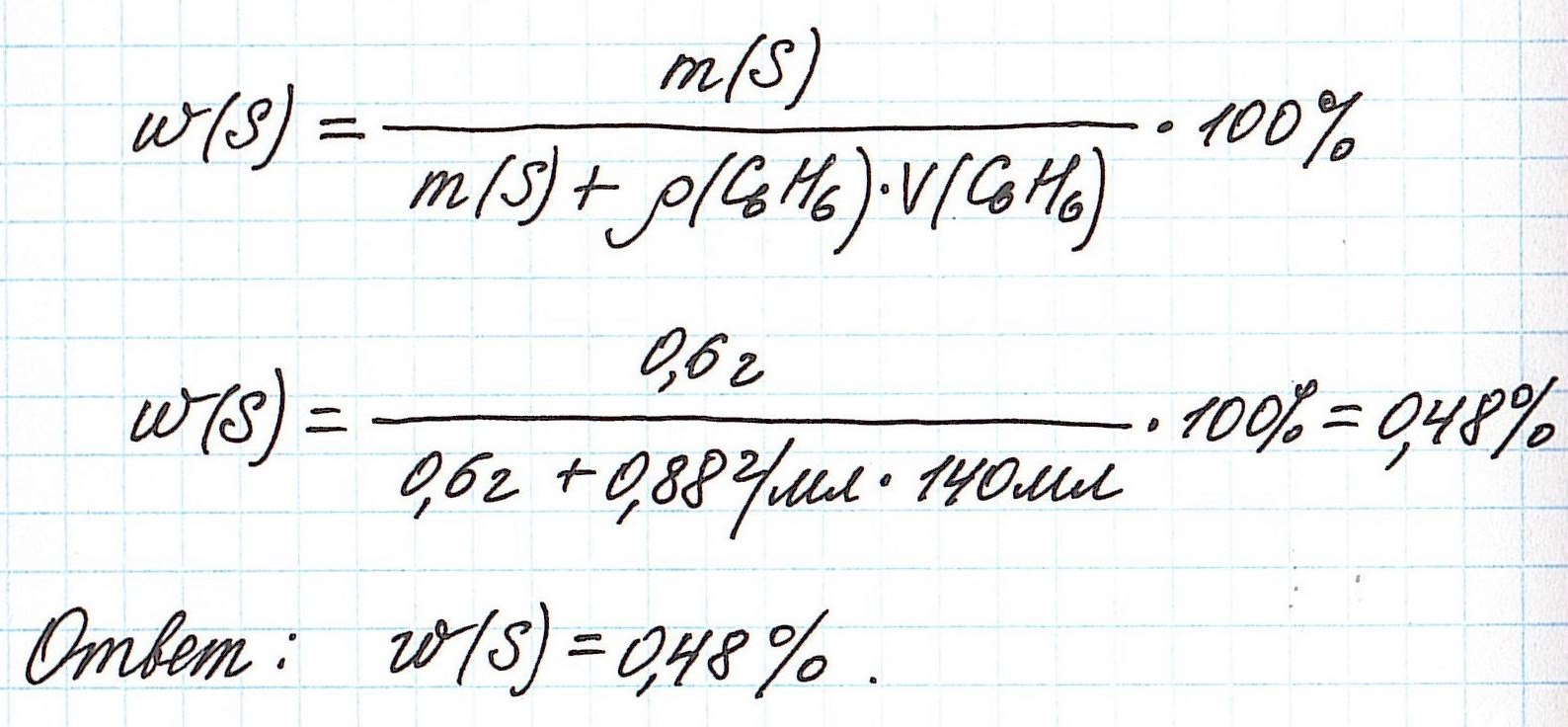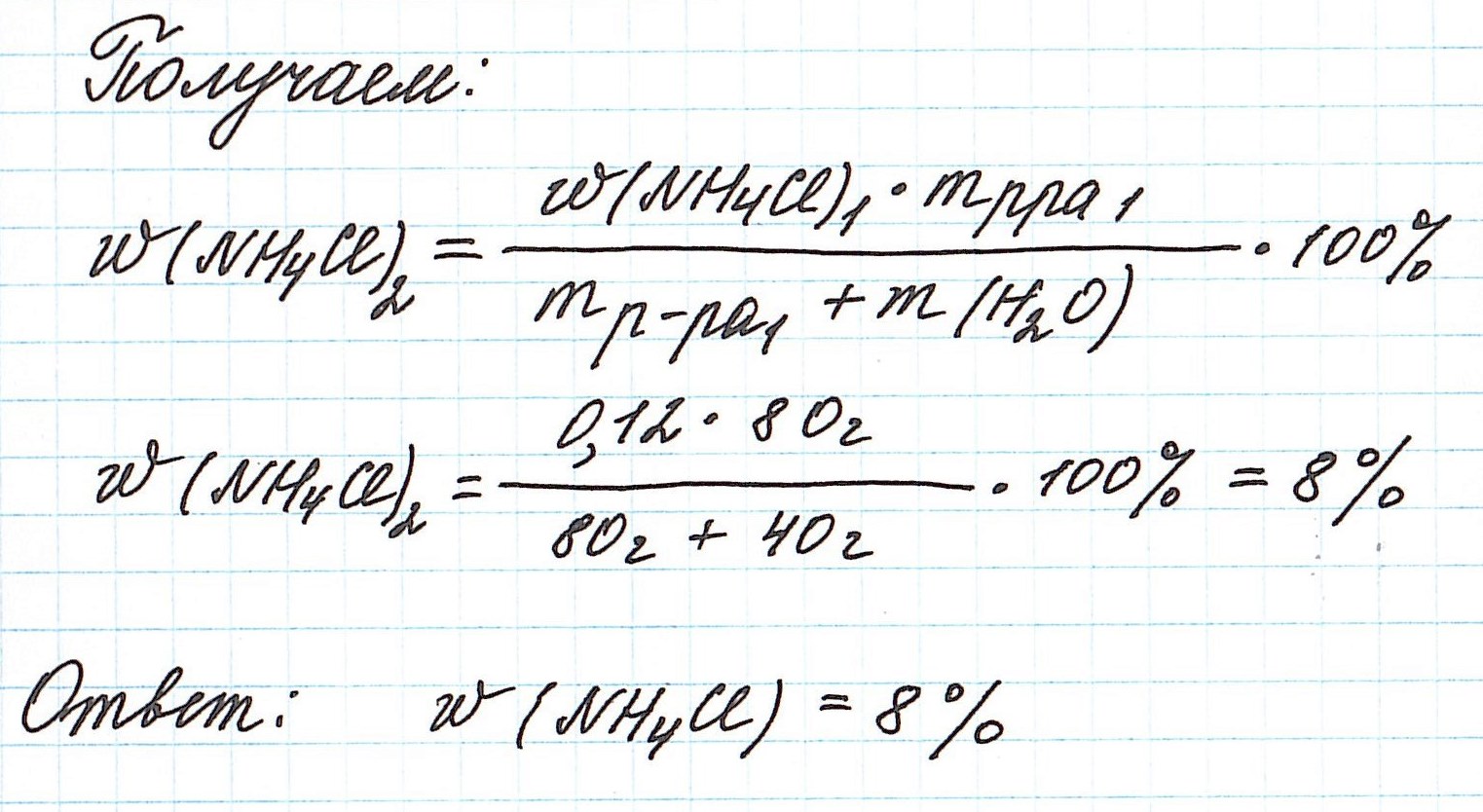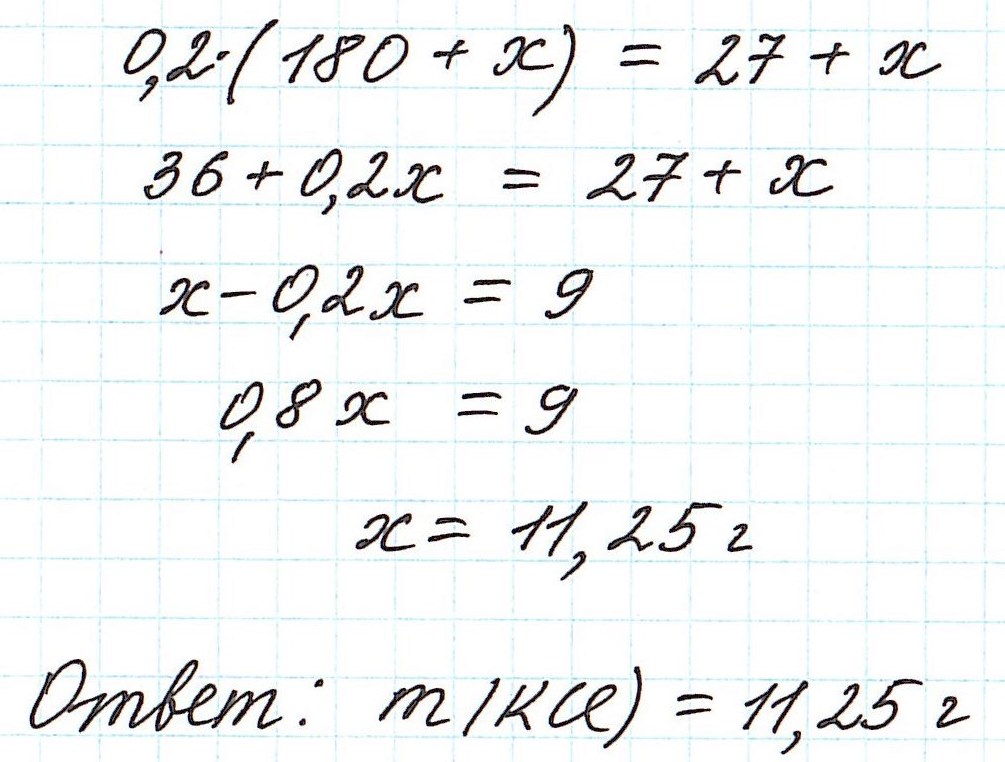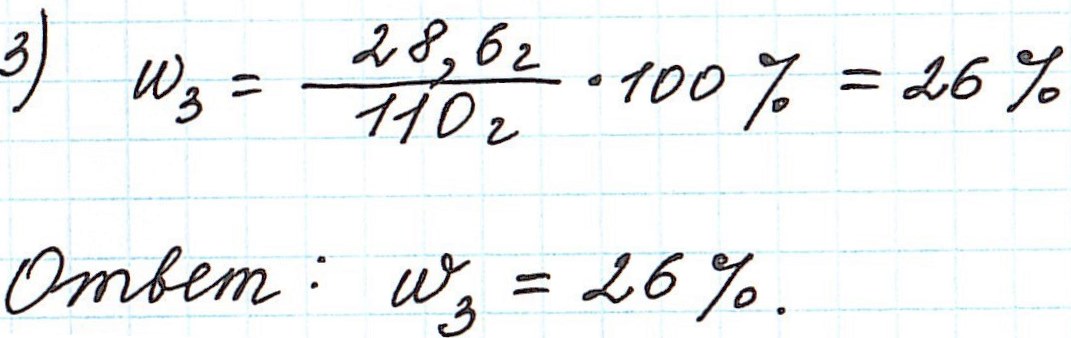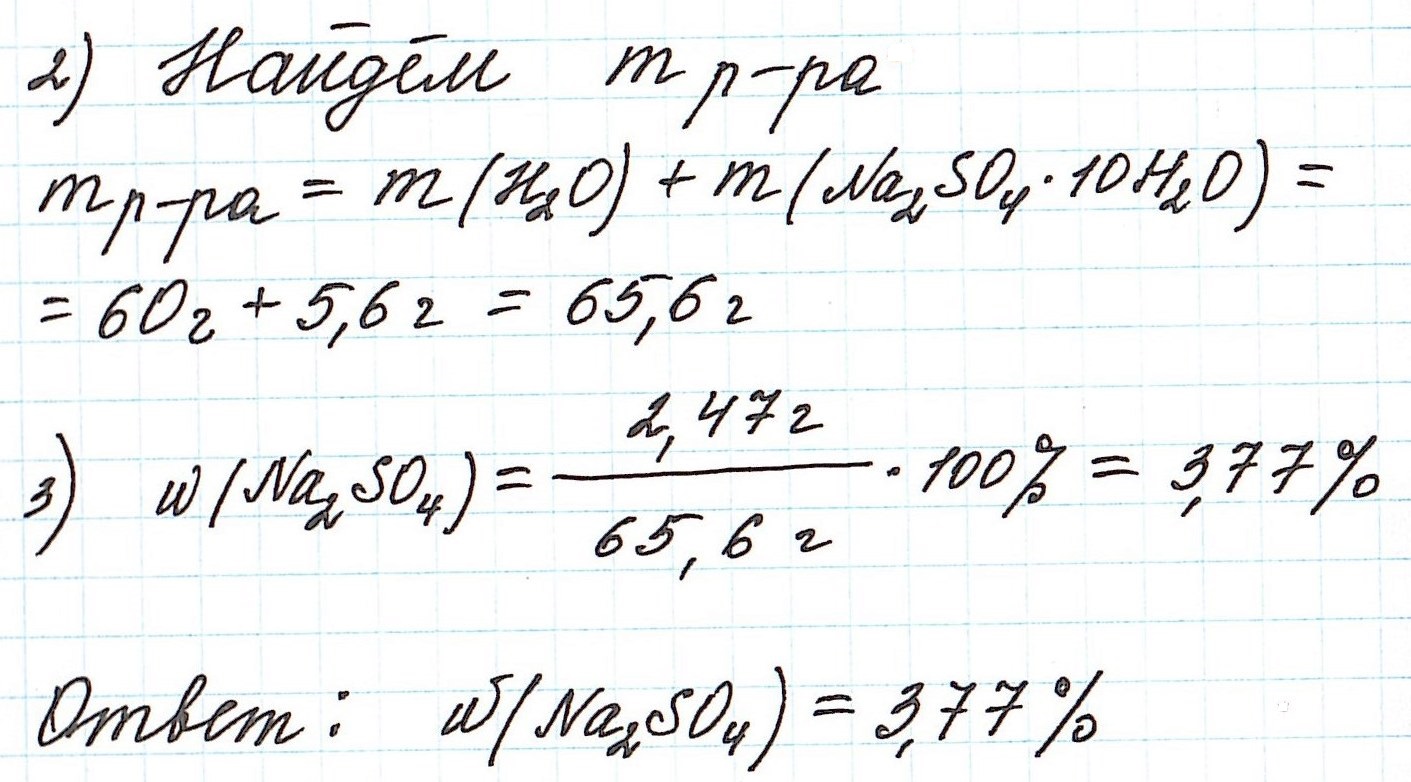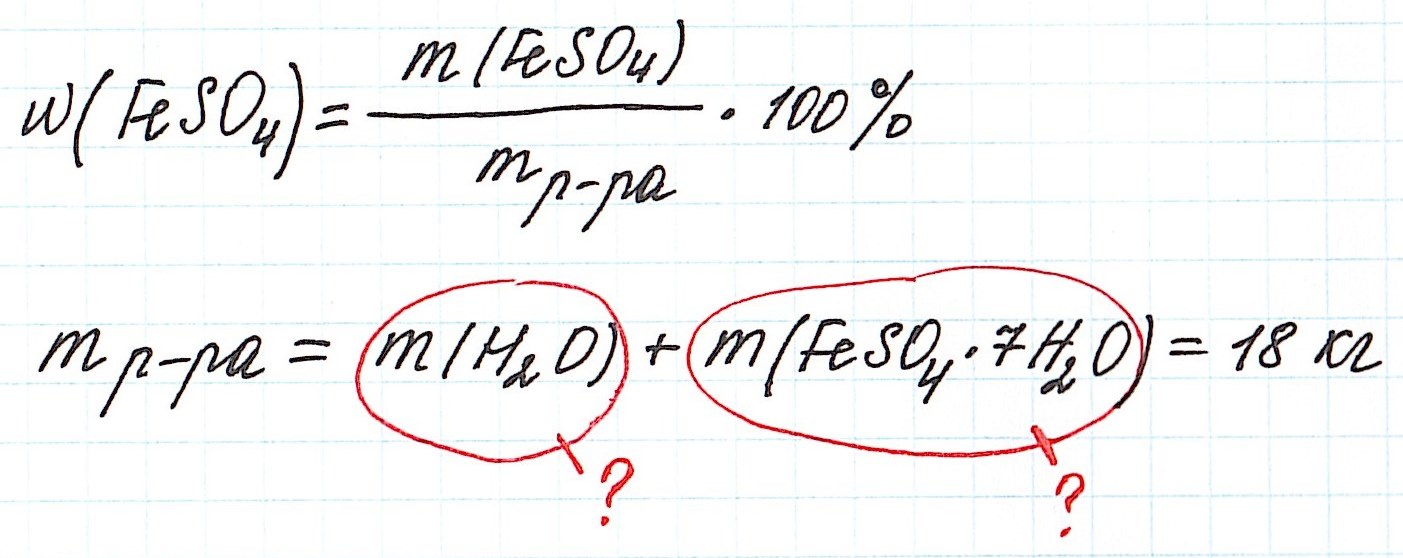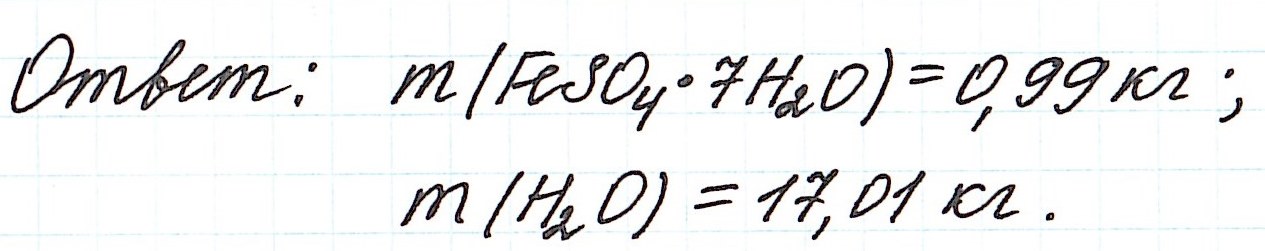ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
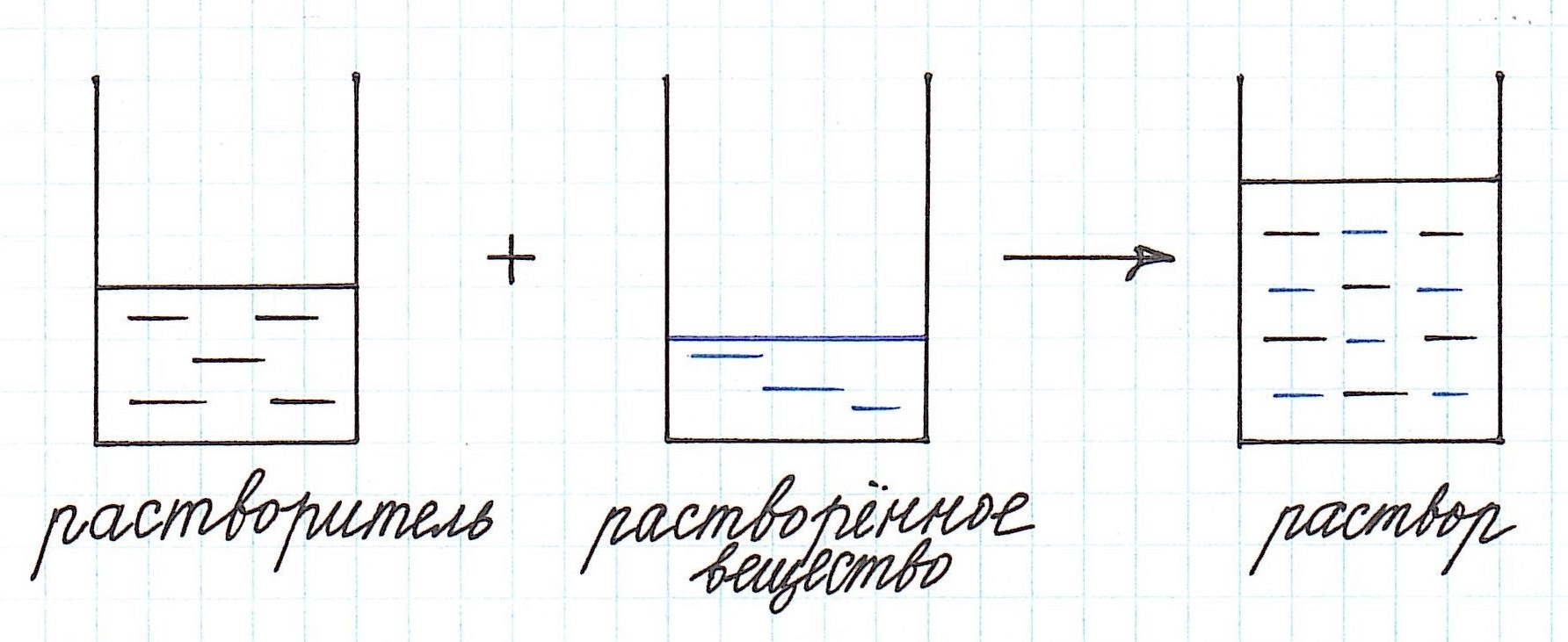
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
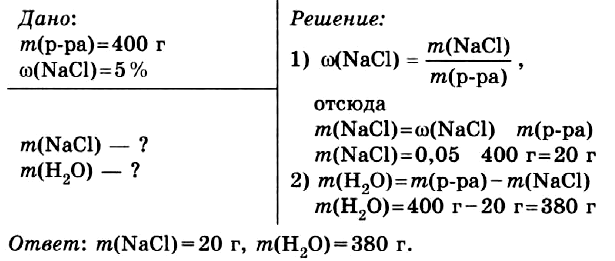
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Большинство реактивов продаётся в сухом виде: это или порошок, или мелкие гранулы. Однако используются реактивы чаще всего в виде растворов. Поэтому один из самых частых вопросов от наших покупателей – как из сухого вещества сделать раствор нужной концентрации.
Напоминаем, что все работы с химическими веществами следует проводить с соблюдением необходимых мер безопасности! Используйте средства индивидуальной защиты органов дыхания, глаз и кожных покровов!
В зависимости от способа и методики приготовления растворы можно разделить на приблизительные и точные. Вторые можно приготовить только в лабораторных условиях с использованием дорогостоящего оборудования и посуды.
С другой стороны, “точности” приблизительных растворов вполне достаточно для проведения домашних опытов, удаления ржавчины или загрязнения, очистки или обеззараживания воды в аквариуме или в бассейне, для таких хобби, как химическая металлизация, печать фотографий, выращивание кристаллов, изготовления мыла и свечей и многих других целей.
Растворение химических веществ может производится в разных средах – воде, спирте, кислотах и т.д. В этой статье мы будем говорить только о растворении в воде.
Что такое концентрация раствора?
Концентрацию раствора выражают в процентах, например 10% раствор или 0,5% раствор. Эта цифра показывает, сколько частей вещества приходится на 100 частей раствора.
Так, в 100 граммах 10%-го раствора поваренной соли находится 10 грамм соли и 90 грамм воды. А в 500 граммах 30%-го раствора гидроксида натрия содержится 150 грамм NaOH и 350 грамм воды. Один килограмм 0,2%-го раствора нитрата серебра состоит из 2 грамм нитрата серебра и 998 грамм воды.
Отметим, что существует разница между массовой концентрацией и объемной концентрацией растворов, и эта разница тем больше, чем больше концентрация растворенного вещества и плотность раствора.
Например, чтобы приготовить 1 килограмм 15%-го раствора NaCl нужно смешать 150 грамм соли и 850 грамм воды. Для приготовления же 1 литра 15%-го раствора NaCl понадобится уже 166,2 грамм NaCl и 941,8 грамм воды (при растворении соли в воде объём раствора несколько увеличится), и плотность увеличится с 1,000 (на самом деле 0,998) до 1,108.
Объясняется такая разница тем, что плотность солевого раствора выше, чем плотность чистой воды.
В этой статье, для упрощения, речь всегда будет идти о массовой концентрации раствора, то есть вес раствора будем измерять в граммах, а не в миллилитрах.
Приготовление водного раствора из сухого безводного реактива
Прежде всего, определитесь – какой вес раствора вам понадобится. Если раствор этого вещества нестабилен или он вам нужен для какой-то разовой работы – готовьте столько раствора, сколько нужно сейчас. Если же раствор хорошо хранится и используется время от времени, можно приготовить его с запасом.
Теперь рассчитаем количество вещества, которое нужно взять для приготовления определенной массы раствора определённой концентрации:
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Соответственно, масса воды вычисляется как разница между общей массой раствора и массой сухого вещества.
Пример 1: приготовим 5%-й раствор гидроксида натрия (NaOH) массой 500 грамм.
Масса NaOH = (5) * (500 гр/100) = 25 грамм.
Масса воды = 475 грамм.
Пример 2: приготовим 37%-й раствор аммония фосфорнокислого (NH4H2PO4) массой 750 грамм.
Масса (NH4H2PO4) = (37) * (750 гр/100) = 277,5 грмм.
Масса воды = 472,5 грамм.
Остаётся растворить навеску сухого реактива в рассчитанном объёме воды.
Приготовление раствора из водных солей (кристаллогидратов)
Откуда взялась вода в сухом реактиве и что такое “водность” вещества – можно прочитать здесь…
Если вам нужно приготовить раствор из вещества, содержащего кристаллизационную воду (например, медный купорос CuSO4*5H2O, хромокалиевые квасцы KCr(SO4)2*12H2O и тому подобные вещества), то методика расчетов меняется, чтобы учесть уже имеющуюся в веществе воду.
Опять же, начинаем с определения массы раствора, который мы хотим приготовить. Затем вычисляем, сколько вещества должно содержаться в растворе такой массы нужной нам концентрации – формула та же, что и при использовании безводных реактивов.
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Далее, пересчитываем массу вещества на кристаллогидрат. Для этого в справочниках (Яндекс или Google – наше всё) находим молярные массы безводной формы этого вещества и кристаллогидрата и вычисляем соотношение – сколько вещества в безводной форме содержится в кристаллогидрате. Так, если молярная масса кристаллогидрата 150 грамм/моль, а безводная форма этого вещества имеет молярную массу 70 грамм/моль, это значит, что в 150 грамм кристаллогидрата содержатся 70 грамм безводной формы вещества.
Определив, какое количество кристаллогидрата вещества нам нужно растворить, вычисляем необходимую массу воды.
Пример 1. Приготовим 500 грамм 15%-го раствора карбоната натрия 10-водного Na2CO3∙ 10H2O
Определяем массу карбоната натрия в 500 граммах 15%-го раствора:
Na2CO3 = (15) * (500 гр/100) = 75 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса Na2CO3 = 106 грамм/моль, молярная масса Na2CO3∙ 10H2O = 286 грамм/моль. Таким образом, 286 грамм карбоната натрия 10-водного содержат 106 грамм карбоната натрия безводного.
Нам нужно, чтобы в растворе оказалось 75 грамм карбоната натрия безводного. Составляем пропорцию и получаем, что нужно взять 202 грамма карбоната натрия 10-водного.
Последний шаг – посчитать нужное количество воды. 500 грамм минус 202 грамма = 298 грамм воды.
Пример 2. Приготовим 1000 грамм 3%-го раствора сульфата магния 7-водного MgSO4∙ 7H2O
Определяем массу сульфата магния в 1000 граммах 3%-го раствора:
MgSO4 = (3) * (1000 гр/100) = 30 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса (MgSO4) = 120 грамм/моль, молярная масса (MgSO4∙ 7H2O) = 246 грамм/моль.
Вычисляем, что для того, чтобы получить в растворе 30 грамм сульфата магния нужно взять 62 грамма сульфата магния 7-водного.
Смешиваем 938 грамм воды и 62 грамма сульфата магния 7-водного, получаем нужный результат.
Как найти массу растворенного вещества
Бывает, что возникает такая задача: как найти массу вещества, содержащегося в том или ином объеме раствора? Ход ее решения зависит от того, какими исходными данными вы располагаете. Оно может быть и очень простым, буквально в одно действие, и более сложным.

Инструкция
Например, вам надо узнать, какое количество поваренной соли содержится в 150 миллилитрах 25%-го раствора. Решение: 25%-й раствор – это значит, что в 100 миллилитрах раствора содержится 25 грамм растворенного вещества (в данном случае поваренной соли). В 150 миллилитрах, соответственно, в полтора раза больше. Произведите умножение: 25* 1,5 = 37,5. Вот и ответ: 37,5 грамм поваренной соли.
Немного видоизмените условия задачи. Предположим, вам даны те же 150 миллилитров раствора поваренной соли. Но вместо массовой концентрации известна молярная – 1 М. Сколько поваренной соли содержится в растворе в этом случае? И здесь нет ничего сложного. Прежде всего, вспомните химическую формулу поваренной соли: NaCl. Заглянув в таблицу Менделеева, уточните атомные массы (округленные) элементов, составляющих это вещество: натрия – 23, хлора – 35,5. Следовательно, молярная масса поваренной соли – 58,5 г/моль.
А что такое молярная концентрация? Это – количество молей растворенного вещества в 1 1 литре 1-молярного раствора поваренной соли содержалось бы 58,5 грамм этого вещества. Сколько же его содержится в 150 миллилитрах? Произведя умножение, получите: 58,5* 0,15 = 8,775 г. Если вам не нужна высокая точность, можно принять результат за 8,78 грамм или за 8,8 грамм.
Предположим, вам известен точный объем раствора и его плотность, но неизвестна концентрация вещества. Как в таком случае определить его количество в растворе? Тут решение займет немного больше времени, но опять-таки не вызовет затруднений. Надо лишь найти любой справочник, где есть таблицы плотностей растворов. Для каждого показателя плотности там приведены соответствующие значения его массовой и молярной концентраций.
Например: даны 200 миллилитров водного раствора вещества Х, с плотностью 1,15 г/мл. По таблице растворимости вы выяснили, что такая плотность соответствует 30%-й концентрации раствора. Сколько вещества Х находится в растворе? Решение: если в 100 миллилитрах раствора содержалось бы 30 грамм вещества Х, то в 200 миллилитрах: 30*2 = 60 грамм.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
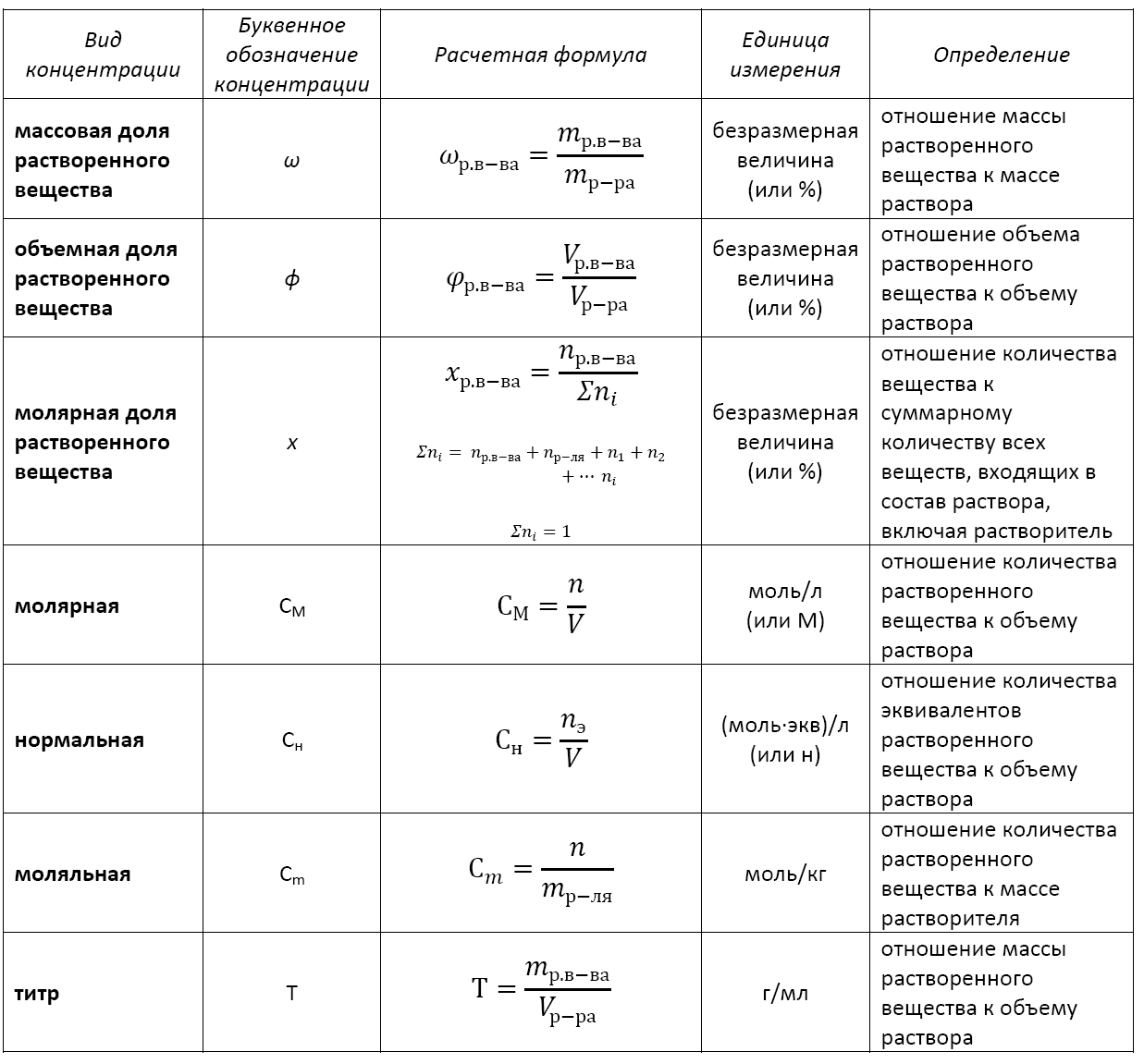
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
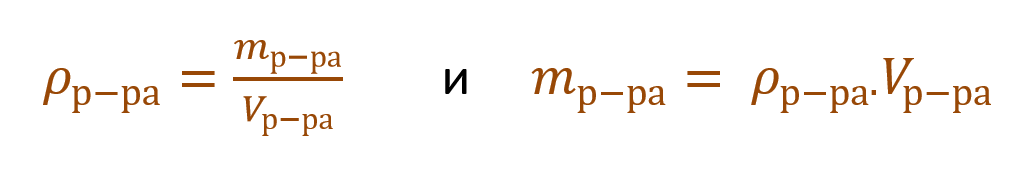
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
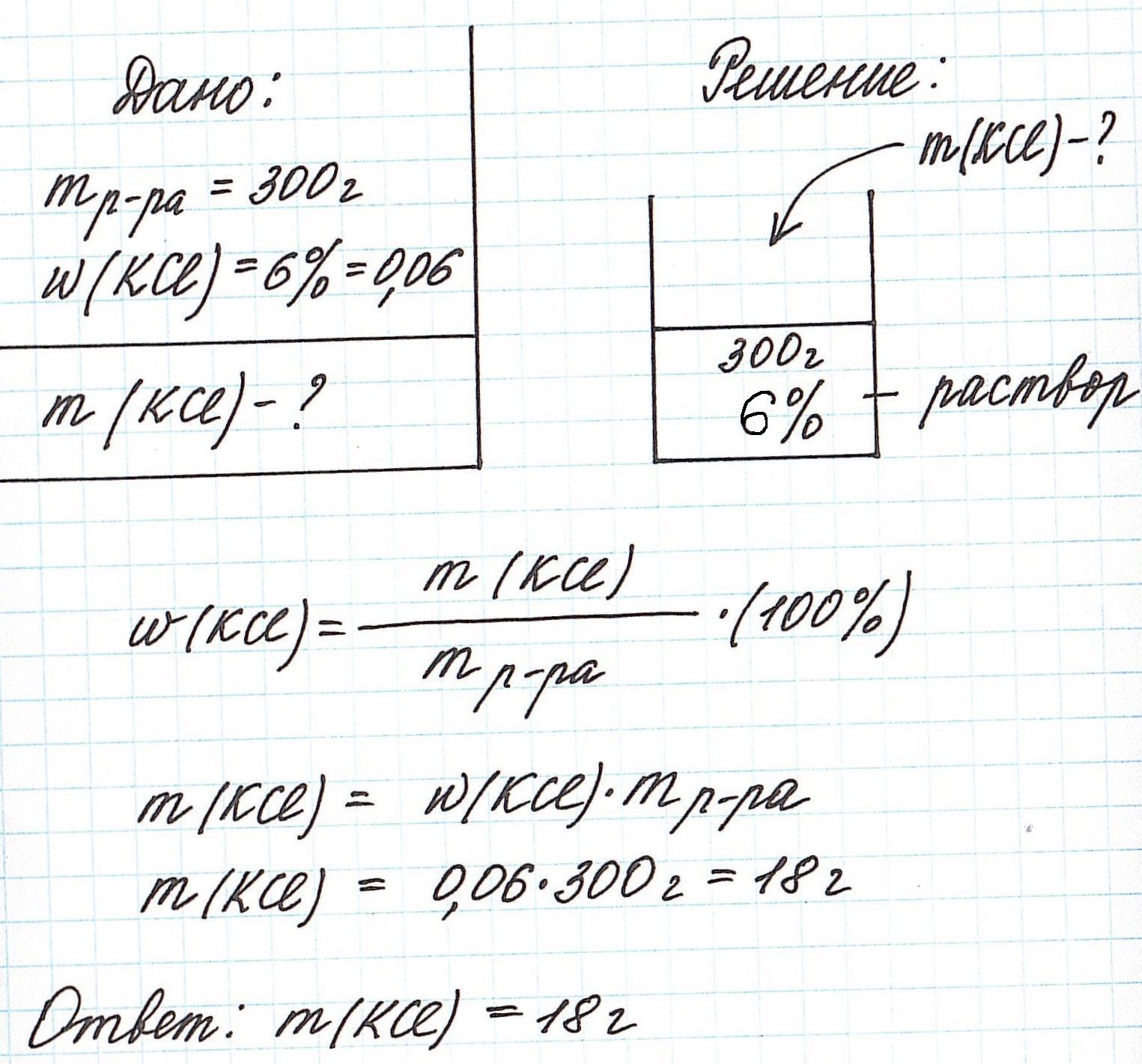
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
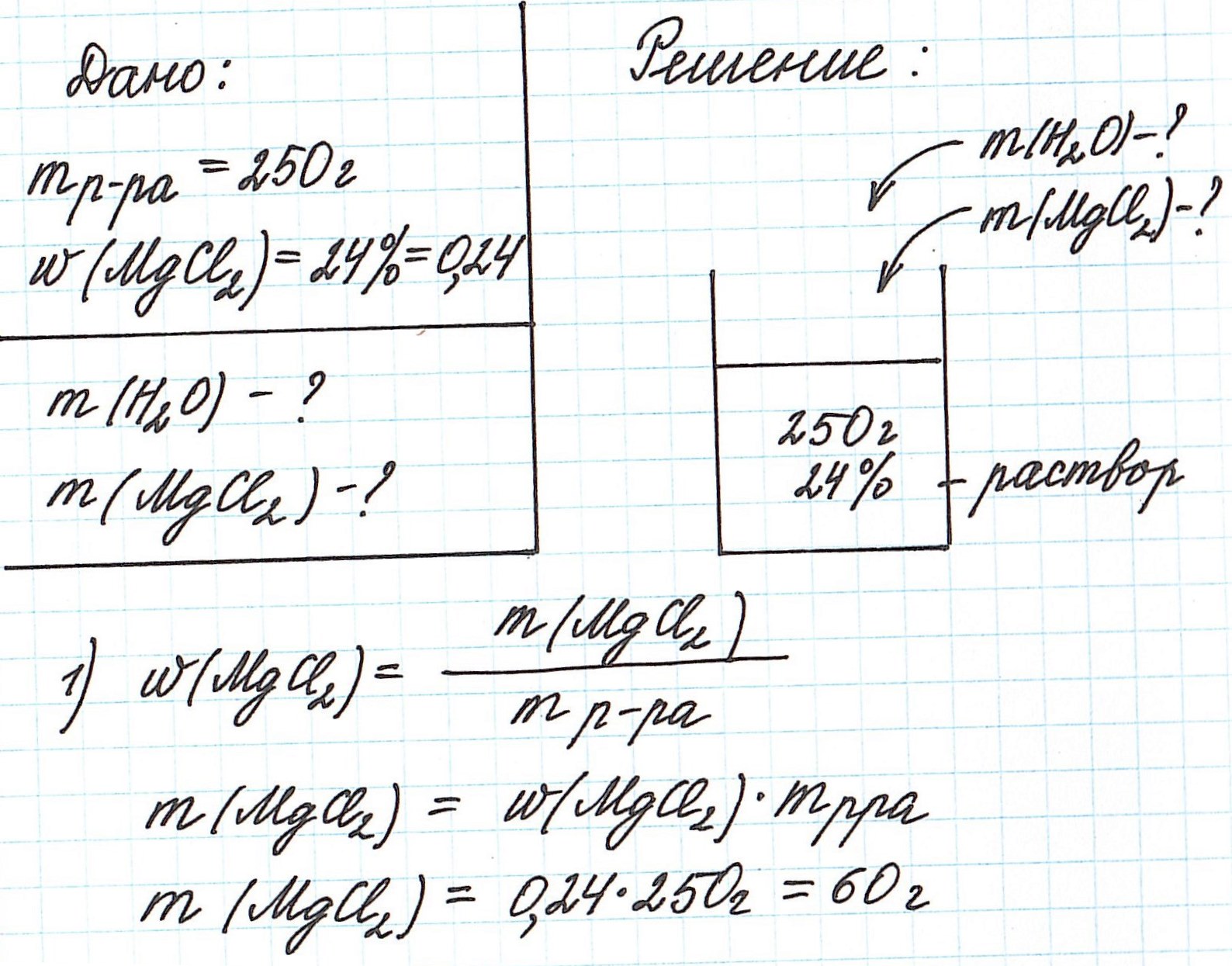
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
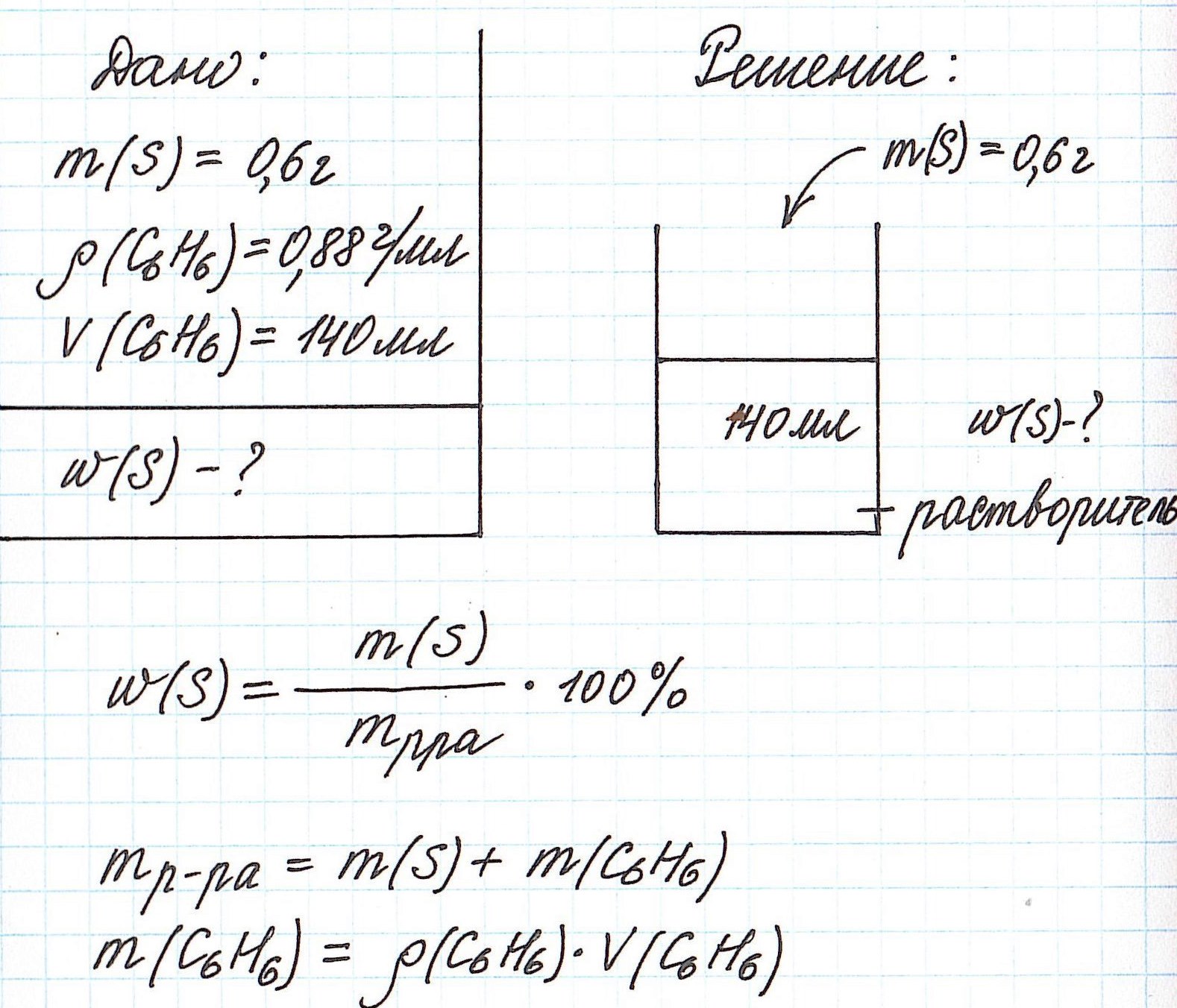
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
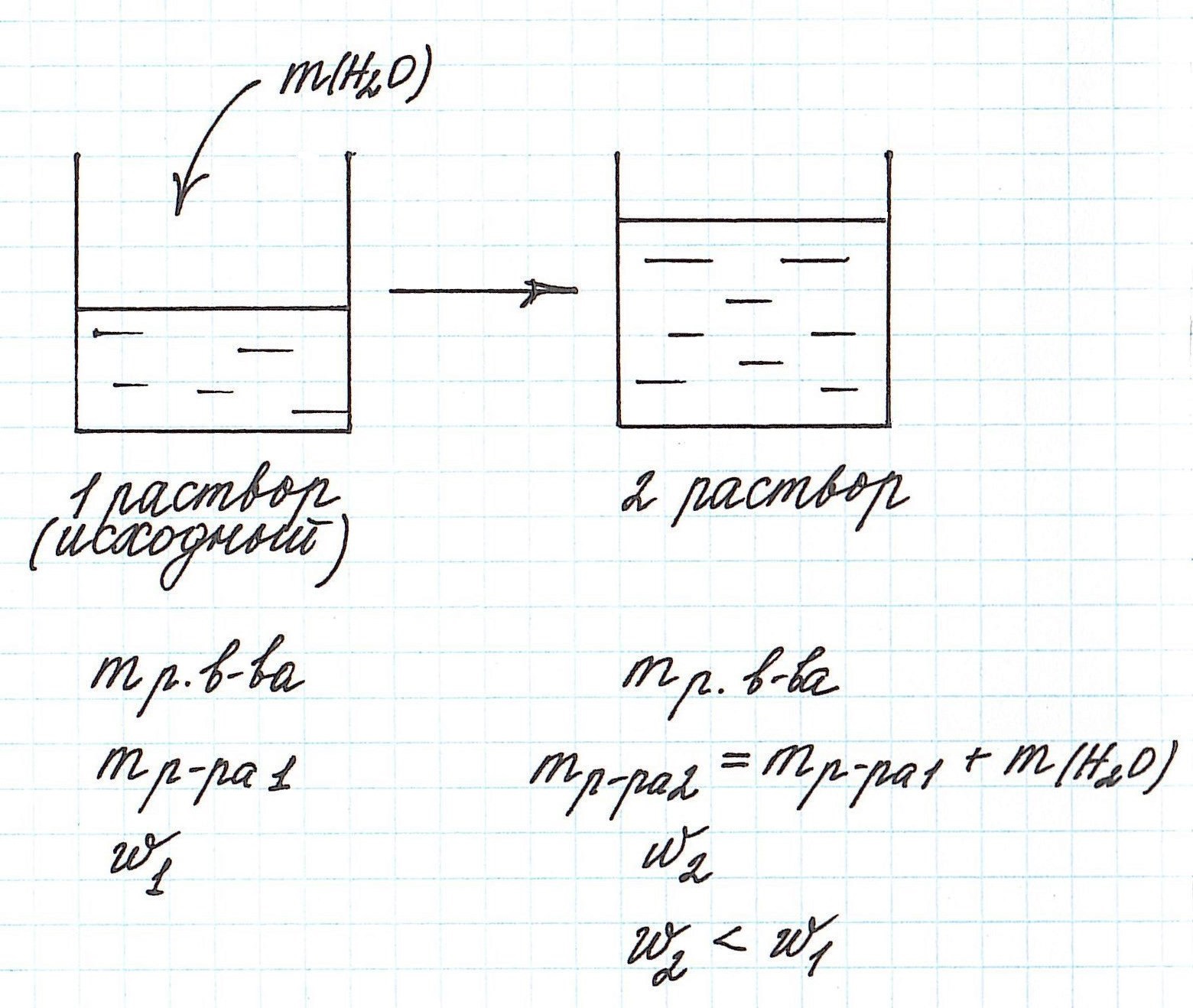
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
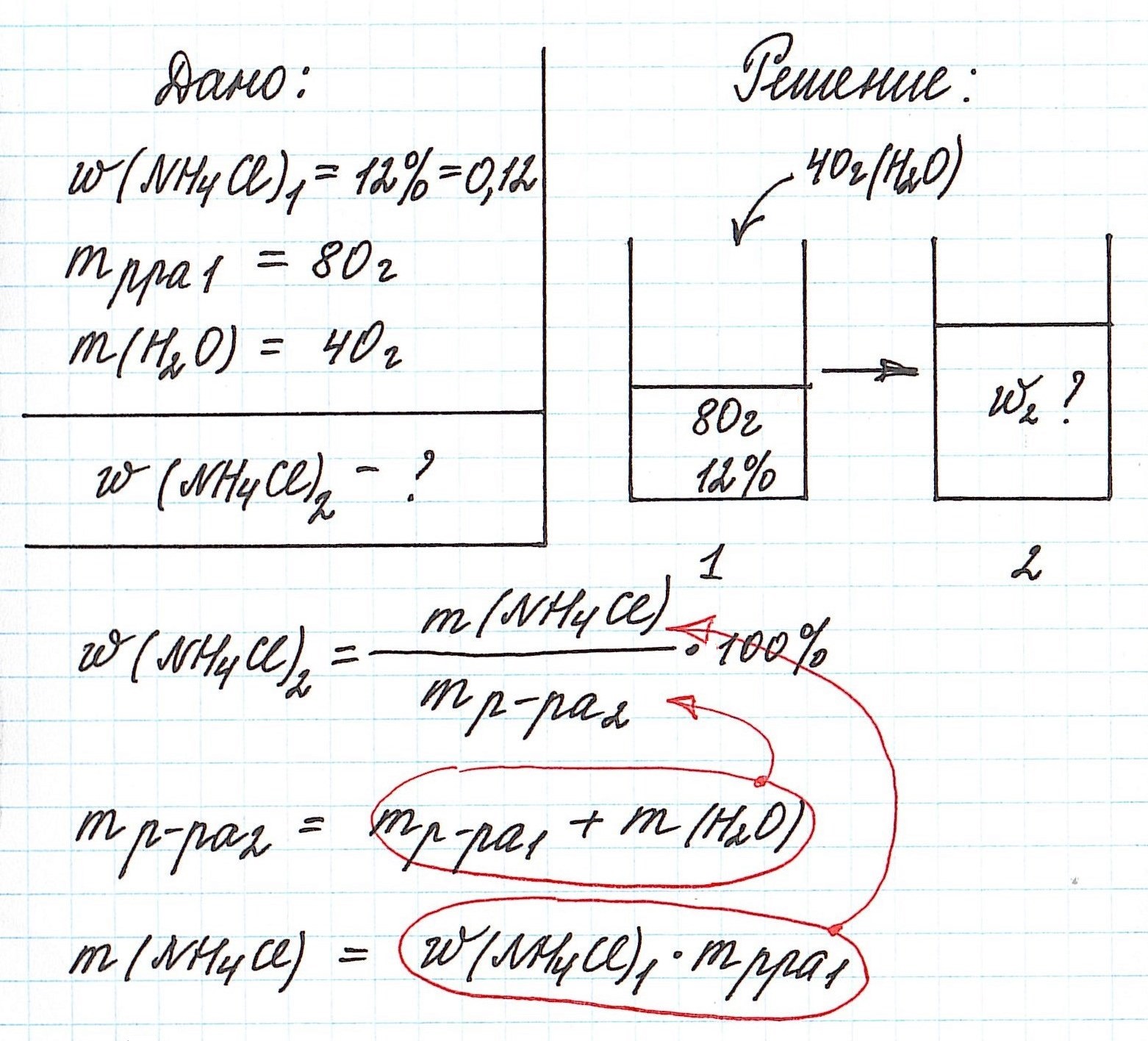
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
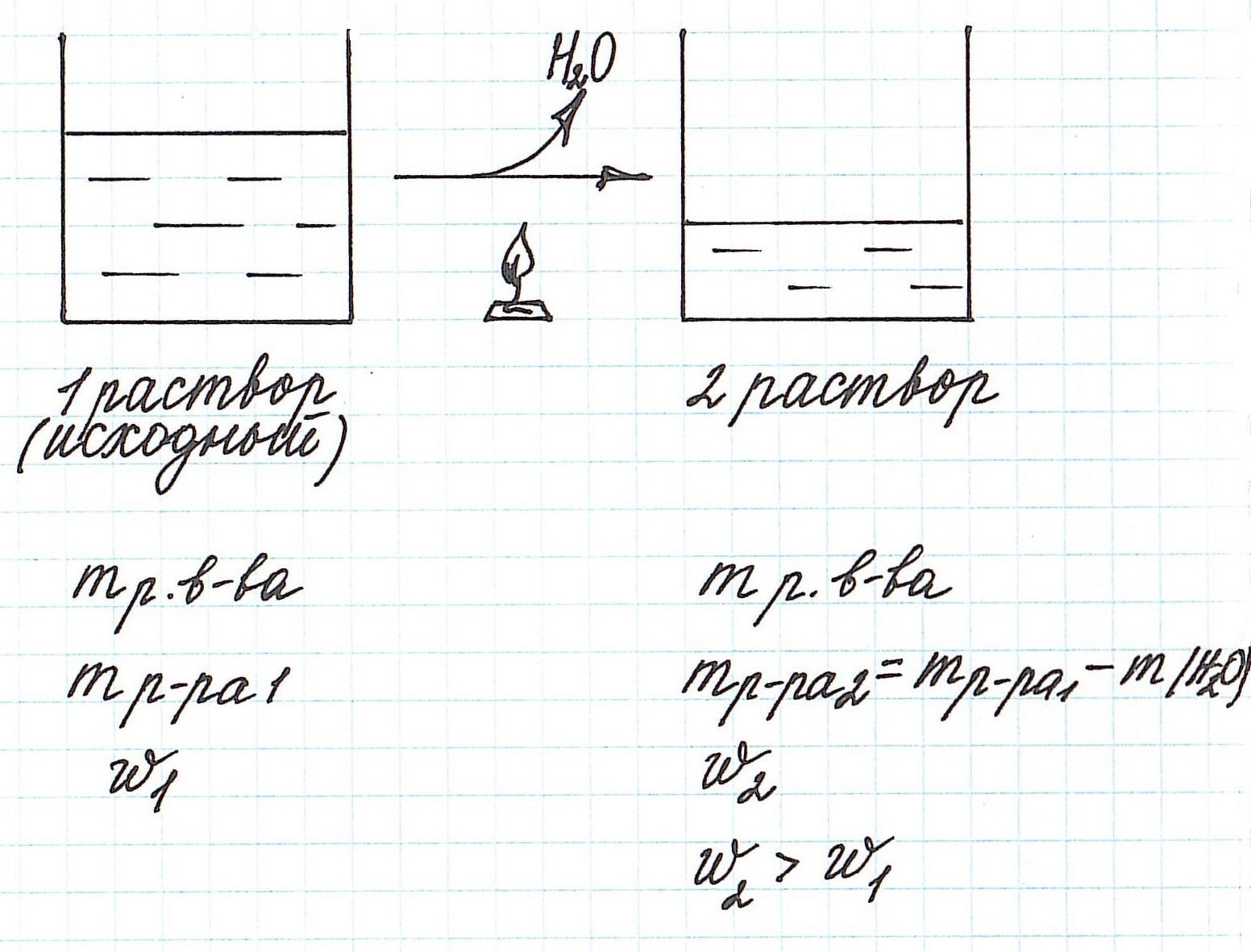
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
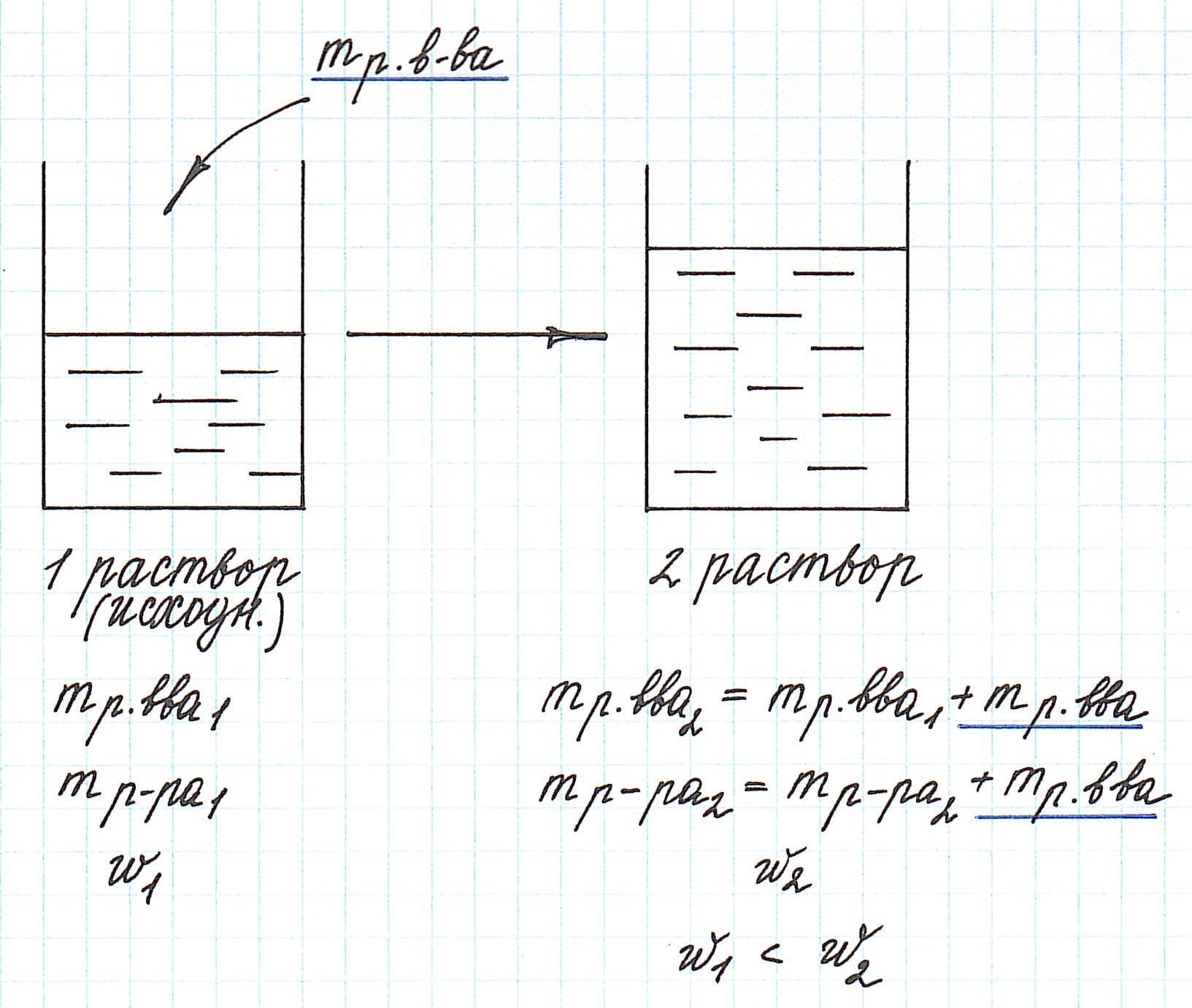
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
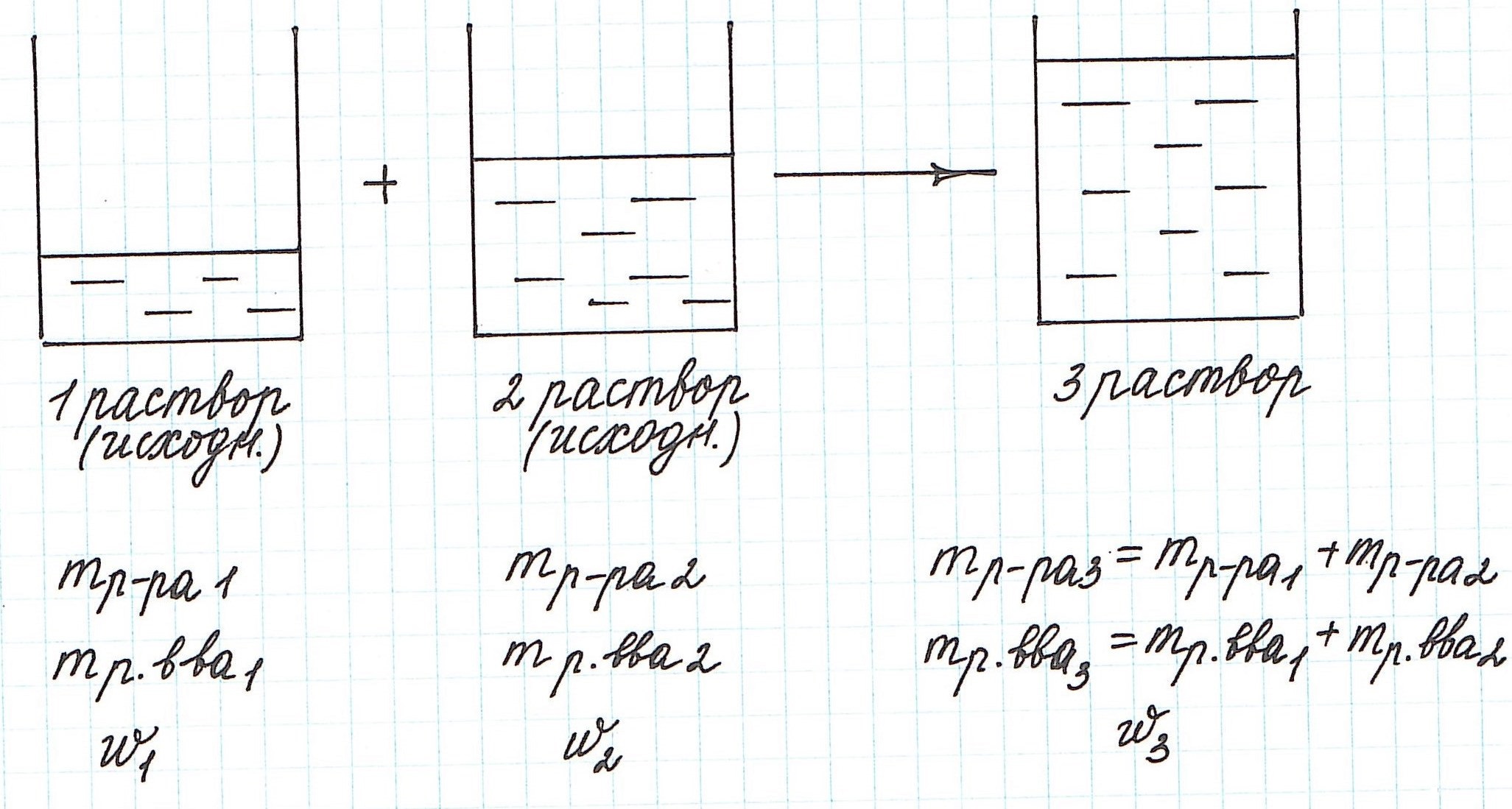
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
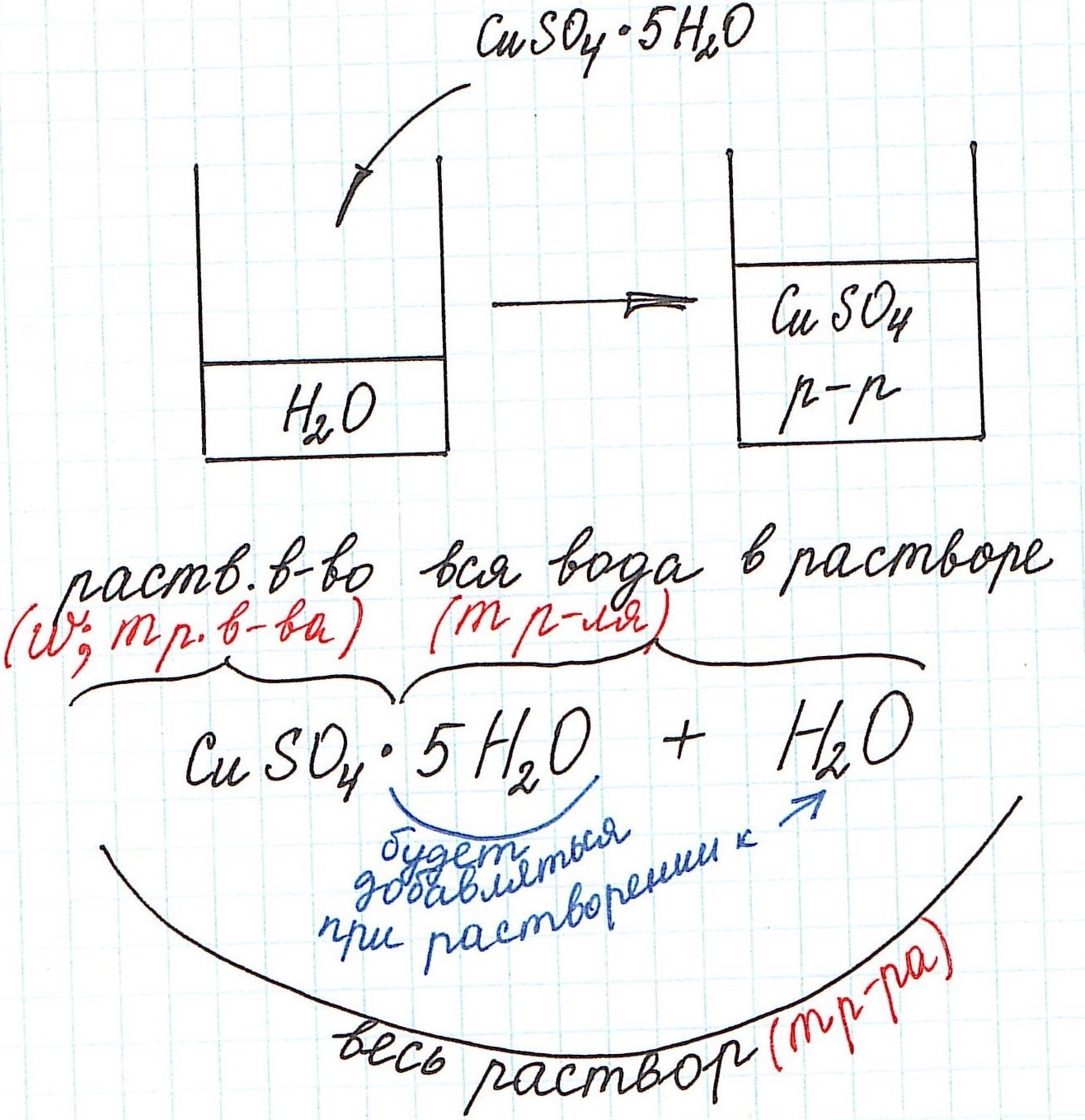
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
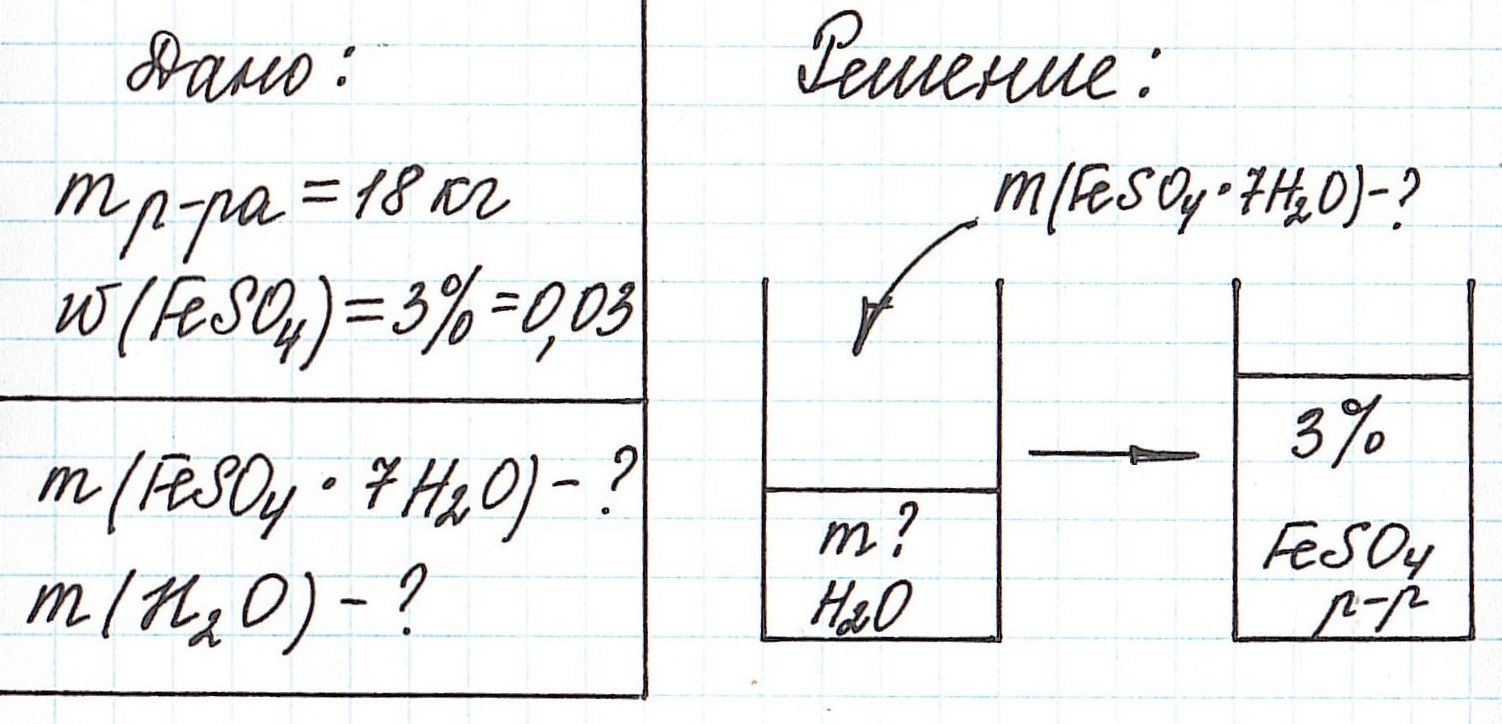
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
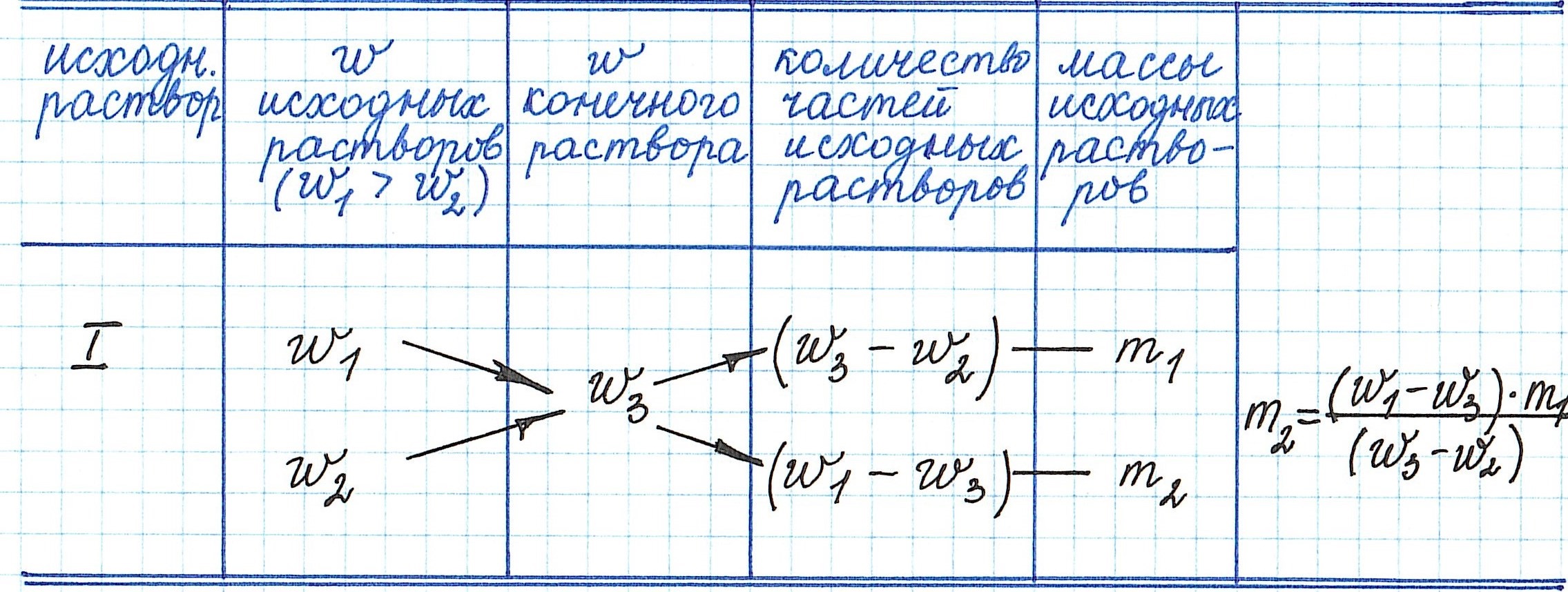
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
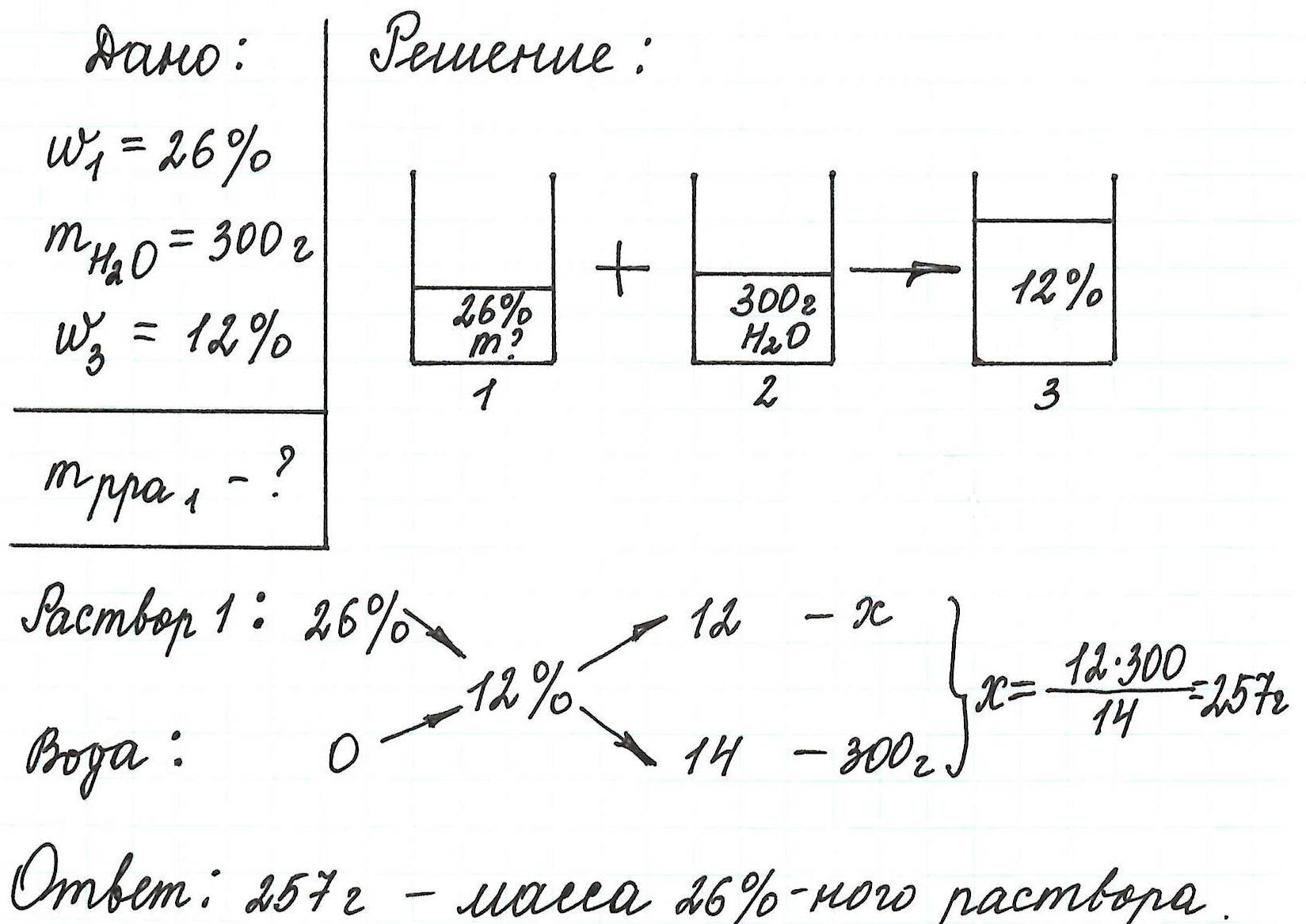
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
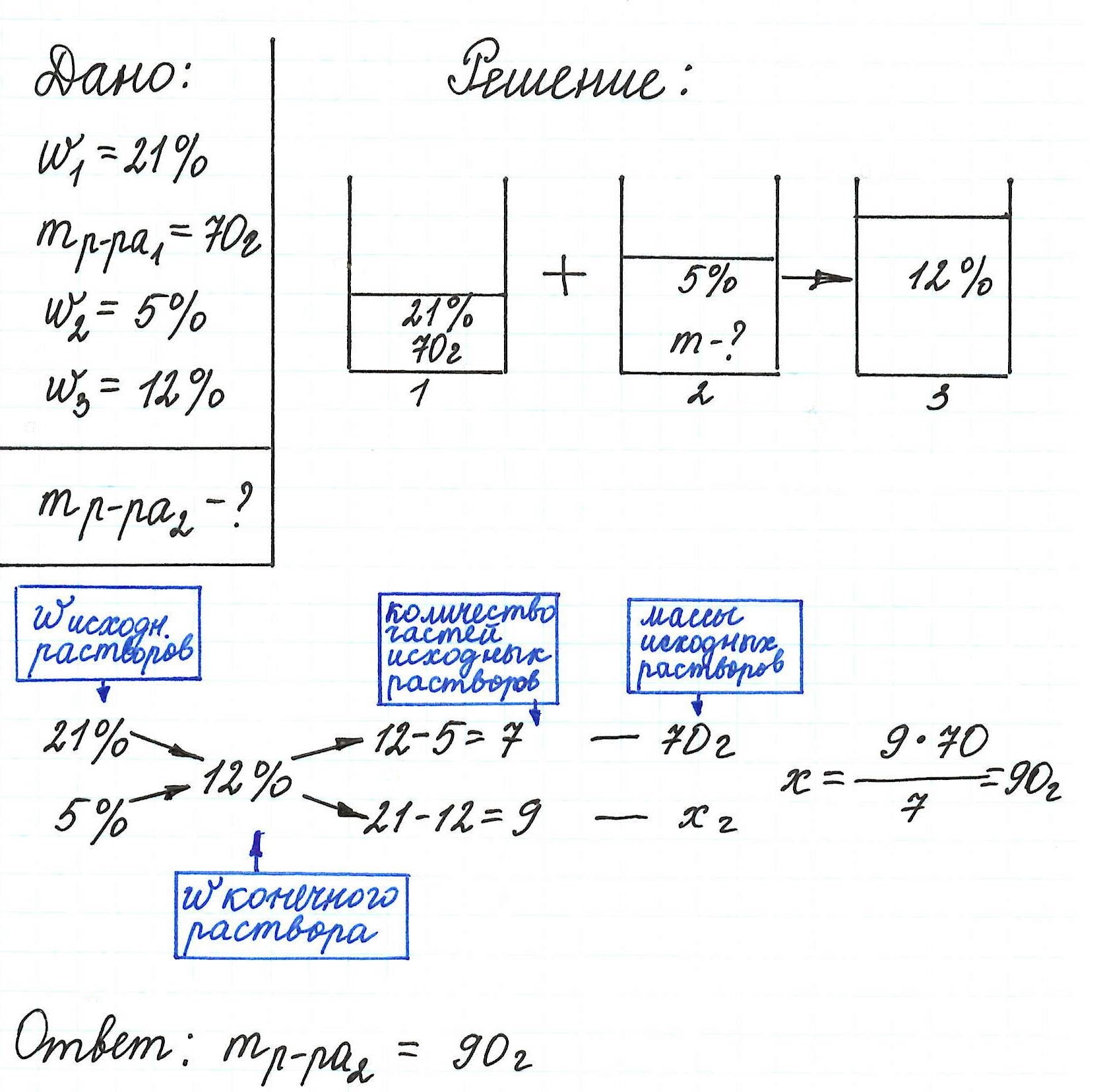
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!