ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
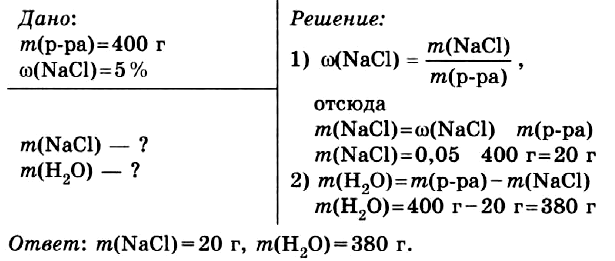
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Алгоритм нахождения массы растворенного вещества и массы воды, необходимые для приготовления раствора.
Задача.
Вычислить
массу соли и воды, необходимые для
приготовления 40 г раствора NаСl
с массовой долей 5%.
1.
Запишите условие задачи с помощью
общепринятых обозначений
Д
m р-ра
= 40г
ω = 5%
m (NаСl)
— ?
m (Н2О)
— ?
Решение:
1. Рассчитайте
массу растворенного вещества по формуле:
m в-ва=
ω ∙
m р-ра/100%
m
(NаСl)
= 5% · 40г/100% = 2г
2. Найдите массу
воды по разности между массой раствора
и массой растворенного вещества:
m р-ля
= m р-ра
– m в-ва
m
(Н2О)
= 40г – 2г = 38 г.
3.
Запишите
ответ.
Ответ: для
приготовления раствора необходимо
взять 2г соли и 38г воды.
Алгоритм нахождения массовой доли растворенного вещества при разбавлении (упаривании) раствора
Задача
К
15% раствору, масса которого 80г, добавили
30г воды. Какой стала массовая доля
растворённого вещества в полученном
растворе?
1. Запишите условие
задачи с помощью общепринятых обозначений.
Д
ω1
= 15%
mр-ра1=80г
m(Н2О)
= 30г
ω2-?
Решение:
1. В результате
разбавления (упаривания) раствора масса
раствора увеличилась (уменьшилась), а
вещества в нём осталось столько же.
Рассчитайте массу
растворённого вещества, преобразуя
формулу:
ω = m в-ва
/m р-ра
∙ 100%
m в-ва
= ω1·
mр-ра1
/100%
m
в-ва
= 15% · 80г = 12г
2. При разбавлении
раствора общая масса его увеличивается
(при упаривании — уменьшается).
Найдите массу
вновь полученного раствора:
m
р-ра2
= m
р-ра1 +
m(H2O)
m р-ра2
= 80г + 30г=110г
3. Рассчитайте
массовую долю растворённого вещества
в новом растворе:
ω2
= m в-ва /
m р-ра2
∙ 100%
ω2
= 12г/ 110г· 100% = 10,9%
4. Запишите ответ
Ответ:
массовая доля растворенного вещества
в растворе при разбавлении равна 10,9%
Алгоритм решения задач по «правилу креста»
Для получения
раствора с заданной массовой долей (%)
растворенного вещества путем смешивания
двух растворов с известной массовой
долей растворенного вещества пользуются
диагональной схемой («правило креста»).
Сущность этого
метода состоит в том, что по диагонали
из большей величины массовой доли
растворенного вещества вычитают меньшую.
|
a с – в / с / в а – с |
где а – большая, |
Разности (с-в) и
(а-с) показывают, в каких соотношениях
нужно взять растворы а и в, чтобы получить
раствор с.
Если
для разбавления в качестве исходного
раствора используют чистый растворитель,
например, Н20,
то концентрация его принимается за 0 и
записывается с левой стороны диагональной
схемы.
Задача
Для
обработки рук хирурга, ран, послеоперационного
поля используется йодная настойка с
массовой долей 5%. В каком массовом
соотношении нужно смешать растворы с
массовыми долями йода 2,5% и 30%, чтобы
получить 330 г йодной настойки с массовой
долей йода 5%?
1. Запишите условие
задачи с помощью общепринятых обозначений.
Д
ω1
= 30%
ω2
= 2,5%
ω3
= 5%
m3
= 330г
m1
= ?
m2
= ?
Решение:
1. Составьте
«диагональную схему». Для этого
запишите массовые доли исходных растворов
друг под другом, по левую сторону креста,
а в центре заданную массовую долю
раствора.
2,5
/
5
/
30
2.
Вычитают из бóльшей массовой доли
меньшую (30–5=25; 5–2,5=2,5) и находят результаты.
Записывают найденные
результаты с правой стороны диагональной
схемы: при возможности сокращают
полученные числа. В данном случае 25 в
десять раз больше, чем 2,5, то есть вместо
25 записывают 10, вместо 2,5 пишут 1.
30 2,5 (1)
/
5
/
2,5 25 (10)
Числа
(в данном случае 25 и 2,5 или 10 и 1)называют
массовыми числами. Массовые числа
показывают, в каком соотношении необходимо
взять исходные растворы, чтобы получить
раствор с массовой долей йода 5%.
3. Определите массу
30% и 2,5% раствора по формуле:
m
р-ра
= число частей · m3/
сумму массовых частей
m1(30%)
= 1· 330г /1+10 = 30г
m2(2,5%)
= 10 · 330г/ 1+10 = 300г
4. Запишите ответ.
Ответ:
для приготовления 330 г раствора с массовой
долей йода 5% необходимо смешать 300 г
раствора с массовой долей 2,5% и 30 г с
массовой долей 30%.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Большинство реактивов продаётся в сухом виде: это или порошок, или мелкие гранулы. Однако используются реактивы чаще всего в виде растворов. Поэтому один из самых частых вопросов от наших покупателей – как из сухого вещества сделать раствор нужной концентрации.
Напоминаем, что все работы с химическими веществами следует проводить с соблюдением необходимых мер безопасности! Используйте средства индивидуальной защиты органов дыхания, глаз и кожных покровов!
В зависимости от способа и методики приготовления растворы можно разделить на приблизительные и точные. Вторые можно приготовить только в лабораторных условиях с использованием дорогостоящего оборудования и посуды.
С другой стороны, “точности” приблизительных растворов вполне достаточно для проведения домашних опытов, удаления ржавчины или загрязнения, очистки или обеззараживания воды в аквариуме или в бассейне, для таких хобби, как химическая металлизация, печать фотографий, выращивание кристаллов, изготовления мыла и свечей и многих других целей.
Растворение химических веществ может производится в разных средах – воде, спирте, кислотах и т.д. В этой статье мы будем говорить только о растворении в воде.
Что такое концентрация раствора?
Концентрацию раствора выражают в процентах, например 10% раствор или 0,5% раствор. Эта цифра показывает, сколько частей вещества приходится на 100 частей раствора.
Так, в 100 граммах 10%-го раствора поваренной соли находится 10 грамм соли и 90 грамм воды. А в 500 граммах 30%-го раствора гидроксида натрия содержится 150 грамм NaOH и 350 грамм воды. Один килограмм 0,2%-го раствора нитрата серебра состоит из 2 грамм нитрата серебра и 998 грамм воды.
Отметим, что существует разница между массовой концентрацией и объемной концентрацией растворов, и эта разница тем больше, чем больше концентрация растворенного вещества и плотность раствора.
Например, чтобы приготовить 1 килограмм 15%-го раствора NaCl нужно смешать 150 грамм соли и 850 грамм воды. Для приготовления же 1 литра 15%-го раствора NaCl понадобится уже 166,2 грамм NaCl и 941,8 грамм воды (при растворении соли в воде объём раствора несколько увеличится), и плотность увеличится с 1,000 (на самом деле 0,998) до 1,108.
Объясняется такая разница тем, что плотность солевого раствора выше, чем плотность чистой воды.
В этой статье, для упрощения, речь всегда будет идти о массовой концентрации раствора, то есть вес раствора будем измерять в граммах, а не в миллилитрах.
Приготовление водного раствора из сухого безводного реактива
Прежде всего, определитесь – какой вес раствора вам понадобится. Если раствор этого вещества нестабилен или он вам нужен для какой-то разовой работы – готовьте столько раствора, сколько нужно сейчас. Если же раствор хорошо хранится и используется время от времени, можно приготовить его с запасом.
Теперь рассчитаем количество вещества, которое нужно взять для приготовления определенной массы раствора определённой концентрации:
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Соответственно, масса воды вычисляется как разница между общей массой раствора и массой сухого вещества.
Пример 1: приготовим 5%-й раствор гидроксида натрия (NaOH) массой 500 грамм.
Масса NaOH = (5) * (500 гр/100) = 25 грамм.
Масса воды = 475 грамм.
Пример 2: приготовим 37%-й раствор аммония фосфорнокислого (NH4H2PO4) массой 750 грамм.
Масса (NH4H2PO4) = (37) * (750 гр/100) = 277,5 грмм.
Масса воды = 472,5 грамм.
Остаётся растворить навеску сухого реактива в рассчитанном объёме воды.
Приготовление раствора из водных солей (кристаллогидратов)
Откуда взялась вода в сухом реактиве и что такое “водность” вещества – можно прочитать здесь…
Если вам нужно приготовить раствор из вещества, содержащего кристаллизационную воду (например, медный купорос CuSO4*5H2O, хромокалиевые квасцы KCr(SO4)2*12H2O и тому подобные вещества), то методика расчетов меняется, чтобы учесть уже имеющуюся в веществе воду.
Опять же, начинаем с определения массы раствора, который мы хотим приготовить. Затем вычисляем, сколько вещества должно содержаться в растворе такой массы нужной нам концентрации – формула та же, что и при использовании безводных реактивов.
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Далее, пересчитываем массу вещества на кристаллогидрат. Для этого в справочниках (Яндекс или Google – наше всё) находим молярные массы безводной формы этого вещества и кристаллогидрата и вычисляем соотношение – сколько вещества в безводной форме содержится в кристаллогидрате. Так, если молярная масса кристаллогидрата 150 грамм/моль, а безводная форма этого вещества имеет молярную массу 70 грамм/моль, это значит, что в 150 грамм кристаллогидрата содержатся 70 грамм безводной формы вещества.
Определив, какое количество кристаллогидрата вещества нам нужно растворить, вычисляем необходимую массу воды.
Пример 1. Приготовим 500 грамм 15%-го раствора карбоната натрия 10-водного Na2CO3∙ 10H2O
Определяем массу карбоната натрия в 500 граммах 15%-го раствора:
Na2CO3 = (15) * (500 гр/100) = 75 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса Na2CO3 = 106 грамм/моль, молярная масса Na2CO3∙ 10H2O = 286 грамм/моль. Таким образом, 286 грамм карбоната натрия 10-водного содержат 106 грамм карбоната натрия безводного.
Нам нужно, чтобы в растворе оказалось 75 грамм карбоната натрия безводного. Составляем пропорцию и получаем, что нужно взять 202 грамма карбоната натрия 10-водного.
Последний шаг – посчитать нужное количество воды. 500 грамм минус 202 грамма = 298 грамм воды.
Пример 2. Приготовим 1000 грамм 3%-го раствора сульфата магния 7-водного MgSO4∙ 7H2O
Определяем массу сульфата магния в 1000 граммах 3%-го раствора:
MgSO4 = (3) * (1000 гр/100) = 30 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса (MgSO4) = 120 грамм/моль, молярная масса (MgSO4∙ 7H2O) = 246 грамм/моль.
Вычисляем, что для того, чтобы получить в растворе 30 грамм сульфата магния нужно взять 62 грамма сульфата магния 7-водного.
Смешиваем 938 грамм воды и 62 грамма сульфата магния 7-водного, получаем нужный результат.

В ПОМОЩЬ УЧИТЕЛЮ ПРИ ПОДГОТОВКЕ ЕГЭ
«Уча других, мы учимся сами»

ПРЕДИСЛОВИЕ
В учебном пособии предложена методика решения задач на образование и разложение растворов без протекания химической реакции. Задачи на растворы есть простые и более сложные, многоходовые, с участием кристаллогидратов, газов и т.п. Не слишком сложные задачи этого типа обычно представлены в заданиях А26 ЕГЭ по химии. При решении таких задач большинство учащихся сталкиваются с определенными трудностями в осмыслении текста задачи и выборе способа ее решения.
Поэтому целью пособия является:
-
объяснить методику решения таких задач, путем постепенного усложнения.
-
выработать у обучающихся правильные навыки оформления задачи;
-
показать логическую последовательность, используемую в ходе решения задач, выработать навыки её применения;
-
формировать умение обучать учащихся решению химических задач.
В пособии предложены способы решения задач, приводятся примеры решения задач, которые разбиты по типам и расположены в порядке усложнения. Задания могут быть использованы учителями не только при подготовке к ЕГЭ, но и при проведении уроков, учениками – для закрепления материала. Каждый учитель должен помнить, что умение решать задачи развивается в процессе обучения, поэтому чтобы развить это умение нужно постоянно и систематически их решать.
Желаю удачи!
В
Анализ условия задачи. Его можно условно разбить на две составляющие – анализ химической стороны задачи и анализ ее количественных характеристик. При анализе химической стороны задачи ученик должен понять, какие вещества и процессы описаны в условии, отобразить их формулами и уравнениями реакций. При анализе количественной стороны задачи ученик должен понять, какие именно величины характеризуются числами в условии задачи, ввести нужные обозначения, правильно указать принадлежность величины. Анализ количественной стороны задачи должен быть отражен в краткой записи условия.
План решения задачи. На этом этапе ученик должен или отнести задачу к одному из известных ему типов задач и восстановить в памяти алгоритм ее решения, или самостоятельно построить алгоритм решения незнакомой задачи.
Выполнение решения задачи. На этом этапе от ученика требуется определенный уровень математических навыков, умение преобразовывать формулы, проводить вычисления, округлять, в отдельных случаях – составлять и решать алгебраические уравнения.
Осмысление результата.
Завершение решения обычно заключается в формулировке ответа.
ЭТО НАДО ЗНАТЬ
-
Раствор – это тоже самое, что гомогенная смесь.
-
Растворителем называют жидкость, растворяющую вещество.
-
«Подобное растворяется в подобном».
-
Существует много способов выражение концентрации вещества в растворе.
-
На растворимость влияют площадь поверхности растворяемого вещества, давление и температура.
-
Разбавлением называют процесс добавления дополнительного количества растворителя в раствор, чтобы уменьшить его концентрации.
-
При выпаривании воды из раствора масса растворенного вещества не изменяется, а масса раствора уменьшается на массу выпаренной воды.
-
При разбавлении раствора водой масса растворенного вещества не изменяется, а масса раствора увеличивается на массу добавленной воды.
-
При сливании двух растворов их массы, а также массы растворенного вещества складываются.
-
При выпадении кристаллов масса растворенного вещества и масса раствора уменьшается на массу выпавших кристаллов, а масса воды не изменяется (если из раствора выделяется безводное вещество)
ОБОЗНАЧЕНИЕ РАЗНОЙ КОНЦЕНТРАЦИИ РАСТВОРОВ
— массовая доля раствора (в долях от единицы), а % — это процентное содержание вещества в растворе;
— объемная доля;
— растворимость (понятие о насыщенных растворах, расчет на чистый растворитель);
С моль/л — молярная концентрация (число молей вещества в 1 л раствора).
КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА СОСТАВА РАСТВОРОВ
Для качественной характеристики растворов используют понятия «разбавленный раствор» (содержит мало растворенного вещества) и «концентрированный раствор» (содержит много растворенного вещества). При работе с растворами необходимо знать их количественный состав. Количественный состав выражается различными способами.
Способы
Массовая доля растворенного Молярная концентрация
вещества
Массовая доля растворенного вещества
Массовой долей растворенного вещества называется отношение массы растворенного вещества к массе раствора:
масса компонента mв-ва
массовая доля = ––––––––––––––––– , т.е. ω= –––––
масса целого m(р-ра)
где ω – массовая доля растворенного вещества, г; mв-ва – масса растворенного вещества, г; m(р-ра) – масса раствора, г.
Массовую долю растворенного вещества можно выражать также в процентах:
mв-ва
ω= ––––– ∙100%
m(р-ра)
Массовую долю растворенного вещества, выраженную в процентах, часто называют процентной концентрацией раствора.
Пример. В водном растворе хлорида натрия NaCI его массовая доля равна 10%, или 0,1. Это значит, что в растворе массой 100 г содержится 10 г хлорида натрия и 90 г воды. Массу раствора можно рассчитать по формулам:
m(р-ра)= m(растворитля) + m(в-ва);
m(р-ра)= •V
где V— объем раствора, мл; плотность раствора, г/мл.
Масса растворенного вещества равна произведению массы раствора на массовую долю растворенного вещества:
mв-ва = m • ω
При сливании растворов складываются как массы растворов:

так и массы растворенных веществ:
m(в-ва1) + m(в-ва2)= m(в-ва3)
Молярная концентрация
Молярная концентрация показывает число молей растворенного вещества в одном литре раствора.
Молярную концентрацию можно рассчитать по формуле: C = n/V,
Где C – молярная концентрация, моль/л; n— количество растворенного вещества, моль,
V— объем раствора, л.
Молярная концентрация С, моль/л
Обозначение молярности
Название раствора
1
1М
Одномолярный
(молярный)
0,5
0,5М
Полумолярный
0,1
0,1М
Децимолярный
0,01
0,01М
Сантимолярный
0,001
0,001М
Миллимолярный
На практике часто переходят от одного способа выражения концентрации к другому по известной плотности раствора, применяя формулу: m(р-ра)= •V
ТИПЫ ЗАДАЧ
-
Задачи на определение массы веществ в растворе
-
З
адачи на определение массы веществ, необходимой для получения раствора нужной концентрации
-
Задачи на определение массовой доли веществ в растворе
-
Задачи на определение процентного содержания веществ в растворе
-
Задачи с использованием понятия растворимости
-
Задачи на определение массы или объема вещества при добавлении его в раствор для изменения концентрации
-
Задачи на определение процентного содержания или массовой доли веществ в растворе, полученном при смешивании растворов разной концентрации
-
Задачи на молярную концентрацию
-
Усложненные задачи
I ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ВЕЩЕСТВ В РАСТВОРЕ
ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ВЕЩЕСТВ В РАСТВОРЕ
Типовая задача.
Какую массу соли и объем воды необходимо взять для приготовления 50 г
0,5 %-ного раствора
Д
m (р-ра) = 50 г m (соли) = 50 г · 0,005 = 0,25 г соли
(соли) = 0,005 m (H2O) = 50 г — 0,25 г = 49,75 г

m (соли) = ? Ответ: m (соли) = 0,25 г, V (H2O) = 49,75 л
З
Какую массу соли и объем воды необходимо взять для приготовления:
-
60 г 1 %-ного раствора
-
70 г 2 %-ного раствора
-
40 г 0,4 %-ного раствора
-
80 г 0,2 %-ного раствора
-
90г раствора с массовой долей соли 0,001
-
60 г раствора с массовой долей соли 0,002
-
50 г раствора с массовой долей соли 0,05
-
70 г раствора с массовой долей соли 0,01
-
120 г 10 %-ного раствора
-
90 г раствора с массовой долей соли 0,06
-
150 г 2 %-ного раствора
-
150 г раствора с массовой долей соли 0,004
-
200 г раствора с массовой долей соли 0,06
-
140 г раствора с массовой долей соли 0,03
-
Какие массы йода и спирта необходимы для приготовления 300 г раствора с массовой долей йода 5%?
I
Типовая задача№1. Какой объем воды надо прилить к 0,5 г сахара, чтобы получить 1 %-ный раствор?
Д
m
(cах.) = 0,01 (1 %) х – 0,5 г сахара
2) m (H2O) = 50 – 0,5 = 45,5 г
V(Н2О) = ?
3) V(Н2О) = 45,5 г / 1 г/мл = 45,5 мл
Ответ: V(Н2О) = 45,5 мл
Типовая задача№2. Какую массу соли надо добавить к 200 мл воды, чтобы получить 3 %-ный раствор? Ответ:
Дано: Решение:
V
(соли) = 0,03 (3 %) и 97 г воды
2) m (200 мл Н2О) = 200 мл · 1 г/мл = 200 г
m (соли) = ? 3) m (соли) = ?
3 г соли – на 97 г Н2О
х — 200 г Н2О
х = 3 ∙200/ 97 = 6,2 г.
Ответ: m (соли) = 6,2 г
Задачи для самостоятельной работы
-
Какой объем воды надо прилить к 8 г соли, чтобы получить 2 %-ный раствор?
-
Какую массу соли надо добавить к 120 мл воды, чтобы получить 1 %-ный раствор?
-
Какую массу нитрата натрия, которую необходимо растворить в 200 г воды для получения раствора с массовой долей 20%
-
Вычислите массу воды, в которой нужно растворить25 г сахара, чтобы получить раствор с массовой долей растворенного вещества 10 %.
-
Рассчитайте, какую массу воды необходимо взять для приготовления раствора с массовой долей вещества 20%, если нужно растворить 100г соли?
-
Определите массу хлорида калия, который нужно растворить в 100 г воды, чтобы получить раствор с массовой долей KCI 5%.
-
Имеется соль массой 200 г. Рассчитайте массу воды, которую надо взять, чтобы получить раствор с массовой долей соли 12,5%
I II ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ ВЕЩЕСТВ В РАСТВОРЕ
II ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ ВЕЩЕСТВ В РАСТВОРЕ
Типовая задача№1. Смешали 0,4 г соли и 200 мл воды. Какова массовая доля соли в полученном растворе?
Дано: Решение:
m

2) m (H2O) = 50 – 0,5 = 45,5
(соли) = ? (cоли) = 0,4 г/ 200,4 г = 0,002 (0,2 %-ный)
Ответ: (соли) = 0,002 (0,2 %-ный)
Типовая задача№2. Смешали гидроксид натрия NaOH в количестве 1 моль с
1 л воды. Какова массовая доля гидроксида натрия в полученном растворе?
Дано: Решение:

V(Н2О) = 1 л 2) m (H2O) = 1000 мл ∙ 1 г/мл = 1000 г
3) m (р-ра) = 1000 г + 40 г = 1040г
(NaOH) = ? 4)(NaOH) = 40 г/1040 г = 0,038 (3,8 %)
Ответ: (NaOH) = 0,038 (3,8 %)
Типовая задача№3. Рассчитайте массовую долю вещества в растворе, полученном при смешивании 200 г воды и 30 г вещества.
Наглядно-логический метод:
Р1
+
Р2
=
Р3
mp = 30/1=30г
mp = 200 г
mp = 230 г
ɷ = 1
т.к. вещество сухое
ɷ = 0
т.к. это вода
ɷ = 30/230 = 0,1304
или 13,04%.
mв =30г
mв =0г (200 · 0=0)
mв = 30г (30+0 =0)
Решение алгебраическим методом:
ɷ= mв/ mp = (mв1 + mв2) / (mp1 + mр2) = (30· 1 +200·0) / (30 +200) = 30/230 = 0,1304 (13, 04%).
Ответ: (вещества)= 0,13.
Задачи для самостоятельной работы
-
Смешали 20 г сахара и 250 мл воды. Какова массовая доля сахара в полученном растворе?
-
Смешали 5 г сахара и 150 мл воды. Какова массовая доля сахара в полученном растворе?
-
Смешали 2 г соли и 140 мл воды. Какова массовая доля соли в полученном растворе?
-
Смешали 0,5 г соли и 300 мл воды. Какова массовая доля соли в полученном растворе?
-
Смешали гидроксид натрия NaOH в количестве 1 моль с 1 л воды. Какова массовая доля гидроксида натрия в полученном растворе?
-
Смешали нитрат натрия NaNO3 в количестве 0,1 моль с 0,5 л воды. Какова массовая доля нитрата натрия в полученном растворе?
-
В 105 г воды растворили 35 г соли. Вычислите массовую долю растворенного вещества.
-
Сахар массой 5 г растворили в воде массой 20 г. Какова массовая доля сахара в растворе?
-
В 200 г воды растворили 67,2 л газообразного хлороводорода HCI (н.у.). Определите массовую долю хлороводорода в полученном растворе.
-
Хлорид бария массой 6 г растворили в 250 мл воды (плотность воды 1 г/мл). Чему равна массовая доля соли в полученном растворе?
-
В 1000 г воды растворили 2 моль сульфата калия. Рассчитайте массовую долю растворенного вещества
-
В 200 г воды растворили 50 г хлорида натрия. Вычислите массовую долю NaCI в полученном растворе.
-
В 1 л раствора серной кислоты содержится 2,1 моль H2SO4. Рассчитайте массовую долю растворенного вещества, учитывая, что плотность раствора равна 1,13г/мл.
-
Массовая доля соляной кислоты, выраженная в процентах, в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды, равна (с точностью до десятых)___
I VТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ВЕЩЕСТВ В РАСТВОРЕ
VТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ВЕЩЕСТВ В РАСТВОРЕ
Типовая задача№1. К 150 г 20 %-ного раствора соляной кислоты прилили 200 мл воды. Каково процентное содержание соляной кислоты во вновь полученном растворе?
Дано: Решение:
m
(HCl) = 0,2 (20 %) 2) m (p-ра) = 150 г + 200 г = 350 г
V(Н2О) = 200 мл m (H2O) = 200 мл ∙ 1 г/мл = 200 г
(HCl) = ? (HCl) =30 г /350 г = 0,086 (8,6 %)
Ответ: (HCl) = 0,086 (8,6 %).
Типовая задача№2. К 120 г 1 %-ного раствора сахара прибавили 4 г сахара. Каково процентное содержание сахара во вновь полученном растворе?
Д
m (p. сахара) = 120 г 1)m(сахара) = 120 г ∙ 0,01 = 1,2 г
= 0,01 (1 %) 2) m(всего сахара) = 1,2 + 4 г = 5,2 г
m(сахара) = 4 г 3) m (р-ра) = 120 г + 4 г = 124 г

Ответ: 0,042 (4,2 %).
Задачи для самостоятельной работы
-
К
200 г 40 %-ного раствора серной кислоты прилили 80 мл воды. Каково процентное содержание серной кислоты во вновь полученном растворе?
-
К 90 г 6 %-ного раствора поваренной соли прилили 200 мл воды. Каково процентное содержание поваренной соли во вновь полученном растворе?
-
К 140 г 15 %-ного раствора сахара долили 160 мл воды. Каково процентное содержание сахара во вновь полученном растворе?
-
К 200 г 40 %-ного раствора уксусной кислоты долили 300 мл воды. Каково процентное содержание уксусной кислоты во вновь полученном растворе?
-
К 80 г 30 %-ного раствора щелочи долили 420 мл воды. Каково процентное содержание щелочи во вновь полученном растворе?
-
К раствору хлорида кальция массой 90 г с массовой долей 5% добавили 10 г этой же соли. Каково процентное содержание соли во вновь полученном растворе?
-
К раствору нитрата кальция массой 80 г с массовой долей 4% добавили 1,8 г этой же соли. Каково процентное содержание соли в полученном растворе равна (с точностью до десятых)___
-
К 300 г раствора нитрата калия с массовой долей 20% добавили 100 г той же соли. Какова массовая доля нитрата калия в полученном растворе?
-
Массовая доля азотной кислоты в растворе, полученном после добавления 20 г воды к 160 г её 5%-ного раствора, равна___
-
К раствору хлорида кальция массой 140 г с массовой долей 5% добавили 10 г этой же соли. Массовая доля соли в полученном растворе равна (с точностью до десятых___
-
К 150 г раствора с массовой долей K2SO4 10% добавили 100г воды. Вычислите массовую долю сульфата калия в полученном растворе.
V ТИП. ЗАДАЧИ С ИСПОЛЬЗОВАНИЕМ ПОНЯТИЯ – РАСТВОРИМОСТЬ
Типовая задача№1. Какую массу сульфата натрия можно получить при выпаривании 50г насыщенного раствора при t 35 0С, если его растворимость 50 (на 100 г воды)?
Д
m
Р(Na2SO4) = 50 г в 50 г — х
m (Na2SO4) = ? х =50 г∙50 г/150 г = 16,7 г
Ответ: 16,7 г Na2SO4
Типовая задача№1. Сколько грамм воды необходимо для растворения 30 г нитрата свинца, чтобы получился насыщенный раствор при t 60 0С (растворимость его 105)?

m
Р(60О С) = 105 г 30 г — х
х =30 г ∙ 100 г / 105 г = 28,57 г
m (H2O) = ?
Ответ: 28,57 г H2O
Типовая задача№3. В 300 г насыщенного при t 55 0С сульфата магния содержится 100 г сульфата магния. Определить его растворимость (коэффициент растворимости).


m (MgSO4) = 100 г 2) в 200 г H2O – 100 г MgSO4
Р(MgSO4)= ? в 100 г — х
х=50 г
Ответ: Р(MgSO4) = 50 г
Типовая задача№4. В 200 г раствора KСlO3 при t 30 0С содержится 20 г KСlO3. Будет ли его раствор насыщенным, если его растворимость при t 30О С – равна 10?

m
m (KClO3) = 20 г 2) В 100 г H2O – 10 г KClO3
m (KClO3) = 20 г в 180 г H2O – х
Будет ли раствор 3) х =180 х 10 г/100 г = 18 г
насыщенным? А в растворе 20 г KClO3, следовательно, раствор
насыщенный.
Типовая задача№5. В 100 г воды при t 60 0С растворяется 110 г нитрата калия, образуя насыщенный раствор. Какова массовая доля нитрата калия в таком растворе?
Д
m
m (KNO3) = 110 г 2) = 110/210 г = 0,524 (52,4 %)
(KNO3) = ? Ответ: 0,524 (52,4 %)
Типовая задача №6. Какая масса хлорида бария выкристаллизуется при выпаривании из 300 г насыщенного при t 90 0С раствора, если его растворимость 55?
Д
m
Р(BaCl2) = 55 г в 300 г – х
2) х =300 г ∙ 55 г/155 г= 106,45 г
m (BaCl2 выкр.) ? Ответ: 106,45 г.
Задачи для самостоятельной работы
-
Имеется 300 г насыщенного при t 15О С раствора нитрата калия. Сколько грамм нитрата калия здесь содержится, если его растворимость 25?
-
Растворимость некоторой соли при температуре 25 0С составляет 185г/л. Какую массу соли можно получить, если упарить 200 мл ее раствора, насыщенного при температуре 250?
-
В 100 г воды при 20 0С растворяется 74,5 г хлорида кальция, а при 800С – 147,0г. Каким будет при этих температурах 42,3%-ный раствор хлорида кальция (насыщенным, ненасыщенным, перенасыщенным)?
-
Воду объемом 100 мл насыщают нитратом калия KNO3 при 700С. Раствор охлаждают до 20 0С. Какая масса соли выпадет в осадок?
-
Растворимость бромида натрия при 20 0С равна 90,5 г. Какую массу этой соли следует растворить в воде массой 900 г при 200С для получения насыщенного раствора?
-
При выпаривании насыщенного при 200С водного раствора хлорида натрия массой 200 г получена соль, масса которой 52,64г. Какова растворимость в воде хлорида натрия при 200С?
-
В какой массе воды надо растворить KNO3 массой 120 г, чтобы получить раствор, насыщенный при 300С?
-
Растворимость хлорида натрия при 20 0С равна 36,0 г в 100г воды, а растворимость фторида натрия при этой же температуре – 4,3 в 100г воды. Определите массовые доли солей в насыщенном водном растворе при этой температуре (в %). Можно ли считать обе соли хорошо растворимыми? Концентрированными или разбавленными являются их насыщенные растворы?

Типовая задача №1. Сколько миллилитров воды надо прилить к 80 г 5 %-ного раствора соли, чтобы получить 2 %-ный раствор?
Д
m
(с) = 0,05 (5 %) 2) m(Н2О) = 80 г – 4 г = 76 г
пол.(с) = 0,02 (2 %) 3) На 98 г Н2О – 2 г соли
V(Н2О) = ? х г Н2О – 4 г соли
х = 196 г Н2О
4)Долить надо 196 г – 76 г = 120 г
V(Н2О) = 120 г /1 г/мл = 120 мл
Ответ: 120 мл.
Типовая задача №2. Сколько грамм соли надо добавить к 150 г 0,5 %-ного раствора этой соли, чтобы получить 6 %-ный раствор? Ответ: 8,78 г.;
Д
m (p-ра соли) = 150 г 1) m (соли) = 150 г ∙0,005 = 0,75 г
(p-ра соли) = 150 г 1) m (соли) = 150 г ∙0,005 = 0,75 г
(с) = 0,005 (5 %) 2) m(Н2О) = 150 г – 0,75 г = 149,25 г
(с) = 0,06 (6 %) 3) на 94 г Н2О – 6 г соли
m(соли) = ? на 149,25 г – х г соли х = 9,53 г
4)m(соли добав.) = 9,53 г – 0,75 г = 8,78 г Ответ: 8,78 г.
Типовая задача №2Сколько надо добавить воды к 450 г 23%-го раствора сахара, чтобы получить 18%-й раствор?
Наглядно-логический метод:
В этой задачи следует рассуждать так: поскольку масса взятого вещества (сахара в растворе) не изменится после приливания воды, мы можем найти массу полученного раствора:
mp2 = mв1/ ɷ = 450 · 0,23/0,18= 103,5/0,18 = 575 г
Р1
+
Р2
=
Р3
mp1 = 450 г
mp2 = Х г
mp3 = 450+Х г
ɷ =0.23(23%)
ɷ = 0
ɷ = 0,18 (18%)
mв1 = 450· 0,23 = 103,5г
mв2 = 0г
mв3 = 103,5г
m Н2О – разница масс полученного и исходного растворов (на схеме это Хг).
m Н2О = 575 – 450 = 125 г.
Ответ: надо добавить 125 г воды.
З адачи для самостоятельной работы
адачи для самостоятельной работы
-
Сколько миллилитров воды надо прилить к 200 г 6 %-ного раствора сахара, чтобы получить 1,5 %-ный раствор сахара?
-
Сколько воды надо прилить к 80 г 10 %-ного раствора гидроксида натрия, чтобы получить 3 %-ный раствор?
-
Сколько грамм сахара надо добавить к 300 г 2 %-ного раствора, чтобы получить 5 %-ный раствор?
-
Сколько миллилитров воды надо добавить к 70 г 20 %-ного раствора серной кислоты, чтобы получить 3 %-ный раствор?
-
Как сделать, чтобы 50 г 10 %-ного раствора поваренной соли превратить в 1 %-ный?
-
Масса воды, которую надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5% равна____
-
Масса воды, которую надо добавить к 20 г раствора уксусной кислоты с массовой долей 70% для получения раствора уксуса с массовой долей 3%, равна (с точностью до целых)___
-
К 1150 г 10%-ного раствора сульфата натрия добавили 115 г воды. Масса воды в полученном растворе равна___
-
Масса спирта, которую необходимо добавить к 120 г 20%-го раствора, чтобы получить раствор с массовой долей 25%, равна ______г. (Запишите ответ с точностью до целых.)
-
Масса воды, которую необходимо добавить к 120 г 40%-го раствора формальдегида, чтобы получить раствор с массовой долей 25%, равна 72
-
Из 600 г 10%-го раствора соли необходимо приготовить 12%-й раствор. Для этого потребуется выпарить ______________г воды. (Ответ укажите с точностью до целых.)
-
Из 200 г 10%-го раствора соли необходимо приготовить 8%-й раствор. Для этого потребуется добавить ______________г воды. (Ответ укажите с точностью до целых.)
-
Сколько граммов воды надо добавить к 200 г 25%-го раствора вещества, чтобы получить 20%-й раствор?
V
Типовая задача№1. Смешали 140 г 0,5 %-ного раствора соляной кислоты с 200 г 3 %-ного раствора соляной кислоты. Каково процентное содержание соляной кислоты во вновь полученном растворе?
Д
m
(HCl) = 0,005 (0,5 %) m (HCl) = 140 г ∙ 0,005 = 0,7 г
m (p. HCl) = 200 г 2) m (HCl) во 2ом р-ре
щ(HCl) = 0,03 (3 %) m (HCl) = 200 г ∙ 0,03 = 6 г
(HCl) = ? 3) Общая m (HCl) = 6 г + 0,7 г = 6,7 г
4) m (p-ра полученного) = 140 г + 200 г = 340 г
5) Новая ?(HCl)
(HCl) =6,7 г/340 г = 0,0197 (1,97 %)
Ответ: (HCl) = 0,0197 (1,97 %)
Типовая задача №2. Какой будет массовая доля вещества в растворе, полученном при сливании 30 г 24%-го и 75 г 12%-го растворов серной кислоты?
Наглядно-логический метод:
Р1
+
Р2
=
Р3
mp1 = 30 г
mp2 = 75 г
mp3 = 30+75=105 г
ɷ =0.24(24%)
ɷ = 0,12 (12%)
ɷ = 16, 2/105 = 0, 154
mв1 = 30· 0, 24= 7,2г
mв2 = 75· 0, 12=9 г
mв3 = 7,2+9 = 16,2 г
Ответ: массовая доля вещества в растворе составляет 15, 4%.
Задачи для самостоятельной работы
-
Смешали 50 г 5 %-ного раствора серной кислоты с 80 г 20 %-ного раствора серной кислоты. Каково процентное содержание серной кислоты во вновь полученном растворе?
-
Смешали 70 г 10 %-ного раствора азотной кислоты с 80 г 25 %-ного раствора азотной кислоты. Каково процентное содержание азотной кислоты во вновь полученном растворе?
-
Смешали 60 г 2 %-ного раствора поваренной соли с 80 г 4 %-ного раствора поваренной соли. Каково процентное содержание поваренной соли во вновь полученном растворе?
-
Смешали 20 г 0,5 %-ного раствора сахара с 20 г 1 %-ного раствора сахара. Какова массовая доля сахара во вновь полученном растворе?
-
Какова массовая доля нитрата калия в растворе, полученном после смешивания 90 г 2 %-ного раствора и 110 г 5 %-ного раствора нитрата калия.
-
Вычислите массовую долю хлорида алюминия в растворе, полученном при смешивании 25г 10%-ного и 750г 25%-ного растворов
VIII ТИП. ЗАДАЧИ НА МОЛЯРНУЮ КОНЦЕНТРАЦИЮ
Типовая задача №1. Определить молярную концентрацию раствора серной кислоты, полученного при смешивании 25 мл 10-молярного раствора серной кислоты и 225 мл воды.
Д
V
C(H2SO4) = 10 моль/л в 25 мл – х моль
V(H2O) = 225мл х = 0,25 моль
C(H2SO4) = ? 2) V(р-ра) = 225 мл + 25 мл = 250 мл
3) C(H2SO4) — ? В 250 мл – 0,25 моль
в 1000 мл – х моль
х = 1 моль/л
Ответ: С = 1 моль/л.
Типовая задача №2. Определить молярную концентрацию 73,8 %-ного раствора серной кислоты, плотность которого 1,655 г/мл.


(p) = 1,655 г/мл 2)В 60,42 мл р. – 73,8 г H2SO4
С=? в 1000 мл – х
х = 1221,45 г
3)n = 1221,45 г /98 г/мл = 12,46 моль
С = 12,45 моль/л
Ответ: С = 12,45 моль/л
Типовая задача №3. Какой объем 36,5 %-ного раствора соляной кислоты (пл. 1,18 г/мл) необходимо взять для приготовления 1000 мл 0,1 молярного раствора?
Д

(p-ра) = 1,18 г/мл 2) В 100 г р-ра – 36,5 г HCl
V(р) = 1000 мл х – 3,65 г
С(HCl) = 0,1 моль/л х = 10 г (р-ра)
V(36,5 % р-ра) = ? 3)V(р-ра) = 10 г /1,18 г/мл = 8,4745 мл
Ответ: V = 8,4745 мл
Типовая задача №4. Определить массовую долю азотной кислоты в 4,97 молярном ее растворе, плотность которого 1,16 г/мл. Ответ: 27 %.;

С
(p) = 1,16 г/мл 2) m (HNO3) = 4,97 моль х 63 г/моль = 313,11 г
(HNO3) = ?= 313,11 г/1160 г = 0,27 (27 %)
Задачи для самостоятельной работы
-
Определить молярную концентрацию 56,68 %-ного раствора азотной кислоты, плотность которого равна 1,356 г/мл.
-
Определить молярную концентрацию 18 %-ного раствора соляной кислоты, плотность которого равна 1,089 г/мл.
-
Вычислите молярную концентрацию 10 %-ного раствора серной кислоты (пл. 1,07 г/мл).
-
Вычислите молярную концентрацию 16 %-ного раствора сульфата меди II, плотностью 1,18 г/мл.
IX ТИП. УСЛОЖНЕННЫЕ ЗАДАЧИ.
Типовая задача №1. Из раствора хлорида алюминия массой 110 г и массовой долей соли 10% выпарили 10 г воды и добавили 5 г той же соли. Массовая доля соли в полученном растворе равна _____%.
Решение:
ω=m (вещества)/m (раствора)
Найдем массу хлорида алюминия из первого раствора
m (вещества)= m (раствора)∙ω
m (вещества)= 110г ∙0,1 = 11 г
m (воды) = m (раствора)— m (вещества)= 110-11 = 99 г
По условию выпарили 10 г воды.
Далее в раствор добавляют 5 г соли
Таким образом, в итоговом растворе будет содержаться:
воды 99-10 = 89 г
хлорида алюминия = 11 + 5 = 16 г
суммарная масса = 89 + 16 = 105 г
Подставим значения в формулу ω= 16∙100%/105 =15,2 %
Типовая задача №2. При смешивании 50%-ного и 10%-ного растворов одного и того же вещества получили 15%-ный раствор. Во сколько раз взяли больше по массе 10%-ного раствора, чем 50%-ного? Ответ запишите в виде целого числа.
Решение:
Пусть масса 10%-ного раствора в n раз больше, тогда
m — масса 50%-ного раствора, а n∙m — масса 10%-ного раствора, тогда
0,5m + 0,1∙(n∙m) = 0,15∙(m + n∙m)
0,5 + 0,1n = 0,15 + 0,15n
0,05n = 0,35
n=7 Ответ: 7
Типовая задача №3. Сколько граммов 10%-го раствора соли надо добавить к 300 г 30%-го раствора этой же соли, чтобы получить 14%-ный раствор? Ответ запишите в виде целого числа.
Решение:
Пусть m — масса добавляемого 10%-го раствора в граммах, тогда
m∙0,1+300∙0,3 = (m+300)∙0,14
0,1m+90=0,14m+42
0,04m=48
(г)
Ответ: 1200г
Типовая задача №4. Определите массы 10%-ного и 50%-ного (по массе) растворов, необходимые для получения 200 г 20%-ного раствора.
Решение:
ω1 = 10%, ω2 = 50%, ω3= 20%, m3 = 200 г, m2 = 200 — m1
Составляем уравнение:
m1∙ 10 + (200 — m1) ∙50 = 200 ∙20
40∙m1 = 6000
m1 = 150 (г),
m2 = 200 — m1 = 200 — 150 = 50 (г)
Ответ: 150 г, 50 г.
Типовая задача №5. Определите массы 25%-ного (по массе) раствора и воды, необходимые для получения 200 г 10%-ного раствора.
Решение:
ω1 = 25%, ω2 = 0%, ω3= 10%, m3 = 200 г
Составляем уравнение:
m1∙ 25 + m2 ∙ 0 = 200∙10
25 ∙m1 = 2000
m1 = 80 (г),
m2 = 200 — m1 = 200 — 80 =120 (г)
Ответ: 80 г, 120 г.
Типовая задача №6. Какую массу оксида серы (VI) следует добавить к 500 г 20%-ного раствора серной кислоты, чтобы увеличить её массовую долю до 40%?
Решение:
1) Составить уравнение химической реакции
SO3+H2O=H2SO4
2) Рассчитать массу серной кислоты, находившейся в исходном растворе и получившейся из х моль оксида серы (VI):
m1 (H2SO4)= m1(р—ра) ∙ ω1 (H2SO4)= 500 • 0,2 = 100 г
m (SO3)=n(SO3)∙M(SO3) = 80x (где х — число молей оксида серы)
m2 (H2SO4)= n(H2SO4) ∙M(H2SO4) = 98x
3) Рассчитать массу раствора и суммарную массу серной кислоты в нём:
m2(р-ра) = m2(р-ра) +m (SO3)= 500 + 80Х
m3 (H2SO4)= m1(H2SO4) + m2 (H2SO4) = 100 + 98x
4) Найти массу SO3, необходимую для растворения:
ω2 (H2SO4) = m3 (H2SO4)/ m2(р—ра)
0,4 = 100+98х/500+80х
откуда х = 1,52 моль, m(SO3) =1,52 · 80 = 121,6 г.
Ответ: 121,6г
Задачи для самостоятельной работы
-
Сколько граммов надо взять 10 %-ного раствора и 35 %-ного раствора соляной кислоты, чтобы получить 300 г 20 %-ного раствора соляной кислоты?
-
Сколько граммов 20 %-ного и 50 %-ного раствора сахара надо взять, чтобы получить 150 г 30 %-ного раствора сахара?
-
Определить массовую долю бромоводорода в растворе, полученном при растворении 280 л (н. у.) бромоводорода в 1 л воды.
-
Определить массу воды, в которой нужно растворить 44,8 л хлороводорода (н. у.), чтобы получить 14,6 %-ный раствор соляной кислоты.
-
При упаривании 76,336 л 28 %-ного раствора гидроксида натрия (пл. 1,31г/мл) получено 70 кг раствора. Какова массовая доля гидроксида натрия в оставшемся растворе?
-
Какой объем 15 %-ного раствора гидроксида натрия плотностью 1,16 г/мл можно приготовить из 2 л его 33 %-ного раствора плотностью 1,36 г/мл?
-
Сколько граммов 20%-го раствора кислоты надо добавить к 200 г 5%-го раствора этой же кислоты, чтобы получить 8%-ый раствор? Ответ запишите в виде целого числа.
-
При смешивании 40%-ного и 15%-ного растворов одного и того же вещества получили 20%-ный раствор. Во сколько раз взяли больше по массе 15%-ного раствора, чем 40%-ного? Ответ запишите в виде целого числа.
-
Какую массу оксида хрома (VI) следует добавить к 275 г 10%-го раствора хромовой кислоты, чтобы увеличить ее массовую долю в полтора раза?
-
При нагревании гидрокарбонат калия превращается в карбонат. Рассчитайте массовую долю гидрокарбоната калия в исходном растворе, нагреванием которого можно получить 8%-ный раствор карбоната калия.

-
-
Тип. Задачи на определение массы веществ в растворе
-
-
m (соли) 0,6 г, V (H2O) 59,4 мл
-
m (соли) 1,4 г, V (H2O) 68,6 мл
-
m (соли) 0,16 г, V (H2O) 39,84 мл
-
m (соли) 0,16 г, V (H2O) 79,84 мл
-
m (соли) 0,09 г, V (H2O) 89,91мл
-
m (соли) 0,12 г, V (H2O) 59,88мл
-
m (соли) 0,25 г, V (H2O) 49,75мл
-
m (соли) 0,7 г, V (H2O) 69,3мл
-
m (соли) 12 г, V (H2O) 108мл
-
m (соли) 5,4 г, V (H2O) 84,6мл
-
m (соли) 3 г, V (H2O) 147мл)
-
m (соли) 0,6 г, V (H2O) 149,4мл
-
m (соли) 12 г, V (H2O) 188мл
-
m (соли) 4,2 г, V (H2O) 135,8мл
-
m (йода) 15г, m (спирта) 285г
II тип. Задачи на определение массы веществ, необходимой для получения раствора нужной концентрации
-
392 мл
-
1,21 г
-
50г
-
225г
-
400г
-
5,26г
-
1400г
III тип. Задачи на определение массовой доли веществ в растворе
-
0,074(7,4%)
-
0,032 (3,2)
-
0,014 (1,4%)
-
0,00166 (0,16%)
-
0,038 (3,8%)
-
0,0167 (1,67%)
-
0,25 (25%)
-
0,2 (20%)
-
0,35 (35%)
-
0,0234 (2,34%)
-
0,2582 (25,82%)
-
0,2 (20%)
-
0,182 (18,2%)
-
1,8%
IV тип. Задачи на определение процентного содержания веществ в растворе
-
0,286 (28,6 %)
-
0,0186 (1,86 %).
-
0,07(7 %)
-
0,16 (16 %)
-
0,048 (4,8 %)
-
0,145(14,5%)
-
061 (6,1%)
-
0,4 (40%)
-
0,044 (4,4%)
-
0,112 (11,2%)
-
0,06 (6%)
V тип. Задачи с использованием понятия растворимости
-
60 г
-
37 г
-
Раствор будет ненасыщенным.
-
80г
-
814,5 г
-
35,7г/100гH2O
-
300г
-
ω (NaCI) = 26,5% ω(NaF)=4,1%
VI тип. Задачи на определение массы или объема вещества при добавлении его в раствор для изменения концентрации
-
600 мл
-
186,7 мл
-
9,47 г
-
396,7 мл
-
долить 450 мл H2O
-
200г
-
447г
-
1150г
-
8г
-
72г
-
100г
-
50г
-
50г
VII тип. Задачи на определение процентного содержания или массовой доли веществ в растворе, полученном при смешивании растворов разной концентрации
-
-
0,142 (14,2 %)
-
0,18 (18%)
-
0,00314 (3,14 %)
-
0,0075 (0,75 %)
-
0,0365 (3,65 %)
-
0,245 (24,5%)
-
VIII тип. Задачи на молярную концентрацию
-
12,2 моль/л
-
5,37 моль/л
-
1,09 моль/л
-
1,18 моль/л
IX тип. Усложненные задачи.
-
-
120 г (35 %) и 180 г (10 %)
-
100 г (20 %) и 50 г (50 %)
-
50,31 %
-
427 г
-
40 %
-
5,16 л
-
50г
-
4
-
13,35г
-
11,3г
-
Используемая литература
-
Егоров А.С. репетитор по химии. Ростов- на-Дону. «Феникс», 2014г.
-
Н.И. Берман. Решение типовых задач. Москва. «Слово», 1997г.
-
КаверинаА.А.ЕГЭ-2013. Химия: типовые экзаменационные варианты. Москва. «Национальное образование», 2013 г
-
Радецкий А.М.,Горшкова В.П. Дидактический материал по химии. Москва. «Просвещение», 2005г.
-
Савинкова Е.В., Логинова Г.П.Химия.Сборник задач. 8-9 классы. Москва. «Аст-пресс», 2001г.
-
Хомченко Г.П. Пособие по химии для поступающих в вузы. Москва. «Оникс», 2003 г.
-
Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в вузы. Москва. «Оникс», 2004 г.
-
Хомченко И.Г. Сборник задач и упражнений по химии. Для средней школы. Москва. «Оникс»,2005 г.
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Расчеты концентрации
растворенных веществ
в растворах
Решение задач на разбавление растворов особой
сложности не представляет, однако требует
внимательности и некоторого напряжения. Тем не
менее можно упростить решение этих задач,
используя закон разбавления, которым пользуются
в аналитической химии при титровании растворов.
Во всех задачниках по химии показаны решения
задач, представленных как образец решения, и во
всех решениях используется закон разбавления,
принцип которого состоит в том, что количество
растворенного вещества и масса m в исходном и разбавленном
растворах остаются неизменными. Когда мы решаем
задачу, то это условие держим в уме, а расчет
записываем по частям и постепенно, шаг за шагом,
приближаемся к конечному результату.
Рассмотрим проблему решения задач на
разбавление, исходя из следующих соображений.
• Количество растворенного вещества :
= c•V,
где c – молярная концентрация
растворенного вещества в моль/л, V – объем
раствора в л.
• Масса растворенного вещества m(р.в.):
m(р. в.) = m(р-ра)•,
где m(р-ра) – масса раствора в г, – массовая доля
растворенного вещества.
Обозначим в исходном (или неразбавленном)
растворе величины c, V, m(р-ра), через с1, V1,
m1(р-ра), 1,
а в разбавленном растворе – через с2, V2,
m2(р-ра), 2.
Составим уравнения разбавления растворов. Левые
части уравнений отведем для исходных
(неразбавленных) растворов, а правые части – для
разбавленных растворов.
Неизменность количества растворенного вещества
при разбавлении будет иметь вид:
Сохранение массы m(р. в.):
Количество растворенного вещества связано с его массой m
(р. в.) cоотношением:
= m(р.
в.)/M(р. в.),
где M(р. в.) – молярная масса растворенного
вещества в г/моль.
Уравнения разбавления (1) и (2) связаны между собой
следующим образом:
с1•V1 = m2(р-ра)•2/M(р. в.),
m1(р-ра)•1 = с2•V2•M(р.
в.).
Если в задаче известен объем растворенного
газа V(газа), то его количество вещества связано с объемом
газа (н.у.) отношением:
= V(газа)/22,4.
Уравнения разбавления примут соответственно
вид:
V(газа)/22,4 = с2•V2,
V(газа)/22,4 = m2(р-ра)•2/M(газа).
Если в задаче известны масса вещества или
количество вещества, взятого для приготовления
раствора, то в левой части уравнения разбавления
ставится m(р. в.) или , в зависимости от условия задачи.
Если по условию задачи требуется объединить
растворы разной концентрации одного и того же
вещества, то в левой части уравнения массы
растворенных веществ суммируются.
Довольно часто в задачах используется плотность
раствора (г/мл). Но
поскольку молярная концентрация с
измеряется в моль/л, то и плотность следует
выражать в г/л, а объем V – в л.
Приведем примеры решения «образцовых» задач.
Задача 1. Какой
объем 1М раствора серной кислоты надо взять,
чтобы получить 0,5 л 0,1М H2SO4?
Дано:
с1 = 1 моль/л,
V2 = 0,5 л,
с2 = 0,1 моль/л.
Найти:
V1 = ?
Решение
V1•с1 = V2•с2,
V1•1 = 0,5•0,1; V1 = 0,05 л,
или 50 мл.
Ответ. V1 = 50 мл.
Задача 2 ([1],
№ 4.23). Определите массу раствора с массовой
долей (СuSО4)
10% и массу воды, которые потребуются для
приготовления раствора массой 500 г с массовой
долей
(СuSО4) 2%.
Дано:
1 = 0,1,
m2(р-ра) = 500 г,
2 = 0,02.
Найти:
m1(р-ра) = ?
m(H2O) = ?
Решение
m1(р-ра)•1 = m2(р-ра)•
2,
m1(р-ра)•0,1 = 500•0,02.
Отсюда m1(р-ра) = 100 г.
Найдем массу добавляемой воды:
m(H2O) = m2(р-ра) – m1(р-ра),
m(H2O) = 500 – 100 = 400 г.
Ответ. m1(р-ра) = 100 г, m(H2O)
= 400 г.
Задача 3 ([1],
№ 4.37). Какой объем раствора с массовой долей
серной кислоты 9,3%
( = 1,05 г/мл)
потребуется для приготовления 0,35М раствора H2SO4
объемом 40 мл?
Дано:
1 = 0,093,
1 = 1050 г/л,
с2 = 0,35 моль/л,
V2 = 0,04 л,
М(H2SO4) = 98 г/моль.
Найти:
V1 = ?
Решение
m1(р-ра)•1 = V2•с2•М(H2SO4),
V1•1•
1
= V2• с2•М(H2SO4).
Подставляем значения известных величин:
V1•1050•0,093 = 0,04•0,35•98.
Отсюда V1 = 0,01405 л, или 14,05 мл.
Ответ. V1 = 14,05 мл.
Задача 4 [2]. Какой
объем хлороводорода (н.у.) и воды потребуется,
чтобы приготовить 1 л раствора ( = 1,05 г/см3), в котором
содержание хлороводорода в массовых долях равно
0,1
(или 10%)?
Дано:
V(р-ра) = 1 л,
(р-ра) = 1050 г/л,
= 0,1,
М(HCl) = 36,5 г/моль.
Найти:
V(HCl) = ?
m(H2O) = ?
Решение
V(HCl)/22,4 = m(р-ра)•/М(HCl),
V(HCl)/22,4 = V(р-ра)•(р-ра)•
/М(HCl),
V(HCl)/22,4 = 1•1050•0,1/36,5.
Отсюда V(HCl) = 64,44 л.
Найдем массу добавляемой воды:
m(H2O) = m(р-ра) – m(HСl),
m(H2O) = V(р-ра)•(р-ра) – V(HCl)/22,4• М(HCl),
m(H2O) = 1•1050 – 64,44/22,4•36,5 = 945 г.
Ответ. 64,44 л HCl и 945 г воды.
Задача 5 ([1],
№ 4.34). Определите молярную концентрацию
раствора с массовой долей гидроксида натрия 0,2 и
плотностью 1,22 г/мл.
Дано:
= 0,2,
= 1220 г/л,
М(NaOH) = 40 г/моль.
Найти:
c = ?
Решение
m(р-ра)• = с•V•М(NaOH),
m(р-ра)• = с•m(р-ра)•М(NaOH)/
.
Разделим обе части уравнения на m(р-ра) и
подставим численные значения величин.
0,2 = c•40/1220.
Отсюда c = 6,1 моль/л.
Ответ. c = 6,1 моль/л.
Задача 6 ([1],
№ 4.30). Определите молярную концентрацию
раствора, полученного при растворении сульфата
натрия массой 42,6 г в воде массой 300 г, если
плотность полученного раствора равна 1,12 г/мл.
Дано:
m(Na2SO4) = 42,6 г,
m(H2O) = 300 г,
= 1120 г/л,
M(Na2SO4) = 142 г/моль.
Найти:
c = ?
Решение
m(Na2SO4) = с•V•М(Na2SO4).
Подставляя численные значения, получим:
42,6 = с•(42,6 + 300)/1120•142.
Отсюда с = 0,98 моль/л.
Ответ. с = 0,98 моль/л.
Задача 7 ([1],
№ 4.19). В лаборатории имеются растворы с
массовой долей хлорида натрия 10% и 20%. Какую массу
каждого раствора надо взять для получения
раствора с массовой долей соли 12% и массой 300 г?
Дано:
1 = 0,1,
2 = 0,2,
3 = 0,12,
m3(р-ра) = 300 г.
Найти:
m1(р-ра) = ?
m2(р-ра) = ?
Решение
m1(р-ра)•1 + m2(р-ра)•
2 = m3(р-ра)•
3,
m1(р-ра)•0,1 + m2(р-ра)•0,2
= 300•0,12.
Поскольку m1(р-ра) + m2(р-ра) = 300
г, то получаем систему из двух уравнений с двумя
неизвестными. Решая совместно два уравнения,
находим:
m1(р-ра) = 240 г, m2(р-ра) =
60 г.
Ответ. m1(р-ра) = 240 г, m2(р-ра)
= 60 г.
Задача 8 ([1],
№ 4.48). В воде массой 100 г при температуре 0 °С
растворяется фторид натрия массой 4,1 г, а при
температуре 40 °С – массой 4,5 г. Какая масса
фторида натрия выпадет в осадок при охлаждении
насыщенного при температуре 40 °С раствора NaF
массой 500 г до температуры 0 °С?
Дано:
m1(NaF) = 4,1 г,
m2(NaF) = 4,5 г,
m2(р-ра) = 500 г,
– массовая доля
NaF,
(1 – ) – массовая
доля воды.
Найти:
m(NaF) = ?
Решение
m(NaF) = m2(р-ра) – m1(р-ра).
Поскольку m2(Н2О) (40 °С) = m1(Н2О)
(0 °С), то можно записать:
m2(р-ра)•(1 – 2) = m1(р-ра)•(1 –
1).
Подставляем значения:
500•(1 – 4,5/(4,5 + 100)) = m1(р-ра)•(1 –
4,1/(4,1 + 100)).
Отсюда m1(р-ра) = 104,1/104,5•500 = 498,09 г,
m(NaF) = 500 – 498,09 = 1,91 г.
Ответ. m(NaF) = 1,91 г.
ЛИТЕРАТУРА
1. Хомченко Г.П., Хомченко И.Г. Задачи по химии
для поступающих в вузы. М.: Новая волна, 2002.
2. Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.:
Просвещение, 1990, с. 166.




















 ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ВЕЩЕСТВ В РАСТВОРЕ
ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ВЕЩЕСТВ В РАСТВОРЕ

 II
II

 V
V


 (p-ра соли) = 150 г
(p-ра соли) = 150 г



