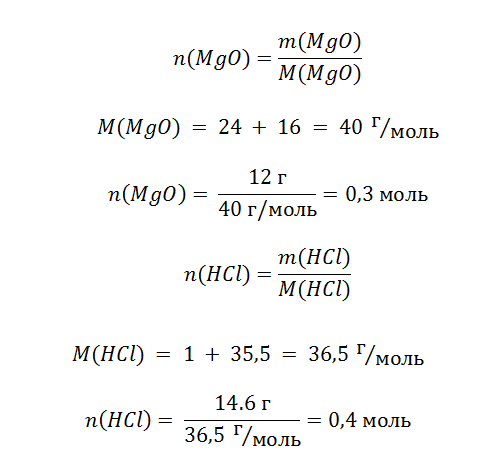Задачи, связанные с изучением растворов, можно условно разделить на следующие группы:
1. вычисление массовой доли растворённого вещества (в процентах) и массы растворенного вещества;
2. вычисление молярной концентрации и массы вещества в растворе определённой молярной концентрации;
3. разбавление растворов с массовой долей растворённого вещества и молярной концентрацией;
4. смещение растворов с массовой долей растворённого вещества и молярной концентрацией;
5. расчёты по химическим уравнениям с применением растворов различной концентрации.
:
вычисление массовой доли растворённого вещества (в процентах) и массы растворенного вещества
Необходимо знать условные обозначения физических величин, которые используются при решение задачи:
· m(р.в.), или m, — масса растворённого вещества в растворе, например, m(CACL2);
· m(р-ра.), или m(р.), — масса раствора;
· w(р.в.), или w, — массовая доля растворённого вещества.
Растворённое вещество является частью целого – раствора. Следовательно, масса раствора представляет собой сумму масс растворённого вещества и растворителя (воды):
w(р.в.) = m(р.в.)/m(р-ра.)*100%
Задача 1: Какова массовая доля растворённого вещества в растворе, полученном растворением хлорида кальция массой 10г в воде 70г?
|
Дано m (CaCL2) =10г m(H2O) = 70г |
Решение w(р.в.) = m(р.в.)/m(р-ра.)*100% w(CaCL2) = m(CaCL2) /m(р—ра.)*100% в данном случае нам из формулы не известна масса раствора. Найдём массу раствора. m(р.в.) –это (CaCL2) его10г m(р-ра) = m(р.в.) + m(H2O) m(р-ра) =10г +70г =80г w(CaCL2) =10г :80г = 0.125*100%=12.5% |
|
Найти : w(CaCL2) — ? |
|
|
Ответ: |
Массовая доля CaCL2 в полученном растворе 12,5% |
2. Приготовление раствора с заданной массовой долей растворённого вещества.
Задача 2
Сколько безводного карбоната натрия и воды надо взять, чтобы приготовить раствор массой 70 г с массовой долей карбоната натрия 10%
|
Дано: m(р-ра) – 70г w(р.в.) – 9% = 0,09 |
Решение w(р.в.) = m(р.в.) / m (р-ра) нам не известно из формулы m(р.в.) следует m(р.в.)=w(р.в.) * m (р-ра) m (р-ра) = m(р.в.) + m(H2O), отсюда, m(H2O) = m (р-ра) — m(р.в.) ; m(р.в.) = 0,09 * 70г = 6.3г m(H2O) = 70г – 6.3г = 63,7г |
|
Найти: m(H2O) -? m(Na2CO3) -? |
|
|
Ответ: |
Для приготовления раствора надо взять 6,3г карбоната натрия (Na2CO3) и 63,7г или 63,7 мл. воды (H2O) |
3. Вычисление молярной концентрации раствора.
Исходные уравнение для вычислений:
с(р.в.) = n(р.в) / V(р-ра) или с(р.в.) = v(р.в.) / V(р-ра)
с(р.в.) – молярная концентрация растворённого вещества,
n(р.в) или v(р.в.) – количество растворенного вещества,
V(р-ра) – объём раствора.
Задача 3
В воде растворили гидроксид натрия массой 21,4г . Объём раствора довели до 300 мл.. Определите молярную концентрацию полеченного раствора.
|
Дано: m(NaOH) = 21.4г V(р-ра) –300мл.= 0.3л |
Решение: с(р.в.) = n(р.в) / V(р-ра) n(р.в) =m / M; M(NaOH) = 40г/моль n(NaOH) =21,2г :40г/моль = 0,53моль c(NaOH) = 0.53моль : 0,3л = 1,77моль/литр или 1,8M |
|
Найти: c(NaOH)-? |
|
|
Ответ: |
Концентрация полученного растворённого 1.8 моль/л |
4, Приготовление раствора заданной молярной концентрации
Растворы молярной концентрации можно готовит из твёрдых, жидких и газообразных веществ. В случае жидкого вещества необходимо знать его плотность; если раствор готовится из газообразного вещества, то применяется молярный объём газов (при н.у.)
Вычисления, связанные с приготовлением молярного раствора, часто являются составным компонентом в расчётах по химическим уравнениям (комбинированные задачи).
Задача 4 Какая масса хлорида цинка потребуется для приготовления раствора этой соли объёмом 500 мл. и с концентрацией 1.15 моль/л
|
Дано: V(р-ра) = 500мл или 0,5 c(ZnCL2) = 1.15моль/л |
Решение: m(ZnCL2) = n(ZnCL2) * M(ZnCL2) M(ZnCL2) =136г/моль c(р.в.) = n(р.в.) / V(р-ра)концентрация хлорида цинка нам дана в задаче, а количество вещества нам не известна n(р.в.) =c(р.в.) * V(р-ра) n(ZnCL2) = 1.15моль/л * 0,5 =0,575моль m(ZnCL2) = n(ZnCL2) * M(ZnCL2) m(ZnCL2) =0,575моль * 136г/моль =78г |
|
Найти: m(ZnCL2) = ? |
|
|
Ответ: |
Для приготовления 500мл 1.15Mраствора потребуется 78г хлорида цинка |
План урока:
Основные величины и формулы их нахождения
Основные величины и формулы их нахождения
Ключевым понятием в химии является вещество. Урок 2 в данном курсе, напомнит Вам, все необходимые сведения. Формула для определения количества вещества, в зависимости от исходных данных, выражается в следующем виде.
Для веществ характерно взаимодействие друг с другом. Перед химиками стоит задача вычислить какое количество вещества необходимо для реакции с другим веществом.В химической промышленности, на производстве важно знать, какая масса или объём реагентов необходим, и сколько возможно получить в итоге реакции продукта. Вещества реагируют между собой в определённых количествах, точнее эквивалентах. Как трактовать последнее предложение. Вспомните себя маленькими, когда вы только начинали изучать количество, на примере мячиков, яблок, конфет и т.д.
Согласитесь, что самому большому шарику будет тесно в маленьком стаканчике, впрочем, как и маленькому шарику не совсем уютно будет в большом стаканчике. Т.е. мы выбираем стаканчик для шарика эквивалентно его размеру.
Возьмём, к примеру, кислород, который реакционно-способный и окисляет другие соединения.
Вспомним закон сохранения массы вещества (ЗСМВ), без которого невозможно составить химические уравнения.
Источник
Следует отметить, чтобы прореагировало 1 моль СН4, необходим кислород количеством молей 2. Снова обращаясь к базовому закону, мы видим, что реагентов и продуктов масса одинаковая, точнее 80 г. Почему именно эта цифра, и откуда она взялась. Для этого смотрим на уравнение реакции.
Другими словами, чтобы образовалось 1 моль СО2 и 2 моль Н2О, необходимо чтобы метан и кислород прореагировали пропорционально 1: 2.
Выразим массу, которая будет соответствовать этому количеству вещества.
m = n * M
Вспомним, каким образом вычисляется молярная масса.
Давайте попробуем чуть-чуть усложниться, к примеру, будет реагировать не 1 моль метана, а 2,5 моль. Сколько тогда потребуется О2?
И здесь приведём такой наглядный пример. Один килограмм конфет стоит 2 рубля. Сколько Вам понадобится денег, чтобы купить 2,5 кг. Не составит труда дать ответ, что необходимо потратить 5 рублей. А если, Вы захотите 4 кг, то придётся попросить у родителей уже 8 рублей. Вот эти размышления перенесём на наш пример.
Какое количество мы бы не взяли метана, то кислорода необходимо в 2 раза больше. Т.е. для реакции 2,5 моль СН4 необходим О2 количеством 5 моль.
Количество вещества – это уникальная величина, от которой можно перейти к другим параметрам вещества (m или V), используя основные формулы.
Рассмотрим задачи на определение массы вещества,а также объёма с помощью химических уравнений. Как и при решении, абсолютно всех задач, первое, что мы делаем, читаем внимательно условие и выписываем все известные физические величины (дано), а также определяем, что неизвестно (найти).
Задача 1. Сколько литров (н. у.) кислорода необходимо потратить для полного сгорания 8,5 г сероводорода.
Дано:
m(H2S) = 8,5 г
Найти:
V(O2) — ?
Решение.
Переведём условие задачи на химический язык, т.е. составим уравнение реакции. Важно отметить, что для удобства и лёгкости решения подчеркните те соединения, о которых идёт речь.
Теперь обратим внимание на коэффициенты в химических уравнениях, именно они отвечают за соотношение веществ.
Следует заметить, что массу (г) сероводорода необходимо выразить в количестве (моль).
Запишем мольное соотношение сероводорода и кислорода, в значение числителя подставляем коэффициенты с уравнения, а в знаменателе – что известно в условии задания.
Из пропорции определим число молей для кислорода.
Ответим на вопрос задачи (находим объём кислорода)
Ответ. V(O2) = 8.4 л
Теперь представим следующую ситуацию, Вам на день Рождения или на другой праздник подарили деньги, чтобы Вы приобрели себе желаемую вещь. К примеру, вы хотите себе наушники, карту памяти и новый чехол на телефон. Возникает закономерный вопрос, а хватит ли Вам денег. Такие задачи встречаются и в химии.
Задача 2. Хватит ли 10 л кислорода для сгорания 12 г магния и 0,6 г углерода (н.у.)?
Дано:
V(O2) = 10 л
m(Mg) = 12 г
m(C) = 0,6 г
Найти:
V(O2) — ?
Решение
Особенность этой задачи, что будет два уравнения реакции, взаимодействие О2 отдельно с магнием и углеродом. Это как покупка в двух разных магазинах. Используя алгоритм, приведённый выше, вычислим количество вещества кислорода. Следует заметить, что отдельно ведём расчёт по магнию (или по углероду), заполняя данные таблицы.
Обратите внимание, в предыдущей задаче кислород был в избытке, в объёме 10 – 6,72 = 3,28 л. Этому избытку не с чем реагировать. Представьте, что Вы помощник деда Мороза и пакуете новогодние подарки. Допустим в одном наборе должно содержаться 5 шоколадных конфет и 8 карамелек. Вам необходимо разделить 55 шоколадки и 72 карамельки. Вопрос: сколько наборов у Вас получится? Проведём нехитрые математические исчисления, знакомые Вам ещё с курса математики младшей школы.
55 : 5 = 11
72 : 8 = 9
И что получается, что шоколадки можно разместить в 11 наборов, а карамельки только в 9. Таким образом, получится 9 новогодних подарков, и 10 (5 ∙ 2 = 10) шоколадок будут лишними, они в избытке.
Расчёты по химическим уравнениям, где один из реагентов берётся в избытке (т.е. его больше, чем необходимо), проводятся аналогично, как и с одним известным веществом.
Задача 3. 48,75 цинка привели в реакцию с 5,6 л (условия нормальные) хлора. Сколько соли получилось в итоге, ответ выразите в граммах.
Дано:
V(Cl2) = 5.6 л
m(Zn) = 48.75 г
Найти:
m(ZnCl2) — ?
Решение.
Составим схему взаимодействия, не забудьте отметить количество реагирующих молей.
Теперь наша с Вами задача определить, какое вещество прореагировало полностью, а какое осталось в избытке. Вспомните пакеты с подарками, какие конфеты мы разложили полностью и почему остались шоколадные лишними. Поможет определиться с избытком, решение неравенства.
n (Zn) ? n (Cl2) ?
Расчёт для цинка производится согласно формуле:
Хлор – это газообразное вещество, поэтому нужно применить формулу:
Сравним полученные значения n(Zn) > n(Cl2), цинк находится в избытке, поэтому расчёт ведём по хлору, который прореагировал полностью количеством 0,25 моль.
Из пропорции вычислим количество образованной соли (не забываем, что числитель отвечает за коэффициенты, а знаменатель – это данные в условии).
Ответ. Масса соли равна 34 г.
Большинство химических реакций происходит в растворе. Однако при расчётах необходима масса именно растворённого вещества, которое непосредственно реагирует. Допустим, команда с 12 человек, которая на 25% состоит из девочек и 75% мальчиков, поехала на соревнования. В одном из этапов участвуют только мальчики. Ваша задача определить, сколько мальчиков поехало на соревнования.
Вот эти 9 мальчишек и участвовали в определённом туре, а девочки на данный момент были не в счёт, они были в группе поддержки.
Задача 4. На 12 г оксида магния подействовали 146 г раствора соляной кислоты, с массовой долей раствора 10%. Вычислите, сколько соли образовалось в процессе взаимодействия этих веществ?
Дано:
m(MgO) = 12 г
mр-ра(HCl) = 146 г
Wр-ра(HCl) = 10%
Найти:
m(MgCl2) — ?
Решение
Особенностью этой задачи является то, что в условии указана масса всего раствора, а необходимо знать только,сколько содержится кислоты, которая будет реагировать с MgO. Формула определения массы вещества, находящегося в растворе, выражается в следующем виде.
Обратите внимание, что из всей массы раствора (146 г) реагирует только 10%, а именно 14,6 г.
Теперь задача определить, какого из реагентов больше и он прореагирует не полностью.
Схема показывает, что для реакции 0,3 моль MgO требуется 0,6 моль кислоты. На это размышление нам указывает схема реакции. Для полного растворения оксида необходимо потратить в 2 раза больше HCl, смотрите соотношение 1:2.Однако в нашем распоряжении есть только 0,4 моль, поэтому n(MgO) >n(HCl), оксид находится в избытке, в то время как кислота прореагировала полностью и мы смело можем использовать её количество вещества для расчёта массы соли.
Снова воспользуемся пропорцией, чтобы узнать количество образованной соли.
Теперь не составит особого труда найти массу.
Ответ. m(MgCl2) = 19 г.
В желаниях человечества изобрести идеальную машину, во время работы которой не будет никаких потерь. Однако на выходе не бывает заветных 100%. Аналогично и во время химических процессов на производстве или лаборатории не удаётся получить продукт с выходом реакции 100%. При решении задач мы вычисляем так называемый теоретический выход, что должно быть в идеальной ситуации. Но мы живём в реальном мире, где есть потери: газообразные продукты могут улетучиться, осадок, образованный в процессе реакции, можно не в полной мере выделить из раствора. Поэтому практический выход всегда будет меньше теоретического.
Задача 5. В результате взаимодействия 59,5 г нитрата серебра с избытком раствора соляной кислоты, был выделен осадок массой 45 г. Определите выход реакции.
Дано:
m(AgNO3) = 59.5 г
m(осадка) = 45 г
Найти:
η — ?
Решение.
Своеобразие этого типа задач в том, что необходимо отличать теоретическую и практическую массу продукта. Маленькой подсказкой вам послужит время глагола, если видите прошедшее или настоящее время (получено, выделили), значит это практическая масса. Чтобы найти выход продукта, необходимо вычислить теоретическую массу или объём (вот за эти параметры как раз и отвечает схема реакции).
Используя привычный алгоритм, определим n нитрата серебра.
Следующим шагом будет определить количество вещества, выпавшего в осадок (AgCl).
Вычислим массу осадка, это будет теоретическая, т.е. та, которая должна получиться, если бы не было потерь.
В идеальной ситуации, мы бы получили 50,225 г, что составило бы 100%. Однако во время процесса образовалось только 45 г продукта. Получается, выход реакции будет меньше и составит:
Ответ. η = 89,6%
Особый тип задач на определение молярной массы вещества. Состав соединений мы можем узнать с химической формулы. При решении этого типа необходимо вспомнить следующие понятия– это доля (массовая) элемента и относительная плотность газов.
Однако следует заметить, что величину D мы можем использовать только для газообразных соединений.
Задача 6. Определите объём кислорода (условия нормальные), что потребуется для сжигания вещества массой 180 г, которое состоит на 26,67 % из углерода, 2,24 % водорода, а также кислорода. Известно, что равняется 45.
Дано:
DH2 = 45
W(C) = 26.67%
W(H) = 2.24%
m(CxHyOz) = 180 г
Найти:
Формула — ?
V(O2) — ?
Решение.
Чтобы решить эту, на первый взгляд, запутанную задачу, нам необходимо сначала определить, что это за соединение, чтобы была возможность составить уравнения химических реакций.
Однако в условии известно только процентный состав вещества. Но всё-таки, этих данных нам достаточно, чтобы найти формулу вещества.
Запишем выражение для нахождения количества атомов углерода (х), водорода (у) и кислорода (z). Представьте, вы купили в коробке шоколадные конфеты из трёх видов.
Следует отметить, что они имеют разную форму, начинку, как следствие и вес. Вернёмся к нашему веществу, которое состоит из 3 элементов, имеющих разнуюAr. Так вот на долю углерода выпадает 26,67% (условно допустим, что это конфета в виде сердечка), водород занимает 2,24% (конфета с воздушной начинкой), а все остальные конфеты в коробке с ореховой начинкой (в соединении их роль играют атомы кислорода). Вопрос: сколько штук занимает каждый вид конфетки? Логично узнать вес одной конфеты (в нашем случае это Ar элементов). Разделив процентное содержание на атомную массу элемента, получим их количество.
Такого же ведь количества конфет не будет в коробке, вы, наверное, слабо себе можете представить, что там будут находиться части конфет. Чтобы получить целые числа, необходимо, выбрать из этих чисел самое маленькое и каждое на него разделить.
Вычисления показывают, что соотношение элементов в данном соединении можно записать в следующем виде: СНО2. Уточним правильность наших расчётов, определив его молекулярную массу, используя величину D.
Обратите внимание, первоначальная запись формулы вещества СНО2 отвечает молярной массе
Однако, это вещество в 45 раз тяжелее водорода, что отвечает 90 г/моль.Чтобы получить её, мы сохранили соотношение элементов 1:1:2, при этом умножили количество каждого элемента на 2. Следовательно, молекулярная формула С2Н2О4.
Количество вещества, отвечающее 45 г вещества С2Н2О4, вычислим привычным методом.
Используя мольное соотношение, определим число молей кислорода, а также его объём.
Ответ. Для сгорания 45 г С2Н2О4 необходимо 5,6 л кислорода.
Обобщая всё выше сказанное, как решать расчётные задачи по химии, с улыбкой или с шоком, принимать решение только Вам. Рассмотрим ещё одну задачу.
Задача 7. Пропан (С3Н8), объёмом 84 л, который содержит 25% негорючих примесей, сожгли в 56 л кислорода. Газ, который выделился, пропустили через гидроксид бария, определите массу осадка, если выход продукта реакции составил 89%.
Дано:
V(С3H8) = 84 л
W(примеси) = 25%
V(O2) = 56 л
η = 89%
Найти:
m(осадка) — ?
Решение.
На что здесь следует обратить внимание. Пропан содержит не горючие примеси. Представьте, вам необходимо в торт 84 г очищенных орехов. Вы идёте в магазин, приобретаете необходимую массу, но придя домой обнаружили, что там 25% содержится мелких остатков скорлупы. Т.е. масса орехов не будет 84 г. Чистых орехов будет 100% — 25% = 75%.
Негорючие примеси входят в общий объём, а гореть будет только пропан. Находим, сколько же его содержится в 84 л.
Составим схему горения газа
Определим количество вещества реагирующих газов
На первый взгляд кажется, что пропан в избытке n(C3H8) > n(O2). Однако посмотрите на уравнение реакции, чтобы сгорело 2,8125 моль пропана необходимо в 5 раз больше кислорода, что составит 14 моль. По этой причине расчёт будем вести по кислороду.
Это количество СО2 пропускают через Ва(ОН)2, что можно отобразить схемой.
Найдём массу ВаСО3, которая будет в виде осадка
Теперь необходимо усчитать выход соли, который составил всего лишь 89%.
Ответ. m(BaCO3) = 263 г.
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
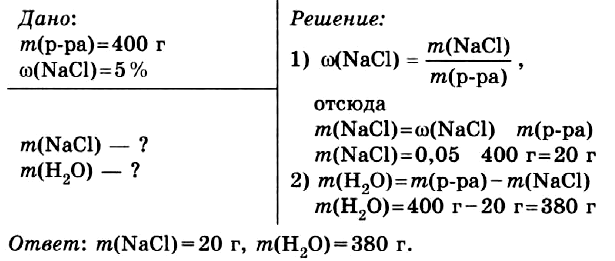
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Пример 5. Определите массу нитрата
натрия и воды, необходимые для приготовления
800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)·m(р-ра) = 0,12·800 =
96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) – m(NaNO3) = 800 – 96
= 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) =
704 г.
Пример 6. Определите массу
кристаллогидрата CuSO4·5H2O и
воды, необходимые для приготовления
0,4 кг раствора с ω(CuSO4) = 8%.
Решение (см. пример 2):
ω(CuSO4) =
=
m(H2O) = m(р-ра) – m(CuSO4·5H2O)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·M(CuSO4·5H2O)
n(CuSO4·5H2O)·= n(CuSO4) =
Находим
m(CuSO4) = ω(CuSO4)·m(р-ра) = 0,08·400
= 32 г.
n(CuSO4) =
=
0,2 моль.
Отсюда m(CuSO4·5H2O) = 0,2·250 = 50 г
Масса воды m(H2O) = 400 – 50 = 350 г
Ответ: m(CuSO4·5H2O) = 50 г,
m(H2O) = 350 г.
1. 2. Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
Пример 7. Определить массу раствора
с массовой долей K2SO4 10%,
который можно приготовить из 200 г воды
и сульфата калия.
Решение:
m(р-ра) =
Из условия задачи m(K2SO4)
неизвестна, но известна масса воды, а
поскольку вода – один из компонентов
раствора, то:
ω(Н2О) = 100% – ω(K2SO4) =
100 – 10 = 90%
m(р-ра) =
=
= 222,2 г.
Ответ: можно приготовить 222,2 г
раствора.
Пример 8. При растворении в 400 г воды
некоторого количества CuSO4·5H2O
получен раствор с массовой долей CuSO4
5%. Рассчитать массу использованного
кристаллогидрата и массу полученного
раствора.
Решение (см. примеры 2, 6):
m(р-ра) =
=
В этом уравнении неизвестны m(р-ра) и
m(CuSO4), но
m(р-ра) = m(CuSO4·5H2O) + m(H2O)
= m(CuSO4·5H2O) + 400
Таким образом, неизвестны две величины:
m(р-ра) и m(CuSO4·5H2O).
m(CuSO4) = n(CuSO4)·m(CuSO4)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·m(CuSO4·5H2O)
m(CuSO4)
= 160 г/моль, m(CuSO4·5H2O)
= 250 г/моль.
Подставим эти величины в исходную
формулу:
400 + n(CuSO4)·250 =
Решаем уравнение относительно n(CuSO4):
20 + 0,05·250· n(CuSO4) = n(CuSO4)·160,
n(CuSO4) =
= 0,136 моль.
Отсюда
m(CuSO4·5H2O) = 0,136·250 = 34 г,
m(р-ра) = 400 + 34 = 434 г.
Возможны и другие варианты решения этой
задачи:
ω(CuSO4) =
=
В этом уравнении тоже два неизвестных
– m(CuSO4) и m(CuSO4·5H2O), но
величину m(CuSO4) можно представить
в виде m(CuSO4·5H2O)·х.
Здесь х – массовая доля CuSO4 в
кристаллогидрате, она равна:
х =
=
= 0,64
С учетом исходных данных, теперь можно
записать:
0,05 =
Решаем уравнение относительно
m(CuSO4·5H2O):
20 + 0,05 m(CuSO4·5H2O) = 0,66·m(CuSO4·5H2O)
m(CuSO4·5H2O) = 34 г.
Находим m(р-ра) = 400 + 34 = 434 г.
Ответ: для приготовления раствора
используют 34 г CuSO4·5H2O, масса
полученного раствора 434 г.
1. 3. Разбавление и концентрирование растворов
При решении задач, связанных с разбавлением
и концентрированием растворов, следует
помнить, что масса растворенного
вещества остается неизменной, т.е.
m(Х) = const. Изменяется только масса
растворителя и, соответственно, масса
раствора.
Пример 9. К 50 мл раствора H2SO4
(ω1 = 48%, ρ = 1,38 г/мл) добавили 950 мл
воды. Определить массовую долю H2SO4
в полученном растворе.
Решение:
ω2(H2SO4) =
m2(р-ра) = m1(р-ра) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 950·1 =
950 г
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
50·1,38 = 69 г
m1(H2SO4) = m1(р-ра)
ω1(H2SO4) = 69·0,48 = 33,12 г
ω2(H2SO4) =
= 0,032 или 3,2%
Ответ: ω(H2SO4) в новом
растворе 0,032 или 3,2%.
Пример 10. Какой объем воды необходимо
добавить к 100 мл раствора азотной кислоты
(ρ = 1,1 г/мл, ω1 = 20%), чтобы получить
раствор HNO3 с ω2 = 5%?
Решение:
V(H2O) =
m(H2O) = m2(р-ра) – m1(р-ра)
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
100·1,1 = 110 г
Масса искомого раствора определяется
по формуле:
m2(р-ра) =
m(HNO3) = m1(р-ра)·ω1(р-ра)
= 110·0,2 = 22 г.
Отсюда масса нового раствора:
m2(р-ра) =
= 440 г
Масса и объем добавленной воды будут
равны
m(H2O) = 440 – 110 = 330 г V(H2O) =
=
330 мл
Ответ: следует добавить 330 мл воды.
Пример 11. Из 200 мл раствора сульфата
меди (ρ = 1,1 г/мл, ω1 = 8%)
выпарили
100 мл воды. Определить ω(CuSO4)
в полученном растворе.
Решение:
ω2(CuSO4) =
При концентрировании растворов масса
растворенного вещества, как и при
разбавлении, остается неизменной, т.е.
m(CuSO4) = const.
m(CuSO4) = m1(р-ра)·ω1(р-ра)
= 220·0,08 = 17,6 г
Масса раствора после упаривания
уменьшилась на 100 г:
m(H2O) = V(H2O)·ρ(H2O) = 100·1
= 100 г
Масса исходного раствора
m1(р-ра) = V1(р-ра)·ρ(р-ра) =
200·1,1 = 220 г
Следовательно, m2(р-ра) = 220 – 100 =
120 г
Отсюда ω2(CuSO4) =
= 0,147 или 14,7%
Ответ: ω(CuSO4) в полученном
растворе равна 0,147 или 14,7%.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #