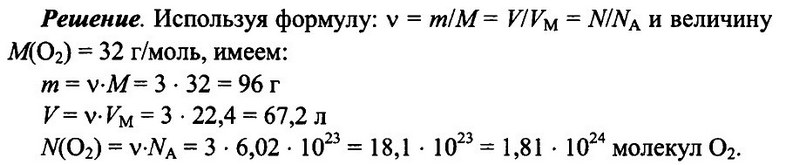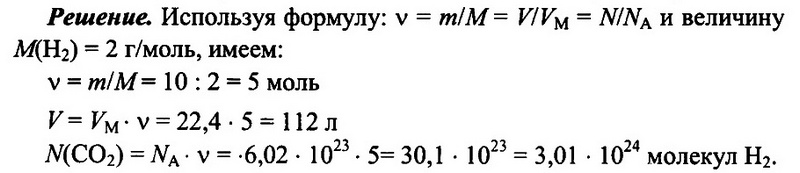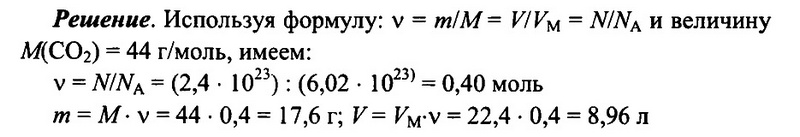Обоснуйте универсальность понятия «количество вещества» для массы, объёма и числа структурных частиц вещества. Предложите формулу для нахождения одной физической величины по другой с использованием понятия «количество вещества».
reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. ГЛАВА ВТОРАЯ. Темы для дискуссии. Номер №3
Решение
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы).
Понятие «количество вещества» универсально для любого вещества. Зная количество вещества можно найти массу, объём и число структурных частиц вещества.
m = n * M,
где m — масса вещества, M — молярная масса вещества. Молярная масса − это масса, которая приходится на один моль данного вещества.
N
=
n
∗
N
A
,
где N − число частиц в веществе,
N
A
− число Авогадро.
N
A
=
6
,
02
∗
10
23
молекул/моль.
V
=
n
∗
V
m
,
где − V − объём газообразного вещества,
V
m
− молярный объём.
V
m
= 22,4 л/моль
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
n
=
N
N
A
=
m
M
=
V
V
m
.
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: «Основные формулы для решения задач по химии»
(Правила комментирования)
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023 атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023 молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:

Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
Na = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:
Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1.
Какое количество вещества содержится в 33 г оксида углерода (IV)?
Ответ: ν(СО2) = 0,75 моль.
Задача № 2.
Какое число молекул содержится в 2,5 моль кислорода?
Ответ: N(O2) = 1,505 • 1024.
Задача № 3.
Определите объем (н. у.), который займут 0,25 моль водорода.
Задача № 4.
Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?
Задача № 5.
Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 1024.
Задача № 6.
Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
Ответ: 5 моль; 112 л; 3,01 • 1024.
Задача № 7.
Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.
Ответ: 2,5 моль; 177,5 г; 1,5 • 1024.
Задача № 8.
Имеется 2,4 • 1023 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9.
Какова масса порции оксида азота (IV), содержащей 4,816 • 1023 молекул? Каков ее объем (н. у.)?
Задача № 10.
Масса порции простого вещества, содержащей 1,806 • 1024 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.
Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Сложные задачи на количество …
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
- Перейти дальше: Решение задач с долей вещества в смеси, в соединении
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
Количество вещества. Молярная масса. Молярный объем газа. Закон Авогадро
Из курса физики мы знаем о таких физических величинах, как масса, объём и плотность. При помощи этих величин легко характеризовать вещества. Например, мы идём в магазин и покупаем 1 кг сахара или литровую бутылку минеральной воды. Но оказывается, что этих величин недостаточно, если необходимо рассмотреть вещество с точки зрения числа частиц. Сколько молекул сахара содержится в 1 кг сахара? А сколько молекул воды в литровой бутылке? А в одной капле? Ответ на этот вопрос можно получить, если знать ещё об одной физической величине, которая называется количество вещества. Точное число молекул посчитать сложно, но если считать не штуками, а порциями, то задача упрощается. Например, мы никогда не покупаем в магазине спички поштучно, но купив одну порцию спичек – коробок, знаем, что там 100 штук. И салфетки мы тоже поштучно не покупаем, но купив пачку салфеток, то есть порцию, мы точно будем знать, сколько штук салфеток мы купили.
Количество вещества – это порция вещества с определённым числом структурных частиц. Количество вещества принято обозначать греческой буквой ν [ню]. В системе СИ единица измерения количества вещества называется моль. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода, а именно 6*1023 частиц. Это количество является постоянной величиной и называется «постоянная Авогадро». Количество вещества можно определить как отношение числа структурных частиц к числу частиц в одном моле вещества.
Например, количество вещества, которое соответствует 3*1023 атомов железа можно легко рассчитать по этой формуле.
Преобразовав исходную формулу легко определить число структурных частиц по известному количеству вещества: N = v * NA
Своё имя эта постоянная получила в честь Амедео Авогадро, который в 1811 году сделал предположение, которое затем подтвердилось экспериментально и теперь носит имя Закона Авогадро. Закон Авогадро: «в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул».
Из закона Авогадро следует, что при одинаковых условиях массы газов, содержащие одинаковое число структурных частиц, будут занимать одинаковый объём. При давлении 1 атмосфера и температуре 0 градусов Цельсия 1 моль любого газа занимает объём равный 22, 4 л. Этот объём называется молярный объём. А условия – нормальные условия. Молярный объём обозначается Vm, показывает объём газа количеством 1 моль. При нормальных условиях является постоянной величиной.
При нормальных условиях количество вещества это отношение объёма к молярному объему.
По этой формуле можно определить объём вещества, если известно его количество: V = ν * Vm
Массу вещества количеством 1 моль называют молярной массой, обозначают буквой M. Молярная масса численно равна относительной молекулярной массе. Единица измерения молярной массы г/моль.
Зная массу вещества, легко определить количество вещества.
Найдём количество вещества 5,6 г железа.
Чтобы найти массу вещества по известному количеству преобразуем формулу: m = ν * M
Справочный материал
• Количество вещества ν [ню] – это физическая величина, характеризующая количество однотипных структурных единиц (любые частицы, из которых состоит вещество – атомы, молекулы, ионы и т.д), содержащихся в веществе. Единица измерения количества вещества в Международной системе единиц (СИ) – моль.
• Моль – это единица измерения количества вещества. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода.
• Молярная масса (M) – масса вещества количеством один моль. Единица измерения г/моль.
• Нормальные условия (н.у.) – физические условия, определяемые давлением 101325 Па (нормальная атмосфера) и температурой 273,15 К (0 °С).
• Молярный объём (Vm) – объём вещества количеством один моль. Единица измерения л/моль; при н.у. Vm = 22,4 л/моль
• Закон Авогадро – в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул.
• Постоянная Авогадро (NA) показывает число структурных частиц в веществе количеством один моль.