Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
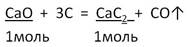 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Алгоритм 12
Вычисление массы реагента по известной массе продукта реакции, если известен выход продукта реакции от теоретически возможного
Пример. Вычислите массу оксида серы(IV), который потребуется для получения 180г оксида серы(VI), если выход продукта реакции составит 90 % от теоретически возможного.
С помощью соответствующих обозначений запишем условие задачи, найдем молярные массы веществ, о которых идет речь в условии задачи
Дано:
m(SO3)=180г
?=90%
—————-
mnp(S02)=?г
М(SО2)=64г/моль
M(SO3)=80г/моль
Найдем количество вещества, которое требуется получить в результате реакции
Решение:
n(SO3)=2,25моль
Запишем уравнение реакции. Расставим коэффициенты
2SO2 + O2 = 2SO3
Над формулами веществ запишем данные о количествах веществ, найденных из условия задачи, а под формулами — стехиометрические соотношения, отображаемые уравнением реакции
? моль 2,25 моль
2SO2 + О2 = 2SO3
2 моль 2 моль
Вычислим количество вещества реагента. Для этого составим пропорцию


Следовательно, n(SO2)=2,25 моль
Найдем массу исходного вещества при 100%-м выходе продукта теоретически требуемую массу)
m(SO2)= n(SO2)•M(SO2)
m(SO2)=2,25моль•64г/моль=144г
Найдем массу исходного вещества с учетом выхода (mnp). Для этого составим пропорцию и решим уравнение
144г SO2 соответствует 90 %,
а г SO2 соответствует 100 %.
а•90%=144•100%, а=160г.
Следовательно, mnp(SO2)=160г
Запишем ответ
Ответ: mnp(SO2)=160г
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём»
могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
Первый тип задач
– Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При
взаимодействии магния массой 1,2 г с раствором серной кислоты получили
соль массой 5, 5 г. Определите выход продукта реакции (%).
|
Дано: m m _____________________ Найти: |
|
|
M M |
|
|
ν(Mg |
|
|
5. По УХР вычисляем теоретическое количество вещества (ν теор) и теоретическую массу (m |
m = ν · M m 120 г/моль · 0,05 моль = 6 г |
|
(MgSO Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
Второй тип задач
– Известны масса (объём) исходного вещества (реагента) и выход (в %)
продукта реакции. Необходимо найти практическую массу (объём) продукта
реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m 80% или 0,8 ____________________ Найти: m |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M M |
|
4. Находим количество вещества реагента по формулам
|
ν(CaO |
|
5. По УХР вычисляем теоретическое количество вещества (ν теор) и теоретическую массу (m |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
m Ответ: |
Третий типзадач
– Известны масса (объём) практически полученного вещества и выход этого
продукта реакции. Необходимо вычислить массу (объём) исходного
вещества.
Задача
3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую
массу карбоната натрия нужно взять для получения оксида углерода (
IV
) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
|
1. Записываем краткое условие задачи |
Дано: н. у. V m = V 85% или 0,85 _____________________ Найти: m(Na 2 CO 3) =? |
|
2. Находим по ПСХЭ молярные массы веществ, если это необходимо |
M (Na 2 CO 3) = |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: m = ν · M V = ν · V m |
m = ν · M m |
РЕШИТЕ ЗАДАЧИ
№1.
При взаимодействии натрия количеством вещества 0, 5 моль с водой
получили водород объёмом 4,2 л (н. у.). Вычислите практический выход
газа (%).
Металлический хром получают восстановлением его оксида Cr 2 O 3
металлическим алюминием. Вычислите массу хрома, который можно получить
при восстановлении его оксида массой 228 г, если практический выход
хрома составляет 95 %.
№3.
Определите, какая масса меди вступит в реакцию с концентрированной
серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если
выход оксида серы (IV) составляет 90%.
№4.
К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор,
содержащий фосфат натрия массой 4,1 г. Определите массу полученного
осадка, если выход продукта реакции составляет 88 %.
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
При обучении учащихся решению расчётных задач
по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности
задач и хода их решения; - не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык,
математические действия и обозначение
физических величин и др.;
Преодоление этих недостатков является одной из
главных целей, который ставит перед собой
учитель, приступая к обучению решению расчетных
задач.
Задача учителя состоит в том, чтобы научить
учащихся анализировать условия задач, через
составление логической схемы решения конкретной
задачи. Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Цели урока:
- формирование умения анализировать условие
задачи; - формирование умения определять тип расчетной
задачи, порядок действий при ее решении; - развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с
использованием понятия “массовая доля выхода
продукта реакции от теоретического”; - отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего
отношение к производственным процессам; - стимулировать углубленное изучение
теоретических вопросов, интерес к решению
творческих задач.
Ход урока
Определяем причину и сущность ситуации,
которые описываются в задачах “на выход
продукта от теоретического”.
В реальных химических реакциях масса продукта
всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят
до конца. - При взаимодействии органических веществ часто
образуются побочные продукты. - При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не
вступает в реакции. - Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может
остаться в растворе.
Вывод:
- масса теоретическая всегда больше
практической; - объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%,
практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению
реакции, — теоретический выход, соответствует 100%.
Доля выхода продукта реакции ( — “этта”) — это отношение
массы полученного вещества к массе, которая
должна была бы получиться в соответствии с
расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества
и продукта
реакции
. Определить выход продукта.
2. Даны массы исходного вещества
и выход продукта
реакции.
Определить массу продукта.
3. Даны массы продукта
и выход продукта.
Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г
хлора, было получено 24,3 г хлорида железа (III).
Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при
нагревании. Определите объем (н.у.) полученного
сероводорода, если выход продукта реакции
составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для
восстановления оксида железа (III), если получено
11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности
данных (известные вещества) – условия задачи
(“выход” и т.п.) – и вопроса (вещества, параметры
которых требуется найти). Кроме этого, в ней есть
система зависимостей, которые связывают искомое
с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и
условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или
теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически
возможного.
1. Запишите уравнение химической реакции и
расставьте коэффициенты.
2. Под формулами веществ напишите количество
вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся
практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен
выход продукта.
1. Запишите “дано” и “найти”, запишите
уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества
для исходных веществ. n =
3. Найдите теоретическое количество вещества
продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем
продукта реакции.
m = M * n или V = V m * n
5. Вычислите практические массу или объем
продукта реакции (умножьте массу теоретическую
или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны
масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе,
найдите теоретический объём или массу (используя
долю выхода продукта).
2. Найдите теоретическое количество вещества
для продукта.
3. Найдите теоретическое количество вещества
для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества
найдите массу или объем исходных веществ в
реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н.у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
2. При взаимодействии азота и водорода получили
95 г аммиака NH 3 с выходом 35%. Какие объёмы
азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком
углерода. Определите массу образовавшегося
металла, если выход продукта реакции равен 65%.
Урок №20. Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического».
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой h (эта), измеряется в процентах или долях.
m практическая х100%
h = m теоретичееская
V практический х100%
h = V теоретичееский
m практическая (MgSO4) = 5,5 г
_____________________
M(Mg) = 24 г/моль
M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль
mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) =
120 г/моль · 0,05 моль = 6 г
(MgSO4)=(5,5г ·100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим
реакции.
1. Записываем краткое условие задачи
m(CaO) = 16,8 г
h =80% или 0,8
_________________
m практ (CaC2) = ?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC2) = 40 + 2 · 12 = 64г/моль
4. Находим количество вещества реагента по формулам
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
6. Находим массовую (объёмную) долю выхода продукта по формуле
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г
Ответ: m практич (CaC2) = 15,36 г
1. Записываем краткое условие задачи
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
h = 85% или 0,85
____________________
2. Находим по ПСХЭ молярные массы веществ, если это необходимо
M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы:
Vтеоретич(CO2) =
28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Находим количество вещества реагента по УХР
Следовательно
ν(Na2CO3) = ν(CO2) = 1,5 моль
5. Определяем массу (объём) реагента по формуле:
V = ν · Vm m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции.
Необходимо найти практическую массу (объём) продукта
реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием . Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции.
Необходимо найти практическую массу (объём) продукта
реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н. у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
В химии термин “теоретический выход” используется для описания максимального количества продукта, которое может получиться в результате химической реакции. Сначала следует записать сбалансированное химическое уравнение и определить ключевой компонент реакции. После того как вы измерите количество этого компонента, можно будет рассчитать количество продукта реакции. Это и будет теоретический выход продукта реакции. В реальных экспериментах часть продукта обычно теряется из-за неидеальных условий.
Шаги
Часть 1
Найдите ключевой компонент реакции
-
Начните со сбалансированного уравнения химической реакции.
Уравнение реакции подобно рецепту. С левой стороны в нем приведены реагенты, а с правой — продукты реакции. В правильно сбалансированном уравнении химической реакции слева и справа стоит одинаковое число атомов каждого элемента.- В качестве примера рассмотрим простое уравнение → . Слева и справа стоит по два атома водорода. Однако со стороны реагентов находятся два атома кислорода, и лишь один атом кислорода представлен в виде продукта реакции.
- Чтобы сбалансировать уравнение, умножим на два продукт реакции: H 2 + O 2 {displaystyle H_{2}+O_{2}}
→ . - Проверим баланс. Теперь у нас правильное количество атомов кислорода, по два атома с каждой стороны. Однако на этот раз мы имеем два атома водорода слева и четыре атома водорода справа.
- Умножим на два водород в части реагентов. В результате у нас получится 2 H 2 + O 2 {displaystyle 2H_{2}+O_{2}}
→ 2 H 2 O {displaystyle 2H_{2}O}
. Теперь мы имеем по четыре атома водорода и по два атома кислорода с каждой стороны уравнения. Таким образом, уравнение сбалансировано. - В качестве более сложного примера рассмотрим реакцию кислорода и глюкозы с образованием углекислого газа и воды: → . В этом уравнении с каждой стороны стоит 6 атомов углерода (C), 12 атомов водорода (H) и 18 атомов кислорода (O). Уравнение сбалансировано.
- Чтобы узнать более подробно, как балансировать химические уравнения, прочтите .
-
Переведите количество каждого реагента из граммов в моли.
В реальном эксперименте известны массы реагентов в граммах. Чтобы перевести их в количество молей, поделите массу каждого реагента на его молярную массу.- Предположим, в реакцию вступают 40 граммов кислорода и 25 граммов глюкозы.
- 40 г O 2 {displaystyle O_{2}} / (32 г/моль) = 1,25 моля кислорода.
- 25 г / (180 г/моль) = примерно 0,139 моля глюкозы.
-
Определите соотношение реагентов.
Моль используется в химии для того, чтобы по массе вещества определить количество его молекул. Определив количество молей кислорода и глюкозы, вы узнаете, сколько молекул каждого вещества вступает в реакцию. Чтобы найти соотношение между двумя реагентами, поделите число молей одного реагента на количество молей другого реагента.- В рассматриваемом примере в начале реакции имеется 1,25 моля кислорода и 0,139 моля глюкозы. Таким образом, отношение количества молекул кислорода к числу молекул глюкозы составляет 1,25 / 0,139 = 9,0. Это означает, что молекул кислорода в 9 раз больше, чем молекул глюкозы.
-
Найдите стехиометрическое соотношение реагентов.
Посмотрите на сбалансированное уравнение химической реакции. Коэффициенты перед каждой молекулой показывают относительное количество данного вида молекул, необходимое для протекания реакции. Уравнение химической реакции дает так называемое стехиометрическое соотношение реагентов, при котором они будут расходоваться полностью.- Для данной реакции имеем 6 O 2 + C 6 H 12 O 6 {displaystyle 6O_{2}+C_{6}H_{12}O_{6}}
. Коэффициенты указывают на то, что на каждую молекулу глюкозы требуется 6 молекул кислорода. Таким образом, стехиометрическое соотношение для этой реакции составляет 6 молекул кислорода / 1 молекула глюкозы = 6,0.
- Для данной реакции имеем 6 O 2 + C 6 H 12 O 6 {displaystyle 6O_{2}+C_{6}H_{12}O_{6}}
-
Сравните соотношения, чтобы найти ключевой компонент реакции.
В большинстве химических реакций один из реагентов расходуется раньше остальных. Этот реагент называют ключевым компонентом реакции. Он определяет, как долго будет продолжаться данная реакция и каким будет теоретический выход продукта реакции. Сравните два рассчитанных соотношения, чтобы определить ключевой компонент реакции:- В рассматриваемом примере начальное количество молей кислорода в 9 раз превышает число молей глюкозы. Согласно уравнению, стехиометрическое отношение кислорода к глюкозе составляет 6:1. Следовательно, у нас имеется больше кислорода, чем требуется, поэтому второй реагент, глюкоза, является ключевым компонентом реакции.
Часть 2
Определите теоретический выход реакции
-
Посмотрите на уравнение и определите ожидаемый продукт реакции.
Правая часть уравнения содержит продукты реакции. Если уравнение сбалансировано, коэффициенты перед каждым продуктом реакции показывают его относительное количество в молях. Они соответствуют теоретическому выходу продуктов реакции в том случае, если взять стехиометрическое соотношение реагентов.- Вернемся к приведенному выше примеру: 6 O 2 + C 6 H 12 O 6 {displaystyle 6O_{2}+C_{6}H_{12}O_{6}}
→ 6 C O 2 + 6 H 2 O {displaystyle 6CO_{2}+6H_{2}O}
. Справа стоят два продукта реакции: углекислый газ и вода. - Чтобы вычислить теоретический выход, можно начать с любого продукта реакции. Бывает так, что интересен только определенный продукт. В этом случае лучше начать с него.
- Вернемся к приведенному выше примеру: 6 O 2 + C 6 H 12 O 6 {displaystyle 6O_{2}+C_{6}H_{12}O_{6}}
-
Запишите количество молей ключевого компонента реакции.
Всегда следует сравнивать число молей реагента с количеством молей продукта реакции. Сравнение их масс не даст правильного результата.- В рассматриваемом примере ключевым компонентом реакции является глюкоза. Расчеты молярной массы показали, что 25 граммов глюкозы соответствуют 0,139 моля.
-
Сравните соотношение молекул продукта и реагента.
Вернитесь к сбалансированному уравнению и поделите количество молекул ожидаемого продукта на число молекул ключевого компонента реакции.- В нашем случае сбалансированное уравнение реакции имеет следующий вид: 6 O 2 + C 6 H 12 O 6 {displaystyle 6O_{2}+C_{6}H_{12}O_{6}}
→ 6 C O 2 + 6 H 2 O {displaystyle 6CO_{2}+6H_{2}O}
. Согласно этому уравнению, на 6 молекул ожидаемого продукта реакции, углекислого газа ( C O 2 {displaystyle CO_{2}} ), приходится 1 молекула глюкозы ( C 6 H 12 O 6 {displaystyle C_{6}H_{12}O_{6}}
). - Отношение углекислого газа к глюкозе составляет 6/1 = 6. Иными словами, в данной реакции из одной молекулы глюкозы получается 6 молекул углекислого газа.
- В нашем примере молярная масса CO 2 составляет около 44 г/моль (молярная масса углерода ~12 г/моль, кислорода ~16 г/моль, в итоге имеем 12 + 16 + 16 = 44).
- Умножьте 0,834 моля CO 2 x 44 г/моль CO 2 = ~36,7 грамма. Таким образом, теоретический выход продукта реакции равен 36,7 грамма CO 2 .
- В нашем случае сбалансированное уравнение реакции имеет следующий вид: 6 O 2 + C 6 H 12 O 6 {displaystyle 6O_{2}+C_{6}H_{12}O_{6}}
-
При желании проделайте такие же вычисления для других продуктов реакции.
Во многих экспериментах интерес представляет лишь один продукт реакции. Однако если вы хотите найти теоретический выход второго продукта, просто повторите вычисления.- В нашем примере вторым продуктом реакции является вода, H 2 O {displaystyle H_{2}O} . Согласно сбалансированному уравнению реакции, из 6 молекул глюкозы получается 6 молекул воды. Это соответствует соотношению 1:1. Таким образом, если в начале реакции имеется 0,139 моля глюкозы, в конце должно получиться 0,139 моля воды.
- Умножьте количество молей воды на ее молярную массу. Молярная масса воды составляет 2 + 16 = 18 г/моль. В результате получаем 0,139 моля H 2 O x 18 г/моль H 2 O = ~2,50 грамма. Таким образом, в данном эксперименте теоретический выход воды составит 2,50 грамма.
Для этого нужно сложить массы всех атомов в этой молекуле.
Пример 1. В молекуле воды Н 2 О 2 атома водорода и 1 атом кислорода. Атомная масса водорода = 1, а кислорода = 16. Поэтому молекулярная масса воды равна 1 + 1 + 16 = 18 атомных единиц массы, а молярная масса воды =18 г/моль.
Пример 2. В молекуле серной кислоты Н 2 SO 4 2 атома водорода, 1 атом серы и 4 атома кислорода. Поэтому молекулярная масса этого вещества составит 1 2 + 32 + 4 16 = 98 а.е.м, а молярная масса — 98 г/моль.
Пример 3. В молекуле сульфата алюминия Al 2 (SO 4) 3 2 атома алюминия, 3 атома серы и 12 атомов кислорода. Молекулярная масса этого вещества равна 27 · 2 + 32 · 3 + 16 · 12 = 342 а.е.м., а молярная масса — 342г/моль.
Моль, молярная масса
Молярная масса — это отношение массы вещества к количеству вещества, т.е. М(х) = m(x)/n(x), (1)
где М(х) — молярная масса вещества Х, m(x) – масса вещества Х, n(x) — количество вещества Х.
Единица СИ молярной массы — кг/моль,однако обычно используется единица г/моль. Единица массы — г, кг.
Единица СИ количества вещества — моль.
Моль — это такое количество вещества, в котором содержится 6,02·10 23 молекул этого вещества.
Любая задача по химии решается через количество вещества. Необходимо помнить основные формулы:
n(x) =m(x)/ М(х)
или общую формулу: n(x) =m(x)/М(х) = V(x)/Vm = N/N A , (2)
где V(x) – объем вещества Х(л), V m — молярный объем газа при н.у. (22,4 л/моль), N — число частиц, N A — постоянная Авогадро (6,02·10 23).
Пример 1. Определите массу иодида натрия NaI количеством вещества 0,6 моль.
Пример 2. Определите количество вещества атомного бора,содержащегося в тетраборате натрия Na 2 B 4 O 7 массой 40,4 г.
|
m(Na 2 B 4 O 7) = 40,4 г. |
Молярная масса тетрабората натрия составляет 202 г/моль. Определяем количество вещества Na 2 B 4 O 7: n(Na 2 B 4 O 7) = m(Na 2 B 4 O 7)/М(Na 2 B 4 O 7) = 40,4/202 = 0,2 моль. Вспомним, что 1 моль молекулы тетрабората натрия содержит 2 моль атомов натрия, 4 моль атомов бора и 7 моль атомов кислорода (см. формулу тетрабората натрия). Тогда количество вещества атомного бора равно: n(B)= 4 · n(Na 2 B 4 O 7) = 4 · 0,2 = 0,8 моль. |
Как найти массу вещества
Массу вещества требуется найти во многих задачах. Это можно сделать с помощью специальных формул. Обычно в условии задачи присутствует реакция, с помощью которой находятся некоторые величины.

Инструкция
При данном в условии задачи объеме и плотности вычисляйте массу следующим образом: m = V*p, где m – масса, V – объем, p – плотность.
В других случаях рассчитывайте массу так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярную массу не трудно подсчитать, для этого нужно сложить все атомные массы простых веществ, входящих в состав сложного (атомные массы указаны в таблице Д.И. Менделеева по обозначение элемента).
Выражайте значение массы из формулы массовой доли вещества: w = m(x)*100%/m, где w – массовая доля вещества, m(x) – масса вещества, m – масса раствора, в котором растворено данное вещество. Чтобы найти массу вещества необходимо: m(x) = w*m/100%.
Из формулы выхода продукта вычисляйте нужную вам массу: выход продукта = mp(x)*100%/m(x), где mp(x) – масса продукта x, полученного в реальном процессе, m(x) – рассчитанная масса вещества x. Выводите: mp(x ) = выход продукта* m(x)/100% или m(x) = mp(x)*100%/ выход продукта. При данном в условии задачи выходе продукта эта формула будет необходима. Если выход продукта не дан, то следует считать, что он равен 100%.
Если в условии присутствует уравнение реакции, то решайте задачу по нему. Для этого сначала составьте уравнение реакции, затем вычислите из него количества вещества полученного или затраченного для данной реакции и уже это количество вещества подставьте в нужные формулы. Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Обратите внимание
Единицами измерения массы могут быть миллиграммы, граммы, килограммы.
Источники:
- «Пособие по химии», Г.П. Хомченко, 2005.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
НЕОБХОДИМЫЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
КОЛИЧЕСТВО ВЕЩЕСТВА — отношение массы вещества к молярной массе вещества.
КОЛИЧЕСТВО ВЕЩЕСТВА — отношение объема газа к молярному объему (22,4л/моль). (н.у.)
МАССОВАЯ ДОЛЯ КОМПОНЕНТА В СМЕСИ — отношение массы компонента к массе всей смеси.
Обычно массовую долю выражают в %, но не обязательно.
МАССОВАЯ ДОЛЯ КОМПОНЕНТА В РАСТВОРЕ — отношение массы компонента к массе всего раствора.
Обычно массовую долю выражают в %, но не обязательно.
МОЛЬНАЯ ДОЛЯ КОМПОНЕНТА В СМЕСИ — отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества А, В и С, то:
ОБЪЕМНАЯ ДОЛЯ КОМПОНЕНТА В СМЕСИ (только для газов) — отношение объёма вещества А к общему объёму всей газовой смеси.
ОПРЕДЕЛЕНИЕ ВЫХОДА ПРОДУКТА по отношению к теоретически возможному :
АЛГОРИТМ 1
ВЫЧИСЛЕНИЕ МАССЫ ИЛИ ОБЪЕМА ВЕЩЕСТВА ПО ИЗВЕСТНОЙ МАССЕ ИЛИ ОБЪЕМУ ДРУГОГО ВЕЩЕСТВА, УЧАСТВУЮЩЕГО В РЕАКЦИИ
2. Записать уравнение реакции, расставим коэффициенты;
3. Найти молярные массы веществ, о которых идет речь в условии задачи
4. Найдем количество веществ, массы или объемы которых даны в условии задачи по формулам:
5. Над формулами веществ запишем найденные количества веществ, а под формулами — стехиометрические соотношения, отображаемые уравнением реакции
6. Составить соотношение количеств веществ (первая дробь — коэффициенты, равно, вторая дробь найденная величина, и что необходимо найти).
7. По формулам, указанным выше, найдем массу или объем вещества, которую требуется вычислить.
АЛГОРИТМ 2
ВЫЧИСЛЕНИЕ МАССЫ ПРОДУКТА ПО ИЗВЕСТНОЙ МАССЕ ИЛИ ОБЪЁМУ ИСХОДНОГО ВЕЩЕСТВА, СОДЕРЖАЩЕГО ПРИМЕСИ.
АЛГОРИТМ 2
ВЫЧИСЛЕНИЕ МАССЫ ИСХОДНОГО ВЕЩЕСТВА, СОДЕРЖАЩЕГО ПРИМЕСИ, ПО ИЗВЕСТНОЙ МАССЕ ИЛИ ОБЪЁМУ ПРОДУКТА РЕАКЦИИ
АЛГОРИТМ 3
ВЫЧИСЛЕНИЕ МАССЫ ПРОДУКТА ПО ИЗВЕСТНОЙ МАССЕ ИЛИ ОБЪЁМУ ИСХОДНОГО РАСТВОРА ВЕЩЕСТВА С ОПРЕДЕЛЕННОЙ МАССОВОЙ ДОЛЕЙ РАСТВОРЕННОГО ВЕЩЕСТВА
АЛГОРИТМ 4
ВЫЧИСЛЕНИЕ МАССЫ ПРОДУКТА РЕАКЦИИ ПО ИЗВЕСТНОЙ МАССЕ РЕАГЕНТА, ЕСЛИ ИЗВЕСТЕН ВЫХОД ПРОДУКТА РЕАКЦИИ.
АЛГОРИТМ 4
ВЫЧИСЛЕНИЕ МАССЫ ИСХОДНОГО ВЕЩЕСТВА ПО ИЗВЕСТНОЙ МАССЕ ПРОДУКТА РЕАКЦИИ, ЕСЛИ ИЗВЕСТЕН ВЫХОД ПРОДУКТА РЕАКЦИИ ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО.
АЛГОРИТМ 5
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, ЕСЛИ ОДНО ИЗ РЕАГИРУЮЩИХ ВЕЩЕСТВ ДАНО В ИЗБЫТКЕ.
26(Б) Задачи ЕГЭ ФИПИ 2015 на расчет массы вещества или объема газов
















![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
























