Как найти массу воздуха
Воздух — это естественная смесь газов, состоящая, большей частью, из азота и кислорода. Масса воздуха в единице объема может меняться, если меняются пропорции составляющих его компонентов, а также при изменении температуры. Массу воздуха можно найти, зная объем, который он занимает, или количество вещества (количество частиц).

Вам понадобится
- плотность воздуха, молярная масса воздуха, количество воздуха, объем, занимаемый воздухом
Инструкция
Пусть нам известен объем V, который занимает воздух. Тогда по известной формуле m = p*V, где — p — плотность воздуха, мы можем найти массу воздуха в этом объеме.
Плотность воздуха зависит от его температуры. Плотность сухого воздуха вычисляется через уравнение Клапейрона для идеального газа по формуле: p = P/(R*T), где P — абсолютное давление, T — абсолютная температура в Кельвинах, а R — удельная газовая постоянная для сухого воздуха (R = 287,058 Дж/(кг*К)).
На уровне моря при температуре 0оС плотность воздуха равна 1,2920 кг/(м^3).
Если известно количество воздуха, то его массу можно найти по формуле: m = M*V, где V — количество вещества в молях, а M — молярная масса воздуха. Средняя относительная молярная масса воздуха равна 28,98 г/моль. Таким образом, подставив ее в эту формулу, вы получите массу воздуха в граммах.
Источники:
- Физические свойства воздуха
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Как найти массу воздуха?
Молярная масса воздуха 29·10-3 кг/моль.? Уравнение Менделеева-Клапейрона, если считать воздух в комнате идеальным газом: P*V = (m/M)*R*T => m = MPV/RT. Вычислим из этого выражения массу m = (29*10^-3)*(112*10^3)*6*5*3/8,31*(27+273) = 292320/2493 = 117,26 кг.
Как определить массу и вес?
1 Часть 1 из 4: Вычисление веса
- Так как вес является силой, X Источник информации эту формулу можно записать и как F = mg.
- P или F — соответственно, вес или сила (измеряется в ньютонах, Н).
- m — масса тела (измеряется в килограммах, кг).
- g — ускорение свободного падения (измеряется в метрах на секунду в квадрате, м/с2).
Как найти массу?
Зная объем V и плотность d предмета, вы можете легко найти его массу по формуле m = d * V.
В чем измеряется масса воздуха?
| Плотность воздуха | |
|---|---|
| Размерность | L−3 M |
| Единицы измерения | |
| СИ | кг/м³ |
| СГС | г/см³ |
Какой вес у воздуха?
Как и все предметы, окружающие нас, воздух тоже подвержен земному притяжению. Оно-то и наделяет воздух весом, который равен 1 кг на 1 см². Плотность воздуха равна около 1,2 кг/м³, то есть куб со стороной 1 м, наполненный воздухом, весит 1,2 кг».
Как определить плотность воздуха в помещении?
ρ = p / (287 · T)…Формула плотности воздуха
- p – атмосферное давление (нормальное значение 101 325 Па),
- M – молярная масса (29 г/моль, если точнее то 28,98 г/моль),
- R – газовая постоянная 8,314 Дж/(моль·К),
- Т – температура воздуха в Кельвинах (К), что на 273° больше, чем в Цельсиях.
Как найти вес Физика 7 класс?
Сила, с которой тело давит на опору или растягивает подвес, называют весом. Вес тела обозначают P и измеряют в ньютонах (H). Вес неподвижного тела равен P = mg . Формула определения веса неподвижного тела точно такая же, как и формула силы тяжести (см.
Как найти плотность вещества?
Плотность равна отношению массы тела к его объёму. В физике плотность обозначают греческой буквой ρ (ро). плотность = масса объём ρ = m V , где m — масса, V — объём. Основной единицей плотности вещества является кг м 3 .
Как найти массу в физике 7 класс?
Решение: Чтобы найти массу тела, нужно плотность умножить на объем: m = ρ · V. Подставим числовые значения величин: 930 кг/м3 · 0,003 м3 = 2,79 кг.
Как найти n в химии?
n = N/N A , где n – количество вещества (моль), N – число частиц, a N A – постоянная Авогадро. Количество вещества может обозначаться также и символом v.
Сколько весит 1 м3 воздуха при нормальных условиях?
Учёные подсчитали, что 1м3 воздуха весит примерно 1,2 кг, с небольшими колебаниями, которые зависят от температуры, влажности, атмосферного давления и химического состава.
Чему равен вес 1 кг воздуха?
Как и все предметы, окружающие нас, воздух тоже подвержен земному притяжению. Оно-то и наделяет воздух весом, который равен 1 кг на 1 см². Плотность воздуха равна около 1,2 кг/м³, то есть куб со стороной 1 м, наполненный воздухом, весит 1,2 кг».
Сколько весит 1 квадратный метр воздуха?
Учёные подсчитали, что 1м3 воздуха весит примерно 1,2 кг, с небольшими колебаниями, которые зависят от температуры, влажности, атмосферного давления и химического состава.
Как найти плотность сухого воздуха?
Тогда формулу для плотности сухого воздуха в зависимости от давления и температуры можно записать следующим образом: ρ = p / (287 · T)
Как найти вес подвижного тела?
P=m(g-a) — вес тела в случае, когда вектор ускорения совпадает по направлению с вектором ускорения свободного падения. В этом случае сила веса по модулю меньше силы тяжести.
Как определить вес груза формула?
Формула расчёта:
- 1 вариант: ОВ (объёмный вес) = объем груза (в м3) х 167 кг.
- 2 вариант: ОВ (объёмный вес) = Длина (см) х Ширина (см) х Высота (см) / 5000.
Как найти плотность прямоугольника?
Согласно определению, плотность равна массе, деленной на объем. Таким образом, поделите измеренную массу на вычисленный объем. В результате вы получите плотность тела, измеренную в г/см3. Например, вычислим плотность предмета объемом 8 см3 и массой 24 г.
Что такое молярная масса?
Молярная масса вещества — это отношение его массы к количеству молей. Для воздуха тоже действует это отношение. Поэтому при проведении вычислений в результате получается масса одного моля. Но не все вещества можно рассчитать подобным образом. Для того, чтобы узнать, чему равна молярная масса воздуха в физике используют специальные формулы. Выражается результат в граммах на моль.
Воздух является смесью различных газов. Из этого следует, что молярная масса воздуха включает в себя молярные массы газов, входящих в его состав. Именно поэтому результаты таких вычислений будут различаться в зависимости от состава воздуха и количества различных газов и примесей в его составе. Существует и усредненный показатель, и средняя молярная масса воздуха равняется 29 г/моль.
Если же при расчетах было выявлено сильное отклонение от нормального показателя без объективных причин, то следует задуматься. Нарушение баланса газов – это очень серьезная проблема, которая очень часто встречается в больших городах. Именно там ежедневно в воздух выбрасывается огромное количество разнообразных веществ, которые меняют состав воздуха. Вредные примеси и их скопления очень плохо влияют на состояние организма человека. Также и увеличение или уменьшение содержания азота, кислорода, углекислого газа и других веществ влечет за собой тоже большие проблемы. Недостаток кислорода губителен для живых организмов и для человека может быть даже смертельно опасным.
Тщательное исследование воздуха может выявить отклонения от нормы и предотвратить их негативное влияние на организм человека. В нашей независимой лаборатории можно заказать комплексное обследование, которое представляет собой проведение исследований на различные показатели и выявление нарушений.

Как же определяется молярная масса воздуха?
Все вещества различаются по массе, и этот показатель является очень индивидуальным. Для сложных веществ учитывается число атомов, находящемся в нем. Так чему равна молярная масса воздуха? Это сумма всех массовых долей элементов, которые входят в данное вещество. В данном случае это молярные массы азота, кислорода, аргона, углекислого газа, водорода и других веществ. Из них азот составляет 78% от общего объема, кислород 21%, а остальные же вещества содержатся в гораздо меньшем количестве.
Существует несколько методов проведения измерения:
- Откачка воздуха из колбы позволяет при помощи уравнения состояния газа позволяет также вычислить этот показатель.
- При помощи классического химического уравнения, в котором находятся все молярные массы газов, входящих в состав воздуха.
- Также существуют уже готовые таблицы, со средними значениями.
Если производить расчеты, следуя определению, что объемы газов являются пропорциональными их количествам, то мы можем выражать среднюю массу как через объем, так и через количество. Поэтому молярная масса воздуха в химии рассчитывается по формуле, включающей в себя отношение массы вещества к его количеству. В сложных веществах надо найти отдельно массы каждого вещества, которое входит в состав.
Но этот способ расчетов по большей части затрагивает ситуации, когда воздух находится в своем обычном состоянии. Также можно вычислить и массу в других ситуациях.
Формула, по которой рассчитывается молярная масса влажного воздуха является формулой для смеси газов. При расчетах учитываются доли сухого воздуха и водяного пара, а также соответствующее для них давление и молярные массы. Получается формула выглядит как сумма объема с молярной массой водяного пара и объема с молярной массой сухого воздуха.

Известно, что молярная масса воздуха при нормальных условиях — 29 г/моль. Именно такой показатель принят за средний. Но он может колебаться в зависимости от состава воздуха. Поэтому сильные изменения свидетельствуют о нарушениях баланса газов в воздухе. Так если в воздухе будет содержаться 92% азота, то это будет смертельно опасно для человека. Именно поэтому состав воздуха так важен и необходимо его постоянно контролировать. Сейчас, в результате деятельности человека, наблюдается неблагоприятная экологическая картина и во многом она связана с загрязнением воздуха. Именно выбросы в воздух различных веществ нарушают его естественный состав, что приводит к ухудшению условий жизни. Многие экологические проблемы тоже являются уже следствием загрязнения воздуха. Смог, кислотные дожди и изменение состава всей атмосферы.
Закажите бесплатно консультацию эколога
Сколько азота в воздухе?
Если говорить о воздухе, то нельзя не затронуть тему содержания в нем азота. Он представляет собой бесцветный газ, у которого нет запаха и вкуса. Если разбирать химическую формулу, то молекула азота представляет собой два атома азота, которые скрещены между собой. Именно он составляет большую часть и составляет около 78% от всего объема воздуха. И молярная масса сжатого воздуха, высчитываемая по формуле, будет содержать в себе и молярную массу азота. Азот содержится практически везде и человек уже давно начал его использовать в своих нуждах. Даже в белке, который является основным строительным материалом всех живых организмов, тоже есть азот. Так аммиак, который применяется в сельском хозяйстве, получается при извлечении азота. И сам человек примерно на 2% состоит из азота.
Но азот может быть и опасным, если превышать его концентрацию. Безопасный азот обычно смешан с водородом в необходимых пропорциях. Азот необходим для разбавления кислорода, ведь чистый кислород тоже может быть губительным для живых организмов. Но если азот будет повышен, то это приведет к гипоксии, то есть понижению уровня кислорода в организме и внутренних органах. Вдыхаемый человеком азот не усваивается в организме, а выдыхается, так как служит только для защиты легких от кислорода.

Человек ежедневно сталкивается с тем, что было создано не без помощи азота. Азот нашел свое применение в различных областях и сейчас мы можем видеть его как в упаковках на прилавках магазинов, так и в медицине. К примеру, жидкую форму азота уже давно используют для транспортировки донорских органов.
Растения тоже не могут обойтись без азота и получают его из почвы в виде нитратов. В почве находится большое количество азота. Так потом он попадает в организмы животных, которые едят растения. Главным поставщиком азота являются бактерии, благодаря которым образовывается более ста тонн этого вещества.
Теплопроводность углекислого газа
Углекислым газом называют химическое соединение углерода и кислорода. В отличие от чистого углерода или кислорода, содержание углекислого газа в воздухе намного меньше. В нормальных условиях содержание будет равно 0,003% от общего объема воздуха. В молекулы газа входит один атом углерода и два атома кислорода. Для человека повышенный уровень углекислого газа может быть смертельно опасен, ведь он мешает поступлению кислорода в организм.
Углекислый газ также участвует в круговороте веществ и без него невозможны многие процессы. Так живые существа выделяют его в процессе дыхания, а растения, наоборот, при фотосинтезе поглощают этот газ. Он выделяется при горении углеродсодержащих предметов. Поэтому при пожарах нарушается естественный состав воздуха и увеличивается содержание в нем углекислого газа.
Теплопроводность представляет собой процесс равномерного перераспределения энергии. Эта способность является индивидуальной для каждых веществ, их состояний, а также зависит и от внешних факторов. Процесс непосредственно зависит от температуры и давления. Поэтому были разработаны таблицы, в которых показана зависимость этих показателей друг от друга.
В специальных таблицах уже рассчитаны показатели теплопроводности углекислого газа в различных его состояниях и условиях.
На основе этих таблиц можно сделать вывод, что теплопроводность углекислого газа уменьшается при повышении температуры и наоборот увеличивается если повысить давление.
Также состояние газа тоже влияет на эту зависимость. В газообразном состоянии он более теплопроводен как при увеличении давления, так и при повышении температуры, в отличие от конденсированного состояния.
На основе именно этого свойства газа работают приборы, которые измеряют содержание углекислого газа.

Зачем нужно проводить химический анализ воздуха?
Воздух является важным условием для жизни на земле. Все живые организмы зависят от воздуха и содержащегося в нем кислорода. Поэтому важно, чтобы в нем не содержалось вредных примесей и все показатели были в норме. Нарушение баланса может вызывать многие проблемы и в том числе, и со здоровьем.
Состав воздуха может изменяться не только в результате загрязнения различными предприятиями или автомобилями. Даже мебель или отделочные материалы в вашей квартиры на самом деле могут быть источниками выброса в воздух различных вредных веществ. Сейчас очень часто производители могут нарушать всевозможные нормы и изготовлять мебель из некачественных дешевых материалов. В процессе эксплуатации изделия начинают менять свои свойства и выделять иногда даже ядовитые вещества.
Для того, чтобы обезопасить себя и своих близких вы можете обратиться в нашу лабораторию «ЭкоТестЭкспресс» и заказать химический анализ воздуха.
Химический анализ представляет собой комплекс различных исследований, который позволяет определить точный состав воздуха, количество содержащихся в нем веществ и примесей. Таким образом можно выявить как нарушения в балансе, так и вредные вещества, которые загрязняют воздух и вызывают различные заболевания.
Наши эксперты-экологи проведут все необходимые измерения и выдадут вам официальные результаты исследования. Также после получения результатов вы можете получить консультацию и понять, какие именно источники вызвали нарушение норм. Своевременное устранение проблемы может сберечь ваше здоровье и комфорт.
Документы, которые выдает наша лаборатория, являются не только официальными, но и имеют юридическую силу. В случае выявления нарушений такие документы могут быть предъявлены в суд в качестве доказательства.
Сколько весит воздух? На первый взгляд, это совершенно бессмысленный вопрос, ведь воздух нельзя потрогать, он, как мы привыкли думать, не давит на нас, он совсем невидим, не ощущается, и вообще, разве может воздух что-то весить? Даже говорят иногда про худеньких и костлявых людей: «Да он (или она) легче воздуха!». Сколько весит воздух, кажется, вопрос совсем абсурдный. И тем не менее, откуда-то он берется.
Вопрос о том, сколько весит воздух, далеко не так абсурден, как кажется на первый взгляд. Он вовсе не лишен смысла, когда речь идет о весе воздуха в контексте химических реакций и расчетов. Обычно химики оперируют молярной массой воздуха.

Что же это такое и каким образом ученым удалось взвесить воздух? Они пользовались какими-то особыми весами? И чему масса воздуха равна? В чем ее измерять? И что делать, если нужно рассчитать вес очень большого объема воздуха?

Что такое молярная масса?
Молярная масса — это отношение (знак деления) массы вещества к количеству молей этого вещества. Иными словами, молярной массой вещества называется масса одного моля этого вещества.

Общепринятая форма записи молярной массы в химических формулах — заглавная буква «М». То есть, если вам нужно записать формулой фразу «молярная масса вещества равна», она будет выглядеть следующим образом: «М = …»
Обычно нижним индексом указывают, молярная масса какого вещества имеется в виду. Для сложного вещества, такого, как воздух, не имеющего определенной краткой формы записи, можно указывать также в скобках. Тогда молярную массу воздуха можно обозначать как Мвоздуха или как М (воздуха). Более предпочтителен все же вариант записи нижним индексом.
В чем измеряется молярная масса?
Единицей измерения молярной массы в Международной системе единиц (СИ) является килограмм на моль. В сокращенном виде в русскоязычном варианте это будет выглядеть как «кг/моль», а принятое международное сокращение записывается как kg/mol. Исторически, однако, сложилось так, что молярная масса измеряется в граммах на моль, так как речь, как правило, ведется об очень малых величинах и количествах вещества, а значит, килограммы здесь только утяжелили бы расчеты, не выполняя никакой иной функции.
Что такое моль?
Как уже было сказано выше, молярная масса выражает вес одного моля вещества. Но что же такое этот моль? Как его посчитать? Кто и когда решил считать массу в молях?
Моль, согласно Резолюции XIV Генеральной конференции по мерам и весам, принятой в 1971 году, и Положению о единицах величин, допускаемых к применению в Российской Федерации, определяется как количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. В качестве структурных элементов могут выступать атомы, молекулы, ионы, электроны или другие частицы и специфицированные группы частиц.
Название этой величины происходит от латинского moles, означающего «количество, масса, счетное множество».
Какова молярная масса воздуха?
Так сколько же все-таки весит воздух? Химики могут дать точный ответ на этот вопрос. Средняя молярная масса воздуха составляет 28,98 граммов на моль. Для простоты расчетов в учебных целях это число обычно округляют до 29 граммов на моль. Записывается это при решении химических уравнений как 28,98 г/моль или как 29 г/моль. Молярная масса воздуха для типовых расчетов, которые не требуют высокой точности, является неизменной.
Как удалось взвесить моль воздуха?
Воздух — это смесь различных газов. В основном в его состав входят азот и кислород. Вместе их доля в воздухе составляет более 98 процентов. Помимо них, в воздухе содержатся водород, углекислый газ, аргон и совсем крошечные примеси других газов, которые образуют атмосферу Земли, а также мельчайшие частицы водяного пара.
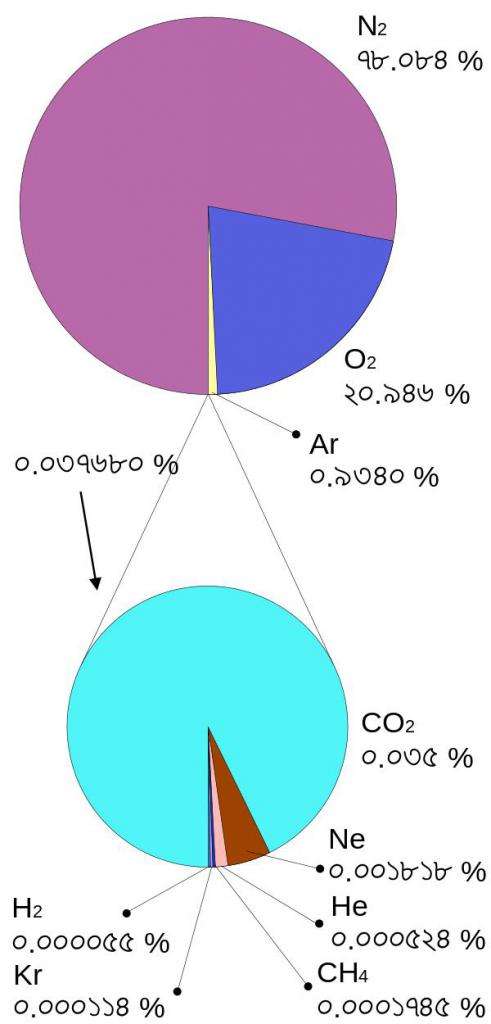
Молярная масса воздуха высчитывается как молярная масса смеси нескольких веществ, входящих в его состав. То есть для нахождения ее необходимо найти среднее арифметическое взвешенное молярной массы массовых долей, которые входят в состав индивидуальных веществ, образующих воздух.
Для удобства подсчетов химиками берутся некоторые идеальные значения молярных масс газов, входящих в состав воздуха, а также некоторые абсолютные доли этих газов в воздухе. Число 28,98 граммов на моль получается в результате нахождения среднего арифметического взвешенного с использованием этих данных.
Всегда ли моль воздуха будет весить ровно столько?
Поскольку воздух представляет собой смесь газов, он представляет собой неустойчивое соединение, в котором точные доли веществ могут изменяться в зависимости от различных условий.
Так, например, содержание в воздухе углекислого газа выше в крупных городах, чем в сельской местности, или тем более в лесах, где он потребляется деревьями, напротив, привносящими в его состав больший процент кислорода. Вообще, состав воздуха в городской среде очень сильно изменен еще и за счет выхлопных газов, работы заводов и предприятий, неравномерной концентрации зеленых и закатанных в бетон и цемент участков, а также промышленных и рекреационных зон.

Другое проявление различий в составе воздуха в разных местах хорошо знакомо альпинистам. Связано оно с тем, что молекулы кислорода имеют большую массу, а потому с высотой его концентрация в воздухе уменьшается. Следовательно, в высокогорных районах кислорода в воздухе содержится намного меньше, чем на равнине или в низине. Концентрация азота в воздухе при этом становится с высотой выше за счет уменьшения концентрации кислорода, так как этот газ имеет меньшую молярную массу, чем молярная масса кислорода. Именно поэтому покорителям горных вершин приходится таскать на себе кислородные баллоны, а у впервые попавшего в горную местность человека может закружиться голова.
Также оказывает влияние на концентрацию газов в воздухе водяной пар. Доля его содержания в воздухе зависит от влажности, температуры, климата, времени года и некоторых других условий. Доля его обычно не слишком значительна, однако может достигать в отдельных местностях нескольких процентов.
Каким образом можно найти массу большего количества воздуха?

Зная молярную массу воздуха, можно рассчитать, сколько весит больший объем воздуха. Для этого необходимо знать количество воздуха.
Масса воздуха рассчитывается путем умножения количества воздуха на его молярную массу. Если записать это утверждение в виде формулы, схема расчетов будет выглядеть следующим образом: m = V × M. В этой формуле m обозначает массу воздуха, V — количество воздуха в молях, а M — молярную массу воздуха.
