Download Article
Download Article
Atomic mass is the sum of all the protons, neutrons, and electrons in a single atom or molecule. However, the mass of an electron is so small, it is considered negligible and not included in the calculation.[1]
Though technically incorrect, the term is also often used to refer to the average atomic mass of all of the isotopes of one element. This second definition is actually the relative atomic mass, also known as the atomic weight, of an element.[2]
The atomic weight takes into account the average of the masses of naturally occurring isotopes of the same element. Chemists need to distinguish between these two types of atomic mass to guide their work — an incorrect value for atomic mass can, for instance, lead to an incorrect calculation of an experiment’s yield.
-
1
Understand how atomic mass is represented. Atomic mass, the mass of a given atom or molecule, can be expressed in standard SI mass units — grams, kilograms, etc. However, because atomic masses, when expressed in these terms, are incredibly small, atomic mass is often expressed in unified atomic mass units (usually shortened to «u» or «amu») or in Dalton’s (Da). The standard for one atomic mass unit is equal to 1/12th of the mass of a standard carbon-12 isotope.[3]
- The atomic mass is the number of grams of the element in one mole of atoms of the element. This is a very useful property when it comes to practical calculations, as it allows easy conversion between the mass and moles of a given quantity of atoms or molecules of the same type.
-
2
Locate atomic mass on the periodic table. Most standard periodic tables list the relative atomic masses (atomic weights) of each element. This is almost always written as a number at the bottom of the element’s square on the table, under its one or two letter chemical symbol. This number is usually expressed as a decimal rather than as a whole number.
- Note that the relative atomic masses listed on the periodic table are average values for the associated element. Chemical elements have different isotopes — chemical forms that differ in mass because of the addition or subtraction of one or more neutrons to the atom’s nucleus.[4]
Thus, the relative atomic mass listed on the periodic table is suitable as an average value for atoms of a certain element, but not as the mass of a single atom of that element. - Relative atomic masses, as listed on the periodic table, are used to calculate molar masses for atoms and molecules. Atomic masses, when expressed in amu, as on the periodic table, are technically unitless. However, by simply multiplying an atomic mass by 1 g/mol, a workable quantity is obtained for an element’s molar mass — the mass (in grams) of one mole of an element’s atoms.
- For example, the atomic mass of iron is 55.847 amu, which means one mole of iron atoms would weigh 55.847 grams.
Advertisement
- Note that the relative atomic masses listed on the periodic table are average values for the associated element. Chemical elements have different isotopes — chemical forms that differ in mass because of the addition or subtraction of one or more neutrons to the atom’s nucleus.[4]
-
3
Understand that periodic table values are an average atomic mass for an element. As has been noted, the relative atomic masses listed for each element on the periodic table are average values of all of an atom’s isotopes. This average value is valuable for many practical calculations — like, for instance, calculating the molar mass of a molecule comprised of several atoms. However, when dealing with individual atoms, this number is sometimes insufficient.
- Because it’s an average of several different types of isotopes, the value on the periodic table isn’t the exact value for any single atom’s atomic mass.
- The atomic masses for individual atoms must be calculated by taking into account the exact number of protons and neutrons in a single atom.
Advertisement
-
1
Find the atomic number of the element or isotope. The atomic number is the number of protons in an element, and never varies.[5]
For example, all hydrogen atoms, and only hydrogen atoms, have 1 proton. Sodium has an atomic number of 11 because its nucleus has 11 protons, while oxygen has an atomic number of 8 because its nucleus has 8 protons. You can find the atomic number of any element on the periodic table — in nearly all standard periodic tables: it’s the number above an element’s 1 or 2-letter chemical symbol. This number will always be a positive whole number.- Let’s say that we’re working with the carbon atom. Carbon always has 6 protons, so we know its atomic number is 6. We can also see on the periodic table that the square for carbon (C) has a «6» at the top, signifying that carbon’s atomic number is 6.
- Note that an element’s atomic number doesn’t have any direct bearing on its relative atomic mass as listed on the periodic table. Though, especially among elements at the top of the periodic table, it may seem that an atoms’ atomic mass is about twice its atomic number, atomic mass isn’t ever calculated by doubling an element’s atomic number.
-
2
Find the number of neutrons in the nucleus. The number of neutrons can vary among atoms of a certain element. While 2 atoms with the same number of protons and differing numbers of neutrons are both the same element, they are different isotopes of that element. Unlike the number of protons in an element, which never changes, the number of neutrons in atoms of a certain element can vary often enough that the average atomic mass of the element must be expressed as a decimal value between two whole numbers.
- The number of neutrons can be determined by the isotope designation of the element. For example, carbon-14 is a naturally occurring radioactive isotope of carbon-12. You will often see an isotope designated with the number as a superscript before the element symbol: 14C. The number of neutrons is calculated by subtracting the number of protons from the isotope number: 14 – 6 = 8 neutrons.
- Let’s say the carbon atom we’re working with has six neutrons (12C). This is by far the most common isotope of carbon, accounting for nearly 99% of all carbon atoms.[6]
However, about 1% of carbon atoms have 7 neutrons (13C). Other types of carbon atoms with more or less than 6 or 7 neutrons exist in very small amounts.
-
3
Add the proton and neutron count. This is the atomic mass of that atom. Don’t worry about the number of electrons orbiting the nucleus — their combined mass is very, very small, so, in most practical cases, it won’t significantly affect your answer.[7]
- Our carbon atom has 6 protons + 6 neutrons = 12. The atomic mass of this specific carbon atom is 12. If it was a carbon-13 isotope, on the other hand, we would know that it has 6 protons + 7 neutrons = an atomic weight of 13.
- The actual atomic weight of carbon-13 is 13.003355[8]
, and is more precise because it was determined experimentally. - Atomic mass is very close to the isotope number of an element. For basic calculation purposes, isotope number is equal to atomic mass. When determined experimentally, the atomic mass is slightly higher than the isotope number due to the very small mass contribution from electrons.
Advertisement
-
1
Determine which isotopes are in the sample. Chemists often determine the relative proportions of isotopes in a given sample by using a special tool called a mass spectrometer. However, at student-level chemistry, this information is often provided for you on school tests, etc., in the form of established values from scientific literature.
- For our purposes, let’s say we’re working with the isotopes carbon-12 and carbon-13.
-
2
Determine the relative abundance of each isotope in the sample. Within a given element, different isotopes appear in different proportions. These proportions are almost always expressed as percentages. Some isotopes will be very common, while others will be very rare — at times, so rare that they can barely be detected. This information can be determined through mass spectrometry or from a reference book.
- Let’s say that the abundance of carbon-12 is 99% and the abundance of carbon-13 is 1%. Other carbon isotopes do exist, but they exist in quantities so small that, for this example problem, they can be ignored.
-
3
Multiply the atomic mass of each isotope by its proportion in the sample. Multiply the atomic mass of each isotope by its percent abundance (written as a decimal). To convert a percentage to a decimal, simply divide it by 100. The converted percentages should always add up to 1.
- Our sample contains carbon-12 and carbon-13. If carbon-12 makes up 99% of the sample and carbon-13 makes up 1% of the sample, multiply 12 (the atomic mass of carbon-12) by 0.99 and 13 (the atomic mass of carbon-13) by 0.01.
- A reference book will give percent proportions based on all the known amounts of an element’s isotopes. Most chemistry textbooks include this information in a table at the end of the book. A mass spectrometer can also yield the proportions for the sample being tested.
-
4
Add the results. Sum the products of the multiplications you performed in the previous step. The result of this addition is the relative atomic mass of your element — the average value of the atomic masses of your element’s isotopes. When discussing an element in general, and not specific isotopes of that element, this value is used.
- In our example, 12 x 0.99 = 11.88 for carbon-12, while 13 x 0.01 = 0.13 for carbon-13. The relative atomic mass of our example is 11.88 + 0.13 = 12.01.
Advertisement
Add New Question
-
Question
How do I find the mass number of an atom?
Add the protons and neutrons together to find the mass, or add the masses of the isotopes multiplied by the atom’s natural abundance.
-
Question
If 1 amu is 1/12 of a carbon 12 atom, why is it that when I add the masses of the individual parts of a carbon 12 atom, I get more than 12 amu?
1 u = 1/12 the mass of carbon 12 by definition. You’re adding the masses of uncombined protons and neutrons, 1.0073 u and 1.0087 u respectively. But when those particles fuse together to form an atom, some of the mass is converted into energy according to E=mc^2. The lost mass is called the «mass defect», and the equivalent amount of energy is the «binding energy.»
-
Question
How can I find the mass of any atom to convert it in a.m.u.?
We can find the mass of any atom by adding the electrons, protons and neutrons.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Things You’ll Need
- Chemistry reference book
- Calculator
References
About This Article
Article SummaryX
To calculate atomic mass, start by finding the atomic number of the element, which is the number above the element on the periodic table. Next, find the number of neutrons in the nucleus by subtracting the atomic number from the isotope number. Finally, add the atomic number and the number of neutrons to get the atomic mass. To learn how to locate an element’s atomic mass on the periodic table, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 954,091 times.
Reader Success Stories
-
«I couldn’t do my homework for my science teacher without this article, it has helped me understand the topic…» more
Did this article help you?
Загрузить PDF
Загрузить PDF
Атомной массой называется сумма масс всех протонов, нейтронов и электронов, из которых состоит тот или иной атом или молекула.[1]
По сравнению с протонами и нейтронами масса электронов очень мала, поэтому она не учитывается в расчетах.[2]
Хотя это и некорректно с формальной точки зрения, нередко данный термин используется для обозначения средней атомной массы всех изотопов элемента. На самом деле это относительная атомная масса, называемая также атомным весом элемента.[3]
Атомный вес – это среднее значение атомных масс всех изотопов элемента, встречающихся в природе. Химики должны различать эти два типа атомной массы при выполнении своей работы – неправильное значение атомной массы может, к примеру, привести к неправильному результату для выхода продукта реакции.
-
1
Изучите как записывается атомная масса. Атомная масса, то есть масса данного атома или молекулы, может быть выражена в стандартных единицах системы СИ – граммах, килограммах и так далее. Однако в связи с тем, что атомные массы, выраженные в этих единицах, чрезвычайно малы, их часто записывают в унифицированных атомных единицах массы, или сокращенно а.е.м. – атомные единицы массы. Одна атомная единица массы равна 1/12 массы стандартного изотопа углерод-12.[4]
- Атомная единица массы характеризует массу одного моля данного элемента в граммах. Эта величина очень полезна при практических расчетах, поскольку с ее помощью можно легко перевести массу заданного количества атомов или молекул данного вещества в моли, и наоборот.
-
2
Найдите атомную массу в периодической таблице Менделеева. В большинстве стандартных таблиц Менделеева содержатся атомные массы (атомные веса) каждого элемента. Как правило, они приведены в виде числа в нижней части ячейки с элементом, под буквами, обозначающими химический элемент. Обычно это не целое число, а десятичная дробь.
- Обратите внимание, что все относительные атомные массы, указанные в таблице Менделеева, для каждого элемента являются средними значениями. У химических элементов есть различные изотопы – химические разновидности, имеющие разные массы из-за дополнительных или отсутствующих нейтронов в атомном ядре.[5]
Следовательно, относительные атомные массы, перечисленные в периодической таблице, могут использоваться как среднее значение для атомов определенного элемента, но не как масса одного атома данного элемента. - Относительные атомные массы, приведенные в периодической таблице, используются для расчета молярных масс атомов и молекул. Атомные массы, выраженные в а.е.м. (как в таблице Менделеева), по существу безразмерны. Однако просто умножив атомную массу на 1 г/моль, мы получаем полезную характеристику элемента – массу (в граммах) одного моля атомов этого элемента.
- Обратите внимание, что все относительные атомные массы, указанные в таблице Менделеева, для каждого элемента являются средними значениями. У химических элементов есть различные изотопы – химические разновидности, имеющие разные массы из-за дополнительных или отсутствующих нейтронов в атомном ядре.[5]
-
3
Помните о том, что в периодической таблице приведены средние атомные массы элементов. Как было отмечено ранее, относительные атомные массы, указанные для каждого элемента в периодической системе, являются средними значениями масс всех изотопов атома. Это среднее значение ценно для многих практических целей: к примеру, оно используется при расчете молярной массы молекул, состоящих из нескольких атомов. Однако когда вы имеете дело с отдельными атомами, этого значения, как правило, бывает недостаточно.
- Поскольку средняя атомная масса представляет собой усредненное значение для нескольких изотопов, величина, указанная в таблице Менделеева не является точным значением атомной массы любого единичного атома.
- Атомные массы отдельных атомов необходимо рассчитывать с учетом точного числа протонов и нейтронов в единичном атоме.
Реклама
-
1
Найдите атомный номер данного элемента или его изотопа. Атомный номер – это количество протонов в атомах элемента, оно никогда не изменяется.[6]
Например, все атомы водорода, причем только они, имеют один протон. Атомный номер натрия равен 11, поскольку в его ядре одиннадцать протонов, тогда как атомный номер кислорода составляет восемь, так как в его ядре восемь протонов. Вы можете найти атомный номер любого элемента в периодической таблице Менделеева – практически во всех ее стандартных вариантах этот номер указан над буквенным обозначением химического элемента. Атомный номер всегда является положительным целым числом.- Предположим, нас интересует атом углерода. В атомах углерода всегда шесть протонов, поэтому мы знаем, что его атомный номер равен 6. Кроме того, мы видим, что в периодической системе, в верхней части ячейки с углеродом (C) находится цифра «6», указывающая на то, что атомный номер углерода равен шести.
- Обратите внимание, что атомный номер элемента не связан однозначно с его относительной атомной массой в периодической системе. Хотя, особенно для элементов в верхней части таблицы, может показаться, что атомная масса элемента вдвое больше его атомного номера, она никогда не рассчитывается умножением атомного номера на два.
-
2
Найдите число нейтронов в ядре. Количество нейтронов может быть различным для разных атомов одного и того же элемента. Когда два атома одного элемента с одинаковым количеством протонов имеют разное количество нейтронов, они являются разными изотопами этого элемента. В отличие от количества протонов, которое никогда не меняется, число нейтронов в атомах определенного элемента может зачастую меняться, поэтому средняя атомная масса элемента записывается в виде десятичной дроби со значением, лежащим между двумя соседними целыми числами.
- Количество нейтронов можно определить по обозначению изотопа элемента. Например, углерод-14 представляет собой радиоактивный изотоп углерода-12, встречающийся в природе. Часто номер изотопа указывается в виде надстрочного числа, стоящего перед символом элемента: 14C. Количество нейтронов находится путем вычитания числа протонов из номера изотопа: 14 – 6 = 8 нейтронов.
- Допустим, что интересующий нас атом углерода имеет шесть нейтронов (12C). Это наиболее распространенный изотоп углерода, насчитывающий около 99% всех атомов данного элемента.[7]
Однако около 1% атомов углерода имеют 7 нейтронов (13C). Другие виды атомов углерода имеют больше 7 или меньше 6 нейтронов и существуют в очень малых количествах.
-
3
Сложите количество протонов и нейтронов. Это и будет атомной массой данного атома. Не обращайте внимания на количество электронов, которые окружают ядро – их суммарная масса чрезвычайно мала, поэтому они практически не влияют на ваши расчеты.
- Наш атом углерода имеет 6 протонов + 6 нейтронов = 12. Таким образом, атомная масса данного атома углерода равна 12. Если бы это был изотоп «углерод-13», то мы бы знали, что у него есть 6 протонов + 7 нейтронов = атомная масса 13.
- В действительности атомная масса углерода-13 составляет 13,003355[8]
, причем это значение является более точным, поскольку было определено экспериментальным путем. - Атомная масса очень близка к номеру изотопа. Для удобства вычислений номер изотопа часто полагают равным атомной массе. Экспериментально определенные значения атомной массы немного превышают номер изотопа из-за очень малого вклада со стороны электронов.
Реклама
-
1
Определите, какие изотопы содержатся в образце. Химики часто определяют соотношение изотопов в конкретном образце с помощью специального прибора под названием масс-спектрометр. Однако при обучении эти данные будут предоставлены вам в условиях заданий, контрольных и так далее в виде значений, взятых из научной литературы.
- В нашем случае допустим, что мы имеем дело с двумя изотопами: углеродом-12 и углеродом-13.
-
2
Определите относительное содержание каждого изотопа в образце. Для каждого элемента различные изотопы встречаются в разных соотношениях. Эти соотношения почти всегда выражают в процентах. Некоторые изотопы встречаются очень часто, тогда как другие очень редки – временами настолько, что их с трудом можно обнаружить. Эти величины можно определить с помощью масс-спектрометрии или найти в справочнике.
- Допустим, что концентрация углерода-12 равна 99%, а углерода-13 – 1%. Другие изотопы углерода действительно существуют, но в количествах настолько малых, что в данном случае ими можно пренебречь.
-
3
Умножьте атомную массу каждого изотопа на его концентрацию в образце. Умножьте атомную массу каждого изотопа на его процентное содержание (выраженное в виде десятичной дроби). Чтобы перевести проценты в десятичную дробь, просто разделите их на 100. Полученные концентрации в сумме всегда должны давать 1.
- Наш образец содержит углерод-12 и углерод-13. Если углерод-12 составляет 99% образца, а углерод-13 – 1%, то необходимо умножить 12 (атомная масса углерода-12) на 0,99 и 13 (атомная масса углерода-13) на 0,01.
- В справочниках даются процентные соотношения, основанные на известных количествах всех изотопов того или иного элемента. Большинство учебников по химии содержат эту информацию в виде таблицы в конце книги. Для изучаемого образца относительные концентрации изотопов можно также определить с помощью масс-спектрометра.
-
4
Сложите полученные результаты. Просуммируйте результаты умножения, которые вы получили в предыдущем шаге. В результате этой операции вы найдете относительную атомную массу вашего элемента – среднее значение атомных масс изотопов рассматриваемого элемента. Когда рассматривается элемент в целом, а не конкретный изотоп данного элемента, используется именно эта величина.
- В нашем примере 12 x 0,99 = 11,88 для углерода-12, и 13 x 0,01 = 0,13 для углерода-13. Относительная атомная масса в нашем случае составляет 11,88 + 0,13 = 12,01.
Реклама
Советы
- Некоторые изотопы менее стабильны, чем другие: они распадаются на атомы элементов с меньшим количеством протонов и нейтронов в ядре с выделением частиц, входящих в состав атомного ядра. Такие изотопы называют радиоактивными.
Реклама
Что вам понадобится
- Справочник по химии
- Калькулятор
Об этой статье
Эту страницу просматривали 136 679 раз.
Была ли эта статья полезной?
- Курс
Меня зовут Кузьмин Владимир Александрович.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Относительная атомная масса.
Важной характеристикой отдельно взятого атома является его масса. Масса атома складывается из масс входящих в его состав протонов, нейтронов и электронов с учётом дефекта массы.
Массой электронов в расчётах можно пренебрегать, так как она несоизмеримо мала по сравнению с массами покоя протона и нейтрона. Поэтому, вполне можно пользоваться понятием масса нуклида.
Напомним, что нуклид — это ядро атома с конкретным числом протонов и нейтронов.
Дефект массы – потеря ядром атома части массы при его синтезе из отдельных протонов и нейтронов.
Δm – изменение массы (кг); ΔЕ – изменение энергии (Дж); с – скорость света в вакууме (3∙108 м/с).
Данная формула свидетельствует, что при ядерном синтезе ядро теряет часть массы с выделяющейся энергией. Поэтому масса ядра атома всегда меньше суммы масс покоя входящих в состав ядра протонов и нейтронов.
Разность между суммой масс покоя нуклонов (протонов и нейтронов), входящих в состав ядра и массой ядра и есть дефект массы.
Масса нуклида выраженная в килограммах называется абсолютной массой нуклида.
Во многих учебниках можно встретить информацию о том, что в расчётах величиной абсолютной массы, якобы, пользоваться не удобно, поэтому вводят величину относительной атомный массы. Но это заблуждение. Причина использования относительной атомной массы совершенно другая. Корни её кроются в истории.
Абсолютная масса очень маленькая величина.
Для химиков и физиков 16-17 веков экспериментально её измерить было невозможно. Но даже в то время было важно проводить химические расчёты.
Первым учёным, решившим эту проблему, был Джон Дальтон, он предложил ввести величину относительной атомной массы (Аr). Относительной она называется потому, что вычисляется по отношению к массе произвольно выбранного эталона. Дальтон выбрал за эталон массу самого лёгкого атома — атома водорода и, принял её равной 1.
Относительные атомные массы известных на то время элементов рассчитывались Дальтоном на основе открытым им закона кратных отношений.
В настоящее время за эталон выбрана 1/12 часть абсолютной массы нуклида 12С. Этот эталон принято называть атомной единицей массы, сокращённо а.е.м.
Относительная масса нуклида – безразмерная величина, равная отношению абсолютной массы нуклида к 1/12 части массы нуклида 12C (атомной единице массы — а.е.м.).
Химический элемент представляет из себя смесь изотопов с определенной массовой долей каждого, поэтому можно вычислить усреднённую массу атома данного химического элемента, такая величина называется средней абсолютной массой атома элемента.
Средняя абсолютная масса атома элемента – масса атома элемента, выраженная в кг., вычисленная с учётом его изотопного состава.
Понятие относительной массы нуклида, не следует путать с понятием относительной атомной массы химического элемента. Не забываем, что элемент — это смесь изотопов. Поэтому относительная атомная масса элемента — величина средняя.
Относительная атомная масса элемента – безразмерная величина, равная отношению средней абсолютной массы атома элемента к 1/12 части массы нуклида 12С.
С учётом того, что отношение абсолютной массы нуклида к атомной единице массы есть ни что иное как относительная масса нуклида, выражение можно привести в виду:
Приведенную формулу мы будем использоваться для решения расчетных задач.
Атом
– это наименьшая частица химического
элемента, сохраняющая все его химические
свойства. Атом состоит из положительно
заряженного ядра и вращающихся вокруг
него электронов, ядро состоит из протонов
и нейтронов. Все электроны атома образуют
его электронную оболочку, строение
которой определяет многие химические
свойства элемента.
Электрон
(ē) – это
отрицательно заряженная микрочастица,
входящая в состав атома и несущая
наименьший электрический заряд.
Заряд электрона в кулонах оказался
величиной чрезвычайно малой (1,610-19
Кл), поэтому для удобства величина этого
«элементарного» заряда принята за
единицу qe=-1.
Так как атом в целом электронейтрален,
то число электронов, движущихся вокруг
ядра, равно заряду ядра этого атома.
Например, заряд ядра атома натрия +11.
Вокруг ядра размещается 11 электронов
с общим отрицательным зарядом –11. Самый
простой состав имеет ядро атома водорода
– один положительный заряд и массу,
близкую к единице атомной массы. Ядро
водорода назвали протоном.
Протон (р+)
– это
микрочастица, входящая в состав ядра
атома, имеющая положительный заряд
qр=+1
и массу, близкую к 1 а.е.м..
В любом атоме число протонов в ядре
равно числу электронов.
Нейтрон (n0)
– это
электронейтральная микрочастица,
входящая в состав ядра атома, его масса,
как и масса протона, близка к 1 а.е.м..
Масса электронов
в атоме очень мала – он почти в две
тысячи раз легче протона, поэтому массой
электрона в атоме пренебрегают и масса
атома считается равной сумме масс
протонов и нейтронов, т.е. сумме количества
протонов и нейтронов в атоме.
Большинство
элементов в природе встречаются в виде
атомов, характеризующихся разными
атомными массами. Такие атомы называются
изотопы –
атомы, имеющие
одинаковый заряд ядра, но разные атомные
массы. Это
объясняется тем, что они содержат
одинаковое число протонов, но разное
число нейтронов. Например, изотопы
водорода: протий, дейтерий и тритий.
Ядро протия состоит из одного протона,
дейтерия – из одного протона и одного
нейтрона, трития – из одного протона и
двух нейтронов.
Атомы различных изотопов одного и того
же элемента наряду с разными ядерными
свойствами имеют одинаковое строение
электронной оболочки, поэтому химические
и физические свойства изотопов почти
одинаковы.
Строение электронной оболочки
Электроны
характеризуются двойственной природой:
они имеют свойства и частицы, и волны.
Для движущегося электрона невозможно
указать его точное местоположение,
можно лишь определить вероятность
нахождения электрона в различных частях
внутриатомного пространства. Область
пространства, в которой наиболее вероятно
нахождение электрона,
называется атомной
орбиталью
(АО).
Состояние электрона в атоме характеризуется
четырьмя квантовыми числами.
Главное квантовое число n
определяет энергию электрона в атоме
и размер АО, т.е. удаленность электрона
от ядра. Главное квантовое число n
принимает значения целых чисел 1, 2, 3, 4…
Совокупность электронов с одинаковым
значением n
называется энергетическим уровнем.
Наименьшую энергию имеют электроны
первого от ядра энергетического уровня
(n=1); с увеличением n
энергия электрона и его удаленность от
ядра возрастают. Состояние атома,
когда его электроны находятся на таких
энергетических уровнях, что их суммарная
энергия является минимальной,
называется основным, или невозбужденным.
Состояния с более высокими значениями
энергии называются возбужденными.
Энергетические уровни обозначают
буквами:
Числовое
значение n
1 2 3 4 5 6 7
Буквенное
обозначение K
L
M
N
O
P
Q.
На
одном и том же энергетическом уровне
могут находиться атомные орбитали
различной формы, отличающиеся друг от
друга по энергии. Поэтому энергетические
уровни разделяются на подуровни. Энергию
электрона на подуровне и форму атомной
орбитали
характеризует
орбитальное
квантовое число l.
Значение l
зависит от главного квантового числа:
l
принимает значения от 0 до (n–1),
т. е. 0, 1, 2, 3… (n–1).
В пределах
данного энергетического уровня
совокупность электронов, характеризующихся
одинаковым значением l,
называется энергетическим
подуровнем.
Подуровни обозначают буквами:
Орбитальное
квантовое число l
0 1 2 3
Обозначение
энергетического подуровня s
p
d
f.
Таким
образом, при l
= 0, 1, 2, 3
электроны находятся соответственно на
s-,
p-,
d-,
f—подуровнях.
При данном значении главного квантового
числа n
наименьшую энергию имеют электроны
s-подуровня,
затем p-,
d-,
f—подуровней.
Электроны различных подуровней называют
s-,
p-,
d-,
f—электронами.
В этом случае говорят также о состояниях
s-,
p-,
d-,
f—электронов,
или s-,
p-,
d-,
f—атомных
орбиталях.
Число
энергетических подуровней в уровне не
должно быть больше главного квантового
число n.
Так, первый уровень (n=1)
имеет один подуровень (s),
второй уровень (n=2)
– два подуровня (s
и p),
третий (n=3)
– три (s,
p,
d),
четвертый (n=4)
– четыре (s,
p,
d,
f).
В оболочках атомов ныне известных
элементов электроны застраивают на
каждом уровне не более четырех подуровней.
Уровни O
(n=5),
P
(n=6),
Q
(n=7)
содержат по четыре подуровня.
Каждый
подуровень составлен из орбиталей,
количество которых определяется
магнитными квантовым числом ml.
Магнитное
квантовое число
ml
определяет
возможные
ориентации орбитали в пространстве,
связано с орбитальным квантовым числом
и может принимать целочисленные значения
от –l
до +l,
включая ноль. Определенному значению
l
соответствует (2l+1)
возможных значений магнитного квантового
числа. Число значений ml
указывает на число атомных орбиталей
в подуровне и число возможных направлений,
по которым они могут ориентироваться
в пространстве.
Для
s-подуровня
l=0
и потому ml
имеет единственное значение: ml
=0. Таким образом, на s-подуровне
имеется единственная s-орбиталь,
которая расположена симметрично ядру
атома. Для p-подуровня
l=1
и ml
приобретает три значения: –1, 0, 1, т. е.
р-подуровень
имеет три р-орбитали
и они ориентированы по трем осям
координат; d-подуровень
(l=2)
имеет пять значений ml:
–2, –1, 0, 1, 2 и, следовательно, пять
d-орбиталей,
которые ориентированы по пяти разным
направлениям; f-подуровень
(l=3)
имеет семь значений ml:
–3, –2, –1, 0, 1, 2, 3, т. е. семь f—орбиталей.
Число ориентаций f—орбиталей
равно семи.
У
атомные орбитали АО обозначают в виде
квадрата (квантовой ячейки) Error: Reference source not found.
Соответственно для s-подуровня
имеется одна АО Error: Reference source not found,
для p‑подуровня
– три АО , для d-подуровня
– пять АО Error: Reference source not found, для
f‑подуровня
– семь АО .Error: Reference source not found
Таким
образом, электроны в атоме располагаются
по энергетическим уровням, удаленность
которых от ядра характеризуется значением
главного квантового числа n;
уровни состоят из подуровней, число
которых для каждого уровня не превышает
значение n;
в свою очередь, подуровень состоит из
орбиталей, форма которых определяется
значением орбитального квантового
числа l,
а количество задается числом значений
магнитного квантового числа ml.
Квантовые числа n,
l,
ml
характеризуют орбиталь.
Кроме
движения вокруг ядра, электрон вращается
вокруг собственной оси. Это движение
получило название «спин». Спиновое
квантовое число
ms
характеризует
два возможных
направления вращения электрона вокруг
собственной оси
(по часовой стрелке или против). Спиновое
квантовое число ms
принимает
два значения: +1/2
и –1/2.
Электроны с разными спинами обычно
обозначаются противоположно направленными
стрелками ↓↑.
Четыре
квантовых числа n,
l,
ml,
ms
полностью характеризуют состояние
электрона в атоме.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Строение атома
Атом (от греческого atomos — неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойств вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (количество нейтронов может быть равно или чуть больше или меньше, чем протонов). Протоны и нейтроны называют нуклонами, то есть частицами ядра. Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома в основном определяется массой его ядра, поскольку масса электрона примерно в 1836 раз меньше массы протона и нейтрона и в расчётах редко учитывается. Точное количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A—Z).
Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N), называется нуклидом (это могут быть как разные элементы с одинаковым общим количеством нуклонов (изобары) или нейтронов (изотоны), так и один химический элемент — одно количество протонов, но разное количество нейтронов (изомеры)).
| элементарная частица | заряд (условные единицы) | заряд (Кл) | масса (а.е.м.) | масса (г) |
|---|---|---|---|---|
| протон | +1 | 1,6·10×10-19 | 1 | 1,7·10×10-24 |
| нейтрон | 0 | 0 | 1 | 1,7·10×10-24 |
| электрон | -1 | -1,6·10×10-19 | 0 | 9,1·10×10-28 |
Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объёмом атома, то ядро условно принимается материальной точкой, покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
Свойства электрона
Перед изучением свойств электрона и правил формирования электронных уровней необходимо затронуть историю формирования представлений о строении атома. Мы не будем рассматривать полную историю становления атомарного строения, а остановимся лишь на самых актуальных и наиболее «верных» представлениях, способных наиболее наглядно показать как располагаются электроны в атоме. Первыми наличие атомов как элементарных составляющих вещества предположили еще древнегреческие философы (если какое-либо тело начать делить пополам, половинку ещё пополам и так далее, то этот процесс не сможет происходить до бесконечности; мы остановимся на частичке, которую уже не сможем поделить, — это и будет атом). После чего история строения атома прошла сложный путь и разные представления, такие как неделимость атома, Томсоновская модель атома и другие. Наиболее близкой оказалась модель атома, предложенная Эрнестом Резерфордом в 1911 году. Он сравнил атом с солнечной системой, где в роли солнца выступало ядро атома, а электроны двигались вокруг него подобно планетам. Размещение электронов на стационарных орбитах было очень важным шагом в понимании строения атома. Однако такая планетарная модель строения атома шла в противоречие с классической механикой. Дело в том, что при движении электрона по орбите он должен был терять потенциальную энергию и в конце концов «упасть» на ядро, и атом должен был прекратить свое существование. Такой парадокс был устранен введением постулатов Нильсом Бором. Согласно этим постулатам, электрон двигался по стационарным орбитам вокруг ядра и при нормальных условиях не поглощал и не испускал энергию. Постулаты показывают, что для описания атома законы классической механики не подходят. Такая модель атома называется моделью Бора-Резерфорда. Продолжением планетарного строения атома является квантово-механическая модель атома, согласно которой мы и будем рассматривать электрон.
Электрон является квазичастицей, проявляя корпускулярно-волновой дуализм: он одновременно является и частицей (корпускула), и волной. К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам — способность к дифракции и интерференции. Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля:
где 



Для электрона невозможно рассчитать траекторию его движения, можно говорить только о вероятности нахождения электрона в том или ином месте вокруг ядра. По этой причине говорят не об орбитах движения электрона вокруг ядра, а об орбиталях — пространстве вокруг ядра, в котором вероятность нахождения электрона превышает 95%. Для электрона невозможно одновременно точно измерить и координату, и скорость (принцип неопределённости Гейзенберга).
где 

Чем точнее мы измеряем координату электрона, тем больше погрешность в измерении его скорости, и наоборот: чем точнее мы знаем скорость электрона, тем больше неопределённость в его координате.
Наличие волновых свойств у электрона позволяет применить к нему волновое уравнение Шредингера.

где 


Представленное уравнение написано для одноэлектронной системы. Для систем, содержащих более одного электрона, принцип описания остаётся прежним, но уравнение принимает более сложный вид. Графическим решением уравнения Шредингера является геометрия атомных орбиталей. Так, s-орбиталь имеет форму шара, p-орбиталь — форму восьмерки с «узлом» в начале координат (на ядре, где вероятность обнаружения электрона стремится к нулю).
В рамках современной квантово-механической теории электрон описывается набором квантовых чисел: n, l, ml, s и ms. Согласно принципу Паули в одном атоме не может быть двух электронов с полностью идентичным набором всех квантовых чисел.
Главное квантовое число n определяет энергетический уровень электрона, то есть на каком электронном уровне расположен данный электрон. Главное квантовое число может принимать только целочисленные значения больше 0: n=1;2;3… Максимальное значение n для конкретного атома элемента соответствует номеру периода, в котором расположен элемент в периодической таблице Д. И. Менделеева.
Орбитальное (дополнительное) квантовое число l определяет геометрию электронного облака. Может принимать целочисленные значения от 0 до n-1. Для значений дополнительного квантового числа l применяют буквенное обозначение:
| значение l | 0 | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| буквенное обозначение | s | p | d | f | g |
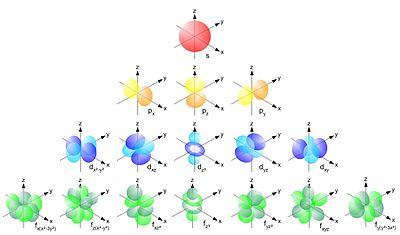
S-орбиталь имеет форму шара, p-орбиталь — форму восьмерки. Остальные орбитали имеют очень сложную структуру, как, например, представленная на рисунке d-орбиталь.
-
s-орбиталь
-
p-орбиталь
-
d-орбиталь
-
вид орбиталей на разных энергетических уровнях (при разных n)
Электроны по уровням и орбиталям располагаются не хаотично, а по правилу Клечковского, согласно которому заполнение электронов происходит по принципу наименьшей энергии, то есть в порядке возрастания суммы главного и орбитального квантовых чисел n+l. В случае, когда сумма для двух вариантов заполнения одинакова, первоначально заполняется наименьший энергетический уровень (например: при n=3 а l=2 и n=4 а l=1 первоначально заполняться будет уровень 3).
Магнитное квантовое число ml определяет расположение орбитали в пространстве и может принимать целочисленное значение от -l до +l, включая 0. Для s-орбитали возможно только одно значение ml=0. Для p-орбитали — уже три значения -1, 0 и +1, то есть p-орбиталь может располагаться по трём осям координат x, y и z.
Электрон обладает собственным моментом импульса — спином, обозначающимся квантовым числом s. Спин электрона — величина постоянная и равная 1/2. Явление спина можно условно представить как движение вокруг собственной оси. Первоначально спин электрона приравнивали к движению планеты вокруг собственной оси, однако такое сравнение ошибочно. Спин — чисто квантовое явление, не имеющее аналогов в классической механике.





















![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/2/ava/thumbnails/RgocnqRS3C4j3ys.jpg)