| Напечатано:: | Гость |
| Дата: | вторник, 30 мая 2023, 02:19 |
Описание
1. Первый закон Фарадея — фундаментальный количественный закон электрохимии.
2.Электрохимический эквивалент.
3.Кулонометры.Классификация кулонометров.
4. Выход вещества по току.
5.Способы определения выхода по току при использовании постоянного и импульсного тока.
6.Второй закон Фарадея.
7.Кажущиеся случаи отклонения от законов Фарадея.
Оглавление
- 1. Первый закон Фарадея
- 2. Электрохимический эквивалент.
- 3. Кулонометры. Классификация кулонометров.
- 4. Выход по току
- 5. Способы определения ВТ при использовании импульсного тока
- 6. Второй закон Фарадея.
- 7. Кажущиеся случаи отклонения от законов Фарадея
1. Первый закон Фарадея
Первый закон Фарадея: Если на границе раздела проводник I рода — проводник II рода при прохождении постоянного электрического тока протекает одна, и только одна, электрохимическая реакция, то масса каждого из участников реакции, претерпевших превращение, прямо пропорциональна количеству прошедшего через границу электричества.
Первый закон Фарадея устанавливает связь между количеством прошедшего через электрохимическую систему электричества и количеством прореагировавшего вещества.
Математически этот закон выражается уравнением:
m = k.I.t,
где m – масса прореагировавшего вещества, г; k – электрохимический эквивалент, г/(А.час); I – постоянный ток, проходящий через границу раздела фаз, А; t – продолжительность прохождения тока, час.
или m = k.Q, где Q – количество прошедшего электричества (Q = I.t)
2. Электрохимический эквивалент.
Электрохимический эквивалент представляет собой количество вещества, прореагировавшего в результате протекания единицы количества электричества.
Электрохимический эквивалент может быть получен расчетным путем, если известна электрохимическая реакция, т.е. исходные вещества и ее продукты. Уравнение для расчета электрохимического эквивалента выглядит следующим образом:

где М – молярная масса реагента, n – число электронов, участвующих в реакции, F – число или постоянная Фарадея: F = 96486 ≈96500 Кл/моль.
3. Кулонометры. Классификация кулонометров.
Наиболее точное определение количества электричества, проходящего через электрохимическую систему можно получить с помощью серебряного кулонометра. В этом случае точность определения составляет 0,005% .
В серебряном кулонометре определяется масса серебра, выделяющаяся
из водного раствора нитрата серебра. Платиновая чаша служит Имеются системы, в которых весь ток расходуется только на одну электрохимическую реакцию. Такие электрохимические системы используются для измерения количества электричества и называются кулонометрами.
Известны три основных типа кулонометров: весовые (гравиметрические), объемные (волюметрические) и титрационные.
В весовых кулонометрах (к ним относятся серебряные и медные) количество прошедшего в них электричества рассчитывается по изменению массы катода или анода. В объемных кулонометрах расчет производится на основании измерения объема получающихся веществ (газа в водородном кулонометре, жидкой ртути в ртутном кулонометре). В титрационныхкулонометрах количествоэлектричества определяется по данным титрования веществ, образующихся в растворе в результате электродной реакции.
Медный кулонометр наиболее распространен в практике лабораторных исследований, т.к. он является простым в изготовлении и достаточно точным. Точность определения количества электричества составляет 0,1 %. Кулонометр состоит из двух медных анодов и катода из тонкой медной фольги, расположенного между ними. Электролитом в медномкулонометре служит водный раствор состава: CuSO4 ∙ 5H2O, H2SO4 и этанол C2H5OH.Серная кислота повышает электрическую проводимость электролита и, кроме того, препятствует образованию основных соединений меди в прикатодном пространстве, которые могут адсорбироваться на катоде, увеличивая тем самым его массу. H2SO4в электролите медного кулонометра необходима для предотвращения накопления соединений Cu1+, которые могут образовываться в результате реакции диспропорционирования:
Cu0+ Cu2+ → 2Cu+
Этиловый спирт добавляют в электролит для получения более мелкокристаллических, компактных катодных осадков и с целью предотвращения окисления медных электродов кулонометра.
О количестве прошедшего электричества судят по изменению массы катода, до и после электролиза.
катодом, а анод готовится из чистого серебра.
В качестве электролита в серебряном кулонометре используется нейтральный или слабокислый 30% раствор нитрата серебра.
Газовый водородно-кислородный кулонометр применяется для приближенных измерений малых количеств электричества. В нем измеряют общий объем водорода и кислорода, выделяющихся при электролизе водного раствора H2SO4или NaOH, а из этой величины вычисляют количество прошедшего электричества. Применяют эти кулонометры сравнительно редко, т.к. точность их небольшая, а в работе они менее удобны, чем весовые кулонометры.
К объемным кулонометрам относится также ртутный кулонометр. Он применяется главным образом в промышленности для измерений количества электричества. Точность ртутного кулонометра составляет 1%, но он может работать при больших плотностях тока. Анодом служит ртуть. Уголь – катод. Электролитом служит раствор иодида ртути и иодида калия. По уровню ртути в трубке рассчитывают количество электричества.
Наиболее распространенные из титрационныхкулонометров – йодный
и кулонометрКистяковского.
Йодныйкулонометр представляет собой сосуд с разделенными катодным и анодным пространствами платиновоиридиевыми электродами. В анодное отделение вводят концентрированный раствор иодида калия с добавлением соляной кислоты, в катодное отделение – раствор соляной кислоты. При пропускании тока на аноде выделяется йод, который затем титруют тиосульфатом натрия (Na2S2O3). По результатам титрования рассчитывают количество электричества.
Кулонометр Кистяковского — это стеклянный сосуд. Анодом служит серебряная проволока, впаянная в стеклянную трубку со ртутью, для обеспечения контакта. Сосуд заполняют раствором нитрата калия (15-20%). В этот раствор погружают платиновоиридиевый катод. При пропускании тока происходит анодное растворение серебра. И также по результатам титрования раствора рассчитывают количество электричества.
4. Выход по току
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
Zn2+ +2ē →Zn
протекает реакция восстановления ионов гидроксония: 2Н3О+ +2ē → Н2 + 2H2O.
Если на электроде протекает несколькопараллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Для практических целей, для того, чтобы учесть какая доля тока или количества прошедшего через электрохимическую систему электричества расходуется на каждую конкретную реакцию введено понятие выхода вещества по току.
Таким образом, ВТ позволяет определить часть количества прошедшего через электрохимическую систему электричества, которая приходится на долю данной электрохимической реакции.
Знание ВТ необходимо, как при решении теоретических вопросов: например, при построении парциальных поляризационных кривых и выяснении механизма электрохимической реакции, так и в практике электроосаждения металлов, неметаллов, сплавов, с целью оценки эффективности технологической операции. ВТ на практике чаще всего определяют делением практической массы вещества на теоретическую массу, определенную по закону Фарадея.
mпракт – масса вещества, практически превратившегося в результате прохождения определенного количества электричества; mтеор — масса вещества, которая должна превратиться теоретически при прохождении того же количества электричества.
ВТ для процессов, протекающих на катоде, как правило, не совпадают с ВТ анодных процессов, поэтому следует различать катодный и анодный выход по току. До сих пор были рассмотрены случаи определения ВТ когда через границу раздела проводник I рода — проводник II рода протекает постоянный электрический ток.
5. Способы определения ВТ при использовании импульсного тока
Если же через границу раздела фаз протекает импульсный ток, то при определении ВТ возникают большие трудности. Единой методики или прибора для определения ВТ при импульсномэлектролизе не существует. Сложность определения ВТ в условиях импульсногоэлектролиза обусловлена тем, что проходящий через систему ток расходуется не только на электрохимическую реакцию, но и на заряжение двойного электрического слоя. Электрический ток, проходящий через границу раздела и вызывающий электрохимическое превращение, называется часто фарадеевским током. Ток заряжения расходуется на заряжение двойного электрического слоя, реорганизацию растворителя, самого реагента, т.е. на все на то, что создает условия для протекания электрохимической реакции, поэтому выражение для общего тока, проходящего через электрохимическую систему, будет выглядеть следующим образом:
I = Iз + Iф, где Iз – ток заряжения, Iф – фарадеевский ток.
Если не требуется определения абсолютных значений ВТ, то в качестве критерия оценки эффективности импульсного электролиза можно использовать отношения количества электричества, затраченного на растворение осадка к количеству электричества, затраченного на его формирование.
6. Второй закон Фарадея.
Второй закон Фарадея является непосредственным следствием первого закона. Во втором законе Фарадея отражена связь, существующая между количеством прореагировавшего вещества и его химической природой.
Согласно второму закону Фарадея:
Если на границе раздела проводник I рода — проводник II рода протекает одна и только одна, электрохимическая реакция, в которой участвует несколько веществ, то массы участников реакции, претерпевших превращения, относятся друг к другу как их химические эквиваленты.
Математически этот закон выражается уравнением:
Второй закон Фарадея является непосредственным следствием первого закона. Во втором законе Фарадея отражена связь, существующая между количеством прореагировавшего вещества и его химической природой.
Согласно второму закону Фарадея:
Если на границе раздела проводник I рода — проводник II рода протекает одна и только одна, электрохимическая реакция, в которой участвует несколько веществ, то массы участников реакции, претерпевших превращения, относятся друг к другу как их химические эквиваленты.
7. Кажущиеся случаи отклонения от законов Фарадея
I закон Фарадея, базирующийся на атомистической природе вещества и электричества, является точным законом природы. Отклонений от него быть не может. Если на практике при расчетах наблюдаются отклонения от этого закона, то они всегда обусловлены неполным учетом процессов, сопутствующих основной электрохимической реакции. Например, при электролизе водного раствора NaCl в системе с платиновыми электродами и разделенными пористой диафрагмой анодным и катодным пространствами на катоде протекает реакция:
2H2O + 2ē = H2 + 2OH—
а на аноде: 2Cl— — 2ē = Cl2
Количество образующегося газообразного хлора всегда меньше, чем это следует по закону Фарадея из-за того, что Cl2растворяется в электролите и вступает в реакцию гидролиза:
Cl2+ H2O → HCl+ HClO
Если учесть массу хлора, прореагировавшего с водой, получим результат, соответствующий рассчитанному по закону Фарадея.
Или при анодном растворении многих металлов параллельно идут два процесса – образование ионов нормальной валентности и так называемых субионов – т.е. ионов низшей валентности, например: Cu0 — 2ē → Cu2+ и
Cu- 1ē → Cu+. Поэтому расчет по закону Фарадея в предположении, что образуются только ионы высшей валентности, оказывается неправильным.
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
Zn2+ +2ē →Zn
протекает реакция восстановления ионов гидроксония: 2Н3О+ +2ē → Н2 + 2H2O.
Если на электроде протекает несколько параллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Закон Фарадея для электролиза
Содержание
- 1 Что такое электролиз
- 2 Законы Фарадея об электролизе
- 2.1 Первый закон
- 2.2 Второй закон
- 2.3 Объединённый закон
- 3 Практическое применение
- 4 Видео по теме
В результате исследований Майкла Фарадея были открыты основополагающие законы электролиза. Этот процесс активно используется в современной технике и промышленности. Законы электролиза Фарадея позволяют рассчитать условия протекания процесса и его количественные показатели.
Что такое электролиз
Ток, как известно, представляет собой упорядоченное движение зарядов. Он может протекать не только по проводам, но и через другие вещества. Для этого необходимо, чтобы вещество имело носители зарядов.
В качестве проводника может выступать жидкость, в которой происходят окислительно-восстановительные реакции. В ней имеется большое количество ионов. При пропускании через такой раствор электрического тока происходит оседание вещества на электродах. На практике этим можно воспользоваться, например, для получения металлов с высокой степенью чистоты.
При электролизе на катоде будет проходить процесс восстановления, а на аноде — окисления. Продукты реакций иногда откладываются на электродах, а в некоторых случаях продолжают вступать во вторичные реакции.
Если раствор содержит соли металлов, то последний будет откладываться на катоде, а на аноде образуется газ. Это можно продемонстрировать на электролизе поваренной соли (NaCl). Чистый натрий будет оседать на катоде, а хлор — на аноде.
Растворы веществ, обеспечивающих высокое содержание ионов в жидкости, называются электролитами. Этот термин ввёл в употребление Фарадей. Согласно его определению, речь идёт о тех жидкостях, способных пропускать электроток.
Протекание электролитических реакций возможно при выполнении следующих условий:
- В электролите не должно быть пространственной электрической однородности. В нем должна присутствовать объёмная неравномерность по уровню потенциала. Как пример можно привести ситуацию, когда в аккумуляторах происходит выработка электрического тока. Под его воздействием происходит неравномерное объёмное распределение зарядов в электролитах. Электроток обязательно должен быть постоянным.
- Чтобы можно было говорить о прохождении тока, в растворе должны присутствовать носители электрозарядов. При этом важно, чтобы они могли свободно перемещаться под действием приложенного к ним электрического поля.
На практике к электролитам относят растворимые соли, а также кислоты и щёлочи. При прохождении электротока через металлический проводник в качестве носителей заряда выступают только электроны. В электролитах присутствует ещё одна их разновидность — ионы.
Обычно атомы водорода или металлов теряют электроны и становятся положительными ионами. Отрицательно заряженные ионы —это гидроксильные группы или кислотные молекулярные остатки. При воздействии электрополя на раствор ионы с отрицательным зарядом начинают притягиваться к аноду, а с положительным — к катоду. Электрический ток в жидкостях практически представляет собой одновременное перемещение носителей заряда противоположных знаков.
В результате отрицательные ионы отдают лишние электроны положительному электроду. Соответственно, положительные ионы восполняют недостающие электроны за счёт частиц, которые получают у отрицательного электрода. После восстановления электрической нейтральности эти вещества выделяются из раствора, осаждаясь или выделяясь в виде газа.
Здесь рассмотрена ситуация, когда происходит только одна электролитическая реакция. На практике получившиеся вещества могут участвовать в других реакциях. В результате процесс электролиза становится более сложным. Таких реакций может быть 2, 3 или больше.
Законы Фарадея об электролизе
Процессы электролиза подчиняются законам Фарадея. Он обнародовал свои изыскания в 1833 году, основываясь на собственноручно проделанных опытах.
Первый закон
Первый закон электролиза Фарадея рассматривает массу вещества, которое задержалось на электродах в результате химической реакции при пропускании электротока за определённое время.
Формулировка первого закона Фарадея имеет следующий вид: если взвесить вещество, образовавшееся на электродах в результате пропускания через раствор электротока, то его вес будет пропорционален заряду, прошедшему через этот раствор.
Формула содержит коэффициент пропорциональности k. Он является постоянным для определённого вещества. Его величина равна весу вновь образованного материала при прохождении заряда в 1 Кулон. Коэффициент носит название электрохимического эквивалента.
Уравнение представлено в двух вариантах — с учётом заряда или силы тока. В последнем случае закон Фарадея для электролиза формулируется следующим образом: количество вещества, выделенного на электродах за определённое время, пропорционально силе электротока, протекающего в жидкости.
Закономерность, которую выражает первый закон Фарадея, можно продемонстрировать с помощью опыта. Для этого нужно через раствор медного купороса пропустить электрический ток. Следует сравнить две ситуации, когда пропускается электроток различной силы. При более слабом количество меди, выделившейся на электроде, будет меньше.
Второй закон
Второй закон Фарадея тесно связан с первым. Он гласит следующее: масса, полученного при помощи электролиза вещества, пропорциональна его химическому эквиваленту.
К такому выводу Фарадей пришел, пропуская один и тот же электрический ток в жидкостях различного состава. Взвешивая каждый раз полученный металл, он увидел, что результат получается различным. Ученый понял, что результат зависит от химического состава вещества. Поэтому в законе используется понятие химического эквивалента. Он выражается отношением молярной массы вещества к валентности.
Фарадей провёл дополнительные эксперименты и выяснил, что получить один моль вещества можно, если на электролитическую реакцию затратить 96485 Кулонов. Это число называют постоянной Фарадея и обозначают буквой F.
Исходя из этого, можно записать выражение для определения электрохимического эквивалента:
Следовательно, зная химическую формулу вещества и массу, которую необходимо получить, можно вычислить, какой заряд необходимо в этом случае потратить.
Объединённый закон
Для определения количественных показателей электрохимических реакций на практике используется объединённый закон Фарадея.
Обобщенный закон можно представить в виде такой формулировки: отношение массы полученного вещества к его химическому эквиваленту равно отношению использованного заряда к тому, который надо потратить на извлечение одного моля вещества.
Практическое применение
Электролиз и поясняющие его законы Фарадея, имеют широкое практическое применение. Впервые в истории это явление использовал русский физик Якоби. Он создал оттиски фигур для оформления Исаакиевского собора в Санкт-Петербурге, применив метод, который носит название гальванопластики. Данный метод позволяет получать качественные копии металлических фигур.
Ещё одно направление использования электролиза в химии — получение металлов высокой степени чистоты. В частности, таким образом можно добывать магний, алюминий, натрий и кальций. Обычно электролизу подвергается расплав руды.
Применяя такую технологию, как гальваностегия можно покрывать металлическую деталь тонкой и равномерной оболочкой определённого вещества. Данным способом создают защитные покрытия.
С помощью электролиза можно проводить очищение металлов от примесей, повышая их степень чистоты. Также можно получать концентрированные щёлочи и кислоты.
Электролиз приносит пользу не только за счет того, что на электроде оседает вещество, но и за счет того, что на аноде выделяется газ. Такой технологический процесс позволяет получать, например, водород.
Электрохимия нашла своё применение и при очистке сточных вод. При помощи химического разложения загрязнения выводятся из жидкости, делая её пригодной для повторного использования.
Видео по теме
Связь
между количеством выделившегося при
электролизе веществ и количеством
электричества, прошедшего через
электролит, выражается двумя законами
Фарадея.
Первый
закон Фарадея.
Масса
вещества, выделившегося на электроде
при электролизе, прямо пропорциональна
количеству электричества, прошедшего
через электролит:
m
= kQ,
где
m
— масса вещества, г; k
– электрохимический эквивалент, т.е.
масса вещества, выделившаяся при
прохождении одного кулона электричества,
г/Кл; Q
– количество электричества, Кл (Q
= It,
где I —
сила тока, t
— время, с).
Второй
закон Фарадея. Одинаковое
количество электричества выделяет при
электролизе на электродах эквивалентные
массы различных веществ. Для выделения
одного моля эквивалента любого вещества
необходимо затратить одно и то же
количество электричества, а именно
96485 Кл, называемое числом Фарадея.
Тогда электрохимический
эквивалент:
,
где
Mэкв
— молярная
масса химического эквивалента
вещества (иона),
г/моль экв.
Из первого и
второго законов Фарадея вытекает
объединенное уравнение:
;
.
(4)
1.5. Примеры решения задач
Пример
1. Написать
уравнения электрохимических процессов,
происходящих на аноде (анод инертный)
и катоде при электролизе раствора
бромида меди (II).
Решение.
В водном растворе CuBr2
диссоциирует следующим образом:
CuBr2
←→
Cu2+
+ 2Br
–.
Стандартный
электродный потенциал водородного
электрода в нейтральной водной среде:
2H2O
+ 2ē
→ H2↑
+ 2OH–
(–0,41В).
Это
значительно отрицательнее потенциала
системы:
Cu2+
+ 2e
→ Cu0
(+0,34В).
Поэтому
на катоде
будет происходить электрохимическое
осаждение меди:
Cu2+
+ 2ē
→ Cu0.
На
аноде будет
происходить окисление ионов брома,
приводящее к выделению газообразного
брома:
Br
– – ē
→ Br0
;
2Br0
→ Br2↑;
поскольку
электрохимическое окисление воды:
2H2O
– 4e
→ O2↑
+ 4H+
из
нейтральных сред может протекать при
потенциалах не менее (+1,23 В), что выше
стандартного электродного потенциала,
характеризующего выделение газообразного
брома (+1,07 В).
Пример
2. Написать
уравнения электрохимических процессов,
происходящих на аноде и катоде при
электролизе раствора сульфата натрия
(анод инертный).
Решение.
В водном растворе Na2SO4
диссоциирует следующим образом:
Na2SO4
←→
2Na+
+ SO42–.
Стандартный
электродный потенциал системы:
Na+
+ ē
→ Na0
(–2,71 В)
значительно
отрицательнее потенциала водородного
электрода в нейтральной среде (–0,41
В). Поэтому на
катоде будет
происходить электрохимическое разложение
воды с выделением водорода:
2H2O
+ 2ē
→ H2↑
+ 2OH–,
а
ионы натрия, приходящие к катоду, будут
накапливаться в прилегающей к нему
части раствора (катодное пространство).
На
аноде будет
происходить электрохимическое окисление
воды, приводящее к выделению кислорода:
2H2O
– 4e
→ O2↑
+ 4H+,
поскольку
отвечающей этой системе стандартный
электродный потенциал (+1,23 В) значительно
ниже, чем стандартный электродный
потенциал (+2,01 В), характеризующий
систему:
2SO42–
– 2ē
→ S2O82–.
Сульфат-ионы,
движущиеся при электролизе к аноду,
будут накапливаться в анодном
пространстве.
Пример 3.
Написать уравнения электрохимических
процессов, происходящих на катоде и
аноде при электролизе раствора сульфата
цинка с цинковым анодом.
Решение.
В водном растворе ZnSO4
диссоциирует следующим образом:
ZnSO4
←→
Zn2+
+ SO42–.
Стандартный
электродный потенциал системы:
Zn2+
+ 2ē
→ Zn0
(–0,76 В)
близок
к потенциалу водородного электрода в
нейтральной водной среде (– 0,41 В),
поэтому на катоде будут совместно
протекать два процесса восстановления:
Zn2+
+ 2ē
→ Zn0;
2H2O
+ 2ē
→ H2↑
+ 2OH–.
На
аноде возможно протекание трех
окислительных процессов: электрохимического
окисления воды, приводящего к выделению
кислорода (+1,23 В), окисления сульфат-ионов
(+2,01 В) и окисления материала анода,
т.е. цинка (–0,76 В). Сравнение электродных
потенциалов систем позволяет сделать
вывод об окислении анода и выделении
ионов цинка в раствор:
Zn0
– 2ē
→ Zn2+.
Пример 4.
Определить массу цинка, которая выделится
на катоде при электролизе сульфата
цинка в течение одного часа при токе
26,8 А, если выход
по току
цинка равен 50 %.
Решение.
Расчет ведем согласно объединенному
уравнению из законов Фарадея (4). Масса
моля эквивалента (химический эквивалент
вещества) цинка в ZnSO4
равна (65,38 / 2) = 32,69 г/моль экв. Не забыв
выразить время в секундах, подставим
в уравнение закона Фарадея все известные
значения и определим массу цинка,
которая должна выделиться (при условии,
если весь ток будет израсходован на
выделение цинка):
m
= (32,69 ∙ 26,8 ∙ 3600) / 96485 = 32,69 г.
Так как выход по
току цинка составляет 50%, то практически
на катоде выделится цинка:
mпр
= 32,69 ∙ (50/100) = 16,345 г.
Пример 5.
Рассчитать ток при электролизе раствора
в течение 1 ч 40 мин 25 с, если на
катоде выделилось 1,4 л водорода,
измеренного при нормальных условиях.
Решение.
Из формулы (4) выразим силу тока:
.
Так
как количество водорода дано в единицах
объема, то отношение m/Э
заменяем отношением VH2/Vэкв
H2
, где VH2
— объем водорода, л; Vэкв
H2
— объем одного моля эквивалента
водорода.
Объем моля эквивалента
водорода при нормальных условиях равен
половине моля молекул водорода Vэкв
H2
= 22,4/2 = 11,2 л, так как моль любого газа в
нормальных условиях занимает объем,
равный 22,4 л, а в процессе электрохимического
восстановления водорода участвуют два
электрона. Подставив в приведенную
формулу числовые значения, получим:
=
2 А.
Закон Фарадея для электролиза

4.3
Средняя оценка: 4.3
Всего получено оценок: 269.
4.3
Средняя оценка: 4.3
Всего получено оценок: 269.
В 1836 году Майкл Фарадей опубликовал выведенные математически количественные характеристики электролиза. Обнаруженные взаимосвязи между количеством прошедшего через электролит электричества и количеством выделившегося при этом вещества впоследствии были названы законами Фарадея для электролиза.
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
m = kIt,
где:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
m = kq.
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
μeq = μ/z,
где:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
k = (1/F) μeq или k = (1/zF)μ.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Лиза Шифр
4/5
-
Евгений Пшеничный
5/5
-
Татьяна Батарон
4/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 269.
А какая ваша оценка?
1 Найти электрохимический эквивалент натрия. Молярная масса натрия μ = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея
Решение:
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I=2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка
Решение:
3 Найти постоянную Фарадея, если при прохождении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Решение:
Согласно объединенному закону Фарадея
отсюда
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит N0=NА/z атомов или молекул.
Решение:
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.
Следовательно, элементарный заряд
5 Молярная масса серебра μ1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент . Найти электрохимический эквивалент золота k2, если молярная масса золота μ2 = 0,197 кг/моль, его валентность z2 = 3.
Решение:
По второму закону Фарадея имеем
отсюда электрохимический эквивалент золота
6 Найти массы веществ, выделившихся за время τ = 10 ч на катодах трех электролитических ванн, включенных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiSО4 и AgNО3. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см2. Электрохимические эквиваленты меди, никеля и серебра
Решение:
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
7 При никелировании изделий в течение времени τ = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля , его плотность
Решение:
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток I0=1,5А. Какую поправку надо внести в показание амперметра, если за время τ = 10 мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди .
Решение:
По первому закону Фарадея m = kIτ, где I-ток в цепи; отсюда I=m/kτ=1,6 А, т.е. в показание амперметра надо внести поправку
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время τ = 5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра .
Решение:
По первому закону Фарадея m = klτ, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kτ= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
10 Для серебрения ложек через раствор соли серебра в течение времени τ = 5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра μ = 0,108 кг/моль, его валентность z = 1 и плотность .
Решение:
Толщина слоя
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда . Молярные массы железа и хлора
.
Решение:
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
во второй ванне
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
12 При электролизе раствора серной кислоты (CuSO4) расходуется мощность N=37 Вт. Найти со-противление электролита, если за время t = 50 мин выделяется масса водорода m = 0,3 г. Молярная масса водорода μ = 0,001 кг/моль, его валентность z=1.
Решение:
13 При электролитическом способе получения никеля на единицу массы расходуется Wm= 10 кВт·ч/кг электроэнергии. Электрохимический эквивалент никеля . При каком напряжении производится электролиз?
Решение:
14 Найти массу выделившейся меди, если для ее получения электролитическим способом затрачено W= 5 кВт·ч электроэнергии. Электролиз проводится при напряжении V=10 В, к.п.д. установки η = 75%. Электрохимический эквивалент меди .
Решение:
К.п.д. установки
где q-заряд, прошедший через ванну. Масса выделившейся меди m=kq; отсюда
15 Какой заряд проходит через раствор серной кислоты (CuSO4) за время τ = 10 с, если ток за это время равномерно возрастает от I1=0 до I2 = 4А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди .
Решение: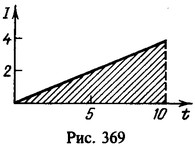
Заряд, протекший через раствор,
Нахождение заряда графическим путем показано на рис. 369. На графике зависимости тока от времени заштрихованная площадь численно равна заряду. Масса меди, выделившейся на катоде,
16 При рафинировании меди с помощью электролиза к последовательно включенным электролитическим ваннам, имеющим общее сопротивление R = 0,5 Ом, подведено напряжение V=10 В. Найти массу чистой меди, выделившейся на катодах ванны за время τ = 10 ч. Э.д.с. поляризации ε = 6 В. Электрохимический эквивалент меди .
Решение:
17 При электролизе воды через электролитическую ванну в течение времени τ = 25 мин шел ток I=20 А. Какова температура t выделившегося кислорода, если он находится в объеме V= 1 л под давлением р = 0,2 МПа? Молярная масса воды μ = 0,018 кг/моль. Электрохимический эквивалент кислорода .
Решение:
где R= 8,31 Дж/(молъ К)-газовая постоянная.
18 При электролитическом способе получения алюминия на единицу массы расходуется W1m = 50 кВт·ч/кг электроэнергии. Электролиз проводится при напряжении V1 = 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении V2 = 8,1 В?
Решение:














