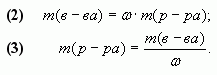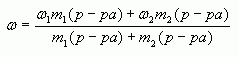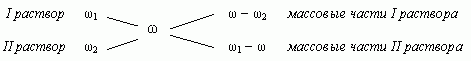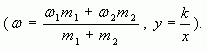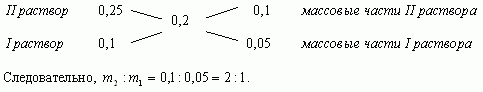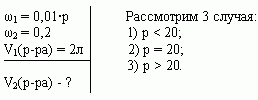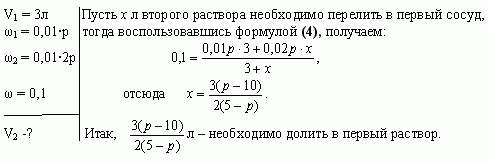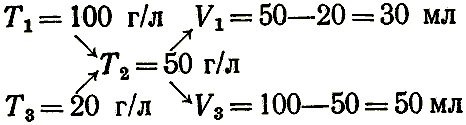“Только из союза двоих, работающих
вместе и при помощи друг друга, рождаются великие
вещи.”
Антуан Де Сент-Экзюпери
Математика многообразна и многогранна.
Существует ряд ситуаций в образовательном
процессе, когда при изучении какой-либо темы по
физике, химии, биологии и т.д. затрагиваются
понятия математики, например, существуют задачи,
которые решают как на уроках математики, так и на
уроках химии. Способы решения задач представляют
и учителя химии, и математики, но есть проблема:
математики знают математику, а химики — химию. И
не всегда способы совпадают.
В данной статье приводятся рекомендации по
решению химических задач на смешение растворов
разными способами: с помощью расчетной формулы,
“Правила смешения”, “Правила креста”,
графического метода, алгебраического метода.
Приведены примеры решения задач.
1. Основные химические понятия
Приведем некоторые указания к решению задач на
растворы.
Основными компонентами этого типа задач
являются:
а) массовая доля растворенного вещества в
растворе;
б) масса растворенного вещества в растворе;
в) масса раствора.
Предполагают, что:
а) все получившиеся смеси и сплавы являются
однородными;
б) смешивание различных растворов происходит
мгновенно;
в) объем смеси равен сумме объемов смешиваемых
растворов;
г) объемы растворов и массы сплавов не могут
быть отрицательными.
Определения и обозначения.
Массовая доля растворенного вещества в
растворе — это отношение массы этого вещества к
массе раствора.
где — массовая
доля растворенного вещества в растворе;
— масса
растворенного вещества в растворе;
— масса
раствора.
Следствия формулы (1):
Введем обозначения:
— массовая доля
растворенного вещества в первом растворе;
—
массовая доля растворенного вещества во втором
растворе;
—
массовая доля растворенного вещества в новом
растворе, полученном при смешивании первого и
второго растворов;
m1(в-ва), m2(в-ва), m(в-ва) — массы
растворенных веществ в соответствующих
растворах;
m1(р-ра), m2(р-ра), m(р-ра) — массы
соответствующих растворов.
Основными методами решения задач на смешивание
растворов являются: с помощью расчетной формулы,
“Правило смешения”, “Правило креста”,
графический метод, алгебраический метод.
Приведем описание указанных методов.
1.1. С помощью расчетной формулы
В наших обозначениях, получим формулу для
вычисления массовой доли вещества (?) в смеси.
1. Масса полученного при смешивании раствора
равна:
m(р-ра) = m1(р-ра) + m2(р-ра).
2. Определим массы растворенных веществ в
первом и втором растворах:
m1(в-ва)= •m1(р-ра), m2(в-ва)=
•m2(р-ра).
3. Следовательно, масса растворенного вещества
в полученном растворе вычисляется как сумма масс
веществ в исходных растворах:
m(в-ва) = m1(в-ва) + m2(в-ва) = •m1(р-ра) +
•m2(р-ра).
4. Таким образом, массовая доля растворенного
вещества в полученном растворе равна:
или
или
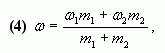
где — массы
соответствующих растворов.
Замечание: При решении задач удобно
составлять следующую таблицу.
|
1-й раствор |
2-й раствор |
Смесь двух растворов |
|
|
Масса растворов |
m1 |
m2 |
m1 + m2 |
|
Массовая доля |
|
|
|
|
Масса вещества в |
|
|
|
1.2. “Правило смешения”
Воспользуемся формулой (4):
тогда 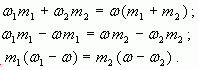
Отсюда
Таким образом, отношение массы первого
раствора к массе второго равно отношению
разности массовых долей смеси и второго раствора
к разности массовых долей первого раствора и
смеси.
Аналогично получаем, что при
Замечание: Формула (5) удобна тем, что на
практике, как правило, массы веществ не
отвешиваются, а берутся в определенном
отношении.
1.3. “Правило креста”
“Правилом креста” называют диагональную
схему правила смешения для случаев с двумя
растворами.
Слева на концах отрезков записывают исходные
массовые доли растворов (обычно слева
вверху-большая), на пересечении отрезков —
заданная, а справа на их концах записываются
разности между исходными и заданной массовыми
долями. Получаемые массовые части показывают в
каком отношении надо слить исходные растворы.
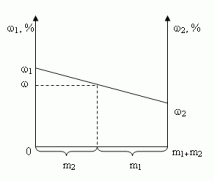
1.4. Графический метод
Отрезок прямой (основание графика)
представляет собой массу смеси, а на осях ординат
откладывают точки, соответствующие массовым
долям растворенного вещества в исходных
растворах. Соединив прямой точки на осях ординат,
получают прямую, которая отображает
функциональную зависимость массовой доли
растворенного вещества в смеси от массы
смешанных растворов в обратной пропорциональной
зависимости
Полученная функциональная прямая позволяет
решать задачи по определению массы смешанных
растворов и обратные, по массе смешанных
растворов находить массовую долю полученной
смеси.
Построим график зависимости массовой доли
растворенного вещества от массы смешанных
растворов. На одной из осей ординат откладывают
точку, соответствующую массовой доли , а на другой —
. Обозначим на оси абсцисс
точки А и В с координатами (0,0) и (m1 + m2,0),
соответственно. На графике точка А(0,0)
показывает, что массовая доля всего раствора
равна , а точка В(m1
+ m2,0) — массовая доля всего раствора равна . В направлении от
точки А к точке В возрастает содержание в
смеси 2-го раствора от 0 до m1+ m2 и
убывает содержание 1-го раствора от m1+ m2
до 0. Таким образом, любая точка на отрезке АВ будет
представлять собой смесь, имеющую одну и ту же
массу с определенным содержанием каждого
раствора, которое влияет на массовую долю
растворенного вещества в смеси.
Замечание: Данный способ является наглядным
и дает приближенное решение. При использовании
миллиметровой бумаги можно получить достаточно
точный ответ.
1.5. Алгебраический метод
Задачи на смешивание растворов решают с
помощью составления уравнения или системы
уравнений.
2. Примеры решения задач
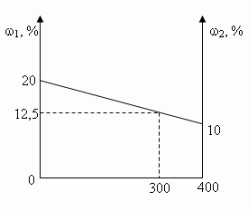
Задача 1. (№1.43, [1])
В 100 г 20%-ного раствора соли добавили 300 г её
10%-ного раствора. Определите процентную
концентрацию раствора.
Решение:
- C помощью расчетной формулы
- Графический
- Путем последовательных вычислений
- Сколько растворенного вещества содержится:
- Сколько вещества содержится в образовавшемся
растворе? - Чему равна масса образовавшегося раствора?
- Какова процентная концентрация полученного
раствора? - Алгебраический
Ответ: 12,5%
а) в 100 г 20%-ного раствора; [100•0,2 = 20(г)]
б) в 300 г 10%-ного раствора? [300•0,1 = 30(г)]
20 г + 30 г = 50 г
100 г + 300 г = 400 г
(50/400)100 = 12,5(%)
Ответ: 12,5%
Пусть х — процентная концентрация
полученного раствора. В первом растворе
содержится 0,2•100(г) соли, а во втором 0,1•300(г), а в
полученном растворе х•(100 + 300)(г) соли.
Составим уравнение:
0,2•100 + 0,1•300 = х•(100 + 300);
х = 0,125 (12,5%)
Ответ: 12,5%
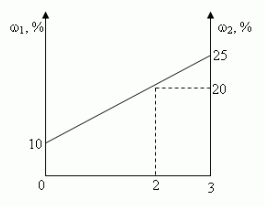
Задача 2. u(№10.26, [1])
Смешали 10%-ный и 25%-ный растворы соли и получили 3
кг 20%-ного раствора. Какое количество каждого
раствора в килограммах было использовано?
Решение:
- Алгебраический
- Графический.
- “Правило смешения”
- “Правило креста”
а) C помощью уравнения:
Пусть х (кг) — масса 1-го раствора, тогда 3-х (кг)
-масса 2-го раствора.
0,1•х (кг) содержится соли в 1-ом растворе,
0,25•(3-х) (кг) содержится соли в 2-ом растворе,
0,2•3 (кг) содержится соли в смеси.
Учитывая, что масса соли в 1-ом и 2-ом растворах
равна массе соли в смеси, составим и решим
уравнение:
0,1•х + 0,25•(3-х) = 0,2•3;
0,15х = 0,15;
х = 1, 1кг-масса 1-го раствора
3 — х = 3 — 1 =2 (кг) — масса 2-го раствора.
Ответ: 1 кг, 2 кг.
б) С помощью системы уравнений
Пусть х (кг) — количество первого раствора, у (кг)
— количество второго раствора. Система уравнений
имеет вид:
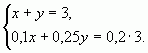
Ответ: 1 кг, 2 кг.
Ответ: 1кг, 2кг.

Составим диагональную схему
Ответ: 1кг, 2кг.
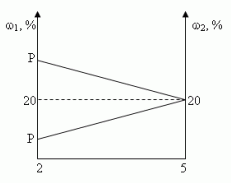
Задача 3 ([2])
Сосуд емкостью 5 л содержит 2 л р%-ного (по объёму)
раствора соли. Сколько литров 20%-ного раствора
такой же соли надо налить в сосуд, чтобы
процентное содержание соли в сосуде стало
наибольшим?
Решение (графический способ)
Заметим, что по условию, объём второго раствора
не превышает трёх литров.
- Ели р < 20, то для того, чтобы получить
максимальную массовую долю вещества в растворе,
необходимо добавить 3 л 20% — ного раствора соли; - Если р = 20, то при добавлении 2-го раствора,
процентное содержание соли в растворе не
изменится, следовательно, можно прилить от 0 л до 3
л 20% — ного раствора соли; - Если р > 20, то при добавлении 2-го раствора,
процентное содержание соли будет уменьшаться,
т.е. прилить нужно 0 л.
Ответ: 3 л, если 0 < р < 20, [0,3], если р = 20, 0л, если 20
< р 100.
Задача 4 (работа 5, №2, [1])
В двух сосудах по 5л каждый содержится раствор
соли. Первый сосуд содержит 3л р% — ного раствора, а
второй — 4л 2р% — ного раствора одной и той же соли.
Сколько литров надо перелить из второго сосуда в
первый, чтобы получить в нем 10% — ный раствор соли?
При каких значениях р задача имеет решение?
Решение
Найдем, при каких значениях р задача имеет
решение. По условию задачи 5-ти литровый сосуд
содержит 3л первого раствора, следовательно, к
нему можно прилить от 0 до 2л второго раствора.
Имеем, Решая
неравенство, получаем
Ответ:
3. Заключение
Данные рекомендации предназначены учителям
математики, желающим организовать элективные
курсы, как в девятых, так и в десятых и
одиннадцатых классах. Цель создаваемых курсов:
научить учащихся пользоваться математическим
аппаратом при решении химических задач.
Список литературы
- Галицкий и др. Сборник задач по алгебре для 8-9
классов: Учебное пособие для учащихся шк. и
классов с углубл. изуч. математики / М.Л. Галицкий,
А.М. Гольдман, Л.И. Звавич.-2-е изд. — М.:
Просвещение,1994. — 271с. - Сборник задач по математике для поступающих в
вузы: Учебное пособие/ П.Т.Дыбов, А.И.Забоев, А.С.
Иванов и др.; Под ред. А.И. Прилепко. — М.:Высш. школа,
1983. — 239 с. - Ерыгин Д.П., Шишкин Е.А. Методика решения задач по
химии: Учебное пособие для студентов пед. ин-тов
по биол. и хим. спец. — М.: Просвещение,1989. — 176с. - Хомченко Г.П., Хомченко И.Г. Задачи по химии для
поступающих в вузы: Учебное пособие. — 2-е изд..
исправ. и доп. — М.: Высш. школа, 1993. — 302 с.
При смешивании масса полученного
раствора (m) равняется сумме масс
смешиваемых растворов (m1, m2,
m3 … mn):
m = m1 + m2 + m3 +…+ mn,
г
Аналогично, масса растворенного вещества
будет равна сумме масс веществ в
смешиваемых растворах:
m(X) = m1(X) + m2(X) + m3(X) +…+
mn(X), г
Пример 12. Определить массовую долю
HNO3 в растворе, полученном при
смешивании 100 мл раствора с ω1(HNO3)
= 10% (ρ1 = 1,05 г/мл) и 150 мл раствора с
ω2(HNO3) = 20% (ρ2 = 1,12
г/мл).
Решение:
ω(HNO3) =
=
Находим
m1(р-ра) = V1(р-ра)·ρ1(р-ра)
= 100·1,05 = 105 г
m2(р-ра) = V2(р-ра)·ρ2(р-ра)
= 150·1,12 = 168 г
m1(HNO3) = m1(р-ра)·ω1(р-ра)
= 105·0,1 = 10,5 г
m2(HNO3) = m2(р-ра)·ω2(р-ра)
= 168·0,2 = 33,6 г
Рассчитываем
ω(HNO3) =
= 0,162 или 16,2%
Ответ: массовая доля HNO3 в
растворе после смешения равна 0,162 или
16,2%.
Пример 13. Какие объемы растворов
гидроксида калия с ω1(KOH) = 50%
(ρ1 = 1,51 г/мл) и с
ω2(KOH) = 10% (ρ2 = 1,1 г/мл)
необходимо использовать для приготовления
одного литра раствора гидроксида калия
с ω(KOH) = 20% (ρ = 1,19 г/мл)?
Решение:
Масса полученного раствора равна
m(р-ра) = m1(р-ра) + m2(р-ра)
m(р-ра) = V(р-ра)·ρ(р-ра) = 1000·1,19 = 1190 г
Отсюда m1(р-ра) = 1190 – m2(р-ра)
Масса KOH в полученном растворе равна
m(KOH) = m(р-ра)·ω(KOH) = 1190·0,2 = 238 г
В то же время масса КОН в полученном
раствора равна:
m(KOH) = m1(KOH) + m2(KOH)
m1(KOH) = m1(р-ра)·ω1(KOH) =
m1(р-ра)·0,5
m2(KOH) = m2(р-ра)·ω2(KOH) =
m2(р-ра)·0,1
Получаем 238 = m1(р-ра)·0,5 + m2(р-ра)·0,1
Подставим в это уравнение выражение
для m1(р-ра):
238 = [1190 – m2(р-ра)]·0,5 + m2(р-ра)·0,1
Решим уравнение относительно m2(р-ра):
0,4m2(р-ра) = 357 m2(р-ра) = 892,5 г
Тогда m1(р-ра) = 1190 – 892,5 = 297,5 г
Находим объемы растворов:
V1(р-ра) =
=
=
197 мл
V2(р-ра) =
=
=
811,4 мл
Ответ: V1 = 197 мл, V2 = 811,4
мл.
1. 5. Задания для самостоятельной работы
1. Определите массовую долю
растворенного вещества (Х)% в следующих
растворах:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
m(X), г |
5 |
28 |
46,7 |
53,1 |
62,2 |
|
m(H2O), г |
300 |
450 |
528 |
630 |
720 |
2. Рассчитать массу вещества (г),
необходимую для приготовления следующих
растворов:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
ω(Х),% |
2 |
1 |
5 |
10 |
8 |
|
Объем р-ра, л |
0,25 |
0,8 |
0,5 |
0,3 |
0,45 |
|
ρ, г/мл |
1,015 |
1,007 |
1,046 |
1,090 |
1,067 |
3. Рассчитайте массу кристаллогидрата
Х·nH2O (г) и объем воды (мл), необходимые
для приготовления 500 мл следующих
растворов:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
Вещество (Х·nH2O) |
CuSO4·5H2O |
FeSO4·7H2O |
Na2SO4·10H2O |
MgSO4·7H2O |
AlCl3·6H2O |
|
ω(соли),% |
0,25 |
6 |
15 |
0,085 |
10 |
|
ρ, г/мл |
1,06 |
1,11 |
1,13 |
1,04 |
1,02 |
4. Рассчитать массу кристаллогидрата
Х·nH2O (г), которую надо растворить
в воде для получения раствора, содержащего
Х% безводной соли:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
Вещество (Х·nH2O) |
CuSO4·5H2O |
FeSO4·7H2O |
Na2SO4·10H2O |
MgSO4·7H2O |
AlCl3·6H2O |
|
ω(Х),% |
8 |
15 |
18 |
6 |
20 |
|
Объем воды |
0,66 л |
400 мл |
0,75 л |
350 мл |
900 мл |
5. Сколько литров газа (н.у.)
необходимо растворить в V мл воды для
получения раствора с массовой долей,
указанной в таблице:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
ω(Х),% |
17 |
30 |
2 |
1,5 |
3 |
|
Вещество |
NH3 |
HCl |
CO2 |
SO2 |
H2S |
|
V воды, мл |
200 |
1500 |
900 |
600 |
1000 |
6. Определить объем воды, в котором
надо растворить V л газа (н.у.), для
получения раствора с указанной массовой
долей:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
ω(Х),% |
20 |
25 |
3 |
2 |
15 |
|
Вещество |
NH3 |
HCl |
CO2 |
SO2 |
H2S |
|
V, л |
40 |
56,5 |
3,2 |
12,5 |
1,5 |
7. Определите массу раствора (г),
который можно приготовить из воды и
щелочи KOH, если:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
m(H2O), г |
100 |
150 |
175 |
225 |
250 |
|
ω(KOH),% |
15 |
20 |
25 |
30 |
35 |
8. Рассчитать массовую долю (%)
растворенных веществ, содержащихся в
V л воды:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
Вещество (Х) |
HCl |
H2S |
CO2 |
NH3 |
SO2 |
|
V(X), л |
10 |
2 |
1 |
20 |
0,5 |
|
V воды, л |
1,5 |
4,5 |
6,5 |
0,4 |
0,65 |
9. Определить массу воды (г), которую
надо добавить к указанной массе раствора
m1 с массовой долей вещества ω1(Х),
для получения раствора с массовой долей
ω2(Х):
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
m1, г |
500 |
700 |
900 |
980 |
993 |
|
ω1(Х),% |
40 |
50 |
58 |
60 |
72 |
|
ω2(Х),% |
20 |
32 |
36 |
40 |
53 |
10. Определить объем воды, который
следует выпарить из исходного раствора
массой m1 с
массовой долей вещества ω1(Х),
чтобы получить раствор, в котором
массовая доля соли равна ω2(Х):
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
m1, г |
200 |
250 |
300 |
350 |
400 |
|
ω1(Х),% |
10 |
20 |
30 |
40 |
50 |
|
ω2(Х),% |
25 |
42 |
50 |
60 |
80 |
11. Определить объем раствора HNO3
с указанными массовой долей ω1(HNO3)
и плотностью, который необходимо добавить
к 1,2 л воды для получения раствора с
массовой долей ω2(HNO3) = 10%:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
ω1(Х),% |
52 |
60 |
63 |
70 |
75 |
|
ρ1, г/мл |
1,3 |
1,35 |
1,36 |
1,40 |
1,43 |
12. Какой объем раствора CuSO4
с указанными в таблице массовой долей
ω2(CuSO4) и плотностью ρ2
можно приготовить из 120 мл раствора с
массовой долей ω1(CuSO4) = 42%
(ρ1
= 1,36 г/мл)?
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
ω2(CuSO4),% |
52 |
60 |
63 |
70 |
75 |
|
ρ2, г/мл |
1,3 |
1,35 |
1,36 |
1,40 |
1,43 |
13. Какие объемы растворов серной
кислоты с массовой долей ω1(H2SO4)
и плотностью ρ1 и массовой долей
ω2(H2SO4) и плотностью
ρ2 необходимо взять для приготовления
2 литров раствора H2SO4 с
массовой долей ω(H2SO4) = 14% (ρ
= 1,095 г/мл)?
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
ω1(H2SO4),% |
30 |
35 |
38 |
40 |
50 |
|
ρ1, г/мл |
1,219 |
1,32 |
1,35 |
1,38 |
1,4 |
|
ω2(H2SO4),% |
6 |
5 |
4,8 |
4 |
2 |
|
ρ2, г/мл |
1,038 |
1,030 |
1,028 |
1,022 |
1,018 |
14. Определить массовую долю Na2CO3
в растворе, полученном при растворении
указанной массы кристаллогидрата
Na2CO3·10Н2О в растворе
Na2CO3 массой m с массовой долей
ω1(Na2CO3) = 13%:
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
m(Na2CO3·10Н2О), г |
40 |
46 |
48 |
52 |
56 |
|
m, г |
300 |
420 |
450 |
500 |
530 |
15. Какую массу раствора гидроксида
калия с массовой долей ω1(KOH) надо
добавить к раствору KOH массой m2 и
массовой долей ω2(KOH), чтобы получить
раствор KOH с массовой долей ω3(KOH)?
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
ω1(KOH),% |
20 |
30 |
40 |
50 |
60 |
|
m2, г |
1000 |
500 |
480 |
35 |
25 |
|
ω2(KOH),% |
50 |
10 |
90 |
5 |
2 |
|
ω3(KOH),% |
25 |
20 |
15 |
10 |
5 |
16. Сколько литров NH3 (н.у.)
необходимо растворить в растворе NH3·Н2О
массой m1 с массовой долей ω1(NH3)
для получения раствора NH3·Н2О
с массовой долей ω(NH3)?
|
Вариант |
|||||
|
а |
б |
в |
г |
д |
|
|
m1, г |
200 |
300 |
400 |
500 |
600 |
|
ω1(NH3),% |
10 |
12 |
15 |
18 |
20 |
|
ω(NH3),% |
15 |
18 |
20 |
25 |
33,5 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Задачи на смеси и сплавы — подробнее
Концентрация какого-то вещества в растворе – это отношение массы или объема этого вещества к массе или объему всего раствора.
То же самое относится и к сплавам: содержание одного из металлов в сплаве – это отношение массы этого металла к массе всего сплава.
Обычно концентрация измеряется в процентах.
Что такое процент?
Напомню, что это сотая доля числа. То есть, если массу или объем разделить на ( displaystyle 100), получим ( displaystyle 1%) этой массы или объема.
Чтобы вычислить концентрацию в процентах, достаточно полученное число умножить на ( displaystyle 100%).
Почему?
Сейчас покажу: пусть масса всего раствора равна ( displaystyle M), а масса растворенного вещества (например, соли или кислоты) – ( displaystyle m). Тогда один процент от массы раствора равен ( displaystyle frac{M}{100}).
Как узнать, сколько таких процентов содержится в числе ( displaystyle m)?
Просто: поделить число ( displaystyle m) на этот один процент: ( displaystyle frac{m}{frac{M}{100}}=frac{m}{M}cdot 100), но ведь ( displaystyle frac{m}{M}) – это концентрация.
Вот и получается, что ее надо умножить на ( displaystyle 100), чтобы узнать, сколько процентов вещества содержится в растворе.
Более подробно о процентах – в темах «Дроби, и действия с дробями»и «Проценты».
Поехали дальше.
Масса раствора, смеси или сплава равна сумма масс всех составляющих.
Логично, правда?
Например, если в растворе массой ( displaystyle 10) кг содержится ( displaystyle 3) кг соли, то сколько в нем воды? Правильно, ( displaystyle 7)кг.
И еще одна очевидность:
При смешивании нескольких растворов (или смесей, или сплавов), масса нового раствора становится равной сумме масс всех смешанных растворов.
А масса растворенного вещества в итоге равна сумме масс этого же вещества в каждом растворе отдельно.
Например: в первом растворе массой ( displaystyle 10) кг содержится ( displaystyle 3) кг кислоты, а во втором растворе массой ( displaystyle 14) кг – ( displaystyle 5) кг кислоты.
Когда мы их смешаем, чему будет равна масса нового раствора?
( displaystyle 10+14=24) кг.
А сколько в новом растворе будет кислоты? ( displaystyle 3+5=8) кг.
Перейдем к задачам.
Бонус: Вебинары из нашего курса подготовки к ЕГЭ по математике
ЕГЭ №11. Задачи на растворы, смеси и сплавы (и на проценты)
В этом видео мы научимся решать текстовые задачи на проценты, а так же на растворы, смеси и сплавы — на все, что содержит разные вещества в каком-то соотношении.
Задачи на смеси и сплавы очень часто попадаются на ОГЭ (№23) и профильном ЕГЭ (под номером 12).
Мы научимся очень простому способу сводить эти задачи к обычному линейному уравнению или к системе из двух таких уравнений.
Также мы научимся решать сложные задачи на проценты — в основном они на банковские вклады и кредиты и прочие финансовые штуки.
Это, в том числе, даст нам очень большой задел для “ экономической» задачи №17 (которая стоит аж 3 первичных балла).
ЕГЭ №17 Экономическая задача. Вклады
Экономические задачи в основном довольно простые, но дают аж 3 первичных балла!
Но это не совсем 3 балла нахаляву. Эти задачи требуют очень подробного и чёткого описания решения.
По сути, мы составляем математическую модель какой-то жизненной ситуации (например, связанной с банковскими вкладами или кредитами), и важно научиться ничего не пропускать при описании этой модели: описывать словами все введённые обозначения, обосновывать уравнения, которые мы записываем, и всё в таком духе.
Если не написать эти объяснения, вы гарантированно получите 0 баллов даже за правильно найденный ответ!
На этом уроке мы узнаем, как работают вклады, научимся решать и, главное, правильно оформлять решение таких задач.
Задачи на смешивание
(смеси, растворы, сплавы) очень часто встречаются на практике, и, как показывает
опыт, вызывают некоторые трудности при решении. Условно разделяют два вида
задач на смешивание:
– задачи на смешивание первого рода;
– задачи на смешивание второго рода.
К задачам первого
роду относятся задачи, в которых дано количество смешиваемых растворов (сплавов)
и их процентные концентрации (пробы), а необходимо найти процентную концентрацию
(пробу) полученной смеси (сплава).
Задачи на смешивание
первого роду ещё иначе называются
задачами на нахождение среднего арифметического, или задачами на среднее взвешенное.
Распространёнными задачами на смешивание первого рода это задачи на нахождение
средней цены, средней температуры, средней скорости, среднего часа и другие. В этих
задачах необходимо определить “цену” смеси по данным “ценам” и количеством отдельных
сортов (слово “цена” тут употребляется в широком смысле). Поэтому, речь идёт
про нахождение среднего арифметического некоторой суммы слагаемых, взятых группами
(говорят также “среднее взвешенное”). Искомым может быть не только среднее
арифметическое, а и цена одного из сортов. Известные задачи на нахождение среднего
арифметического нескольких чисел есть отдельные случаи названных выше задач.
В условиях задач на
растворы фигурирует термин концентрация. Необходимо пояснить значение этого
понятия.
Концентрацией раствора называется количество (масса или объём) растворённого
вещества, которое содержится в некотором количестве (массы или объёму) раствора.
Процентной концентрацией раствора называется выражение в процентном
отношении массы растворённого вещества n к массе
всего раствору m:
Концентрацию раствора
можно выразить не только в процентах, а и в частях. Говорят, например, что
концентрация соли в морской воде равна 1/20 (по массе).
Промилле – это одна тысячная часть числа, или десятая часть процента.
Обозначается так: ‰
‰ = 0,001;
‰ =
0,1%
Сплав можно рассматривать
как раствор, в котором один из компонентов (любой) будет растворителем, а второй
растворённым веществом. Среди задач на сплавы отдельное место занимают задачи
на “пробы”.
Проба – это количество граммов
чистого золота (серебра, латуни и т. д.) в одном килограмме сплава. Так,
золото 875 пробы – это сплав, 1000 г в котором содержится 875 г чистого
золота.
Следует обратить внимание на основную зависимость между количеством
веществ, взятых до смешивания и полученных после смешивания, которую часто применяют,
решая задачи на смешивание. Эту зависимость часто формулируют так:
Количество веществ, взятых до смешивания,
равно количеству этих веществ, полученных после смешивания.
ПРИМЕР:
Если к раствору, в котором находится
m граммов
соли, долить воды, то и в полученном растворе будет m граммов этой соли.
Если смешать два раствора,
в одном из которых будет m, а во втором n граммов соли, то в полученном растворе будет m + n граммов этой соли.
Общая масса смеси всегда
равна сумме масс их составных частей.
В задачах на смешивание (сплавы) обычно речь идёт про массы m1, m2,…, их процентную
концентрацию (пробу) p1, p2,…, а также про массу m и концентрацию (пробу) полученной смеси
(сплава) p. В этом случае всегда правильным считается соотношение:
m1p1 + m2p2
= (m1 + m2)p.
Если в задаче известны
значения m1, m2,
p1, p2 и необходимо определить p, то это задача на смешивание первого рода. Её
можно решить за формуле:
При решении задач
не обязательно пользоваться готовой формулой. Можно постепенно делать расчёты, связанные
с определением массы растворённого вещества,
пользуясь понятием концентрации. Решая задачи на концентрацию кислот и сплавов,
необходимо помнить, что крепость кислоты или спирта обычно выражается в сотых
долях, или процентах, которые в этом случае называются градусами.
Решение задач путём
последовательных вычислений.
ЗАДАЧА:
Сплавили 180
г золота
920-й пробы со 100
г 752-й пробы. Какой пробы получился сплав ?
РЕШЕНИЕ:
В первом слитке чистого золота было 0,92 от 180
г, т. е.
180 × 0,92 = 165,6 (г).
Во втором слитке чистого золота было 0,752 от 100
г, т. е.
100 × 0,752 = 75,2 (г).
Следовательно, в полученном сплаве чистого золота
содержится:
164,6 + 75,2 =
240,8 (г).
Общий вес сплава равен
180 + 100 = 280 (г).
Его проба равна
ОТВЕТ:
Получен сплав 860 пробы.
ЗАДАЧА:
К 2
кг воды прибавили 8
кг 70-процентного
раствора серной кислоты. Определить процентную концентрацию полученного
раствора.
РЕШЕНИЕ:
Сначала определим, сколько в растворе чистой (безводной) кислоты
8 кг × 0,7 = 5,6 кг.
Найдём вес раствора
2 кг + 8 кг = 10 кг.
Теперь найдём процентную концентрацию раствора
5,6 кг : 10 кг = 0,56 =
56%.
ОТВЕТ:
Концентрация получившегося раствора 56%.
Если количество
кислоты выражено не в килограммах, а в литрах, то подобные задачи можно решать
только с помощью таблиц удельных весов растворов серной кислоты.
ЗАДАЧА:
К 2
л воды прибавили 8
л 70-процентного
раствора серной кислоты. Определить процентную концентрацию полученного
раствора.
РЕШЕНИЕ:
В таблице находим удельный вес 70-процентного
раствора серной кислоты. Он равен 1,6.
Следовательно, 8 л этого раствора
весят
1,6 × 8 = 12,8 (кг).
Безводной кислоты в нм содержится
12,8 × 0,7 = 8,96 (кг).
Концентрация раствора равна
8,96 : 14,8 ≈ 0,6 = 60%.
ОТВЕТ: 60%
Задания к уроку 38
Расчеты при приготовлении растворов и особенности приготовления растворов разных концентраций
Точность расчетов при приготовлении растворов зависит оттого, какой готовят раствор: приблизительный или точный. При расчетах приблизительных растворов атомные и молекулярные массы округляют до трех значащих цифр. Так, например, атомную массу хлора принимают равной 35,5 вместо 35,453, атомную массу водорода — 1,0 вместо 1,00797 и т. п. Округление ведут обычно в большую сторону.
При приготовлении стандартных растворов вычисления проводят с точностью до пяти значащих цифр. Атомные массы элементов берут с такой же точностью. При расчетах пользуются пятизначными или четырехзначными логарифмами. Растворы, концентрацию которых будем затем устанавливать титрованием, готовят, как и приблизительные.
Растворы могут быть приготовлены растворением твердых веществ, жидкостей или разбавлением более концентрированных растворов.
Расчеты при приготовлении растворов нормальной концентрации
Навеску вещества (г) для приготовления раствора определенной нормальности рассчитывают по формуле:
mн=ЭNV/1000,
где Э — химический эквивалент растворяемого вещества;
N — требуемая нормальность раствора, г-экв/л;
V — объем раствора, мл.
Навеску вещества обычно растворяют в мерной колбе. Разбавленные приблизительные растворы можно готовить, растворяя навеску вещества в объеме растворителя, равном объему раствора. Этот объем может быть отмерен мерным цилиндром или мензуркой.
Если раствор готовят из навески кристаллогидрата вещества, то в расчетное уравнение для определения навески подставляют величину химического эквивалента кристаллогидрата.
При приготовлении раствора с определенной нормальной концентрацией путем разбавления более концентрированного раствора объем концентрированного раствора (мл) рассчитывают по формуле:
Vк=ЭNV/Тк,
где Тк — концентрация концентрированного раствора, г/л, или:
Vк=NV/Nк,
где Nк — нормальность концентрированного раствора, или:
Vк=ЭNV/10 pкdк,
где pк — процентная концентрация концентрированного раствора;
dк — плотность концентрированного раствора, г/см3.
Концентрированные растворы разбавляют в мерных колбах. При приготовлении точных растворов (например, эталонных растворов из более концентрированного стандартного раствора) концентрированные растворы отмеривают пипетками или приливают их из бюреток. При приготовлении приблизительных растворов разбавление можно делать путем смешивания концентрированного раствора с объемом воды, равным разности между объемами разбавленного и концентрированного растворов:
VH2O=V-Vk
Расчеты при приготовлении растворов, концентрация которых выражена в граммах на 1 л
Величину навески вещества (г) для таких растворов рассчитывают по формуле:
mн=TV/1000,
где Т — концентрация раствора, г/л;
V — объем раствора, мл.
Растворение вещества обычно ведут в мерной колбе с доведением объема раствора после растворения до метки. Приблизительные растворы можно готовить путем растворения навески в объеме воды, равном объему раствора.
Если раствор готовят из навески кристаллогидрата, а концентрация раствора выражена из расчета на безводное вещество, навеску кристаллогидрата вычисляют по формуле:
mн=TVMk/1000M,
где Mk — молекулярная масса кристаллогидрата;
М —молекулярная масса безводного вещества.
При приготовлении растворов путем разбавления более концентрированных объем концентрированного раствора определяют по формуле:
Vк=VT/Tk,
где Tk — концентрация концентрированного раствора, г/л, или:
Vк=100VT/1000pkdk,
где pk — процентная концентрация концентрированного раствора;
dk — плотность концентрированного раствора, г/см3;
или:
Vк=VT/ЭNk,
где Nk — нормальная концентрация концентрированного раствора; Э — химический эквивалент вещества.
Растворы готовят так же, как и при приготовлении растворов определенной нормальной концентрации путем разбавления более концентрированных растворов.
Для приближенных расчетов, связанных с приготовлением растворов путем разбавления более концентрированных, можно пользоваться правилом разбавления («правилом креста»), которое гласит, что объемы смешиваемых растворов обратно пропорциональны разностям концентраций смешиваемых и полученного при смешивании растворов. Это выражают схемами:
или:
где N1, Т1, N3, T3 — концентрации смешиваемых растворов;
N2, Т2 — концентрации раствора, полученного при смешивании;
V1, V3 — объемы смешиваемых растворов.
Если раствор готовят разбавлением концентрированного раствора водой, то N3 = 0 или Т3 = 0.
Например, для приготовления раствора концентрации Т2 = 50 г/л из растворов концентрации T1 = 100 г/л и T3 = 20 г/л необходимо смешать объем V1 = 50 – 20 = 30 мл раствора концентрации 100 г/л и V3 = 100 – 50 = 50 мл раствора концентрации 20 г/л:
Расчеты при приготовлении растворов определенной процентной концентрации
Массу навески (г) рассчитывают по формуле:
mн=pQ/100,
где p — процентная концентрация раствора;
Q — масса раствора, г.
Если задан объем раствора V, массу раствора определяют:
Q=dV,
где d — плотность раствора, г/см3 (может быть найдена в справочных таблицах).
Массу навески при заданном объеме раствора рассчитывают:
mн=pdV/100.
Массу воды для растворения навески определяют:
mH2O=Q-m,
Так как масса воды численно приблизительно равна ее объему, то воду обычно отмеривают мерным цилиндром.
Если раствор готовят растворением кристаллогидрата вещества, а концентрация раствора выражена в процентах безводного вещества, то массу кристаллогидрата рассчитывают по формуле:
mн=pQMk/100M,
где Мk — молекулярная масса кристаллогидрата;
М — молекулярная масса безводного вещества.
Приготовление растворов разбавлением более концентрированных удобно производить путем отмеривания определенных объемов растворов и воды, при этом объем концентрированного раствора вычисляют по формуле:
Vк=pdV/pkdk,
где dk — плотность концентрированного раствора.
Растворы определенной процентной концентрации готовят как приблизительные, а поэтому навески веществ с точностью до двух-трех значащих цифр взвешивают на технических весах, а для отмеривания объемов пользуются мензурками или мерными цилиндрами.
Если раствор получают смешиванием двух других растворов, один из которых имеет большую концентрацию, а другой —меньшую, то массу исходных растворов можно определить, пользуясь правилом разбавления («правилом креста»), которое для растворов определенной процентной концентрации гласит: массы смешиваемых растворов обратно пропорциональны разностям процентных концентраций смешиваемых и получаемого растворов. Это правило выражают схемой:
Например, для получения раствора в концентрации p2=10% из растворов концентрации p1=20% и р3=5% нужно смешать количество исходных растворов: m1=10-5=5г 20%-ного раствора и m3=20-10=10г 5%-ного раствора. Зная плотность растворов, можно легко определить требуемые для смешивания объемы.