Статья на конкурс «био/мол/текст»: Потенциал покоя — это важное явление в жизни всех клеток организма, и важно знать, как он формируется. Однако это сложный динамический процесс, трудный для восприятия целиком, особенно для студентов младших курсов (биологических, медицинских и психологических специальностей) и неподготовленных читателей. Впрочем, при рассмотрении по пунктам, вполне возможно понять его основные детали и этапы. В работе вводится понятие потенциала покоя и выделяются основные этапы его формирования с использованием образных метафор, помогающих понять и запомнить молекулярные механизмы формирования потенциала покоя.
«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Мембранные транспортные структуры — натрий-калиевые насосы — создают предпосылки для возникновения потенциала покоя. Предпосылки эти — разность в концентрации ионов на внутренней и наружной сторонах клеточной мембраны. Отдельно проявляет себя разность концентрации по натрию и разность концентрации по калию. Попытка ионов калия (K+) выровнять свою концентрацию по обе стороны мембраны приводит к его утечке из клетки и потере вместе с ними положительных электрических зарядов, за счёт чего значительно усиливается общий отрицательный заряд внутренней поверхности клетки. Эта «калиевая» отрицательность составляет бóльшую часть потенциала покоя (−60 мВ в среднем), а меньшую его часть (−10 мВ) составляет «обменная» отрицательность, вызванная электрогенностью самого ионного насоса-обменника.
Давайте разбираться подробнее.
Зачем нам нужно знать, что такое потенциал покоя и как он возникает?
Вы знаете, что такое «животное электричество»? Откуда в организме берутся «биотоки»? Как живая клетка, находящаяся в водной среде, может превратиться в «электрическую батарейку» и почему она моментально не разряжается?
Совершенно очевидно, что для понимания того, как работает нервная система, необходимо вначале разобраться, как работает её отдельная нервная клетка — нейрон. Главное, что лежит в основе работы нейрона — это перемещение электрических зарядов через его мембрану и появление вследствие этого на мембране электрических потенциалов. Можно сказать, что нейрон, готовясь к своей нервной работе, вначале запасает энергию в электрической форме, а затем использует ее в процессе проведения и передачи нервного возбуждения.
Таким образом, наш самый первый шаг к изучению работы нервной системы — это понять, каким образом появляется электрический потенциал на мембране нервных клеток. Этим мы и займёмся, и назовём этот процесс формированием потенциала покоя.
Определение понятия «потенциал покоя»
В норме, когда нервная клетка находится в физиологическом покое и готова к работе, у неё уже произошло перераспределение электрических зарядов между внутренней и наружной сторонами мембраны. За счёт этого возникло электрическое поле, и на мембране появился электрический потенциал — мембранный потенциал покоя.
Как известно из физики, электрические заряды (движущиеся и неподвижные) формируют в пространстве электромагнитное поле, которое влияет на тела, обладающие электрическим зарядом. С точки зрения электромагнетизма клеточную мембрану можно представить как плоский конденсатор, заполненный однородным диэлектриком из неполярных молекул. Если конденсатор заряжен, то внутри него возникает электрическое поле, обусловленное поверхностной плотностью заряда. На поверхности мембраны возникают некомпенсированные заряды: положительные у «отрицательной» поверхности и отрицательные — у «положительной» [6].
Таким образом, мембрана оказывается поляризованной. Это означает, что она имеет разный электрический потенциал наружной и внутренней поверхностей. Разность между этими потенциалами вполне возможно зарегистрировать.
В этом можно убедиться, если ввести внутрь клетки микроэлектрод, соединённый с регистрирующей установкой. Как только электрод попадает внутрь клетки, он мгновенно приобретает некоторый постоянный электроотрицательный потенциал по отношению к электроду, расположенному в окружающей клетку жидкости. Величина внутриклеточного электрического потенциала у нервных клеток и волокон, например, гигантских нервных волокон кальмара, в покое составляет около −70 мВ. Эту величину называют мембранным потенциалом покоя (МПП). Во всех точках аксоплазмы этот потенциал практически одинаков.
Ещё немного физики. Макроскопические физические тела, как правило, электрически нейтральны, т.е. в них в равных количествах содержатся как положительные, так и отрицательные заряды. Зарядить тело можно, создав в нем избыток заряженных частиц одного вида, например, трением о другое тело, в котором при этом образуется избыток зарядов противоположного вида. Учитывая наличие элементарного заряда (e), полный электрический заряд любого тела можно представить как q = ±N×e, где N — целое число.
Потенциал электростатического поля φ определяется как отношение потенциальной энергии W пробного заряда q к величине этого заряда: φ = W/q, откуда следует, что потенциал численно равен потенциальной энергии, которой обладает в данной точке поля единичный положительный заряд. Единицей измерения потенциала служит вольт (1 В) [4]. В некоторых случаях потенциал электрического поля нагляднее определяется как физическая величина, численно равная работе внешних сил против сил электрического поля E при перемещении единичного положительного точечного заряда из бесконечности в данную точку. Последнее определение удобно записать следующим образом:
В электрофизиологии кроме потенциала покоя рассматриваются и другие электрические потенциалы: локальные постсинаптические и рецепторные потенциалы (возбуждающие и тормозные), электротонические и следовые потенциалы, миниатюрные потенциалы концевой пластинки, концентрационный потенциал и потенциал действия [5].
Потенциал покоя — это разность электрических потенциалов, имеющихся на внутренней и наружной сторонах мембраны, когда клетка находится в состоянии физиологического покоя. Его величина измеряется изнутри клетки, она отрицательна и составляет в среднем −70 мВ (милливольт), хотя в разных клетках может быть различной: от −35 мВ до −90 мВ.
Важно учитывать, что в нервной системе электрические заряды представлены не электронами, как в обычных металлических проводах, а ионами — химическими частицами, имеющими электрический заряд. И вообще в водных растворах в виде электрического тока перемещаются не электроны, а ионы. Поэтому все электрические токи в клетках и окружающей их среде — это ионные токи.
Итак, изнутри клетка в покое заряжена отрицательно, а снаружи — положительно. Это свойственно всем живым клеткам, за исключением, разве что, эритроцитов, которые, наоборот, заряжены отрицательно снаружи. Если говорить конкретнее, то получается, что снаружи вокруг клетки будут преобладать положительные ионы (катионы Na+ и K+), а внутри — отрицательные ионы (анионы органических кислот, не способные свободно перемещаться через мембрану, как Na+ и K+).
Теперь нам всего лишь осталось объяснить, каким же образом всё получилось именно так. Хотя, конечно, неприятно сознавать, что все наши клетки кроме эритроцитов только снаружи выглядят положительными, а внутри они — отрицательные.
Термин «отрицательность», который мы будем применять для характеристики электрического потенциала внутри клетки, пригодится нам для простоты объяснения изменений уровня потенциала покоя. В этом термине ценно то, что интуитивно понятно следующее: чем больше отрицательность внутри клетки — тем ниже в отрицательную сторону от нуля смещён потенциал, а чем меньше отрицательность — тем ближе отрицательный потенциал к нулю. Это намного проще понять, чем каждый раз разбираться в том, что же именно означает выражение «потенциал возрастает» — возрастание по абсолютному значению (или «по модулю») будет означать смещение потенциала покоя вниз от нуля, а просто «возрастание» — смещение потенциала вверх к нулю. Термин «отрицательность» не создаёт подобных проблем неоднозначности понимания.
Сущность формирования потенциала покоя
Попробуем разобраться, откуда берётся электрический заряд нервных клеток, хотя их никто не трёт, как это делают физики в своих опытах с электрическими зарядами.
Здесь исследователя и студента поджидает одна из логических ловушек: внутренняя отрицательность клетки возникает не из-за появления лишних отрицательных частиц (анионов), а, наоборот, из-за потери некоторого количества положительных частиц (катионов)!
Так куда же деваются из клетки положительно заряженные частицы? Напомню, что это покинувшие клетку и скопившиеся снаружи ионы натрия — Na+ — и калия — K+.
Главный секрет появления отрицательности внутри клетки
Сразу откроем этот секрет и скажем, что клетка лишается части своих положительных частиц и заряжается отрицательно за счёт двух процессов:
- вначале она обменивает «свой» натрий на «чужой» калий (да-да, одни положительные ионы на другие, такие же положительные);
- потом из неё происходит утечка этих «наменянных» положительных ионов калия, вместе с которыми из клетки утекают положительные заряды.
Эти два процесса нам и надо объяснить.
Первый этап создания внутренней отрицательности: обмен Na+ на K+
В мембране нервной клетки постоянно работают белковые насосы-обменники (аденозинтрифосфатазы, или Na+/K+-АТФазы), встроенные в мембрану. Они меняют «собственный» натрий клетки на наружный «чужой» калий.
Но ведь при обмене одного положительного заряда (Na+) на другой такой же положительный заряд (K+) никакого дефицита положительных зарядов в клетке возникать не может! Правильно. Но, тем не менее, из-за этого обмена в клетке остаётся очень мало ионов натрия, потому что они почти все ушли наружу. И в то же время клетка переполняется ионами калия, которые в неё накачали молекулярные насосы. Если бы мы могли попробовать на вкус цитоплазму клетки, мы бы заметили, что в результате работы насосов-обменников она превратилась из солёной в горько-солёно-кислую, потому что солёный вкус хлорида натрия сменился сложным вкусом довольно-таки концентрированного раствора хлорида калия. В клетке концентрация калия достигает 0,4 моль/л. Растворы хлорида калия в пределах 0,009–0,02 моль/л имеют сладкий вкус, 0,03–0,04 — горький, 0,05–0,1 — горько-солёный, а начиная с 0,2 и выше — сложный вкус, состоящий из солёного, горького и кислого [8].
Важно здесь то, что обмен натрия на калий — неравный. За каждые отданные клеткой три иона натрия она получает всего два иона калия. Это приводит к потере одного положительного заряда при каждом акте ионного обмена. Так что уже на этом этапе за счёт неравноценного обмена клетка теряет больше «плюсов», чем получает взамен. В электрическом выражении это составляет примерно −10 мВ отрицательности внутри клетки. (Но помните, что нам надо ещё найти объяснение для оставшихся −60 мВ!)
Чтобы легче было запомнить работу насосов-обменников, образно можно выразиться так: «Клетка любит калий!» Поэтому клетка и затаскивает калий к себе, несмотря на то, что его и так в ней полно. И поэтому она невыгодно обменивает его на натрий, отдавая 3 иона натрия за 2 иона калия. И поэтому она тратит на этот обмен энергию АТФ. И как тратит! До 70% всех энергозатрат нейрона может уходить на работу натрий-калиевых насосов. (Вот что делает любовь, пусть она даже и не настоящая!)
Кстати, интересно, что клетка не рождается с готовым потенциалом покоя. Ей его ещё надо создать. Например, при дифференцировке и слиянии миобластов потенциал их мембраны изменяется от −10 до −70 мВ, т.е. их мембрана становится более отрицательной — поляризуется в процессе дифференцировки. А в экспериментах на мультипотентных мезенхимальных стромальных клетках костного мозга человека искусственная деполяризация, противодействующая потенциалу покоя и уменьшающая отрицательность клеток, даже ингибировала (угнетала) дифференцировку клеток [1].
Образно говоря, можно выразиться так: Создавая потенциал покоя, клетка «заряжается любовью». Это любовь к двум вещам:
- любовь клетки к калию (поэтому клетка насильно затаскивает его к себе);
- любовь калия к свободе (поэтому калий покидает захватившую его клетку).
Механизм насыщения клетки калием мы уже объяснили (это работа насосов-обменников), а механизм ухода калия из клетки объясним ниже, когда перейдём к описанию второго этапа создания внутриклеточной отрицательности. Итак, результат деятельности мембранных ионных насосов-обменников на первом этапе формирования потенциала покоя таков:
- Дефицит натрия (Na+) в клетке.
- Избыток калия (K+) в клетке.
- Появление на мембране слабого электрического потенциала (−10 мВ).
Можно сказать так: на первом этапе ионные насосы мембраны создают разность концентраций ионов, или градиент (перепад) концентрации, между внутриклеточной и внеклеточной средой.
Второй этап создания отрицательности: утечка ионов K+ из клетки
Итак, что начинается в клетке после того, как с ионами поработают её мембранные натрий-калиевые насосы-обменники?
Из-за образовавшегося дефицита натрия внутри клетки этот ион при каждом удобном случае норовит устремиться внутрь: растворённые вещества всегда стремятся выровнять свою концентрацию во всём объёме раствора. Но это у натрия получается плохо, поскольку ионные натриевые каналы обычно закрыты и открываются только при определённых условиях: под воздействием специальных веществ (трансмиттеров) или при уменьшении отрицательности в клетке (деполяризации мембраны).
В то же время в клетке имеется избыток ионов калия по сравнению с наружной средой — потому что насосы мембраны насильно накачали его в клетку. И он, тоже стремясь уравнять свою концентрацию внутри и снаружи, норовит, напротив, выйти из клетки. И это у него получается!
Тут ещё важно понять то, что ионы натрия и калия как бы «не замечают» друг друга, они реагируют только «на самих себя». Т.е. натрий реагирует на концентрацию натрия же, но «не обращает внимания» на то, сколько вокруг калия. И наоборот, калий реагирует только на концентрацию калия и «не замечает» натрий. Получается, что для понимания поведения ионов надо по отдельности рассматривать концентрации ионов натрия и калия. Т.е. надо отдельно сравнить концентрацию по натрию внутри и снаружи клетки и отдельно — концентрацию по калию внутри и снаружи клетки, но не имеет смысла сравнивать натрий с калием, как это, бывает, делается в учебниках.
По закону выравнивания химических концентраций, который действует в растворах, натрий «хочет» снаружи войти в клетку; туда же его влечёт и электрическая сила (как мы помним, цитоплазма заряжена отрицательно). Хотеть-то он хочет, но не может, так как мембрана в обычном состоянии плохо его пропускает. Натриевые ионные каналы, имеющиеся в мембране, в норме закрыты. Если все же его заходит немножко, то клетка сразу же обменивает его на наружный калий с помощью своих натрий-калиевых насосов-обменников. Получается, что ионы натрия проходят через клетку как бы транзитом и не задерживаются в ней. Поэтому натрий в нейронах всегда в дефиците.
А вот калий как раз может легко выходить из клетки наружу! В клетке его полно, и она его удержать не может. Он выходит наружу через особые каналы в мембране — «калиевые каналы утечки», которые в норме открыты и выпускают калий [5, 7].
К+-каналы утечки постоянно открыты при нормальных значениях мембранного потенциала покоя и проявляют взрывы активности при сдвигах мембранного потенциала, которые длятся несколько минут и наблюдаются при всех значениях потенциала. Усиление К+-токов утечки ведёт к гиперполяризации мембраны, тогда как их подавление — к деполяризации. …Однако, существование канального механизма, ответственного за токи утечки, долгое время оставалось под вопросом. Только сейчас стало ясно, что калиевая утечка — это ток через специальные калиевые каналы.
От химического — к электрическому
А теперь — ещё раз самое главное. Мы должны осознанно перейти от движения химических частиц к движению электрических зарядов.
Калий (K+) положительно заряжен, и поэтому он, когда выходит из клетки, выносит из неё не только самого себя, но и положительный заряд. За ним изнутри клетки к мембране тянутся «минусы» — отрицательные заряды. Но они не могут просочиться через мембрану — в отличие от ионов калия — т.к. для них нет подходящих ионных каналов, и мембрана их не пропускает. Помните про оставшиеся необъяснёнными нами −60 мВ отрицательности? Это и есть та самая часть мембранного потенциала покоя, которую создаёт утечка ионов калия из клетки! И это — большая часть потенциала покоя.
Для этой составной части потенциала покоя есть даже специальное название — концентрационный потенциал [5]. Концентрационный потенциал — это часть потенциала покоя, созданная дефицитом положительных зарядов внутри клетки, образовавшимся за счёт утечки из неё положительных ионов калия.
Ну, а теперь немного физики, химии и математики для любителей точности.
Электрические силы связаны с химическими по уравнению Гольдмана. Его частным случаем является более простое уравнение Нернста, по формуле которого можно рассчитать трансмембранную диффузионную разность потенциалов на основе различной концентрации ионов одного вида по разные стороны мембраны. Так, зная концентрацию ионов калия снаружи и внутри клетки, можно рассчитать калиевый равновесный потенциал EK:
где Ек — равновесный потенциал, R — газовая постоянная, Т — абсолютная температура, F — постоянная Фарадея, К+внеш и K+внутр — концентрации ионов К+ снаружи и внутри клетки, соответственно. По формуле видно, что для расчёта потенциала между собой сравниваются концентрации ионов одного вида — K+.
Более точно итоговая величина суммарного диффузионного потенциала, который создаётся утечкой нескольких видов ионов, рассчитывается по формуле Гольдмана-Ходжкина-Катца. В ней учтено, что потенциал покоя зависит от трех факторов: (1) полярности электрического заряда каждого иона; (2) проницаемости мембраны Р для каждого иона; (3) [концентраций соответствующих ионов] внутри (внутр) и снаружи мембраны (внеш). Для мембраны аксона кальмара в покое отношение проводимостей РK : PNa :PCl = 1 : 0,04 : 0,45 [5].
Заключение
Итак, поте нциал покоя состоит из двух частей:
- −10 мВ, которые получаются от «несимметричной» работы мембранного насоса-обменника (ведь он больше выкачивает из клетки положительных зарядов (Na+), чем закачивает обратно с калием).
- Вторая часть — это всё время утекающий из клетки калий, уносящий положительные заряды. Его вклад — основной: −60 мВ. В сумме это и дает искомые −70 мВ.
Что интересно, калий перестанет выходить из клетки (точнее, его вход и выход уравниваются) только при уровне отрицательности клетки −90 мВ. В этом случае сравняются химические и электрические силы, проталкивающие калий через мембрану, но направляющие его в противоположные стороны. Но этому мешает постоянно подтекающий в клетку натрий, который несёт с собой положительные заряды и уменьшает отрицательность, за которую «борется» калий. И в итоге в клетке поддерживается равновесное состояние на уровне −70 мВ.
Вот теперь мембранный потенциал покоя окончательно сформирован.
Схема работы Na+/K+-АТФазы наглядно иллюстрирует «несимметричный» обмен Na+ на K+: выкачивание избыточного «плюса» в каждом цикле работы фермента приводит к отрицательному заряжению внутренней поверхности мембраны. Чего в этом ролике не сказано, так это того, что АТФаза ответственна за менее чем 20% потенциала покоя (−10 мВ): оставшаяся «отрицательность» (−60 мВ) появляется за счет выхода из клетки через «калиевые каналы утечки» ионов K+, стремящихся выровнять свою концентрацию внутри клетки и вне нее.
- Jacqueline Fischer-Lougheed, Jian-Hui Liu, Estelle Espinos, David Mordasini, Charles R. Bader, et. al.. (2001). Human Myoblast Fusion Requires Expression of Functional Inward Rectifier Kir2.1 Channels. J Cell Biol. 153, 677-686;
- Liu J.H., Bijlenga P., Fischer-Lougheed J. et al. (1998). Role of an inward rectifier K+ current and of hyperpolarization in human myoblast fusion. J. Physiol. 510, 467–476;
- Sarah Sundelacruz, Michael Levin, David L. Kaplan. (2008). Membrane Potential Controls Adipogenic and Osteogenic Differentiation of Mesenchymal Stem Cells. PLoS ONE. 3, e3737;
- Павловская М.В. и Мамыкин А.И. Электростатика. Диэлектрики и проводники в электрическом поле. Постоянный ток / Электронное пособие по общему курсу физики. СПб: Санкт-Петербургский государственный электротехнический университет;
- Ноздрачёв А.Д., Баженов Ю.И., Баранникова И.А., Батуев А.С. и др. Начала физиологии: Учебник для вузов / Под ред. акад. А.Д. Ноздрачёва. СПб: Лань, 2001. — 1088 с.;
- Макаров А.М. и Лунева Л.А. Основы электромагнетизма / Физика в техническом университете. Т. 3;
- Зефиров А.Л. и Ситдикова Г.Ф. Ионные каналы возбудимой клетки (структура, функция, патология). Казань: Арт-кафе, 2010. — 271 с.;
- Родина Т.Г. Сенсорный анализ продовольственных товаров. Учебник для студентов вузов. М.: Академия, 2004. — 208 с.;
- Кольман Я. и Рем К.-Г. Наглядная биохимия. М.: Мир, 2004. — 469 с.;
- Шульговский В.В. Основы нейрофизиологии: Учебное пособие для студентов вузов. М.: Аспект Пресс, 2000. — 277 с..
A relatively static membrane potential which is usually referred to as the ground value for trans-membrane voltage.
The Na+
/K+
-ATPase, as well as effects of diffusion of the involved ions, are major mechanisms to maintain the resting potential across the membranes of animal cells.
The relatively static membrane potential of quiescent cells is called the resting membrane potential (or resting voltage), as opposed to the specific dynamic electrochemical phenomena called action potential and graded membrane potential.
Apart from the latter two, which occur in excitable cells (neurons, muscles, and some secretory cells in glands), membrane voltage in the majority of non-excitable cells can also undergo changes in response to environmental or intracellular stimuli. The resting potential exists due to the differences in membrane permeabilities for potassium, sodium, calcium, and chloride ions, which in turn result from functional activity of various ion channels, ion transporters, and exchangers. Conventionally, resting membrane potential can be defined as a relatively stable, ground value of transmembrane voltage in animal and plant cells.
Because the membrane permeability for potassium is much higher than that for other ions, and because of the strong chemical gradient for potassium, potassium ions flow from the cytosol into the extracellular space carrying out positive charge, until their movement is balanced by build-up of negative charge on the inner surface of the membrane. Again, because of the high relative permeability for potassium, the resulting membrane potential is almost always close to the potassium reversal potential. But in order for this process to occur, a concentration gradient of potassium ions must first be set up. This work is done by the ion pumps/transporters and/or exchangers and generally is powered by ATP.
In the case of the resting membrane potential across an animal cell’s plasma membrane, potassium (and sodium) gradients are established by the Na+/K+-ATPase (sodium-potassium pump) which transports 2 potassium ions inside and 3 sodium ions outside at the cost of 1 ATP molecule. In other cases, for example, a membrane potential may be established by acidification of the inside of a membranous compartment (such as the proton pump that generates membrane potential across synaptic vesicle membranes).[citation needed]
Electroneutrality[edit]
In most quantitative treatments of membrane potential, such as the derivation of Goldman equation, electroneutrality is assumed; that is, that there is no measurable charge excess on either side of the membrane. So, although there is an electric potential across the membrane due to charge separation, there is no actual measurable difference in the global concentration of positive and negative ions across the membrane (as it is estimated below), that is, there is no actual measurable charge excess on either side. That occurs because the effect of charge on electrochemical potential is hugely greater than the effect of concentration so an undetectable change in concentration creates a great change in electric potential.[citation needed]
Generation of the resting potential[edit]
Cell membranes are typically permeable to only a subset of ions. These usually include potassium ions, chloride ions, bicarbonate ions, and others. To simplify the description of the ionic basis of the resting membrane potential, it is most useful to consider only one ionic species at first, and consider the others later. Since trans-plasma-membrane potentials are almost always determined primarily by potassium permeability, that is where to start.
A diagram showing the progression in the development of a membrane potential from a concentration gradient (for potassium). Green arrows indicate net movement of K+ down a concentration gradient. Red arrows indicate net movement of K+ due to the membrane potential. The diagram is misleading in that while the concentration of potassium ions outside of the cell increases, only a small amount of K+ needs to cross the membrane in order to produce a membrane potential with a magnitude large enough to counter the tendency of the potassium ions to move down the concentration gradient.
- Panel 1 of the diagram shows a diagrammatic representation of a simple cell where a concentration gradient has already been established. This panel is drawn as if the membrane has no permeability to any ion. There is no membrane potential because despite there being a concentration gradient for potassium, there is no net charge imbalance across the membrane. If the membrane were to become permeable to a type of ion that is more concentrated on one side of the membrane, then that ion would contribute to membrane voltage because the permeant ions would move across the membrane with net movement of that ion type down the concentration gradient. There would be net movement from the side of the membrane with a higher concentration of the ion to the side with lower concentration. Such a movement of one ion across the membrane would result in a net imbalance of charge across the membrane and a membrane potential. This is a common mechanism by which many cells establish a membrane potential.
- In panel 2 of the diagram, the cell membrane has been made permeable to potassium ions, but not the anions (An−) inside the cell. These anions are mostly contributed by protein. There is energy stored in the potassium ion concentration gradient that can be converted into an electrical gradient when potassium (K+) ions move out of the cell. Note that potassium ions can move across the membrane in both directions but by the purely statistical process that arises from the higher concentration of potassium ions inside the cell, there will be more potassium ions moving out of the cell. Because there is a higher concentration of potassium ions inside the cells, their random molecular motion is more likely to encounter the permeability pore (ion channel) that is the case for the potassium ions that are outside and at a lower concentration. An internal K+ is simply «more likely» to leave the cell than an extracellular K+ is to enter it. It is a matter of diffusion doing work by dissipating the concentration gradient. As potassium leaves the cell, it is leaving behind the anions. Therefore, a charge separation is developing as K+ leaves the cell. This charge separation creates a transmembrane voltage. This transmembrane voltage is the membrane potential. As potassium continues to leave the cell, separating more charges, the membrane potential will continue to grow. The length of the arrows (green indicating concentration gradient, red indicating voltage), represents the magnitude of potassium ion movement due to each form of energy. The direction of the arrow indicates the direction in which that particular force is applied. Thus, the building membrane voltage is an increasing force that acts counter to the tendency for net movement of potassium ions down the potassium concentration gradient.
- In Panel 3, the membrane voltage has grown to the extent that its «strength» now matches the concentration gradients. Since these forces (which are applied to K+) are now the same strength and oriented in opposite directions, the system is now in equilibrium. Put another way, the tendency of potassium to leave the cell by running down its concentration gradient is now matched by the tendency of the membrane voltage to pull potassium ions back into the cell. K+ continues to move across the membrane, but the rate at which it enters and leaves the cell are the same, thus, there is no net potassium current. Because the K+ is at equilibrium, membrane potential is stable, or «resting» (EK).
The resting voltage is the result of several ion-translocating enzymes (uniporters, cotransporters, and pumps) in the plasma membrane, steadily operating in parallel, whereby each ion-translocator has its characteristic electromotive force (= reversal potential = ‘equilibrium voltage’), depending on the particular substrate concentrations inside and outside (internal ATP included in case of some pumps). H+ exporting ATPase render the membrane voltage in plants and fungi much more negative than in the more extensively investigated animal cells, where the resting voltage is mainly determined by selective ion channels.
In most neurons the resting potential has a value of approximately −70 mV. The resting potential is mostly determined by the concentrations of the ions in the fluids on both sides of the cell membrane and the ion transport proteins that are in the cell membrane. How the concentrations of ions and the membrane transport proteins influence the value of the resting potential is outlined below.
The resting potential of a cell can be most thoroughly understood by thinking of it in terms of equilibrium potentials. In the example diagram here, the model cell was given only one permeant ion (potassium). In this case, the resting potential of this cell would be the same as the equilibrium potential for potassium.
However, a real cell is more complicated, having permeabilities to many ions, each of which contributes to the resting potential. To understand better, consider a cell with only two permeant ions, potassium, and sodium. Consider a case where these two ions have equal concentration gradients directed in opposite directions, and that the membrane permeabilities to both ions are equal. K+ leaving the cell will tend to drag the membrane potential toward EK. Na+ entering the cell will tend to drag the membrane potential toward the reversal potential for sodium ENa. Since the permeabilities to both ions were set to be equal, the membrane potential will, at the end of the Na+/K+ tug-of-war, end up halfway between ENa and EK. As ENa and EK were equal but of opposite signs, halfway in between is zero, meaning that the membrane will rest at 0 mV.
Note that even though the membrane potential at 0 mV is stable, it is not an equilibrium condition because neither of the contributing ions is in equilibrium. Ions diffuse down their electrochemical gradients through ion channels, but the membrane potential is upheld by continual K+ influx and Na+ efflux via ion transporters. Such situation with similar permeabilities for counter-acting ions, like potassium and sodium in animal cells, can be extremely costly for the cell if these permeabilities are relatively large, as it takes a lot of ATP energy to pump the ions back. Because no real cell can afford such equal and large ionic permeabilities at rest, resting potential of animal cells is determined by predominant high permeability to potassium and adjusted to the required value by modulating sodium and chloride permeabilities and gradients.
In a healthy animal cell Na+ permeability is about 5% of the K+ permeability or even less, whereas the respective reversal potentials are +60 mV for sodium (ENa)and −80 mV for potassium (EK). Thus the membrane potential will not be right at EK, but rather depolarized from EK by an amount of approximately 5% of the 140 mV difference between EK and ENa. Thus, the cell’s resting potential will be about −73 mV.
In a more formal notation, the membrane potential is the weighted average of each contributing ion’s equilibrium potential. The size of each weight is the relative conductance of each ion. In the normal case, where three ions contribute to the membrane potential:
,
where
- Em is the membrane potential, measured in volts
- EX is the equilibrium potential for ion X, also in volts
- gX/gtot is the relative conductance of ion X, which is dimensionless
- gtot is the total conductance of all permeant ions in arbitrary units (e.g. siemens for electrical conductance), in this case gK+ + gNa+ + gCl−
Membrane transport proteins[edit]
For determination of membrane potentials, the two most important types of membrane ion transport proteins are ion channels and ion transporters. Ion channel proteins create paths across cell membranes through which ions can passively diffuse without direct expenditure of metabolic energy. They have selectivity for certain ions, thus, there are potassium-, chloride-, and sodium-selective ion channels. Different cells and even different parts of one cell (dendrites, cell bodies, nodes of Ranvier) will have different amounts of various ion transport proteins. Typically, the amount of certain potassium channels is most important for control of the resting potential (see below). Some ion pumps such as the Na+/K+-ATPase are electrogenic, that is, they produce charge imbalance across the cell membrane and can also contribute directly to the membrane potential. Most pumps use metabolic energy (ATP) to function.
Equilibrium potentials[edit]
For most animal cells potassium ions (K+) are the most important for the resting potential.[1] Due to the active transport of potassium ions, the concentration of potassium is higher inside cells than outside. Most cells have potassium-selective ion channel proteins that remain open all the time. There will be net movement of positively charged potassium ions through these potassium channels with a resulting accumulation of excess negative charge inside of the cell. The outward movement of positively charged potassium ions is due to random molecular motion (diffusion) and continues until enough excess negative charge accumulates inside the cell to form a membrane potential which can balance the difference in concentration of potassium between inside and outside the cell. «Balance» means that the electrical force (potential) that results from the build-up of ionic charge, and which impedes outward diffusion, increases until it is equal in magnitude but opposite in direction to the tendency for outward diffusive movement of potassium. This balance point is an equilibrium potential as the net transmembrane flux (or current) of K+ is zero. A good approximation for the equilibrium potential of a given ion only needs the concentrations on either side of the membrane and the temperature. It can be calculated using the Nernst equation:
where
- Eeq,K+ is the equilibrium potential for potassium, measured in volts
- R is the universal gas constant, equal to 8.314 joules·K−1·mol−1
- T is the absolute temperature, measured in kelvins (= K = degrees Celsius + 273.15)
- z is the number of elementary charges of the ion in question involved in the reaction
- F is the Faraday constant, equal to 96,485 coulombs·mol−1 or J·V−1·mol−1
- [K+]o is the extracellular concentration of potassium, measured in mol·m−3 or mmol·l−1
- [K+]i is likewise the intracellular concentration of potassium
Potassium equilibrium potentials of around −80 millivolts (inside negative) are common. Differences are observed in different species, different tissues within the same animal, and the same tissues under different environmental conditions. Applying the Nernst Equation above, one may account for these differences by changes in relative K+ concentration or differences in temperature.
For common usage the Nernst equation is often given in a simplified form by assuming typical human body temperature (37 °C), reducing the constants and switching to Log base 10. (The units used for concentration are unimportant as they will cancel out into a ratio). For Potassium at normal body temperature one may calculate the equilibrium potential in millivolts as:
Likewise the equilibrium potential for sodium (Na+) at normal human body temperature is calculated using the same simplified constant. You can calculate E assuming an outside concentration, [K+]o, of 10mM and an inside concentration, [K+]i, of 100mM. For chloride ions (Cl−) the sign of the constant must be reversed (−61.54 mV). If calculating the equilibrium potential for calcium (Ca2+) the 2+ charge halves the simplified constant to 30.77 mV. If working at room temperature, about 21 °C, the calculated constants are approximately 58 mV for K+ and Na+, −58 mV for Cl− and 29 mV for Ca2+. At physiological temperature, about 29.5 °C, and physiological concentrations (which vary for each ion), the calculated potentials are approximately 67 mV for Na+, −90 mV for K+, −86 mV for Cl− and 123 mV for Ca2+.
Resting potentials[edit]
The resting membrane potential is not an equilibrium potential as it relies on the constant expenditure of energy (for ionic pumps as mentioned above) for its maintenance. It is a dynamic diffusion potential that takes this mechanism into account—wholly unlike the pillows equilibrium potential, which is true no matter the nature of the system under consideration. The resting membrane potential is dominated by the ionic species in the system that has the greatest conductance across the membrane. For most cells this is potassium. As potassium is also the ion with the most negative equilibrium potential, usually the resting potential can be no more negative than the potassium equilibrium potential. The resting potential can be calculated with the Goldman-Hodgkin-Katz voltage equation using the concentrations of ions as for the equilibrium potential while also including the relative permeabilities of each ionic species. Under normal conditions, it is safe to assume that only potassium, sodium (Na+) and chloride (Cl−) ions play large roles for the resting potential:
This equation resembles the Nernst equation, but has a term for each permeant ion. Also, z has been inserted into the equation, causing the intracellular and extracellular concentrations of Cl− to be reversed relative to K+ and Na+, as chloride’s negative charge is handled by inverting the fraction inside the logarithmic term. *Em is the membrane potential, measured in volts *R, T, and F are as above *Ps is the relative permeability of ion s *[s]Y is the concentration of ion s in compartment Y as above. Another way to view the membrane potential, considering instead the conductance of the ion channels rather than the permeability of the membrane, is using the Millman equation (also called the Chord Conductance Equation):
or reformulated
where gtot is the combined conductance of all ionic species, again in arbitrary units. The latter equation portrays the resting membrane potential as a weighted average of the reversal potentials of the system, where the weights are the relative conductances of each ion species (gX/gtot). During the action potential, these weights change. If the conductances of Na+ and Cl− are zero, the membrane potential reduces to the Nernst potential for K+ (as gK+ = gtot). Normally, under resting conditions gNa+ and gCl− are not zero, but they are much smaller than gK+, which renders Em close to Eeq,K+. Medical conditions such as hyperkalemia in which blood serum potassium (which governs [K+]o) is changed are very dangerous since they offset Eeq,K+, thus affecting Em. This may cause arrhythmias and cardiac arrest. The use of a bolus injection of potassium chloride in executions by lethal injection stops the heart by shifting the resting potential to a more positive value, which depolarizes and contracts the cardiac cells permanently, not allowing the heart to repolarize and thus enter diastole to be refilled with blood.
Although the GHK voltage equation and Millman’s equation are related, they are not equivalent. The critical difference is that Millman’s equation assumes the current-voltage relationship to be ohmic, whereas the GHK voltage equation takes into consideration the small, instantaneous rectifications predicted by the GHK flux equation caused by the concentration gradient of ions. Thus, a more accurate estimate of membrane potential can be calculated using the GHK equation than with Millman’s equation.[2]
Measuring resting potentials[edit]
In some cells, the membrane potential is always changing (such as cardiac pacemaker cells). For such cells there is never any «rest» and the «resting potential» is a theoretical concept. Other cells with little in the way of membrane transport functions that change with time have a resting membrane potential that can be measured by inserting an electrode into the cell.[3] Transmembrane potentials can also be measured optically with dyes that change their optical properties according to the membrane potential.
Summary of resting potential values in different types of cells[edit]
| Cell types | Resting potential |
|---|---|
| Skeletal muscle cells | -95 mV[4] |
| Astroglia | -80 to -90 mV |
| Neurons | -60 to -70 mV[5] |
| Smooth muscle cells | -60 mV |
| Aorta Smooth muscle tissue | -45mV[5] |
| Photoreceptor cells | -40 mV |
| Hair cell (Cochlea) | -15 to -40mV[6] |
| Erythrocytes | -8.4 mV[7] |
| Chondrocytes | -8mV[5] |
History[edit]
Resting currents in nerves were measured and described by Julius Bernstein in 1902 where he proposed a «Membrane Theory» that explained the resting potential of nerve and muscle as a diffusion potential.[8]
See also[edit]
- Action potential
- Depolarization
- Hyperpolarization (biology)
- Membrane potential
References[edit]
- ^ An example of an electrophysiological experiment to demonstrate the importance of K+ for the resting potential. The dependence of the resting potential on the extracellular concentration of K+ is shown in Figure 2.6 of Neuroscience, 2nd edition, by Dale Purves, George J. Augustine, David Fitzpatrick, Lawrence C. Katz, Anthony-Samuel LaMantia, James O. McNamara, S. Mark Williams. Sunderland (MA): Sinauer Associates, Inc.; 2001.
- ^ Hille, Bertil (2001) Ion Channels of Excitable Membranes, 3 ed.
- ^ An illustrated example of measuring membrane potentials with electrodes is in Figure 2.1 of Neuroscience by Dale Purves, et al. (see reference #1, above).
- ^ «Muscles». users.rcn.com. 2015-01-24. Archived from the original on 2015-11-07. Retrieved 2016-06-01.
- ^ a b c Lewis, Rebecca; Asplin, Katie E.; Bruce, Gareth; Dart, Caroline; Mobasheri, Ali; Barrett-Jolley, Richard (2011-11-01). «The role of the membrane potential in chondrocyte volume regulation». Journal of Cellular Physiology. 226 (11): 2979–2986. doi:10.1002/jcp.22646. ISSN 1097-4652. PMC 3229839. PMID 21328349.
- ^ Ashmore, J. F.; Meech, R. W. (1986-07-24). «Ionic basis of membrane potential in outer hair cells of guinea pig cochlea». Nature. 322 (6077): 368–371. Bibcode:1986Natur.322..368A. doi:10.1038/322368a0. PMID 2426595. S2CID 4371640.
- ^ Cheng, K; Haspel, HC; Vallano, ML; Osotimehin, B; Sonenberg, M (1980). «Measurement of membrane potentials (psi) of erythrocytes and white adipocytes by the accumulation of triphenylmethylphosphonium cation». J. Membr. Biol. 56 (3): 191–201. doi:10.1007/bf01869476. PMID 6779011. S2CID 19693916.
- ^ Seyfarth, Ernst-August (2006-01-01). «Julius Bernstein (1839-1917): pioneer neurobiologist and biophysicist». Biological Cybernetics. 94 (1): 2–8. doi:10.1007/s00422-005-0031-y. ISSN 0340-1200. PMID 16341542. S2CID 2842501.
External links[edit]
- Neuroscience — online textbook by Purves, et al.
- Basic Neurochemistry Molecular, Cellular, and Medical Aspects by Siegel, et al.
- Bertil Hille Ion channels of excitable membranes, 3rd ed., Sinauer Associates, Sunderland, MA (2001). ISBN 0-87893-321-2
- Wright, SH (2004). «Generation of resting membrane potential». Adv Physiol Educ. 28 (1–4): 139–42. doi:10.1152/advan.00029.2004. PMID 15545342. S2CID 5009629.
- Resting Membrane Potential — Online lecture notes on the resting membrane potential
- The Origin of the Resting Membrane Potential — Online interactive tutorial
Мембранным
потенциалом покоя (МПП)
или потенциалом
покоя (ПП) называют
разность потенциалов покоящейся
клетки между внутренней и наружной
сторонами мембраны.Внутренняя
сторона мембраны клетки заряжена
отрицательно по отношению к наружной.
Принимая потенциал наружного раствора
за нуль, МПП записывают со знаком «минус».
ВеличинаМПП зависит от вида ткани
и варьирует от -9 до -100 мв. Следовательно,
в состоянии покоя клеточная мембранаполяризована. Уменьшение величины
МПП называютдеполяризацией, увеличение
—гиперполяризацией, восстановление
исходного значенияМПП —реполяризацией
мембраны.
Основные
положения мембранной теории происхождения
МПП сводятся к следующему. В состоянии
покоя клеточная мембрана хорошо
проницаема для ионов К+(в ряде
клеток и для СГ), менее проницаема для
Na+и практически непроницаема для
внутриклеточных белков и других
органических ионов. Ионы К+диффундируют из клетки по концентрационному
градиенту, а непроникающие анионы
остаются в цитоплазме, обеспечивая
появление разности потенциалов
через мембрану.
Возникающая
разность потенциалов препятствует
выходу К+из клетки и при
некотором ее значении наступает
равновесие между выходом К+по
концентрационному градиенту и входом
этих катионов по возникшему
электрическому градиенту. Мембранный
потенциал, при котором достигается
это равновесие, называетсяравновесным
потенциалом. Его величина может
быть рассчитана из уравнения Нернста:
10
В
нервных волокнах сигналы передаются с
помощью потенциалов действия, которые
представляют собой быстрые изменения
мембранного потенциала, быстро
распространяющиеся вдоль мембраны
нервного волокна. Каждый потенциал
действия начинается со стремительного
сдвига потенциала покоя от нормального
отрицательного значения до положительной
величины, затем он почти так же быстро
возвращается к отрицательному потенциалу.
При проведении нервного сигнала потенциал
действия движется вдоль нервного волокна
вплоть до его окончания. На рисунке
показаны изменения, возникающие на
мембране во время потенциала действия,
с переносом положительных зарядов
внутрь волокна вначале и возвращением
положительных зарядов наружу в конце.
В нижней части рисунка графически
представлены последовательные изменения
мембранного потенциала в течение
нескольких 1/10000 сек, иллюстрирующие
взрывное начало потенциала действия и
почти столь же быстрое восстановление.
Стадия покоя. Эта стадия представлена
мембранным потенциалом покоя, который
предшествует потенциалу действия.
Мембрана во время этой стадии поляризована
в связи с наличием отрицательного
мембранного потенциала, равного -90 мВ.
Фаза деполяризации. В это время мембрана
внезапно становится высокопроницаемой
для ионов натрия, позволяя огромному
числу положительно заряженных ионов
натрия диффундировать внутрь аксона.
Нормальное поляризованное состояние
в -90 мВ немедленно нейтрализуется
поступающими внутрь положительно
заряженными ионами натрия, в результате
потенциал стремительно нарастает в
положительном направлении. Этот процесс
называют деполяризацией, В крупных
нервных волокнах значительный избыток
входящих внутрь положительных ионов
натрия обычно приводит к тому, что
мембранный потенциал «проскакивает»
за пределы нулевого уровня, становясь
слегка положительным. В некоторых более
мелких волокнах, как и в большинстве
нейронов центральной нервной системы,
потенциал достигает нулевого уровня,
не «перескакивая» его. Фаза реполяризации.
В течение нескольких долей миллисекунды
после резкого повышения проницаемости
мембраны для ионов натрия, натриевые
каналы начинают закрываться, а калиевые
— открываться. В результате быстрая
диффузия ионов калия наружу восстанавливает
нормальный отрицательный мембранный
потенциал покоя. Этот процесс называют
реполя-ризацией мембраны. потенциал
действия Для более полного понимания
факторов, являющихся причиной деполяризации
и реполяризации, необходимо изучить
особенности двух других типов транспортных
каналов в мембране нервного волокна:
электроуправляемых натриевых и калиевых
каналов. Электроупавляемые натриевые
и калиевые каналы. Необходимым участником
процессов деполяризации и реполяризации
во время развития потенциала действия
в мембране нервного волокна является
электроуправляемый натриевый канал.
Электроуправляемый калиевый канал
также играет важную роль в увеличении
скорости реполяризации мембраны. Оба
типа электроуправляемых каналов
существуют дополнительно к Na+/K+ -насосу
и каналам К*/Na+-утечки. Электроуправляемый
натриевый канал. В верхней части рисунка
показан электроуправляемый натриевый
канал в трех различных состояниях. Этот
канал имеет двое ворот: одни вблизи
наружной части канала, которые называют
активационными воротами, другие — у
внутренней части канала, которые называют
инактивационными воротами. В верхней
левой части рисунка изображено состояние
этих ворот в покое, когда мембранный
потенциал покоя равен -90 мВ. В этих
условиях активационные ворота закрыты
и препятствуют поступлению ионов натрия
внутрь волокна. Активация натриевого
канала. Когда мембранный потенциал
покоя смещается в направлении менее
отрицательных значений, поднимаясь от
-90 мВ в сторону нуля, на определенном
уровне (обычно между -70 и -50 мВ) происходит
внезапное конформационное изменение
актива-ционных ворот, в результате они
переходят в полностью открытое состояние.
Это состояние называют активированным
состоянием канала, при котором ионы
натрия могут свободно входить через
него внутрь волокна; при этом натриевая
проницаемость мембраны возрастает в
диапазоне от 500 до 5000 раз. Инактивация
натриевого канала. В верхней правой
части рисунке показано третье состояние
натриевого канала. Увеличение потенциала,
открывающее активационные ворота,
закрывает инактивационные ворота.
Однако инактивационные ворота закрываются
в течение нескольких десятых долей
миллисекунды после открытия активационных
ворот. Это значит, что конформационное
изменение, приводящее к закрытию
инактивационных ворот, — процесс более
медленный, чем конформационное изменение,
открывающее активационные ворота. В
результате через несколько десятых
долей миллисекунды после открытия
натриевого канала инактивационные
ворота закрываются, и ионы натрия не
могут более проникать внутрь волокна.
С этого момента мембранный потенциал
начинает возвращаться к уровню покоя,
т.е. начинается процесс реполяризации.
Существует другая важная характеристикая
процесса инактивации натриевого канала:
инактивационные ворота не открываются
повторно до тех пор, пока мембранный
потенциал не вернется к значению, равному
или близкому к уровню исходного потенциала
покоя. В связи с этим повторное открытие
натриевых каналов обычно невозможно
без предварительной реполяризации
нервного волокна.
13Механизм проведения
возбуждения по нервным волокнам зависит
от их типа. Существуют два типа нервных
волокон: миелиновые и безмиелиновые.
Процессы
метаболизма в безмиелиновых волокнах
не обеспечивают быструю компенсацию
расхода энергии. Распространение
возбуждения будет идти с постепенным
затуханием – с декрементом. Декре-ментное
поведение возбуждения характерно для
низкоорганизованной нервной системы.
Возбуждение распространяется за счет
малых круговых токов, которые возникают
внутрь волокна или в окружающую его
жидкость. Между возбужденными и
невозбужденными участками возникает
разность потенциалов, которая способствует
возникновению круговых токов. Ток будет
распространяться от «+» заряда к«-». В
месте выхода кругового тока повышается
проницаемость плазматической мемб-раны
для ионов Na, в результате чего происходит
деполяризация мембраны. Между вновь
возбужденным участком и соседним
невозбужденным вновь возникает разность
потенциалов, что приводит к возникновению
круговых токов. Возбуждение постепенно
охватывает соседние участки осевого
цилиндра и так распространяется до
конца аксона.
В миелиновых волокнах
благодаря совершенству метаболизма
возбуждение проходит, не затухая, без
декремента. За счет большого радиуса
нервного волокна, обусловленного
миелиновой оболочкой, электрический
ток может входить и выходить из волокна
только в области перехвата. При нанесения
раздражения возникает деполяризация
в области перехвата А, соседний перехват
В в это время поляризован. Между
перехватами возникает разность
потенциалов, и появляются круговые
токи. За счет круговых токов возбуждаются
другие перехваты, при этом возбуждение
распространяется сальтаторно,
скачкообразно от одного перехвата к
другому.
Существует три закона
проведения раздражения по нервному
волокну.
Закон анатомо-физиологической
целостности.
Проведение импульсов
по нервному волокну возможно лишь в том
случае, если не нарушена его
целостность.
Закон изолированного
проведения возбуждения.
Существует
ряд особенностей распространения
возбуждения в периферических, мякотных
и безмя-котных нервных волокнах.
В
периферических нервных волокнах
возбуждение передается только вдоль
нервного волокна, но не передается на
соседние, которые находятся в одном и
том же нервном стволе.
В мякотных
нервных волокнах роль изолятора выполняет
мие-линовая оболочка. За счет миелина
увеличивается удельное сопротивление
и происходит уменьшение электрической
емкости оболочки.
В безмякотных
нервных волокнах возбуждение передается
изолированно.
Закон двустороннего
проведения возбуждения.
Нервное
волокно проводит нервные импульсы в
двух направлениях – центростремительно
и цен-тробежно.
14
Синапсы
– это специализированная структура,
которая обеспечивает передачу нервного
импульса из нервного волокна на
эффекторную клетку – мышечное волокно,
нейрон или секреторную клетку.
Синапсы
– это места соединения нервного отростка
(аксона) одного нейрона с телом или
отростком (дендритом, аксоном) другой
нервной клетки (прерывистый контакт
между нервными клетками).
Все
структуры, обеспечивающие передачу
сигнала с одной нервной структуры на
другую – синапсы.
Значение
– передает нервные импульсы с одного
нейрона на другой => обеспечивает
передачу возбуждения по нервному волокну
(распространение сигнала).
Большое
количество синапсов обеспечивает
большую площадь для передачи информации.
Строение
синапса:
1.
Пресинаптическая
мембрана —
принадлежит нейрону, ОТ которого
передается сигнал.
2.
Синаптическая
щель,
заполненная жидкостью с высоким
содержанием ионов Са.
3.
Постсинаптическая
мембрана —
принадлежит клеткам, НА которые передается
сигнал.
Между
нейронами всегда существует перерыв,
заполненный межтканевой жидкостью.
В
зависимости от плотности мембран,
выделяют:
—
симметричные
(с
одинаковой плотностью мембран)
—
асимметричные
(плотность
одной из мембран выше)
Пресинаптическая
мембрана покрывает
расширение аксона передающего нейрона.
Расширение
— синаптическая
пуговка/синаптическая бляшка.
На
бляшке — синаптические
пузырьки (везикуль).
С
внутренней стороны пресинаптической
мембраны – белковая/гексогональная
решетка (необходима
для высвобождения медиатора), в которой
находится белок — нейрин.
Заполнена синаптическими пузырьками,
которые содержат медиатор
–
специальное вещество, участвующее в
передаче сигналов.
В
состав мембраны пузырьков входит —
стенин
(белок).
Пузырьки
содержат молекулы медиатора
(внутри)
— вещество, необходимое для передачи
сигнала.
Постсинаптическая
мембрана
покрывает эффекторную клетку. Содержит
белковые молекулы, избирательно
чувствительные к медиатору данного
синапса, что обеспечивает взаимодействие.
Эти
молекулы – часть каналов постсинаптической
мембраны + ферменты (много), способные
разрушать связь медиатора с рецепторами.
Рецепторы
постсинаптической мембраны.
Постсинаптическая
мембрана содержит рецепторы, обладающие
родством с медиатором данного синапса.
Между
ними находится снаптическая
щель.
Она заполнена межклеточной жидкостью,
имеющей большое количество кальция.
Обладает рядом структурных особенностей
– содержит белковые молекулы,
чувствительные к медиатору, осуществляющему
передачу сигналов.
15
Синаптическая
задержка проведения возбуждения
Для
того, чтобы возбуждение распространилось
по рефлекторной дуге затрачивается
определенное время. Это время состоит
из следующих периодов:
1.
период временно необходимый для
возбуждения рецепторов (рецептора) и
для проведения импульсов возбуждения
по афферентным волокнам до центра;
2.
период времени, необходимый для
распространения возбуждения через
нервные центры;
3.
период времени, необходимый на
распространение возбуждения по
эфферентным волокнам до рабочего органа;
4.
латентный период рабочего органа.
16
Торможение
играет важную роль в обработке поступающей
в ЦНС информации. Особенно ярко выражена
эта роль у пресинаптического торможения.
Оно более точно регулирует процесс
возбуждения, поскольку этим торможением
могут быть заблокированы отдельные
нервные волокна. К одному возбуждающему
нейрону могут подходить сотни и тысячи
импульсов по разным терминалям. Вместе
с тем число дошедших до нейрона импульсов
определяется пресинаптическим
торможением. Торможение латеральных
путей обеспечивает выделение существенных
сигналов из фона. Блокада торможения
ведет к широкой иррадиации возбуждения
и судорогам, например при выключении
пресинаптического торможения бикукулином.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
12.05.2015102.4 Кб121.doc
Краткое описание:
Библиографическая ссылка для цитирования: Сазонов В.Ф. 2_1 Мембранный потенциал покоя кратко (доцент Сазонов В.Ф.) [Электронный ресурс] // Кинезиолог, 2009-2021: [сайт]. Дата обновления: 31.12.2021. URL: http://kineziolog.su/content/21-membrannyi-potentsial-pokoya-kratko-dotsent-sazonov-vf (дата обращения: __.__.20___).
__________________________________Описано формирование потенциала покоя мембраны клеток, роль натрий-калиевого насоса и утечки ионов калия из клетки.
Введение
Зачем нам нужно знать, что такое потенциал покоя?
Что такое «животное электричество»? Откуда в организме берутся «биотоки»? Как живая клетка, находящаяся в водной среде, может превратиться в «электрическую батарейку»?
— На эти вопросы мы сможем ответить, если узнаем, как клетка за счёт перераспределения электрических зарядов (заряженных частиц — ионов) создаёт себе электрический потенциал на мембране.
Как работает нервная система? С чего в ней всё начинается? Откуда в ней берётся электричество для нервных импульсов?
— На эти вопросы мы также сможем ответить, если узнаем, как нервная клетка создаёт себе электрический потенциал на мембране.
Итак, понимание того, как работает нервная система, начинается с того, что надо разобраться, как работает отдельная нервная клетка — нейрон.
В основе работы нейрона с нервными импульсами лежит перераспределение электрических зарядов на его мембране и изменение величины электрических потенциалов. Но чтобы потенциал изменять, его нужно для начала иметь. Поэтому можно сказать, что нейрон, готовясь к cвоей нервной работе, создаёт на своей мембране электрический потенциал, как возможность для такой работы.
Таким образом, наш самый первый шаг к изучению работы нервной системы — это понять, каким образом перемещаются электрические заряды в нервных клетках и как за счёт этого на мембране появляется электрический потенцил. Этим мы и займёмся, и назовём этот процесс появления электрического потенциала у нейронов — формирование потенциала покоя.
Определение
В норме, когда клетка готова к работе, у неё уже есть электрический потенциал на поверхности мембраны. Он называется мембранный потенциал покоя.
Потенциал покоя — это разность электрических потенциалов между внутренней и наружной сторонами мембраны, когда клетка находится в состоянии физиологического покоя. Его средняя величина составляет -70 мВ (милливольт).
«Потенциал» — это возможность, он сродни понятию «потенция». Электрический потенциал мембраны — это её возможности по перемещению электрических зарядов, положительных или отрицательных. В роли зарядов выступают заряженные химические частицы — ионы натрия и калия, а также кальция и хлора. Из них только ионы хлора заряжены отрицательно (-), а остальные — положительно (+).
Таблица 1. Физико-химические свойства ионов натрия и калия
|
Ион |
Радиус, Å |
Координационное число |
Равновесный потенциал, мВ |
Предельная температура гидратации, ºС |
|
Na+ |
0,98 |
6-8 |
+60 |
+20 |
|
K+ |
1,33 |
6 |
-94 |
+70 |
По таблице видно, что натрий и калий в ионизированном состоянии не отличаются друг от друга по заряду, мало отличаются по размеру и числу создаваемых ими координационных связей, но существенно отличаются по величине предельной температуры, то есть той температуры, выше которой разрешена их гидратация (Тпред). Для натрия она составляет +20°С, а для калия +70°С. Таким образом, по крайней мере в диапазоне температур выше +20°С, в котором функционируют большинство живых организмов, натрий легко взаимодействует с молекулами воды, образуя гидратную оболочку, а калий отталкивает воду. Поскольку гидратированный ион натрия близок по размерам к негидратированному иону калия, то в водных растворах ни по заряду, ни по размерам эти ионы не отличаются друг от друга, и наиболее существенным различием для их различения является величина гидрофобности. Количественно эта величина может быть выражена энергией гидратации, которая при комнатной температуре составляет для натрия +1,03 кДж/моль, а для калия – -1,05 кДж/моль. Очевидно, что биологические молекулы могут использовать именно этот параметр для отбора и распознавания этих двух ионов. В частности, липиды хорошо различают Na+и К+, вероятно, именно благодаря различиям в их гидрофобности. Если, например, приготовить пузырьки-везикулы из смеси природных липидов (такой упрощенный прообраз клеточных везикул называют липосомами), то оказывается, что скорость простой диффузии через их мембраны будет в 3–7 раз выше для калия, чем для натрия (в зависимости от состава липидов, ионной силы и других условий). Так что в обычных условиях натрию всегда труднее, чем калию, перемещаться через клеточную мембрану. А клетке, соответственно, легче сдерживать перемещение через её мембрану натрия, чем калия. Калий неудержим!
Однако, и Na+, и К+потенциально способны перемещаться под действием электрических сил туда, где преобладают не положительные, а отрицательные электрические заряды (отрицательно заряженные частицы — анионы).
Итак, имея электрический потенциал, мембрана может перемещать в клетку или из клетки указанные выше заряженные ионы с помощью электрических сил.
Важно понимать, что в нервной системе электрические заряды создаются не электронами, как в металлических проводах, а ионами — химическими частицами, имеющими электрический заряд. Электрический ток в организме и его клетках — это поток ионов, а не электронов, как в проводах. Обратите также внимание на то, что заряд мембраны измеряется изнутри клетки, а не снаружи.
Если говорить уж совсем примитивно просто, то получается, что снаружи вокруг клетки будут преобладать «плюсики», т.е. положительно заряженные ионы, а внутри — «минусики», т.е. отрицательно заряженные ионы. Можно сказать, что внутри клетка электроотрицательна. И теперь нам всего лишь надо объяснить, как это так получилось. Хотя, конечно, неприятно сознавать, что все наши клетки — отрицательные «персонажи». ((
Сущность
Сущность потенциала покоя — это преобладание на внутренней стороне мембраны отрицательных электрических зарядов в виде анионов и недостаток положительных электрических зарядов в виде катионов, которые сосредотачиваются на её наружной стороне, а не на внутренней.
Внутри клетки — «отрицательность», а снаружи — «положительность».
Такое положение вещей достигается с помощью трёх явлений: (1) поведения мембраны, (2) поведения положительных ионов калия и натрия и (3) соотношения химической и электрической силы.
1. Поведение мембраны
В поведении мембраны для потенциала покоя важны три процесса:
1) Обмен внутренних ионов натрия на наружные ионы калия. Обменом занимаются специальные транспортные структуры мембраны: ионные насосы-обменники. Таким способом мембрана перенасыщает клетку калием, но обедняет натрием.
2) Открытые калиевые ионные каналы. Через них калий может как заходить в клетку, так и выходить из неё. Он выходит в основном.
3) Закрытые натриевые ионные каналы. Из-за этого натрий, выведенный из клетки насосми-обменниками, не может вернуться в неё обратно. Натриевые каналы открываются только при особых условиях — и тогда потенциал покоя нарушается и смещается в сторону нуля (это называется деполяризацией мембраны, т.е. уменьшением полярности).
2. Поведение ионов калия и натрия
Ионы калия и натрия по-разному перемещаются через мембрану:
1) Через ионные насосы-обменники натрий насильно выводится из клетки, а калий затаскивается в клетку.
2) Через постоянно открытые калиевые каналы калий выходит из клетки, но может и возвращаться в неё обратно через них же.
3) Натрий «хочет» войти в клетку, но «не может», т.к. каналы для него закрыты.
3. Соотношение химической и электрической силы
По отношению к ионам калия между химической и электрической силой устанавливается равновесие на уровне — 70 мВ.
1) Химическая сила выталкивает калий из клетки, но стремится затянуть в неё натрий.
2) Электрическая сила стремится затянуть в клетку любые положительно заряженные ионы (как натрий, так и калий).
Формирование потенциала покоя
Попробую рассказать коротко, откуда берётся мембранный потенциал покоя в нервных клетках — нейронах. Ведь, как всем теперь известно, наши клетки только снаружи положительные, а внутри они весьма отрицательные, и в них существует избыток отрицательных частиц — анионов и недостаток положительных частиц — катионов.
И вот тут исследователя и студента поджидает одна из логических ловушек: внутренняя электроотрицательность клетки возникает не из-за появления лишних отрицательных частиц (анионов), а наоборот — из-за потери некоторого количества положительных частиц (катионов).
И поэтому сущность нашего рассказа будет заключаться не в том, что мы объясним, откуда берутся отрицательные частицы в клетке, а в том, что мы объясним, каким образом в нейронах получается дефицит положительно заряженных ионов — катионов.
Куда же деваются из клетки положительно заряженные частицы? Напомню, что это ионы натрия — Na+ и калия — K+. Удивительно, но оба этих иона покидают клетку, хотя и разными путями.
С чего начать, чтобы не сбиться и не запутаться? Начнём с калия.
Чтобы легче было запомнить, образно можно сказать так:
«Клетка любит калий!»
или: «клетка копит калий!» (К+)
и «ненавидит натрий» (Na+).
И что же она, клетка, делает с этими ионами? Она их обменивает друг на друга! С помощью специального обменного насоса.
Натрий-калиевый насос
Дело заключается в том, что в мембране нервной клетки постоянно работают насосы-обменники, образованные специальными белками, встроенными в мембрану. Что они делают? Они меняют «собственный» натрий клетки на наружный «чужой» калий. Из-за этого в клетке оказывается в конце концов недостаток натрия, который ушёл на обмен. И в то же время клетка переполняется ионами калия, который в неё натащили эти молекулярные насосы.
Итак: «Клетка любит калий!« (Хотя об истинной любви здесь, разумеется, не может идти и речи!) Поэтому она и затаскивает калий в себя, несмотря на то, что его итак уже полно. Поэтому она невыгодно обменивает его на натрий, отдавая 3 иона натрия за 2 иона калия (любимого). Поэтому она тратит на этот обмен энергию АТФ. И как тратит! До 70% всех энергозатрат нейрона может уходить на работу натрий-калиевых насосов. Вот что делает любовь, пусть даже не настоящая!
Кстати, интересно, что клетка не рождается с потенциалом покоя в готовом виде. Например, при дифференцировке и слиянии миобластов при формировании мышечного волокна потенциал их мембраны изменяется от -10 до -70 mV, т.е. их мембрана становится более электроотрицательной, она поляризуется в процессе дифференцировки. А в экспериментах на мультипотентных мезенхимальных стромальных клетках (ММСК) костного мозга человека искусственная деполяризация ингибировала дифференцировку клеток (Fischer-Lougheed J., Liu J.H., Espinos E. et al. Human myoblast fusion requires expression of functional inward rectifier Kir2.1 channels. Journal of Cell Biology 2001; 153: 677-85; Liu J.H., Bijlenga P., Fischer-Lougheed J. et al. Role of an inward rectifier K+ current and of hyperpolarization in human myoblast fusion. Journal of Physiology 1998; 510: 467-76; Sundelacruz S., Levin M., Kaplan D.L. Membrane potential controls adipogenic and osteogenic differentiation of mesenchymal stem cells. Plos One 2008; 3).
Образно говоря, можно выразиться так:
Создавая потенциал покоя, клетка «заряжается любовью».
Это любовь к двум вещам:
1) любовь клетки к калию,
2) любовь калия к свободе.
Как ни странно, но результат этих двух видов любви — пустота!
Именно она, пустота, создаёт в клетке отрицательный электрический потенциал — потенциал покоя. Точнее, отрицательный потенциал создают пустые места, оставшиеся от убежавшего из клетки калия.
Итак, результат деятельности мембранных ионных насосов-обменников таков:
Натрий-калиевый ионный насос-обменник создаёт три потенциала (возможности):
1. Электрический потенциал — возможность притягивать внутрь клетки любые положительно заряженные частицы (ионы).
2. Ионный натриевый химический потенциал — возможность затягивать внутрь клетки ионы натрия (и именно натрия, а не какого-нибудь другого вещества).
3. Ионный калиевый химический потенциал — возможновть выталкивать из клетки ионы калия (и именно калия, а не какого-нибудь другого вещества).
4. Дефицит натрия (Na+) в клетке.
5. Избыток калия (K+) в клетке.
Можно сказать так: ионные насосы мембраны создают разность концентраций ионов, или градиент (перепад) концентрации, между внутриклеточной и внеклеточной средой.
Именно из-за получившегося дефицита натрия в клетку теперь «полезет» этот самый натрий снаружи. Так всегда ведут себя вещества: они стремятся выровнять свою концентрацию во всём объёме раствора.
И в то же время в клетке получился избыток ионов калия по сравнению с наружной средой. Потому что насосы мембраны накачали его в клетку. И он стремится уравнять свою концентрацию внутри и снаружи, и поэтому стремится выйти из клетки.
Тут ещё важно понять, что ионы натрия и калия как бы «не замечают» друг друга, они реагируют только «на самих себя». Т.е. натрий реагирует на концентрацию натрия же, но «не обращает внимания» на то, сколько вокруг калия. И наоборот, калий реагирует только на концентрацию калия и «не замечает» натрий. Получается, что для понимания поведения ионов в клетке надо по-отдельности сравнивать концентрации ионов натрия и калия. Т.е. надо отдельно сравнить концентрацию по натрию внутри и снаружи клетки и отдельно — концентрацию калия внутри и снаружи клетки, но не имеет смысла сравнивать натрий с калием, как это часто делается в учебниках.
По закону выравнивания концентраций, который действует в растворах, натрий «хочет» снаружи войти в клетку. Но не может, так как мембрана в обычном состоянии плохо его пропускает. Его заходит немножко, и клетка его опять тут же обменивает на наружный калий. Поэтому натрий в нейронах всегда в дефиците.
А вот калий как раз может легко выходить из клетки наружу! В клетке его полно, и она его удержать не может. Так вот он и выходит наружу через особые белковые дырочки в мембране (ионные каналы).
Анализ
От химического — к электрическому
А теперь — самое главное, следите за излагаемой мыслью! Мы должны перейти от движения химических частиц к движению электрических зарядов.
Калий заряжен положительным зарядом, и поэтому он, когда выходит из клетки, выносит из неё не только себя, но и «плюсики» (положительные заряды). На их месте в клетке остаются «минусы» (отрицательные заряды). Это и есть мембранный потенциал покоя!
Мембранный потенциал покоя — это дефицит положительных зарядов (положительно заряженных ионов) внутри клетки, образовавшийся за счёт утечки из клетки положительных ионов калия.
Заключение
Рис. Схема формирования потенциала покоя (ПП). Автор благодарит Попову Екатерину Юрьевну за помощь в создании рисунка.
Составные части потенциала покоя
Потенциал покоя — отрицательный со стороны клетки и состоит как бы из двух частей.
1. Первая часть — это примерно -10 милливольт, которые получаются от неравносторонней работы мембранного насоса-обменника (ведь он больше выкачивает «плюсиков» с натрием, чем закачивает обратно с калием).
2. Вторая часть — это утекающий всё время из клетки калий, утаскивающий положительные заряды из клетки. Он дает большую часть мембранного потенциала, доводя его до -70 милливольт.
Калий перестанет выходить из клетки (точнее, его вход и выход сравняются) только при уровне электроотрицательности клетки в -90 милливольт. Но этому мешает постоянно подтекающий в клетку натрий, который тащит с собой свои положительные заряды. И в клетке поддерживается равновесное состояние на уровне -70 милливольт.
Так что всё дело в натрий-калиевом мембранном насосе-обменнике и последующем вытекании из клетки «лишнего» калия. За счёт потери положительных зарядов при этом вытекании внутри клетки нарастает электроотрицательность. Она-то и есть «мембранный потенциал покоя». Он измеряется внутри клетки и составляет обычно -70 мВ.
Выводы
Говоря образно, «мембрана превращает клетку в «электрическую батарейку» с помощью управления ионными потоками».
Мембранный потенциал покоя образуется за счёт двух процессов:
1. Работа калий-натриевого насоса мембраны.
Новая гипотеза механизма работы Na,K-АТФазы рассматривается здесь: Механизм натрий-калиевого насоса
Работа калий-натриевого насоса, в свою очередь, имеет 2 следствия:
1.1. Непосредственное электрогенное (порождающее электрические явления) действие ионного насоса-обменника. Это создание небольшой электроотрицательности внутри клетки (-10 мВ).
Виноват в этом неравный обмен натрия на калий. Натрия выбрасывается из клетки больше, чем поступает в обмен калия. А вместе с натрием удаляется и больше «плюсиков» (положительных зарядов), чем возвращается вместе с калием. Возникает небольшой дефицит положительных зарядов. Мембрана изнутри заряжается отрицательно (примерно -10 мВ).
1.2. Создание предпосылок для возникновения большой электроотрицательности.
Эти предпосылки — неравная концентрация ионов калия внутри и снаружи клетки. Лишний калий готов выходить из клетки и выносить из неё положительные заряды. Об этом мы скажем сейчас ниже.
2. Утечка ионов калия из клетки.
Из зоны повышенной концентрации внутри клетки ионы калия выходят в зону пониженной концентрации наружу, вынося заодно положительные электрические заряды. Возникает сильный дефицит положительных зарядов внутри клетки. В итоге мембрана дополнительно заряжается изнутри отрицательно (до -70 мВ).
Финал
Итак:
Калий-натриевый насос создает предпосылки для возникновения потенциала покоя. Это — разность в концентрации ионов между внутренней и наружной средой клетки. Отдельно проявляет себя разность концентрации по натрию и разность концентрации по калию. Попытка клетки выравнять концентрацию ионов по калию приводит к потере калия, потере положительных зарядов и порождает электроотрицательность внутри клетки. Эта электроотрицательность составляет большую часть потенциала покоя. Меньшую его часть составляет непосредственная электрогенность ионного насоса, т.е. преобладающие потери натрия при его обмене на калий.
Видео: Мембранный потенциал покоя (Resting membrane potential)
© 2009-2021 Сазонов В.Ф. © 2016-2021 kineziolog.su
Потенциал покоя и потенциал действия
Автор статьи Зыбина А.М.
Мембрана всех живых клеток поляризована. Внутренняя сторона мембраны несет отрицательный заряд по сравнению с межклеточным пространством (рис. 1). Величина заряда, который несет мембрана называется мембранным потенциалом (МП). В невозбудимых тканях МП низкий, и составляет около -40 мВ. В возбудимых тканях он высокий, около -60 — -100 мВ и называется потенциалом покоя (ПП).
Потенциал покоя, как и любой мембранный потенциал формируется за счет избирательной проницаемости клеточной мембраны. Как известно, плазмолемма состоит из липидного бислоя, через который движение заряженных молекул затруднено. Белки, встроенные в мембрану, могут избирательно изменять проницаемость мембраны для различных ионов, в зависимости от приходящих стимулов. При этом, для формирования потенциала покоя ведущую роль играют ионы калия, кроме них важны ионы натрия и хлора.
Рис. 1. Концентрации и распределение ионов с внутренней и внешней стороны мембраны.
Большинство ионов распределяются неравномерно с внутренней и внешней стороны клетки (рис. 1). Внутри клетки концентрация ионов калия выше, а натрия и хлора – ниже, чем снаружи. В состоянии покоя мембрана проницаема для ионов калия и практически непроницаема для ионов натрия и хлора. Несмотря на то, что калий может свободно выходить из клетки, его концентрации остаются неизменными благодаря отрицательному заряду на внутренней стороне мембраны. Таким образом, на калий действуют две силы, находящиеся в равновесии: осмотические (градиент концентрации К+) и электрические (заряд мембраны), благодаря чему число входящих в клетку ионов калия равно выходящим. Движение калия осуществляется через калиевые каналы утечки, открытые в состоянии покоя. Величину заряда мембраны, при которой ионы калия находятся в равновесии можно вычислить по уравнению Нернста:
Ем = Ек = RT / nF ln [ K+]н / [ K+]вн
где Ек — равновесный потенциал для К+; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; n — валентность К+ (+1), [К+н] — [К+вн] — наружная и внутренняя концентрации К+.
Если подставить в уравнение значения из таблицы на рис. 43, то мы получим величину равновесного потенциала, равную примерно -95 мВ. Это значение вписывается в диапазон мембранного потенциала возбудимых клеток. Отличия ПП разных клеток (даже возбудимых) могут возникать по трем причинам:
- отличия внутриклеточной и внеклеточной концентраций ионов калия в разных тканях (в таблице приведены данные по среднестатистическому нейрону);
- натрий-калиевая АТФаза может вносить свой вклад в значение заряда, так как она выводит из клетки 3 Na+ в обмен на 2 К+;
- несмотря на минимальную проницаемость мембраны для натрия и хлора, эти ионы все-таки могут попадать в клетки, хоть и от 10 до 100 раз хуже, по сравнению с калием.
Чтобы учесть проникновение других ионов в клетку существует уравнение Нернста-Гольдмана:
Ем = RT / nF ln Pk[ K+]вн +PNa[ Na+]вн +PCl[ Cl—]н / Pk[ K+]н +PNa[ Na+]н + PCl[ Cl—]вн,
, где Еm — мембранный потенциал; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; РK , PNa и РCl — константы проницаемости мембраны для К+ Na+ и Сl, соответственно; [К+н], [K+вн], [Na+н], [Na+вн], [Сl—н] и [Сl—вн ]- концентрации K+, Na+ и Сl снаружи (н) и внутри (вн) клетки.
Такое уравнение позволяет установить более точную величину ПП. Обычно, мембрана оказывается на несколько мВ менее поляризована, по сравнению с равновесным потенциалом для К+.
Потенциал действия (ПД) может возникать в возбудимых клетках. Если на нерв или мышцу нанести раздражение выше порога возбуждения, то ПП нерва или мышцы быстро уменьшится и на короткий промежуток времени (миллисекунда) произойдет кратковременная перезарядка мембраны: ее внутренняя сторона станет заряженной положительно относительно наружной, после чего восстановится ПП. Это кратковременное изменение ПП, происходящее при возбуждении клетки называется потенциалом действия.
Возникновение ПД возможно благодаря тому, что в отличие от ионов калия, ионы натрия далеки от равновесия. Если подставить в уравнение Нернста натрий вместо калия, то мы получим равновесный потенциал, равный примерно +60 мВ. Во время ПД, происходит кратковременное увеличение проницаемости для Na+. При этом, натрий начнет проникать в клетку под действием двух сил: по градиенту концентрации и по заряду мембраны, стремясь подстроить заряд мембраны под свой равновесный потенциал. Движение натрия осуществляется по потенциал-зависимым натриевым каналам, которые открываются в ответ на смещение мембранного потенциала, после чего сами инактивируются.
Рис. 2. Потенциал действия нервного волокна (А) и изменение проводимости мембраны для ионов натрия и калия (Б).
На записи ПД выглядит как кратковременный пик (рис. 44), имеющий несколько фаз.
- Деполяризация (фаза нарастания) (рис. 44) – увеличение проницаемости для натрия из-за открытия натриевых каналов. Натрий стремится к своему равновесному потенциалу, но не достигает его, так как канал успевает инактивироваться.
- Реполяризация – возвращение заряда к величине потенциала покоя. Помимо калиевых каналов утечки здесь подключаются потенциал-зависимые калиевые каналы (активируются от деполяризации). В это время калий выходит из клетки, возвращаясь к своему равновесному потенциалу.
- Гиперполяризация (не всегда) – возникает в случаях, если равновесный потенциал по калию превышает по модулю ПП. Возвращение к ПП происходит после возвращения к равновесному потенциалу по К+.
Во время ПД происходит изменение полярности заряда мембраны. Фаза ПД, при которой заряд мембраны положителен, называется овершутом (рис. 2).
Для генерации ПД оказывается очень важной система активации и инактивации потенциал-управляемых натриевых каналов (рис. 3). Эти каналы имеют две створки: активационную (М-ворота) и инактивационную (Н-ворота). В состоянии покоя М-ворота открыты, а Н-ворота закрыты. Во время деполяризации мембраны М-ворота быстро открываются, а Н-ворота начинают закрываться. Ток натрия в клетку возможен пока М-ворота уже открыты, а Н-ворота еще не закрылись. Вход натрия приводит к дальнейшей деполяризации клетки, приводя к открытию большего количества каналов и запуская цепочку положительной обратной связи. Деполяризация мембраны будет продолжаться до тех пор, пока все потенциал-управляемые натриевые каналы не окажутся инактивированными, что происходит на пике ПД. Минимальная величина стимула, приводящая к возникновению ПД называется пороговой. Таким образом, возникший ПД будет подчиняться закону «все или ничего» и его величина не будет зависеть от величины стимула, вызвавшего ПД.
Благодаря Н-воротам инактивация канала происходит раньше, чем потенциал на мембране достигнет равновесной величины по натрию. После прекращения поступления натрия в клетку, происходит реполяризация за счет выходящих из клетки ионов калия. При этом к каналам утечки в этом случае подключаются еще и потениал-активируемые калиевые каналы. Во время реполяризации, в быстром натриевом канале быстро закрываются М-ворота. Н-ворота открываются гораздо медленнее и остаются закрытыми еще некоторое время после возвращения заряда к потенциалу покоя. Этот период принято называть периодом рефрактерности.
Рис. 3. Работа потенциал-управляемого натриевого канала.
Концентрации ионов внутри клетки восстанавливает натрий-калиевая АТФаза, которая с затратой энергии в виде АТФ откачивает из клетки 3 иона натрия и закачивает 2 иона калия.
По немиелинизированному волокну или по мембране мышцы потенциал действия распространяется непрерывно. Возникший потенциал действия за счет электрического поля способен деполяризовать мембрану соседнего участка до порогового значения, в результате чего на соседнем участке возникает деполяризация. Главную роль в возникновении потенциала на новом участке мембраны предыдущий участок. При этом на каждом участки сразу после ПД наступает период рефрактерности, за счет которое ПД распространяется однонаправленно. При прочих равных условиях распространение потенциала действия по немиелинизированному аксону происходит тем быстрее, чем больше диаметр волокна. У млекопитающих скорость составляет 1-4 м/с. Поскольку у беспозвоночных животных отсутствует миелин, в гигантских аксонах кальмара скорость ПД может достигать 100 м/c.
По миелинизированному волокну потенциал действия распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах немиелинизированных волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. Потенциал действия, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до порогового значения, что приводит к возникновению в них новых потенциалов действия, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье потенциал действия возбуждает 2-й, 3-й, 4-й и даже 5-й, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Сальтаторное проведение увеличивает скорость проведения ПД 15-20 раз до 120 м/с.
Работа нейронов
Нервная система состоит из нейронов и глиальных клеток. Однако, главную роль в проведении и передаче нервных импульсов играют нейроны. Они получают информацию от множества клеток по дендритам, анализируют ее и передают или не передают на следующий нейрон.
Передача нервного импульса с одной клетки на другую осуществляется с помощью синапсов. Различают два основных типа синапсов: электрические и химические (рис. 4). Задача любого синапса – передать информацию с пресинаптической мембраны (мембрана аксона) на постсинаптическую (мембрана дендрита, другого аксона, мышцы или другого органа-мишени). Большинство синапсов нервной системы образуется между окончанием аксонов и дендритами, которые в области синапса образуют дендритные шипики.
Преимущество электрического синапса состоит в том, что сигнал с одной клетки на другую переходит без задержки. Кроме того, такие синапсы не утомляются. Для этого пре- и постсинаптические мембраны соединены поперечными мостиками, через которые ионы из одной клетки могут перемещаться в другую. Однако, существенным минусом такой системы является отсутствие однонаправленной передачи ПД. То есть, он может передаваться как с пресинаптической мембраны на постсинаптическую, так и наоборот. Поэтому, такая конструкция встречается достаточно редко и в основном – в нервной системе беспозвоночных.
Рис. 4. Схема строения химического и электрического синапсов.
Химический синапс весьма распространен в природе. О устроен сложнее, так как необходима система преобразования электрического импульса в химический сигнал, затем, вновь в электрический импульс. Все это приводит к возникновению синаптической задержки, которая может составить 0,2-0,4 мс. Кроме того, может произойти истощение запасов химического вещества, что приведет к утомлению синапса. Однако, такой синапс обеспечивает однонаправленность передачи ПД, что является его главным преимуществом.
Рис. 5. Схема работы (а) и электронная микрофотография (б) химического синапса.
В состоянии покоя окончание аксона, или пресинаптическое окончание, содержит мембранные пузырьки (везикулы) с нейромедиатором. Поверхность везикул заряжена отрицательно, чтобы предотвратить связывание с мембраной, и покрыта специальными белками, и принимающими участие в высвобождении везикул. В каждом пузырьке находится одинаковое количество химического вещества, которое называется квантом нейромедиатора. Нейромедиаторы весьма разнообразны по химическому строению, однако, большинство из них производятся прямо в окончании. Поэтому, в нем могут находиться системы, для синтеза химического посредника, а также аппарат Гольджи и митохондрии.
Постсинаптическая мембрана содержит рецепторы к нейромедиатору. Рецепторы могут быть в виде как ионных каналов, открывающихся при контакте со своим лигандом (ионотропные), так и мембранными белками, запускающими внутриклеточный каскад реакций (метаботропные). Один нейромедиатор может иметь несколько как ионотропных, так и метаботропных рецепторов. При этом, часть из них может быть возбуждающими, а часть – тормозными. Таким образом, реакцию клетки на нейромедиатор будет определять тип рецептора на ее мембране, и разные клетки могут совершенно по-разному реагировать на одно и то же химическое вещество.
Между пре- и постсинаптической мембраной располагается синаптическая щель, шириной 10-15 нм.
При приходе ПД на пресинаптическое окончание, на нем открываются потенциал-активируемые кальциевые каналы и ионы кальция входят в клетку. Кальций связывается с белками на поверхности везикул, что приводит к их транспортировке к пресинаптической мембране с последующим слиянием мембран. После такого взаимодействия нейромедиатор оказывается в синаптической щели (рис. 5) и может связаться со своим рецептором.
Ионотропные рецепторы – это лиганд-активируемые ионные каналы. Это значит, что канал открывается только в присутствии определенного химического вещества. Для разных нейромедиаторов это могут быть натриевые, кальциевые или хлорные каналы. Ток натрия и кальция вызывает деполяризацию мембраны, поэтому такие рецепторы называют возбуждающими. Хлорный ток приводит к гиперполяризации, что затрудняет генерацию ПД. Следовательно, такие рецепторы называют тормозными.
Метаботропные рецепторы к нейромедиаторам относят к классу рецепторов, ассоцированных с G-белками (GPCR). Эти белки запускают разнообразные внутриклеточные каскады реакций, приводящих в конечном итоге либо к дальнейшей передачи возбуждения, либо к торможению.
После передачи сигнала необходимо быстро удалить нейромедиатор из синаптической щели. Для этого в щели присутствуют либо ферменты расщепляющие, нейромедиатор, либо на пресинаптическом окончании или соседних глиальных клетках могут располагаться транспортеры, закачивающие медиатор в клетки. В последнем случае он может использоваться повторно.
Каждый нейрон получает импульсы от 100 до 100 000 синапсов. Одиночная деполяризация на одном дендрите не приведет к дальнейшей передаче сигнала. На нейрон могут приходит одновременно множество как возбуждающих, так и тормозных стимулов. Все они суммируются на соме нейрона. Такая суммация называется пространственной. Далее, может возникнуть или не возникнуть (в зависимости от пришедших сигналов) ПД в области аксонного холмика. Аксонный холмик – это область аксона, примыкающая к соме и обладающая минимальным порогом ПД. Далее импульс распространяется по аксону, конец которого может сильно ветвиться и образовывать синапсы со множеством клеток. Помимо пространственной, существует временная суммация. Она происходит в случае, поступления часто повторяющихся импульсов от одного дендрита.
Помимо классических синапсов между аксонами и дендритами или их шипиками, существуют также синапсы, модулирующие передачу в других синапсах (рис. 6). К ним относят аксо-аксональные синапсы. Такие синапсы способны усиливать или тормозить синаптическую передачу. То есть, если на окончание аксона, образующего аксо-шипиковый синапс, пришел ПД, а в это время по аксо-аксональному синапсу на него пришел тормозный сигнал, высвобождения нейромедиатора в аксо-шипиковом синапсе не произойдет. Аксо-дендритные синапсы могут изменять проведение мембраной ПД на пути от шипика к соме клетки. Также существуют аксо-соматические синапсы, которые могут влиять на суммацию сигнала в области сомы нейрона.
Таким образом, существует огромное многообразие различных синапсов, отличающихся по составу нейромедиаторов, рецепторов и их местоположению. Все это обеспечивает разнообразие реакций и пластичность нервной системы.
Рис. 6. Разнообразие синапсов в нервной системе.


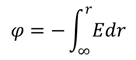
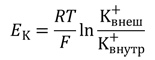
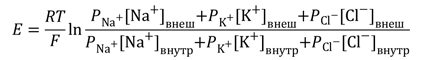
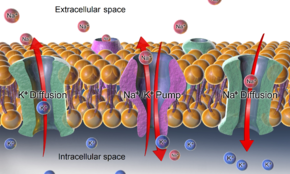
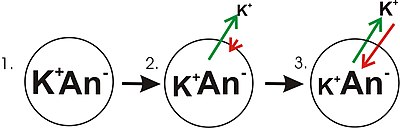

![E_{eq,K^+} = frac{RT}{zF} ln frac{[K^+]_{o}}{[K^+]_{i}} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)
![E_{{eq,K^{+}}}=61.54mVlog {frac {[K^{+}]_{{o}}}{[K^{+}]_{{i}}}},](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d0b62ffda044574b1a52306113028c6a29c89f2)
![E_{{m}}={frac {RT}{F}}ln {left({frac {P_{{Na^{+}}}[Na^{+}]_{{o}}+P_{{K^{+}}}[K^{+}]_{{o}}+P_{{Cl^{-}}}[Cl^{-}]_{{i}}}{P_{{Na^{+}}}[Na^{+}]_{{i}}+P_{{K^{+}}}[K^{+}]_{{i}}+P_{{Cl^{-}}}[Cl^{-}]_{{o}}}}right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aef443116c02ee0a29c6f4d6f5a5fc571e530ec8)


