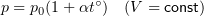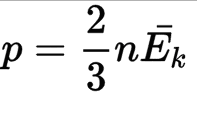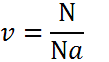2.1. Основные понятия и формулы
Количество
вещества
—
число структурных элементов (молекул,
атомов, ионов и т. п.), содержащихся в
теле или системе. Количество вещества
выражается в молях. Моль равен количеству
вещества системы, содержащей столько
же структурных элементов, сколько
содержится атомов в
0,012
кг изотопа углерода 12C.
Количество вещества тела (системы)
,
где
N
—
число структурных элементов (молекул,
атомов, ионов и т.п.), составляющих тело
(систему). Постоянная Авогадро NА=6,021023
моль-1.
Молярная масса вещества ,
где
m—масса
однородного тела (системы);
—количество
вещества (число молей) этого тела
(системы). Выражается в единицах г/моль
(или кг/моль).
Единица
массы, равная 1/12 массы атома углерода
12C,
называется атомной единицей массы
(а.е.м.). Массы атомов или молекул выраженные
в атомных единицах массы называют
соответственно относительной атомной
или относительной молекулярной массой
вещества. Относительная молекулярная
масса вещества состоит из относительных
атомных масс химических элементов,
составляющих молекулу вещества.
Относительные атомные массы химических
элементов приводятся в таблице Д. И.
Менделеева (см. также таблицу 8 приложения
данного пособия).
Молярная
масса вещества численно равна относительной
атомной или молекулярной массе данного
вещества, если размерность а.е.м. заменить
на размерность г/моль.
Количество вещества смеси n газов
или
,
где
νi,
Ni,
mi,
i
—
соответственно количество вещества,
число молекул, масса и молярная масса
i-го
компонента смеси (i=1,2,…,n).
Уравнение
Менделеева
—
Клапейрона (уравнение состояния
идеального газа)
,
где
т
—
масса газа,
—
молярная масса газа, R
—
универсальная газовая постоянная, ν
—
количество вещества, Т
—
термодинамическая температура.
Опытные
газовые законы, являющиеся частными
случаями уравнения Менделеева
—
Клапейрона для изопроцессов:
а)
закон Бойля—Мариотта
(изотермический процесс: T=const,
m=const)
или
для двух состояний газа, обозначенных
цифрами 1 и 2,
,
б)
закон Гей-Люссака (изобарический процесс:
р=const,
m=const)
или
для двух состояний
,
в)
закон Шарля (изохорический процесс:
V=const,
m=const)
или
для двух состояний
,
г)
объединенный газовый закон (m=const)
или
для двух состояний
.
Под
нормальными условиями понимают давление
po=1
атм (1,013105
Па), температуру 0оС
(T=273
K).
Закон
Дальтона, определяющий давление смеси
n
газов.
,
где
pi
—
парциальные давления компонентов смеси
(i=1,2,…,n).
Парциальным
давлением называется давление газа,
которое производил бы этот газ, если бы
только он один находился в сосуде,
занятом смесью.
Молярная масса смеси n газов
.
Массовая
доля i-го
компонента смеси газа (в долях единицы
или процентах)
,
где
т
—
масса смеси.
Концентрация молекул
,
где
N
—
число молекул, содержащихся в данной
системе;
—
плотность вещества в системе;
V
—
объем системы. Формула справедлива не
только для газов, но и для любого
агрегатного состояния вещества.
Уравнение
Ван-дер-Ваальса для реального газа
,
где
a
и b
—
коэффициенты Ван-дер-Ваальса
Для
идеального газа уравнение Ван-дер-Ваальса
переходит в уравнение Менделеева
—
Клапейрона.
Основное уравнение
молекулярно — кинетической теории газов
,
где
п
—
средняя кинетическая энергия
поступательного движения молекулы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
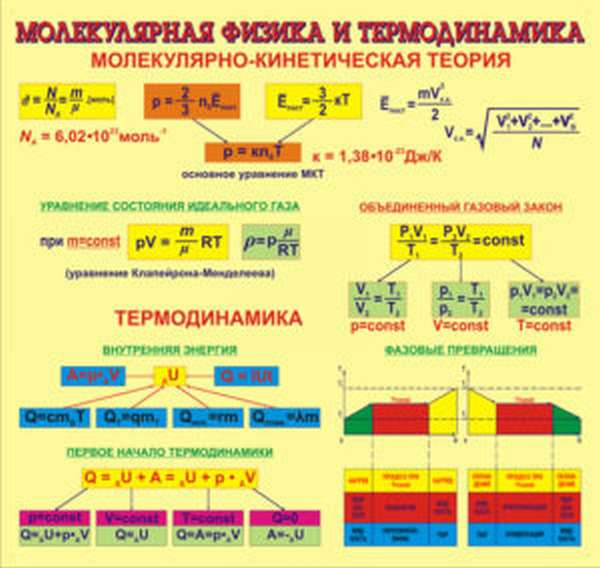
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 


Формула относительной молекулярной массы
Здесь 


Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 




Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 




Формулы средней квадратичной скорости молекул
Здесь 


Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 



Формула средней кинетической энергии молекул
Здесь 


Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 


Объединенный газовый закон — уравнение Клапейрона
при
Здесь 



Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 



Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 




Закон Шарля
при
Здесь V — объем газа 


Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 



Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 


Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 

Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
к адиабатному: при Q = 0
Здесь Т — абсолютная температура (К), 

Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 





Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 



Коэффициент полезного действия идеального теплового двигателя
Здесь 


Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы:
Молекулярная физика изучает свойства тел, руководствуясь поведением отдельных молекул. Все видимые процессы протекают на уровне взаимодействия мельчайших частиц, то, что мы видим невооруженным глазом — лишь следствие этих тонких глубинных связей….
Основные понятия
Она изучает взаимодействие тел на молекулярном уровне, руководствуясь статистическим методом, который определяет закономерности в хаотических движениях минимальных частиц – молекул. Молекулярная физика и термодинамика дополняют друг друга, рассматривая процессы с разных точек зрения. При этом термодинамика не касается атомарных процессов, имея дело только с макроскопическими телами, а молекулярная физика, напротив, рассматривает любой процесс именно с точки зрения взаимодействия отдельных структурных единиц.
Все понятия и процессы имеют собственные обозначения и описываются специальными формулами, которые наиболее наглядно представляют взаимодействия и зависимости тех или иных параметров друг от друга. Процессы и явления пересекаются в своих проявлениях, разные формулы могут содержать одни и те же величины и быть выражены разными способами.
Количество вещества
Количество вещества определяет взаимосвязь между весом (массой) и количеством молекул, которые содержит эта масса. Дело в том, что разные вещества при одинаковой массе имеют разное число минимальных частиц. Процессы, проходящие на молекулярном уровне, могут быть поняты только при рассмотрении именно числа атомных единиц, участвующих во взаимодействиях. Единица измерения количества вещества, принятая в системе СИ, — моль.
Внимание! Один моль всегда содержит одинаковое количество минимальных частиц. Это число называется числом (или постоянной) Авогадро и равняется 6,02×1023.
Эта константа используется в случаях, когда для расчетов требуется учитывать микроскопическое строение данного вещества. Иметь дело с количеством молекул сложно, так как придется оперировать огромными числами, поэтому используется моль – число, определяющее количество частиц в единице массы.
Формула, определяющая количество вещества:
Расчет количества вещества производится в разных случаях, используется во многих формулах и является важным значением в молекулярной физике.
Давление газа
Давление газа — важная величина, имеющая не только теоретическое, но и практическое значение. Рассмотрим формулу давления газа, используемую в молекулярной физике, с пояснениями, необходимыми для лучшего понимания.
Для составления формулы придется сделать некоторые упрощения. Молекулы представляют собой сложные системы, имеющие многоступенчатое строение. Для простоты рассмотрим газовые частицы в определенном сосуде как упругие однородные шарики, не взаимодействующие друг с другом (идеальный газ).
Скорость движения минимальных частиц также будем считать одинаковой. Введя такие упрощения, не сильно меняющие истинное положение, можно вывести такое определение: давление газа — это сила, которую оказывают удары молекул газа на стенки сосудов.
При этом, учитывая трехмерность пространства и наличие двух направлений каждого измерения, можно ограничить количество структурных единиц, воздействующих на стенки, как 1/6 часть.
Таким образом, сведя воедино все эти условия и допущения, можем вывести формулу давления газа в идеальных условиях.
Формула выглядит так:
где P — давление газа,
n — концентрация молекул,
K — постоянная Больцмана (1,38×10-23),
Ek — кинетическая энергия молекул газа.
Существует еще один вариант формулы:
P = nkT,
где n — концентрация молекул,
T — абсолютная температура.
Формула объема газа
Объем газа — это пространство, которое занимает данное количество газа в определенных условиях. В отличие от твердых тел, имеющих постоянный объем, практически не зависящий от окружающих условий, газ может менять объем в зависимости от давления или температуры.
Формула объема газа – это уравнение Менделеева-Клапейрона, которое выглядит таким образом:
PV = nRT
где P — давление газа,
V — объем газа,
n — число молей газа,
R — универсальная газовая постоянная,
T — температура газа.
Путем простейших перестановок получаем формулу объема газа:
Важно! Согласно закону Авогадро равные объемы любых газов, помещенные в совершенно одинаковые условия — давление, температура — будут всегда содержать равное количество минимальных частиц.
Кристаллизация
Кристаллизация — это фазовый переход вещества из жидкого в твердое состояние, т.е. процесс, обратный плавлению. Процесс кристаллизации происходит с выделением теплоты, которую требуется отводить от вещества. Температура совпадает с точкой плавления, весь процесс описывается формулой:
Q = λm,
где Q — количество теплоты,
λ — теплота плавления,
M — масса.
Эта формула описывает как кристаллизацию, так и плавление, поскольку они, по сути, являются двумя сторонами одного процесса. Для того чтобы вещество кристаллизовалось, необходимо охладить его до температуры плавления, а затем отвести количество тепла, равное произведению массы на удельную теплоту плавления (λ). Во время кристаллизации температура не меняется.
Существует еще один вариант понимания этого термина — кристаллизация из перенасыщенных растворов. В этом случае причиной перехода становится не только достижение определенной температуры, но и степень насыщения раствора определенным веществом. На определенном этапе количество частиц растворенного вещества становится слишком большим, что вызывает образование мелких монокристалликов. Они присоединяют молекулы из раствора, производя послойный рост. В зависимости от условий роста кристаллы имеют различную форму.
Число молекул
Определить количество частиц, содержащееся в данной массе вещества, проще всего при помощи следующей формулы:
Отсюда выходит, что число молекул равняется:
То есть необходимо прежде всего определить количество вещества, приходящееся на определенную массу. Затем оно умножается на число Авогадро, в результате чего получаем количество структурных единиц. Для соединений подсчет ведется суммированием атомного веса компонентов. Рассмотрим простой пример:
Определим количество молекул воды в 3 граммах. Формула воды (H2O) содержит два атома водорода и один кислорода. Общий атомный вес минимальной частицы воды составит: 1+1+16 = 18 г/моль.
Количество вещества в 3 граммах воды:
3:18= 1/6.
Число молекул:
1/6 × 6 × 1023 = 1023.
Формула массы молекулы
Один моль всегда содержит одинаковое количество минимальных частиц. Следовательно, зная массу моля, можно разделить ее на количество молекул (число Авогадро), получив в результате массу системной единицы.
Следует учесть, что эта формула относится лишь к неорганическим молекулам. Размеры органических молекул намного больше, их величина или вес имеют совсем другие значения.
Молярная масса газа
Молярная масса — это масса в килограммах одного моля вещества. Поскольку в одном моле содержится одинаковое количество структурных единиц, формула молярной массы имеет такой вид:
M = κ × Mr
где k — коэффициент пропорциональности,
Mr — атомная масса вещества.
Молярная масса газа может быть рассчитана по уравнению Менделеева-Клапейрона:
pV = mRT / M,
из которой можно вывести:
M = mRT / pV
Таким образом, молярная масса газа прямо пропорциональна произведению массы газа на температуру и универсальную газовую постоянную и обратно пропорциональна произведению давления газа и его объема.
Внимание! Следует учесть, что молярная масса газа как элемента может отличаться от газа как вещества, например, молярная масса элемента кислорода (О) равна 16 г/моль, а масса кислорода как вещества (О2) равна 32 г/моль.
Основные положения МКТ.
Физика за 5 минут молекулярная физика
lt,span data-mce-type=bookmark style=display: inline-block, width: 0px, overflow: hidden, line-height: 0, class=mce_SELRES_startgt,lt,/spangt,
Вывод
Формулы, которые содержат молекулярная физика и термодинамика, позволяют вычислить количественные значения всех процессов, происходящих с твердыми веществами и газами. Такие расчеты необходимы как в теоретических изысканиях, так и на практике, поскольку они способствуют решению практических задач.
Основные формулы молекулярной физики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
В кодификаторе ЕГЭ нет тем, непосредственно относящихся к содержанию данного листка. Однако без этого вводного материала дальнейшее изучение молекулярной физики невозможно.
Введём основные величины молекулярной физики и соотношения между ними.
— масса вещества,
— объём вещества,
— плотность вещества (масса единицы объёма). Отсюда
— число частиц вещества (атомов или молекул).
— масса частицы вещества. Тогда
— концентрация вещества (число частиц в единице объёма),
. Отсюда
Что получится, если умножить на
? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т. е. плотность. Формально:
Итак,
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка г, размер атома порядка
см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в граммах углерода. А в
граммах углерода содержится примерно
атомов. Стало быть, в одном моле вещества содержится
частиц. Это число называется постоянной Авогадро:
моль
.
Количество вещества обозначается . Это число молей данного вещества.
Что получится, если умножить на
? Число молей, умноженное на число частиц в моле, даст общее число частиц:
Масса одного моля вещества называется молярной массой этого вещества и обозначается (
= кг/моль). Ясно, что
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия
, поэтому молярная масса алюминия равна
г/моль или
кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна г/моль по определению. В то же время ядро атома углерода содержит
нуклонов. Выходит, что каждый нуклон вносит в молярную массу
г/моль. Поэтому молярная масса химического элемента с атомной массой
оказывается равной
г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа равна
г/моль
кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна г/моль, поскольку его молекула состоит из двух атомов
. То же касается часто встречающихся в задачах азота и кислорода
Вместе с тем, наиболее частый персонаж задач — гелий
— является одноатомным газом и имеет молярную массу
г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку 
Что получится, если умножить на
? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Основные формулы молекулярной физики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023