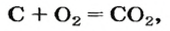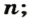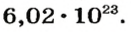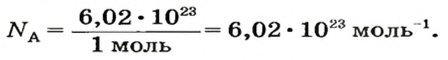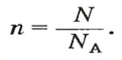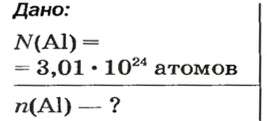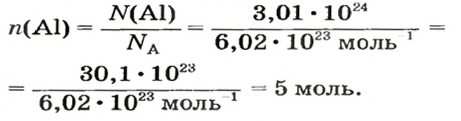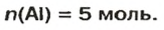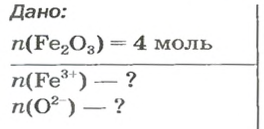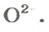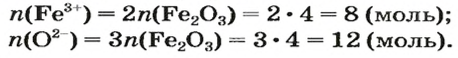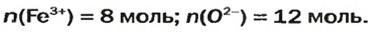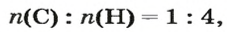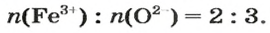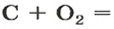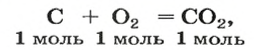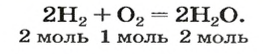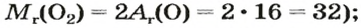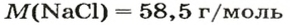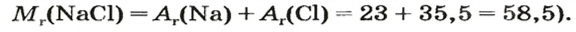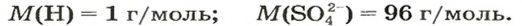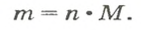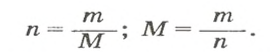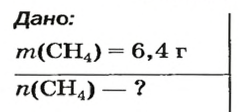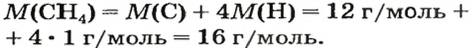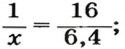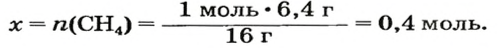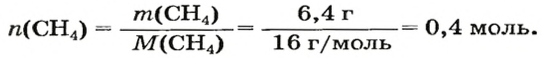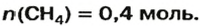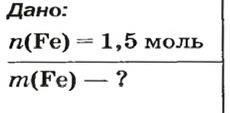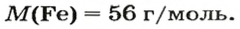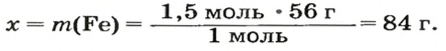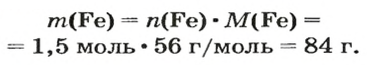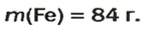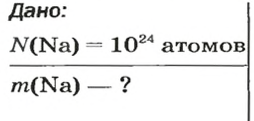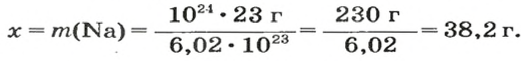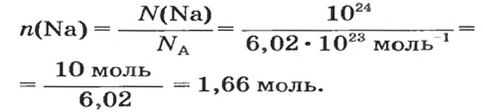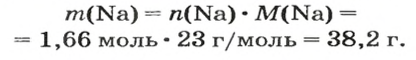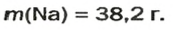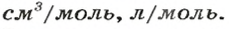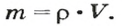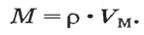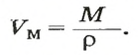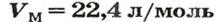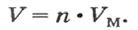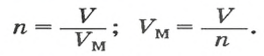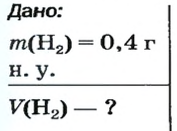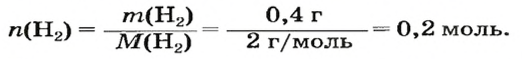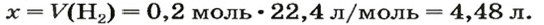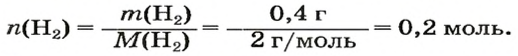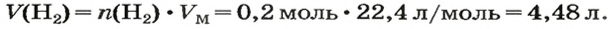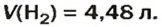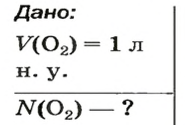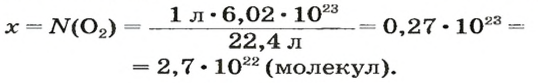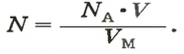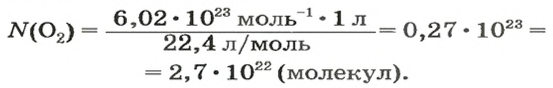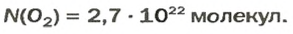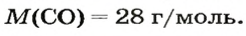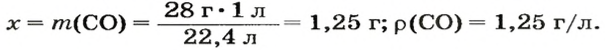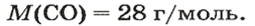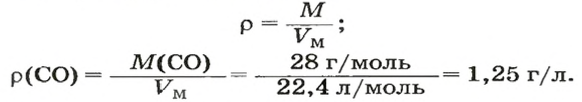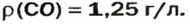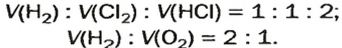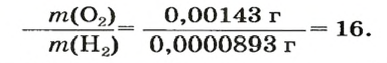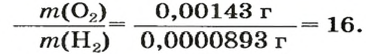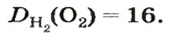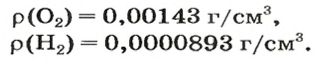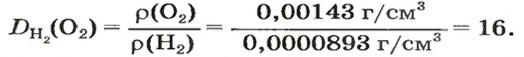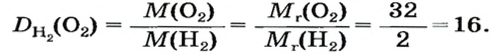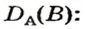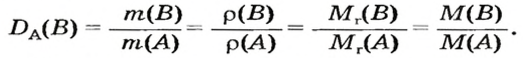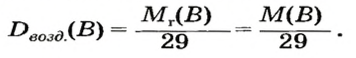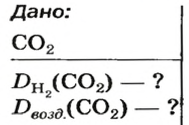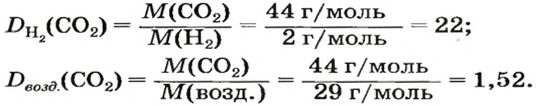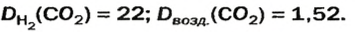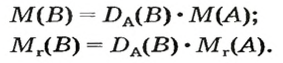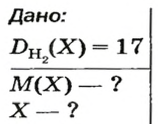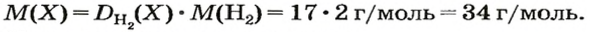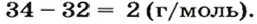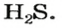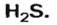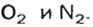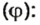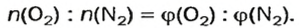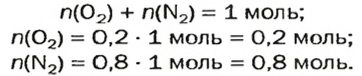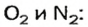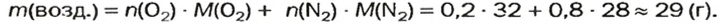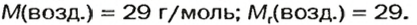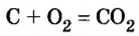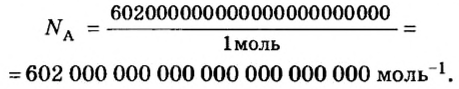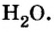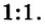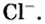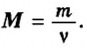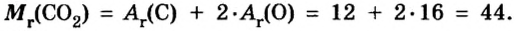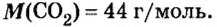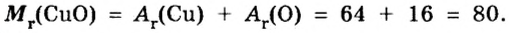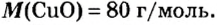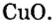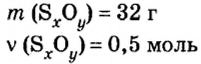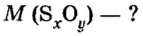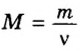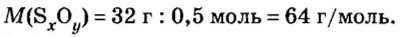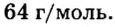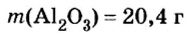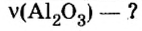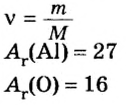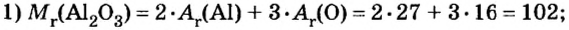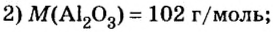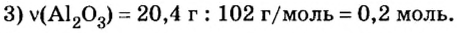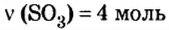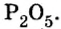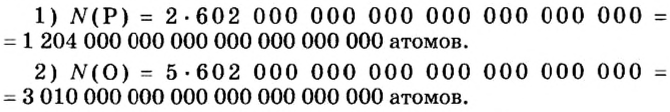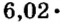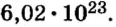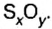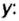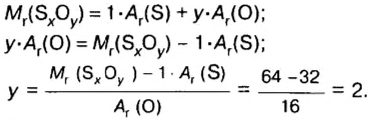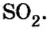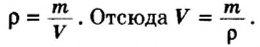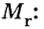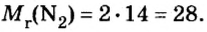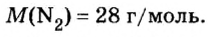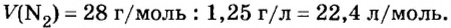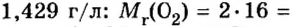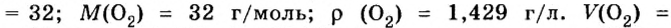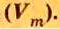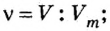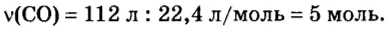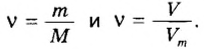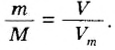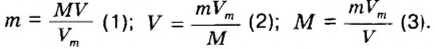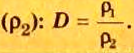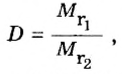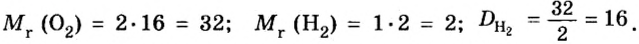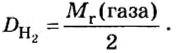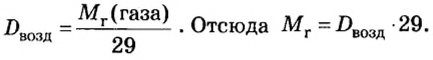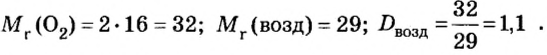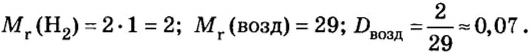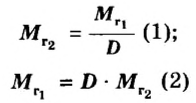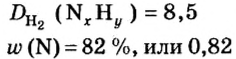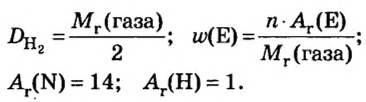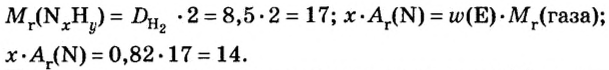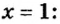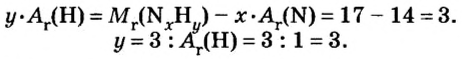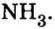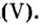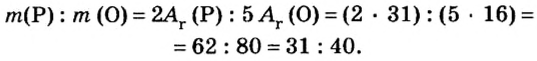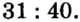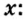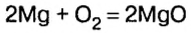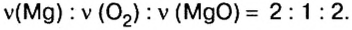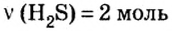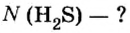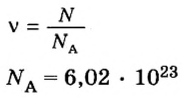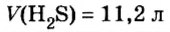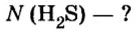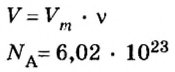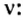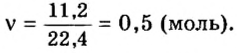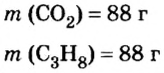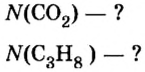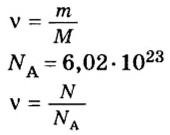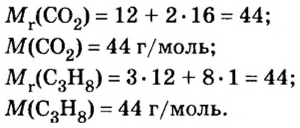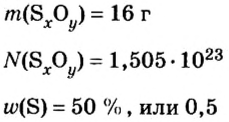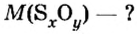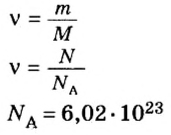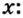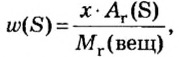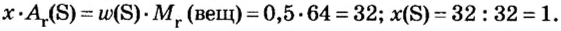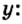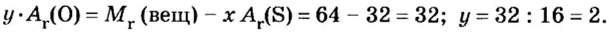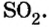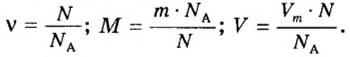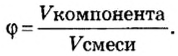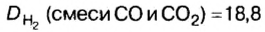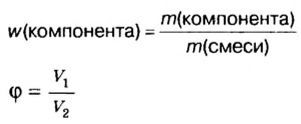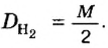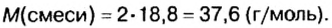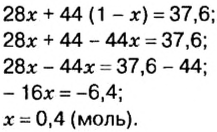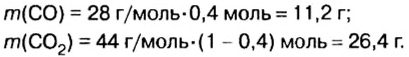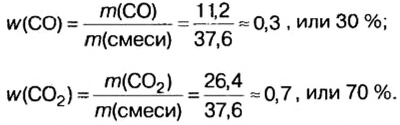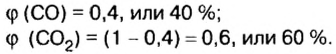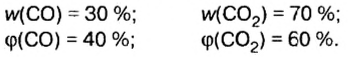Итак, количество вещества в химии обозначается греческой буквой «ню».
Помню, как в 9-м классе мой учитель физики Игорь Юрьевич учил меня правильно писать букву «ню». До этого она у меня получалась немного коряво.
Но поскольку на БВ не проходят греческие буквы, я буду обозначать количество вещества латинской буквой v. Латинская v очень похожа на греческую «ню».
Рассмотрим следующие случаи.
1) Если нам известно количество частиц вещества, то количество вещества можно найти по формуле:
v = n/NA
где
v — количество вещества;
n — количество частиц вещества. Это безразмерная величина, то есть это просто число. Правда, это число бывает очень большим, например, 5*(10^24).
NA — постоянная Авогадро. Постоянная Авогадро представляет собой универсальную константу. NA = 6,022*(10^23) моль^(–1).
2) Если нам известна масса вещества, то количество вещества находится по следующей формуле:
v = m/M
где
v — количество вещества;
m — масса вещества;
M — молярная масса вещества находится по химической формуле вещества, при помощи периодической системы Д. И. Менделеева, путём суммирования атомных масс всех входящих в молекулу атомов с учётом имеющихся индексов.
3) Если нам известен объём газообразного вещества, то мы можем найти количество вещества газа по такой формуле:
v = V/Vm
где
v — количество вещества;
V — объём газа;
Vm — молярный объём газов. Молярный объём газов — это универсальная константа. Vm = 22,414 л/моль = 22414 м3/моль.
Повторюсь, что формула v = V/Vm верна только для газов!
Наконец, рассмотрим Ваш случай.
Вам по условию даны объём и объёмная доля.
Я рискну предположить, что у Вас задача примерно такого рода:
«Объём газовой смеси составляет 240 л. Объёмная доля кислорода в смеси равна 45%. Вычислите количество вещества кислорода в смеси».
Такая задача решается в два действия.
1) Находим объём кислорода:
V (O2) = V0 * ф / 100 = 240 л * 45 / 100 = 108 л.
(Ф — это объёмная доля, она обозначается греческой буквой «фи». Вместо неё приходится писать русскую ф).
2) Находим количество вещества кислорода. Кислород — это газ, значит, мы имеем право воспользоваться формулой v = V/Vm.
v (O2) = V/Vm = 108 л : 22,414 л/моль = 4,818 моль. Округление произведено до тысячных.
Как найти моль вещества
В химии широко используется понятие «моль». Это такое количество вещества, в котором содержится приблизительно 6,02214*10^23 его элементарных частиц — молекул, ионов или атомов. Для облегчения расчетов это огромное число, которое называется числом Авогадро, часто округляют до 6,022*10^23. Моль измеряется в граммах.

Инструкция
Чтобы найти моль вещества, нужно запомнить очень простое правило: масса одного моля любого вещества численно равна его молекулярной массе, только выражается в других величинах. А как определяется молекулярная масса? С помощью таблицы Менделеева вы узнаете атомную массу каждого элемента, входящего в состав молекулы вещества. Далее нужно сложить атомные массы с учетом индекса каждого элемента и получится ответ.
Например, широко используемое в сельском хозяйстве удобрение, аммиачная селитра (или по-другому аммоний азотнокислый). Формула этого вещества NH4NO3. Как определить, чему равен его моль? Прежде всего запишите эмпирическую (то есть общую) формулу вещества: N2H4O3.
Посчитайте его молекулярную массу с учетом индекса каждого элемента: 12*2 + 1*4 + 16*3 = 76 а.е.м. (атомных единиц массы). Следовательно, его молярная масса (то есть масса одного моля) также составляет 76, только ее размерность: грамм/моль. Ответ: один моль аммиачной селитры весит 76 грамм.
Предположим, вам задана такая задача. Известно, что масса 179,2 литров какого-то газа составляет 352 грамма. Необходимо определить, сколько весит один моль этого газа. Известно, что при нормальных условиях один моль любого газа или смеси газов занимает объем, приблизительно равный 22,4 литра. А у вас 179,2 литра. Произведите вычисление: 179,2/22,4 = 8. Следовательно, в этом объеме содержится 8 молей газа.
Разделив известную по условиям задачи массу на количество молей, получите: 352/8 = 44. Следовательно, один моль этого газа весит 44 грамма — это углекислый газ, СО2.
Если имеется какое-то количество газа массой М, заключенное в объеме V при заданной температуре Т и давлении P. Требуется определить его молярную массу (то есть найти, чему равен его моль). Решить задачу вам поможет универсальное уравнение Менделеева-Клапейрона: PV = MRT/m, где m – та самая молярная масса, которую нам надо определить, а R – универсальная газовая постоянная, равная 8,31. Преобразуя уравнение, получите: m = MRT/PV. Подставив в формулу известные величины, вы найдете, чему равен моль газа.
Полезный совет
В расчетах обычно используются округленные величины атомных весов элементов. Если требуется более высокая точность, то округление недопустимо.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Архив уроков › Основные законы химии
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023молекул. Однако чаще всего моль применяют именно к молекулам.
Расчёты в смеси
Задачу можно усложнить, попробовав посчитать этот показатель в смеси, где в разных пропорциях входят различные соединения. Идеальным примером для этого является воздух. В нем можно выделить следующие составляющие:
Искомый параметр будет вычисляться следующим образом: 0,23*32+0,76*28+0,01*40. Результат равен 29,04 г/моль (можно округлить до 29).
Конечно, в воздухе содержатся и другие вещества (углекислый и инертные газы, водород и т. д. ), но их масса составляет менее десятой процента, поэтому для простоты их допускается не учитывать.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
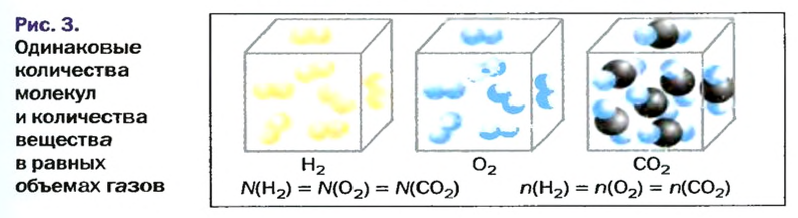
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Определение в сложных веществах
Для простых веществ, состоящих из одного атома, параметр считается так же, как для элемента. Молярная масса углерода всегда равна 12. Этот показатель справедлив и для натрия. Как простое вещество, этот мягкий серебристо-белый металл содержит в себе 23 г/моль, а купрум (так на латинском обозначается медь) — 63,5 г/моль. Газ также может состоять из одного элемента, например, гелий, искомый параметр которого 4 г/моль.
Но существуют и газы, которые образованы двумя молекулами (водород, азот, кислород, хлор, фтор и другие) или тремя (озон). Для них нужно не забывать умножать атомную массу на число молекул. Для сложных веществ параметр можно рассчитать аналогичным образом:
- В H2O содержится два атома водорода и один кислорода, результат считается как 2 * 1 + 16. Итоговое значение молярной массы воды равно 18. Этот параметр для углекислого газа CO2 равен 44 (сумма массы углерода 12 и двух атомов кислорода 32), а для сернистого газа SO2 — 64 г/моль.
- Органическое вещество метан, формула которого CH4, состоит из одного атома углерода и четырёх водорода, следовательно, ему свойственно значение 16. А у этана, содержащего на одну группу CH2 больше, масса равняется 30 г/моль.
- В аммиаке NH3 — 17 г/моль.
- В соляной кислоте HCl содержится 36,5 г/моль (обычно атомную массу хлора считают как 35,5, тогда как для многих других элементов её чаще округляют до целого значения). В хорошо известной калиевой щёлочи KOH — 56 г/моль.
- В натриевой соли серной кислоты Na2SO4, как следует из химической формулы, находится 142 г/моль, а в алюминиевой (Al2 (SO4)3) — 342 г/моль. В азотнокислом серебре AgNO3 — 170 г/моль, в хлориде калия KCl — 74,5 г/моль.
- В молекуле сахара, как в быту называют сахарозу, содержится 12 атомов углерода, 22 водорода и 11 кислорода, а это значит, что его масса равна 342 г/моль. В глюкозе 6, 12 и 6 атомов углерода, водорода и кислорода соответственно, а параметр равен 180 г/моль.
Исходя из этого, формулу молярной массы можно вывести следующим образом: М (XxYy) = М (Хx) + М (Yy) = x * М (Х) + y * М (Y). Таким образом, вычислить этот параметр для любого органического или неорганического вещества совсем несложно.
Главное, иметь под рукой таблицу Менделеева, тогда никакие онлайн-калькуляторы не потребуются.
Как посчитать вес зная объем и плотность
Задача № 1. Найдите плотность молока, если 206 г молока занимают объем 200 см 3 ?
Задача № 2. Определите объем кирпича, если его масса 5 кг?
Задача № 3. Определите массу стальной детали объёмом 120 см 3
Задача № 4. Размеры двух прямоугольных плиток одинаковы. Какая из них имеет большую массу, если одна плитка чугунная, другая — стальная?
Решение: Из таблицы плотности веществ (см. в конце страницы) определим, что плотность чугуна (ρ2 = 7000 кг/м 3 ) меньше плотности стали (ρ1 = 7800 кг/м 3 ). Следовательно, в единице объема чугуна содержится меньшая масса, чем в единице объема стали, так как чем меньше плотность вещества, тем меньше его масса, если объемы тел одинаковы.
Задача № 5. Определите плотность мела, если масса его куска объемом 20 см 3 равна 48 г. Выразите эту плотность в кг/м 3 и в г/см 3 .
Ответ: Плотность мела 2,4 г/см 3 , или 2400 кг/м 3 .
Задача № 6. Какова масса дубовой балки длиной 5 м и площадью поперечного сечения 0,04 м 2 ?
ОТВЕТ: 160 кг.
РЕШЕНИЕ. Из формулы для плотности получаем m = p • V. С учетом того, что объем балки V = S • l , получаем: m = p • S • l.
Вычисляем: m = 800 кг/м 3 • 0,04 м 2 • 5 м = 160 кг.
Задача № 7. Брусок, масса которого 21,6 г, имеет размеры 4 х 2,5 х 0,8 см. Определить, из какого вещества он сделан.
ОТВЕТ: Брусок сделан из алюминия.
Задача № 8 (повышенной сложности). Полый медный куб с длиной ребра а = 6 см имеет массу m = 810 г. Какова толщина стенок куба?
ОТВЕТ: 5 мм.
РЕШЕНИЕ: Объем кубика VK = а 3 = 216 см 3 . Объем стенок VС можно вычислить, зная массу кубика mК и плотность меди р: VС = mК / р = 91 см 3 . Следовательно, объем полости VП = VK — VC = 125 см 3 . Поскольку 125 см 3 = (5 см) 3 , полость является кубом с длиной ребра b = 5 см. Отсюда следует, что толщина стенок куба равна (а — b)/2 = (6 – 5)/2 = 0,5 см.
Задача № 9 (олимпиадный уровень). Масса пробирки с водой составляет 50 г. Масса этой же пробирки, заполненной водой, но с куском металла в ней массой 12 г составляет 60,5 г. Определите плотность металла, помещенного в пробирку.
ОТВЕТ: 8000 кг/м 3
РЕШЕНИЕ: Если бы часть воды из пробирки не вылилась, то в этом случае общая масса пробирки, воды и куска металла в ней была бы равна 50 г + 12 г = 62 г. По условию задачи масса воды в пробирке с куском металла в ней равна 60,5 г. Следовательно, масса воды, вытесненной металлом, равна 1,5 г, т. е. составляет 1/8 массы куска металла. Таким образом, плотность металла в 8 раз больше плотности воды.
Задачи на плотность, массу и объем с решением. Таблица плотности веществ.
Справочный материал «Задачи на плотность, массу и объем»
Конспект урока «Задачи на плотность, массу и объем с решением».
Источник: uchitel.pro
Концентрации и доли. Как перевести одну концентрацию в другую.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% — 21% — 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Ответ:
Потому что в формуле расчёта молярной концентрации участвует объём раствора, а жидкости, как известно, в большинстве своём расширяются с ростом температуры.
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} | large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | |||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} | = | ||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | |||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | |||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | ||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Похожие записи:
Теоретическая выкладка
Ещё в Древней Греции учёные знали формулу определения объема вещей в зависимости от массы и плотности. Так Архимед открыл закон, названный его именем. Почему же ведро с водой поднять заметно легче, чем с песком? Всё объясняется различной плотностью веществ. В единице объёма песка больше вещества, чем в воде, значит, он плотнее жидкой субстанции.
Структура практически всех окружающих субстанций неравномерна, а значит, и концентрация массы в единице веществ отличается, но незначительно. В задачах этой разницей пренебрегают.
Плотностью называется величина, получаемая вследствие разделения массы объекта на занимаемое им пространство. В физике имеет вид:
ρ = m/V, ρ – читается как «ро».
В системе СИ измеряется в кг/м³, на практике применяются кратные и дольные единицы измерения, например, см/кг3.
В физике существует несколько трактовок или типов плотностей:
- объёмная – рассматриваемая величина;
- поверхностная – отношение веса к площади;
- линейная – указывает на обратную пропорциональность массы к длине, применяется в двухмерных вычислениях;
- плотность электрического заряда.
Относительно к газам формула видоизменяется:
ρ = M / Vm, здесь, M и Vm – молярные масса с объёмом соответственно.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Количество вещества
Несколько столетий тому назад алхимики, готовясь к различным опытам и после их проведения, нередко взвешивали вещества, определяли их объемы. После открытия М. В. Ломоносовым и А. Л. Лавуазье закона сохранения массы веществ при химических реакциях химия начала быстро развиваться, обретая статус точной науки. Расчеты стали неотъемлемой частью химических исследований.
Вы уже знаете, что вещества могут иметь молекулярное, атомное или ионное строение. Превращение одних веществ в другие происходит в результате соединения атомов в молекулы, распада молекул на атомы, перегруппировки атомов или ионов.
Комментируя реакцию горения углерода
вы скажете, что каждый атом Карбона взаимодействует с молекулой кислорода с образованием молекулы углекислого газа, два атома Карбона взаимодействуют с двумя молекулами кислорода, образуя две молекулы углекислого газа, и т. д.
Чтобы подготовить какой-либо химический опыт, не имеет смысла пересчитывать атомы, молекулы. Да это и невозможно сделать. Химики используют физическую величину, которая определяется количеством частиц вещества в определенной его порции. Название этой величины — количество вещества. Ее обозначают латинской буквой
Единицей измерения количества вещества является моль*.
Ученые установили, что 1 моль любого вещества содержит 602 ООО ООО ООО ООО ООО ООО ООО его формульных единиц (атомов, молекул, совокупностей ионов). Это число можно записать как 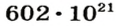
1 моль — это порция вещества, которая содержит 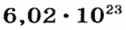
Так, 1 моль углерода (вещество атомного строения) содержит 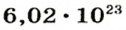
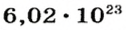
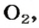
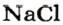
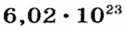
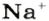
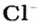
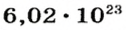
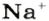
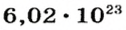
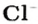
* Термин происходит от латинского слова moles — бесконечное
Понятие «количество вещества» используют не только по отношению к веществам, но и по отношению к частицам — атомам, молекулам, ионам. Например, выражение «1 моль ионов 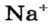
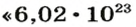
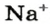
Число 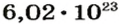
1 моль — это порция вещества, которая содержит столько формульных единиц, сколько атомов Карбона содержится в 12 г углерода.
Представление о порциях различных веществ в 1 моль можно получить из рисунка 1.
Число 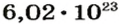
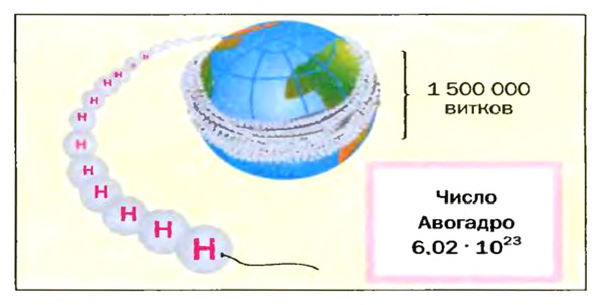
Число Авогадро в миллиарды раз превышает количество волос на головах, в усах, бородах всех живущих на Земле людей. Если покрыть земную поверхность таким количеством (
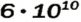
Амедео Авогадро (1776—1856)
Выдающийся итальянский физик и химик. Выдвинул гипотезу о молекулярном строении веществ, в частности газов. Открыл один из законов для газов (1811 год), позже названный его именем. Уточнил атомные массы некоторых элементов, определил состав молекул воды, аммиака, углекислого и угарного газов, метана, сероводорода и др. Разработал экспериментальные методы определения молекулярных масс газообразных веществ.
Числу Авогадро отвечает постоянная Авогадро. Ее обозначение — 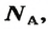
Если порция вещества содержит N частиц (формульных единиц), то можно вывести формулу для вычисления соответствующего количества вещества n:
в 1 моль вещества содержится 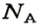
в n моль вещества — N частиц;
Слово «моль» не склоняется, если перед ним есть число, но склоняется, если числа нет.
Примеры словосочетаний: взято 5 моль железа, определение моля.
Решение задач. Решим несколько задач, в которых используется величина «количество вещества».
ЗАДАЧА 1. В каком количестве вещества содержится 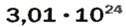
Решение
Воспользуемся формулой, которая отображает связь между количеством вещества и числом частиц (атомов):
Ответ:
В 1 моль какого-либо молекулярного вещества всегда содержится больше чем 1 моль атомов (1 моль элемента). Например, в 1 моль кислорода 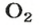

Количества вещества ионов в ионном соединении вычисляют аналогично.
ЗАДАЧА 2. Рассчитать количества вещества ионов в феррум (Ш) оксиде 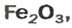
Решение
Формульная единица оксида 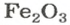
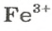
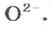
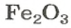
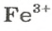
В 4 моль этого соединения количества вещества ионов в четыре раза больше:
Ответ:
По формуле соединения можно определить соотношение в нем количеств вещества атомов (элементов), ионов. Например, в метане
а в феррум(Ш) оксиде 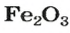
Вернемся к химической реакции 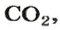
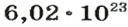
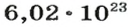
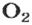
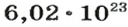
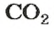
видим, что количества вещества соответствуют коэффициентам. Это справедливо для любой реакции. Приведем еще один пример:
ВЫВОДЫ. Количество вещества в химии определяют числом его частиц. Единица измерения количества вещества — моль. 1 моль содержит 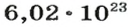
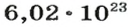
Это интересно. Количество вещества используют для характеристики состава растворов в научных исследованиях.
Молярная масса
Важной величиной, которая связана с количеством вещества, является молярная масса. Ее используют во многих вычислениях — при подготовке к химическому эксперименту, внедрении технологических процессов на заводах, для обработки результатов исследования химических реакций.
Молярная масса — это масса 1 моль вещества.
Молярную массу обозначают латинской буквой М. Ее размерность — г/моль.
Молярная масса численно равна относительной атомной, молекулярной или формульной массе.
Для того чтобы записать молярную массу какого-либо вещества, достаточно указать значение соответствующей относительной атомной, молекулярной или формульной массы и добавить размерность — г/моль. Относительные атомные массы элементов представлены в периодической системе Д. И. Менделеева, а относительные молекулярные и формульные массы веществ вы научились вычислять в 7 классе.
Примеры записи молярных масс простых и сложных веществ:
(расчет относительной молекулярной массы:
(расчет относительной формульной массы:
Поскольку понятие «моль» используют не только по отношению к веществам, но и по отношению к частицам (атомам, молекулам, ионам), то и для них существуют молярные массы. Учитывая, что масса 1 моль атомов Гидрогена составляет 1 г, а 1 моль ионов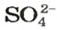
Выведем формулу, которая описывает взаимосвязь между массой, количеством вещества и молярной массой. Если, например, 1 моль атомов Гидрогена имеет массу 1 г, то n моль этих атомов — массу, которая в n раз больше, т. е. n г. Запишем соответствующее математическое выражение:
Общая формула для вычисления массы атомов, ионов, веществ по количеству вещества:
Отсюда
Итак, молярная масса — это отношение массы к количеству вещества.
Решение задач. Рассмотрим два способа решения задач, которые предполагают использование молярной массы. Один из них предусматривает составление пропорции, а другой — вычисления по приведенным выше формулам.
ЗАДАЧА 1. Рассчитать количество вещества метана 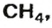
Решение
1-й способ
1. Вычисляем молярную массу соединения:
2. Находим количество вещества метана, составив пропорцию:
1 моль 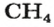
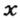
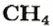
2-й способ
Воспользуемся одной из формул, приведенных в параграфе:
Ответ:
ЗАДАЧА 2. Какая масса железа отвечает количеству вещества 1,5 моль?
Решение
1-й способ
Железо — простое вещество, состоящее из атомов элемента Феррума.
Рассчитываем массу железа с помощью пропорции:
1 моль 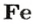
1,5 моль 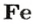
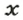
2-й способ
Воспользуемся формулой, приведенной в параграфе:
Ответ:
ЗАДАЧА 3. Вычислить массу 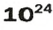
Решение
1-й способ
Поскольку 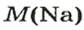
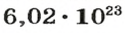
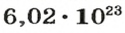
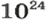
2-й способ
1. Рассчитываем количество вещества Натрия:
2. Вычисляем массу атомов Натрия:
Ответ:
ВЫВОДЫ. Молярная масса — это масса 1 моль вещества. Она численно равна относительной атомной, молекулярной или формульной массе. Молярная масса является отношением массы к количеству вещества.
Молярный объем
Порцию вещества можно охарактеризовать не только ее массой, но и объемом. Поэтому не случайно, что, кроме молярной массы, существует другая физическая величина — молярный, объем.
Молярным объемом называют объем 1 моль вещества.
Обозначение молярного объема — 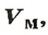
Из курса физики 7 класса вам известна формула, в которую входят масса вещества 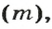
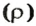
Аналогичная связь существует между молярной массой и молярным объемом:
Из этой формулы получаем другую:
По ней можно вычислять молярный объем любого вещества. Для этого нужно рассчитать молярную массу вещества и найти в справочнике его плотность.
Для каждого твердого и жидкого вещества существует свой молярный объем (например, для алюминия, поваренной соли, воды и спирта — 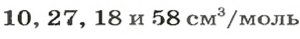
Газы при нагревании или понижении давления заметно расширяются, а при охлаждении или повышении давления сжимаются. Это происходит потому, что расстояния между молекулами в газах очень большие (в отличие от твердых и жидких веществ, где частицы соприкасаются друг с другом).
При изменении условий изменяются также плотность газа и его молярный объем. Поэтому, приводя значения этих физических величин, обязательно указывают соответствующие температуру и давление.
Нормальные условия (н. у.) = О °С; 101,3 кПа
Для газов при н. у.
Ученые установили, что молярный объем различных газов при одинаковых условиях один и тот же. В частности, при температуре О °С и давлении 101,3 кПа (или 760 мм рт. ст.) он составляет 22,4 л/моль. Приведенные условия называют нормальными (сокращенно — н. у.).
1 моль любого газа при нормальных условиях занимает объем 22,4 л.
Описывая физические свойства вещества, указывают его агрегатное состояние при обычных условиях. В этом случае речь идет об условиях, которые чаще всего существуют в помещении, где изучают или используют вещество. Это — температура приблизительно +20 °С и давление приблизительно 760 мм рт. ст.
Связь между объемом 
Из нее можно получить две другие:
Итак, молярный объем — это отношение объема к количеству вещества.
Закон Авогадро
Вы уже знаете, что 1 моль водорода, кислорода или углекислого газа занимает при нормальных условиях объем 22,4 л и содержит 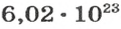
XIX ст. А. Авогадро. Получив впоследствии экспериментальное подтверждение и теоретическое обоснование, эта гипотеза стала законом.
Закон Авогадро формулируют так:
в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул*.
Приводим важное следствие закона Авогадро:
в равных объемах различных газов при одинаковых температуре и давлении содержатся одинаковые количества вещества.
* — Для инертных газов — одинаковое число атомов.
Изложенный материал обобщает рисунок 3.
Решение задач. Рассмотрим несколько задач, при решении которых используют молярный объем газа.
ЗАДАЧА 1. Вычислить объем 0,4 г водорода при нормальных условиях.
Решение
1-й способ
1. Находим количество вещества водорода:
2. Вычисляем объем водорода составлением пропорции:
1 моль 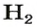
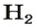
2-й способ
1. Находим количество вещества водорода:
2. Вычисляем объем водорода по соответствующей формуле:
Ответ:
ЗАДАЧА 2. Вычислить количество молекул в 1 л кислорода при нормальных условиях.
Решение
1-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях:
в 22,4 л кислорода содержится 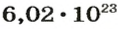
в 1 л кислорода — х молекул;
2-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях. Для этого из формулы 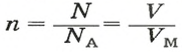
Осуществляем расчет:
Ответ:
Эту задачу можно решить еще одним способом. По соответствующим формулам сначала вычисляют количество вещества кислорода, а затем — количество молекул.
ЗАДАЧА 3. Рассчитать плотность угарного газа СО при нормальных условиях.
Решение
1-й способ
1. Находим молярную массу угарного газа:
2. Вычисляем плотность газа при нормальных условиях:
1 моль угарного газа, т. е.
28 г СО занимает при н. у. объем 22,4 л,
х г СО — 1л;
2-й способ
1. Находим молярную массу угарного газа:
2. Рассчитываем плотность угарного газа при нормальных условиях, преобразовав формулу 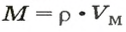
Ответ:
ВЫВОДЫ
Молярный объем — объем 1 моль вещества. Эта физическая величина является отношением объема к количеству вещества.
Молярные объемы твердых и жидких веществ разные, а газов (при одних и тех же температуре и давлении) — одинаковы. При нормальных условиях (температуре О°С и давлении 101,3 кПа, или 760 мм рт. ст.) 1 моль любого газа занимает объем 22,4 л.
В равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул (закон Авогадро).
Соотношение объемов газов в химических реакциях
Согласно закону Авогадро, равные объемы газов содержат одинаковое число молекул (при одинаковых условиях). Если каждая молекула одного газа реагирует с одной молекулой другого, например, во время реакции
то должны взаимодействовать одинаковые объемы веществ, скажем, 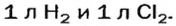
на один объем кислорода должны приходиться два объема реагирующего с ним водорода. Только при таком условии число молекул водорода будет вдвое превышать число молекул кислорода, как того «требует» химическое уравнение.
Обобщением этих выводов является закон объемных соотношений газов, который открыл французский ученый Ж. Гей-Люссак в 1808 г.: объемы газов, которые вступают в реакцию и образуются в результате реакции, соотносятся как небольшие целые числа.
Со временем ученые установили, что эти числа являются соответствующими коэффициентами в химических уравнениях.
Итак, для газов в реакциях (1) и (2)
Использование закона Гей Люссака дает возможность химику или инженеру-технологу определить, какие объемы газов нужно взять для осуществления реакции. Отобрать определенный объем газа значительно легче, чем взвесить его необходимую массу.
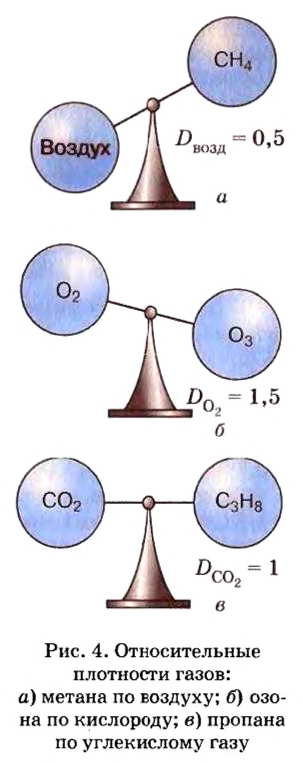
Относительная плотность газа
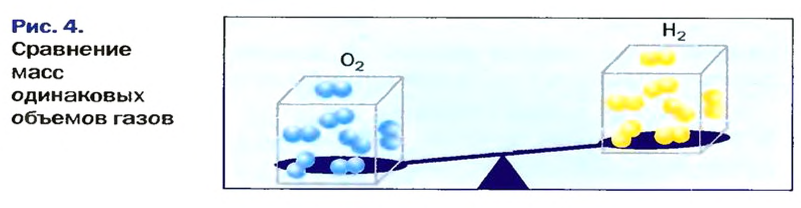
В равных объемах различных газов содержится одно и то же число молекул*. Поскольку молекулы различных веществ обычно имеют разную массу, то массы одинаковых объемов газов, как правило, разные. Например, масса 1 
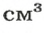
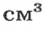
* — При одних и тех же условиях.
Число 16 называют относительной плотностью кислорода по водороду. Ее обозначают буквой D и записывают так:
Относительная плотность газа по другому газу — это отношение массы определенного объема газа к массе такого же объема другого газа (при одинаковых температуре и давлении).
Масса 1 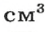
Узнать, во сколько раз кислород тяжелее водорода, можно, разделив плотность кислорода на плотность водорода:
Эта формула объясняет, почему физическую величину, о которой идет речь в параграфе, называют относительной плотностью.
Относительная плотность, как и относительная атомная (молекулярная, формульная) масса, не имеет размерности.
Если взять по 22,4 л кислорода и водорода при нормальных условиях, то массы веществ (в граммах) будут численно равны их молярным массам или относительным молекулярным массам. Отсюда — такие варианты вычисления относительной плотности кислорода по водороду:
Преобразуем все приведенные выше формулы на общие. Более тяжелый газ обозначим буквой В, более легкий — буквой А, а относительную плотность первого газа по второму —
Запомните: соотноы1ение масс газов можно использовать для вычисления относительной плотности лишь при условии, что
Газы часто сравнивают с воздухом. Хотя воздух является смесью газов, его можно условно считать газом с относительной молекулярной массой 29. Это число называют средней относительной молекулярной массой воздуха. Оно находится в промежутке между числами 32 и 28 — относительными молекулярными массами кислорода 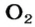
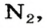
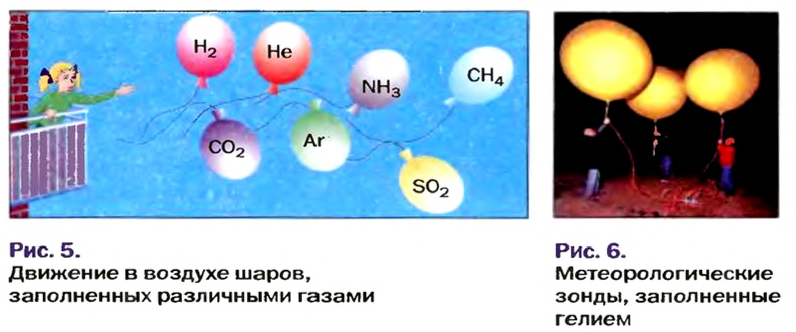
Установить, легче или тяжелее воздуха определенный газ, очень просто. Достаточно заполнить им резиновый шарик и отпустить его (рис. 5, 6).
Формулы для расчета относительной плотности газа В по воздуху имеют такой вид:
Это интересно. Самый легкий среди газов — водород 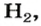
Решение задач. Покажем, как решают задачи с использованием изложенного в параграфе материала.
ЗАДАЧА 1. Рассчитать относительную плотность углекислого газа по водороду и по воздуху.
Решение
Находим относительную плотность углекислого газа по водороду и по воздуху.
Ответ:
В соответствии с полученным результатом углекислый газ в 1,52 раза тяжелее воздуха. Очевидно, что воздух во столько же раз легче углекислого газа.
Если для неизвестного газа В определена его относительная плотность по газу А, то можно вычислить молярную или относительную молекулярную массы газа В по формулам, которые являются производными от приведенных выше:
ЗАДАЧА 2. Относительная плотность газа X (соединение Сульфура) по водороду равна 17. Вычислить молярную массу газа Х и найти формулу соединения.
Решение
1. Вычисляем молярную массу газа X по одной из формул, приведенных в параграфе:
2. Находим формулу соединения. Поскольку 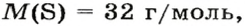
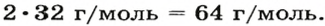
Очевидно, что этим элементом является Гидроген; его атомов в молекуле соединения — два. Формула соединения —
Ответ: 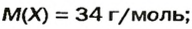
ВЫВОДЫ
Относительная плотность газа по другому газу — это отношение массы определенного объема газа к массе такого же объема другого газа (при одинаковых температуре и давлении). Значение относительной плотности газа показывает, во сколько раз он тяжелее другого газа.
В качестве газа сравнения часто служит воздух. Он ведет себя как газ с относительной молекулярной массой 29.
По относительной плотности газа можно вычислить его молярную массу.
О средней относительной молекулярной массе воздуха.
Почему средняя относительная молекулярная масса воздуха равна 29, а не 30 — среднему арифметическому относительных молекулярных масс кислорода (32) и азота (28)? Потому что в воз духе содержится неодинаковое количество этих газов: кислорода — 21% по объему, азота — 78%.
Вычислим среднюю молярную массу воздуха (она численно равна средней относительной молекулярной массе).
Предположим, что воздух состоит только из кислорода и азота. Тогда средняя молярная масса воздуха будет равна массе 1 моль смеси газов
Количества вещества газов пропорциональны их объемам или объемным долям
Взяв приближенные значения объемных долей газов 
Найдем массу 1 моль воздуха, т. е. 1 моль смеси газов
Таким образом,
Количество вещества
После повторения изученных начальных химических понятий для вас начинается новый этап познания химии. Это — количественные отношения веществ в химических реакциях, связь химических знаний с математическими.
Вы уже знаете, что существуют вещества молекулярного и немолекулярного строения, а их составными частицами могут быть атомы, молекулы, ионы. Абсолютные размеры этих структурных частиц очень малы, тогда как их количественные соотношения в химических уравнениях выражаются небольшими целыми числами, которые равны коэффициентам.
Рассмотрим взаимодействие вещества немолекулярного строения — углерода с веществом молекулярного строения — кислородом:
Как видно из уравнения реакции, 1 атом простого вещества углерода взаимодействует с 1 молекулой простого вещества кислорода и образуется 1 молекула сложного вещества оксида углерода(1У), или углекислого газа. Но для проведения этой реакции никогда не считают атомы углерода и молекулы кислорода, а оперируют такими величинами, как масса углерода и масса или обт/ем кислорода. Как в таких случаях не ошибиться и взять столько каждого из веществ, чтобы их было достаточно для проведения реакции и получения продукта реакции необходимой массы или объема?
Вам известны такие физические величины — время, масса, длина, объем, плотность, температура. С ними в повседневной жизни приходится довольно часто сталкиваться. Однако это не весь перечень характеристик, по которым сравнивают и отличают тела, вещества, явления.
Порция воды объемом 18 мл (приблизительно одна столовая ложка) при комнатной температуре имеет массу 18 г, поскольку плотность воды составляет 1 г/мл. Это привычные для вас числа. А вот приходилось ли вам иметь дело с таким удивительно огромным числом, как 602 000 000 000 000 000 000 000? Именно столько молекул содержится в порции воды объемом 18 мл! Согласитесь, не так уж и удобно отсчитывать число молекул воды (или число любых структурных частиц других веществ) в определенной ее порции, ведь счетчики атомов или молекул еще не сконструированы. Во избежание этих неудобств и была введена физическая величина количество вещества.
Количество вещества — это физическая величина, которая характеризуется числом структурных частиц вещества в определенной ее порции.
Количество вещества обозначают буквой греческого алфавита 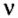
В каких случаях используют эту физическую величину? Прежде всего, когда нужно количественно охарактеризовать реагенты или продукты реакции.
Для каждой физической единицы существует эталон, сравнивая с которым проводят измерения, и способы или приборы для измерений. Вводя ту или иную физическую величину, сразу предлагают и единицы ее измерения. Например, для измерения массы введен кг и производные от него — мг, г, т; для измерения длины — м (мм, см, км). Так, вы можете легко измерить длину медной проволоки или определить массу пакета поваренной соли и не допустить при этом ошибки.
А с чем сравнивать порцию вещества, определяя количество вещества в ней? В каких единицах измеряют эту физическую величину? Существует ли ее эталон?
За единицу измерения количества вещества принят моль. Если единицы большинства физических величин введены в оборот давно, то единицу количества вещества моль ввели лишь в 1971 году. В переводе «моль» означает множественное число.
Моль — это количество вещества, которое содержит столько структурных частиц (атомов, молекул и т. п.) этого вещества, сколько атомов содержится в 12 г более легкой разновидности атома углерода.
Вспомните: изучая в 7 классе атомную единицу массы, вы узнали, что в природе преобладает более легкая разновидность атомов углерода, в ядрах которого есть по 6 протонов и нейтронов. В то же время более тяжелая разновидность углерода представлена атомами, ядра которых состоят из 6 протонов и 7 нейтронов, и в природе их мало.
Из чего состоит 1 моль вещества. Как показали расчеты, 12 г более легкой разновидности атомов углерода содержат 602 204 500 000 000 000 000 000 атомов. С введением физической величины количество вещества было принято, что это число показывает, сколько структурных частиц вещества содержится в одном моле любого вещества. В честь итальянского ученого Амедео Авогадро его назвали числом Авогадро (обозначается 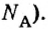
Это — универсальное число, которое указывает на количество структурных частиц в одном моле вещества, независимо от его агрегатного состояния. Число Авогадро 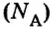
Единица измерения количества вещества моль обозначается так: 1 моль воды, 2 моль сахара, 5 моль углекислого газа и т. п. Обратите внимание, что окончание не изменяется, если слово «моль» пишется после цифры. Если же запись сделана без цифры, то окончание изменяется согласно падежу. Например: «Сколько молей кислорода выделится, если разложить 4 моль перманганата калия?»; «В одном моле воды содержится число Авогадро молекул».
Поупражняемся в применении числа Авогадро относительно конкретных структурных частиц разных веществ — атомов, молекул и др.
Пример 1. Графит 
Пример 2. Вода 
Пример 3. Хлорид натрия 
В 7 классе вы записывали химическую формулу поваренной соли, или хлорида натрия 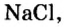
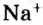
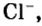
Относительно хлорида натрия число Авогадро означает число формульных единиц вещества в 1 моль этого вещества.
Формульная единица вещества — это совокупность его частиц, которая отображена химической формулой.
Для веществ, структурными частицами которых являются атомы, формульная единица вещества — атом. Для веществ, структурными частицами которых являются молекулы, формульная единица — молекула. А для веществ, структурными частицами которых являются ионы, формульная единица — совокупность ионов, которая отображена в химической формуле вещества. Например, в поваренной соли 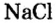
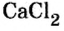
Поэтому правильно говорить, что в 1 моль хлорида натрия насчитывается 1 моль катионов 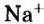
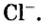
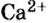
Вы уже умеете оперировать такими физическими величинами, как масса и объем веществ и тел. Умеете пользоваться и приборами для их измерения. Для измерения же количества вещества приборов не существует (рис. 1).
Как же тогда отмерить, например, порцию воды количеством вещества 2 моль? Чтобы получить ответ на этот вопрос, необходимо выяснить сущность понятия «молярная масса».
Итоги:
Амедео Авогадро (1776—1856 гг.) — итальянский химик и физик, первым стал систематически исследовать количественный и качественный состав веществ на основе соотношения объемов газообразных веществ, из которых они образованы. Ему принадлежат правильные записи формул: воды 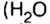
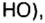
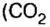
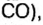
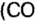
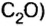
В 1811 г. Авогадро открыл закон, который до сих пор является общепризнанным: в одинаковых объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Закон носит имя своего первооткрывателя.
Ученый первым предсказал, что молекулы водорода, кислорода, азота двухатомны. В его честь число формульных единиц, которое содержится в 1 моль вещества, назвали числом Авогадро.
Один из минералов металлического элемента цезия (в периодической системе находится в ячейке под номером 55) — авогадрит также назван в честь ученого.
Молярная масса
Понятие молярная масса введено для определения соотношения количества вещества 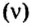
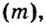
Молярная масса 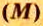
Молярную массу вычисляют по формуле:
То есть, молярная масса — это величина, которая характеризует конкретное вещество и измеряется в килограммах на моль (кг/моль) или в граммах на моль (г/моль). Следует отметить, что в химии преимущественно используют единицу г/моль.
Если взять порции различных веществ, массы которых численно равны их относительным молекулярным массам, например 12 г углерода (С), 18 г воды 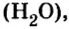
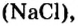
Таким образом, несмотря на разную относительную молекулярную массу веществ 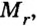
Масса одного моля любого вещества численно равна его относительной молекулярной массе и содержит число Авогадро структурных частиц (формульных единиц) вещества.
Для определения молярной массы вещества нет необходимости каждый раз делить массу порции вещества на количество вещества в ней. Достаточно вычислить ее относительную молекулярную массу и найденное число выразить в единицах молярной массы, то есть в г/моль.
Пример 1.
Таким образом, один моль углекислого газа — вещества молекулярного строения — имеет массу 44 г и содержит число Авогадро молекул.
Пример 2.
Таким образом, один моль оксида меди 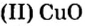
Зная массу порции любого вещества и количество вещества в ней, по формуле 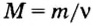
Пример 3. Вычислить молярную массу бинарного соединения серы с кислородом, если в порции массой 32 г количество вещества равно 0,5 моль.
Дано:
Решение:
Ответ: молярная масса соединения равна
Производные формулы 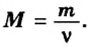
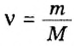
Пример 4. Определить количество вещества в порции оксида алюминия 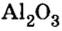
Дано:
Решение:
Ответ: количество вещества в порции оксида алюминия массой 20,4 г составляет 0,2 моль.
Формула 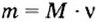
Пример 5. Определить массу порции оксида серы
Дано:
Решение:
Ответ: масса порции оксида серы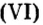
Как вычислить число структурных частиц вещества. Вам известно, что формулы многих веществ содержат индексы. Это дает возможность, характеризуя количественный состав вещества, отмечать число структурных частиц в формульной единице вещества. Число структурных частиц вещества в одном моле вещества принято помечать 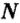
Пример 6. Вычислить, сколько атомов фосфора и сколько атомов кислорода содержится в одном моле оксида фосфора
Анализируя химическую формулу 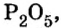
И снова имеем дело с большими числами. На уроках математики вы также будете выполнять действия с очень большими или очень малыми числами. Для удобства их записывают в стандартном виде, то есть в виде 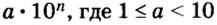
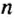
Такими числами удобно пользоваться для обозначения числа Авогадро. Вы легко убедитесь в том, что, умножив 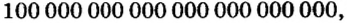
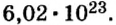
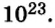
Итоги:
В примере мы ограничились найденным ответом 64 г/моль относительно молярной массы неизвестного вещества. Но вам, наверное, интересно знать, что это за бинарное соединение серы с кислородом? Для этого необходимо установить неизвестные индексы 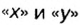
Рассуждаем так: если бы 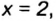
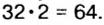
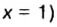
Ответ: формула бинарного соединения —
Молярный объем газов
Как известно, вещества могут находиться в твердом, жидком и газообразном агрегатных состояниях. Особенность газообразного состояния заключается в том, что между структурными частицами (молекулами) газов расстояния в тысячи раз большие, чем расстояния между структурными частицами жидкого, а тем более твердого вещества. Так, один моль воды при комнатной температуре и нормальном атмосферном давлении занимает объем 18 мл (приблизительно 1 столовая ложка). Объем 1 моль мелкокристаллического хлорида натрия втрое больше объема 1 моль воды, а объем 1 моль сахара — больше почти в 20 раз (рис. 2). А для одного моля азота при тех же условиях необходим сосуд приблизительно в 1240 раз вместительнее, чем столовая ложка.
Следовательно, объем одного моля газообразного вещества азота существенно отличается от объема одного моля жидкого или твердого вещества, в то время как разница объемов одного моля жидкости воды и твердого вещества хлорида натрия или сахара незначительная.
Вычислим объем 1 моль азота и некоторых других газообразных веществ в литрах. Для этого воспользуемся такой физической характеристикой вещества, как плотность 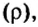
Поскольку давление и температура существенно влияют на объем газообразных веществ, принято проводить определения при температуре 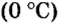
Температура 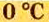
Нормальные условия сокращенно обозначаются их первыми буквами с точкой после каждой в круглых скобках — (н.у.).
Вычисление объема 1 моль азота начнем с нахождения его относительной молекулярной массы
Поскольку молярная масса численно равна относительной молекулярной, то
При нормальных условиях плотность азота 1,25 г/л.
Подставляем значение молярной массы 28 г/моль и плотности азота 1,25 г/л в формулу 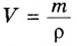
Итак, 1 моль азота при нормальных условиях занимает объем 22,4 л. Заметим, что при других условиях, он будет иметь и другие значения. Так, при 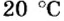
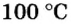
Вычислим молярный объем кислорода при нормальных условиях, если его плотность равна 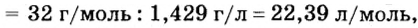
Если бы мы вычисляли молярный объем других газообразных веществ при нормальных условиях, то получили бы значения, близкие к 22,4 л.
Одной из величин, которая характеризует 1 моль любого газообразного вещества при нормальных условиях, является молярный объем газов
Следовательно, 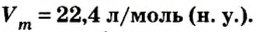
Подумайте и сделайте вывод — одинаковую ли массу они при этом имеют.
Вы, очевидно, обращали внимание на то, что определяющей физической величиной для жидкостей является объем, тогда как для твердых веществ — масса. Это потому, что твердые вещества сохраняют свою форму, а жидкие — нет, они приобретают форму сосуда, в котором содержатся. В этом отношении газы похожи на жидкости, поскольку собственной формы у них также нет.
Рассмотрим примеры вычислений с использованием молярного объема газов.
Пример 1. Вычислить объем азота количеством вещества 0,5 моль при нормальных условиях.
Решение
Воспользуемся формулой
Ответ: объем азота количеством вещества 0,5 моль составляет 11,2 л.
Пример 2. Какому количеству вещества оксида углерода 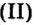
Решение
Воспользуемся формулой
Ответ: количество вещества оксида углерода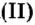
Итоги:
Теперь вы знаете, что количество вещества 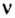
Приравняем их правые части:
Отсюда можно определить массу порции вещества и ее объем, а также молярную массу вещества:
Все три формулы широко применяются в химической практике. Например, если в формулу 1 подставить значение объема известного вещества, то сразу вычислим массу порции этого вещества. Если же в формулу 2 подставить значение массы порции известного вещества, то вычислим объем ее порции. Молярную массу неизвестного вещества можно вычислить с помощью одного действия по формуле 3. Для этого нужно знать массу и объем порции вещества.
Относительная плотность газов
При изучении веществ и явлений не обойтись без сравнений. Их проводят по разным характеристикам — массе, плотности, размерам, зарядам структурных частиц, физическим или химическим свойствам веществ и т. п.
Для газообразных веществ сравнения часто проводят по относительной плотности газов (обозначается буквой латинского алфавита 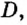
Относительная плотность одного газа по другому газу 
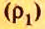
Поскольку плотность — это масса одного объема вещества, а молярный объем всех газов при нормальных условиях одинаков и составляет 22,4 л, делаем вывод, что плотности газов относятся между собой, как и их молярные массы. Вам известно, что молярные массы численно равны относительным молекулярным массам веществ. Отсюда относительная плотность газов может быть вычислена по формуле:
где 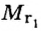
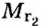
Внизу справа после буквы 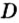
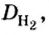
Из формулы для вычисления относительной плотности одного газа по другому следует, что необходимо знать относительные молекулярные массы обоих газообразных веществ. Как и относительная молекулярная масса, относительная плотность газа — величина безразмерная, потому что показывает, во сколько раз один газ легче или тяжелее другого.
Относительную плотность газов можно вычислить по любому газу — водороду, кислороду, углекислому газу и др., а также по газообразным смесям (рис. 4). Чаще всего ее вычисляют по водороду и воздуху. Если говорят о газообразных смесях веществ, то речь идет о средней относительной молекулярной массе смеси, определенной при нормальных условиях в объеме 22,4 л. Так, средняя относительная молекулярная масса воздуха равна 29.
Рассмотрим на примерах, как вычисляется относительная плотность газов и как, воспользовавшись формулой для ее вычисления, находят относительную молекулярную и молярную массы газообразного вещества.
Пример 1. Вычислить относительную плотность кислорода по водороду.
Решение
Ответ: 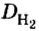
Вычисляя относительную плотность газа по водороду, в знаменателе всегда записывают число 2 (относительная молекулярная масса водорода). Отсюда формулу для вычисления относительной плотности газов по водороду можем подать в таком виде:
На практике часто необходимо определить относительную плотность газа по воздуху. Вспомните: в 7 классе вы выясняли, как необходимо располагать сосуд для собирания газообразного вещества, чтобы наполнить его газом способом вытеснения воздуха.
Поскольку относительная молекулярная масса воздуха составляет 29, то относительную плотность по воздуху вычисляют по формуле:
Пример 2. Вычислить относительную плотность кислорода по воздуху.
Решение
Ответ: относительная плотность кислорода по воздуху равна 1,1.
Таким образом, кислород несколько тяжелее воздуха и потому, чтобы собрать его способом вытеснения воздуха, сосуд располагают книзу дном.
Пример 3. Вычислить относительную плотность водорода по воздуху.
Решение
Ответ: относительная плотность водорода по воздуху равна 0,07.
В рассмотренных примерах кислород тяжелее водорода и воздуха, а водород легче воздуха. Эти и другие примеры доказывают, что если относительная плотность газа больше единицы, то газ тяжелее того газа, с которым его сравнивают. И наоборот, если полученная величина меньше единицы, то газ легче того газа, с которым его сравнивают.
Производными относительной плотности газов являются такие формулы:
Пример 4. Бинарное соединение азота с водородом имеет относительную плотность по водороду 8,5. Установить химическую формулу вещества, если массовая доля азота в ней равна 82 % .
Дано:
Решение
Поскольку относительная атомная масса азота 14, то
Ответ: формула соединения
Итоги:
- Относительная плотность газов — это безразмерная величина, которая показывает, во сколько раз один газ тяжелее или легче другого.
- Для вычисления относительной плотности газа относительную молекулярную или молярную массу одного газа делят на относительную молекулярную или молярную массу другого газа.
- Выбирают способ сбора газов вытеснением воздуха по результатам вычисления относительной плотности газов по воздуху: если она больше единицы, то сосуд для наполнения газом держат книзу дном, а если меньше — вверх дном.
Перенасыщение углекислым газом опасно для организма человека и животного. Установлено, что когда содержание углекислого газа в воздухе превышает 10 %, наступает потеря сознания и даже смерть.
В Италии есть пещера, названная «Собачьей». В нее не рекомендуют заходить с собаками, потому что она почти вполовину человеческого роста заполнена углекислым газом. Если вы определите относительную плотность углекислого газа по воздуху, то поймете, почему человек может находиться в этой пещере определенное время, тогда как собака вскоре начинает задыхаться и может даже погибнуть.
Расчеты по химическим формулам
Изучая химию, вы, наверное, обратили внимание, насколько важная для характеристики вещества информация содержится в его химической формуле. Обобщая эти знания, можно сделать вывод, что химическая формула содержит сведения о молекуле или другой формульной единице вещества, а также о количестве вещества.
Химическая формула информирует о:
- качественном составе вещества (какие элементы его образуют);
- количественном составе вещества (сколько атомов каждого элемента входит в состав его формульной единицы массы);
- принадлежности вещества к простым или сложным.
- Пользуясь химической формулой, можно осуществлять расчеты:
- относительной молекулярной массы вещества;
- молярной массы вещества;
- отношения масс элементов в веществе;
- массовой части элемента в веществе;
- числа структурных частиц вещества в определенной его порции;
- молярной массы, количества и объема вещества;
- относительной плотности газов.
Частью этих расчетов вы уже овладели, ознакомимся с другими расчетами.
Расчеты отношения масс элементов в веществе. Химическая формула, как вам известно, состоит из символов химических элементов и индексов. Индексы являются теми числами, которые передают количественный состав вещества. Это дает возможность по химической формуле вычислять соотношение масс элементов. Рассмотрим такие расчеты на примере.
Пример 1. Вычислить соотношение масс элементов в оксиде фосфора
Решение
Составляем формулу соединения по валентности фосфора: 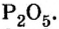
Ответ: отношение масс элементов фосфора и кислорода в оксиде фосфора 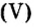
В 7 классе вам демонстрировали горение фосфора в кислороде. Теперь вы знаете, что эти два вещества реагируют полностью, без остатка, если их взять в отношении масс 

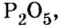
Пример 2. Какие вещества образуются в закрытом сосуде после сжигания в нем фосфора массой 93 г в кислороде массой 160 г?
Не будем строить прогнозы, а проведем четкие математические расчеты. Сначала вычислим, сколько кислорода необходимо, чтобы прореагировал весь фосфор. Для этого составим уравнение, в левой части которого запишем отношение масс элементов фосфора и кислорода по формуле, а в правой — по условию задачи, обозначив массу кислорода
Расчеты показали, что для полного взаимодействия порции фосфора массой 93 г достаточно 120 г кислорода. Его же было 160 г. Следовательно, после прекращения реакции в сосуде еще остается: 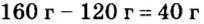
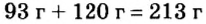
Ответ: после сжигания в сосуде будет 213 г оксида фосфоpa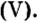
Итоги:
- Химическая формула вещества отображает ее качественный и количественный состав и дает возможность вычислять количество вещества, относительную молекулярную массу, молярную массу, объем и массу порции вещества, число структурных частиц вещества в определенной его порции.
- По химической формуле вычисляют также массовые доли элементов и отношения масс элементов в веществе.
Химики часто устанавливают не только отношения масс элементов по химической формуле вещества, но и отношения количества вещества реагентов и продуктов реакции. Так, если нужно установить массу или объем продуктов реакции, лучше воспользоваться физической величиной количество вещества. Это потому, что коэффициенты (если их правильно расставить) показывают, сколько молей одного вещества реагирует, а другого — образуется. Из уравнения реакции окисления магния
следует, что 2 моль магния вступают в реакцию соединения с 1 моль кислорода и образуют 2 моль оксида магния.
Для этой реакции отношение количества вещества реагентов и продуктов реакции является таким:
Это значит, что, взяв определенное количество вещества магния, мы получим столько же молей оксида магния , тогда как израсходованное количество вещества кислорода будет вдвое меньшим.
Это учитывают на химических заводах по производству различных веществ и всегда проводят необходимые вычисления.
Вычисления с использованием числа Авогадро
К вычислениям по химическим формулам относятся также определение числа структурных частиц в данном количестве вещества, установление молярной массы вещества, массы или объема определенной порции вещества, по известному числу структурных частиц, из которых оно образовано. Рассмотрим конкретные примеры таких вычислений.
Определение числа атомов (молекул) в данном количестве вещества.
Пример 1. Определить число молекул в порции сульфида водорода 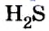
Дано:
Решение
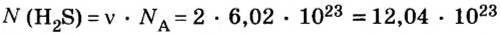
Ответ: в порции сульфида водорода количеством вещества 2 моль содержится 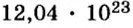
Усложним условие предыдущей задачи.
Пример 2. Определить число молекул в порции сульфида водорода 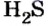
Дано:
Решение
1. Для определения числа молекул необходимо знать количество вещества. Поэтому из формулы 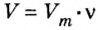
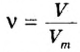
2. Определяем число молекул в порции сульфида водорода количеством вещества 0,5 моль:
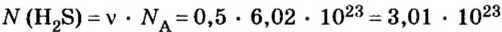
Ответ: в порции сульфида водорода 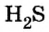

Пример 3. Определить, где больше молекул — в порции углекислого газа массой 88 г или в порции газа пропана 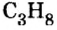
Дано:
Решение
1. Вычислим относительные молекулярные и молярные массы углекислого газа и пропана:
2. Вычислим количество вещества в порции углекислого газа массой 88 г:
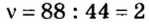
3. Вычислим количество вещества в порции пропана массой 88 г:
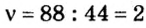
Количество вещества в обеих порциях одинаково, следовательно, число молекул также одинаково.
Ответ: число молекул в порциях углекислого газа и пропана массой 88 г каждая одинаковое.
Пример 4 Вычислить молярную массу соединения серы с кислородом и найти его формулу, если масса 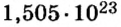
Дано:
Решение
Для вычисления молярной массы соединения нужно знать его химическую формулу. Если же химическая формула неизвестна, можно прибегнуть к вычислениям молярной массы вещества по таким формулам:
1. По формуле 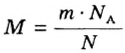
2. По массовой доле серы находим, сколько атомов этого элемента обозначено в формуле буквой
отсюда
3. Находим, сколько атомов кислорода обозначено в формуле буквой
Ответ: молярная масса соединения серы с кислородом равна 64 г/моль, а ее формула —
Итоги:
Используя число Авогадро, определяют числа структурных частиц вещества в данной его порции, устанавливают молекулярную формулу вещества.
Вычисления с применением числа Авогадро проводят по формулам:
Физическую величину количество вещества можно применить не только к индивидуальным веществам, но и к их смесям. Это дает возможность проводить расчеты по более сложным химическим формулам, чем те, которые были приведены в параграфе. В частности, можно вычислять содержимое компонентов в составе газообразной смеси, а также массовые и объемные части газов в смеси.
Пример. Вычислить массовые и объемные доли газов в смеси оксида углерода 
Объемная доля компонента 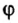
Объемную долю вычисляют в процентах или в долях от единицы.
Дано:
Решая эту задачу, важно помнить, что физическую величину количество вещества 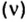
Решение
Вычислим молярную массу смеси по формуле:
Обозначим содержимое оксида углерода
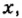
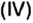
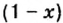
Данными сведениями заполним таблицу:
Составим алгебраическое уравнение и решим его:
Вычислим массу каждого компонента смеси:
Вычислим массовые доли компонентов смеси:
Находим объемные доли компонентов смеси. Поскольку в молярном объеме смеси объемные доли каждого компонента равны его количеству вещества, то:
Ответ: массовые и объемные доли газов в смеси составляют:
- Органические соединения
- Теория химического строения органических соединений А. М. Бутлерова
- Насыщенные углеводороды
- Ненасыщенные углеводороды
- Неметаллы в химии
- Галогены в химии
- Подгруппа кислорода
- Подгруппа азота