Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
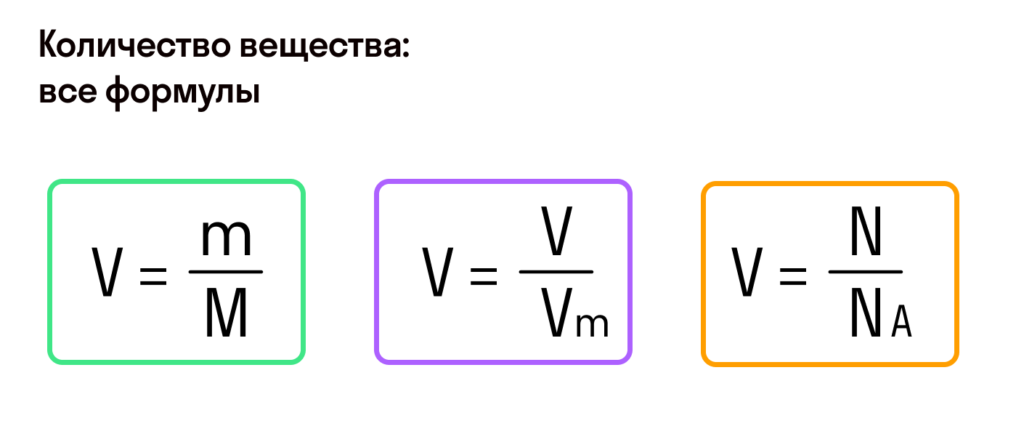
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Важно знать! Как научиться решать задачи по химии.
Задача 1-1. Сколько молекул содержится в одном литре воды?
Решение.
Масса одного литра воды:

Количество вещества — удобная универсальная величина, через которую можно связать между собой число атомов или молекул, массу и объем вещества.
Количество вещества можно рассчитать по следующим формулам:
где




Молярная масса воды:

Пользуясь этими формулами, находим:

Ответ:
Задача 1-2. Сколько атомов водорода содержится: а) в 10 моль аммиака; б) в 100 г воды?
Решение.
а) Формула аммиака — 

б) В одной молекуле воды 




Ответ: а) 

Задача 1-3. Вычислите массу кислорода, содержащуюся в 15,0 г серной кислоты.
Решение.
Молярная масса серной кислоты 
Количество вещества

Согласно химической формуле 

Зная количество кислорода, можно найти его массу:

Ответ: 9,79 г кислорода.
Задача 1-4. Рассчитайте массу одной молекулы гемоглобина (молекулярная формула 
Решение.
а) Для расчета массы молекулы гемоглобина надо знать молярную массу гемоглобина:

Дальше можно использовать два способа.
Объединяя формулы 
можно выразить массу через число молекул:

Подставляя в эту формулу 


находим 
б) Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а. е. м. Относительная молекулярная масса численно равна молярной массе, поэтому масса одной молекулы гемоглобина равна 64388 а. е. м.
Ответ: а) 
Задача 1-5. Рассчитайте массовые доли водорода и кислорода в воде.
Решение.
В этой задаче водород и кислород — это элементы 



Удобное свойство массовой доли состоит в том, что она не зависит от общей массы вещества: массовые доли элементов одинаковы и в капле, и в литре, и в бочке воды. Поэтому для расчета массовой доли можно взять любую массу вещества, например 1 моль.
Масса 1 моль воды: 



Массовые доли элементов:


Ответ: 11,1% H, 88,9% O.
Задача 1-6. Определите простейшую формулу химического соединения, если массовые доли составляющих его элементов равны: H — 2,04%, S — 32,65%, O — 65,31%.
Решение. Простейшая формула отражает соотношение между числом атомов в молекуле, или, что то же, мольные соотношения атомов. Поскольку простейшая формула не зависит от массы вещества, возьмем образец вещества массой 100 г и найдем отношение количеств элементов (в молях) в этом образце. Для этого следует разделить массу каждого элемента на его- относительную атомную массу:
Наименьшее из чисел (1,02) принимаем за единицу и находим отношение:
Оно означает, что в молекуле химического соединения на 2 атома водорода приходится 1 атом серы и 4 атома кислорода, следовательно, простейшая формула искомого соединения — 
Ответ: 
Задача 1-7. Определите молекулярную формулу органического вещества, если оно содержит 40% углерода, 6,7% водорода и 53,3% кислорода по массе, а его молярная масса равна 60 г/моль.
Решение. Действуя так же, как и в предыдущей задаче, можно найти относительные количества элементов и определить простейшую формулу вещества:
Простейшая формула вещества — 


Ответ: 
Задача 1-8. Какая масса хлорида натрия образуется при обработке 15 г карбоната натрия, содержащего 15% примесей, избытком соляной кислоты?
Решение. Прежде всего найдем массу чистого карбоната натрия. Примесей в образце карбоната натрия содержится 15%, а чистого вещества — 85% :

Далее запишем уравнение химической реакции:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O.
Массу продуктов реакции можно рассчитать по количеству вещества, используя следующую схему:
m(исх. вещества) → v(исх. вещества) → v(продукта) → m( продукта).
Найдем количество карбоната натрия:

По основному закону химической стехиометрии отношение количеств реагирующих веществ (в молях) равно отношению соответствующих коэффициентов в уравнении реакции. Коэффициент перед 


Масса хлорида натрия:

Ответ: 14 г 
Задача 1-9. Рассчитайте массу воды, которая образуется при реакции между 5 г водорода и 50 г кислорода.
Решение. Запишем уравнение реакции:
Если даны массы нескольких исходных веществ, то расчет по уравнению реакции проводят по тому из веществ, которое находится в недостатке, т. е. первым заканчивается в реакции. Для того чтобы узнать, какое из веществ находится в недостатке, сравнивают их относительные количества, т. е. количества, деленные на соответствующие коэффициенты в уравнении реакции:


Водорода дано больше, чем кислорода, однако с учетом коэффициентов в уравнении реакции он находится в недостатке, так как
В том, что водород находится в недостатке, можно убедиться и по-другому: для того чтобы сжечь 2,5 моль 


Расчет массы воды ведем по водороду:


Ответ: 45 г 
[Сборник задач и упражнений по химии: Школьный курс / В.В. Еремин, Н.Е. Кузьменко]
AГ
Aлександр Гришанов
Литр воды при нормальных условиях составляет 1 кг.
Количество вещества: n(H2O) = 1000 /18 г/моль = 55,56 моль
Разложение воды: 2H2O (t>1000 град) = 2H2 + O2
Значит, водорода будет 55,56 моль.
Его объём: V(H2) = n*Vм = 55,56 моль*22,4 л/моль = 1244 л
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023 атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023 молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.

Масса водорода в 1 л воды равна ( М(H2O)=18*10^-3 кг/моль, М(Н2)=2*10^-3 кг/моль, р воды=10^3 кг/м^3 )
P.S.Это молекулярная физика, поэтому все нужно переводить в кг
Комментарии



Светило науки — 1118 ответов — 8179 раз оказано помощи
M(молярная масса)=m₀(масса молекулы)*Na(число Авогадро);m₀=M/Na;
m(масса вещества)=m₀*N(число молекул вещества);
N=m/m₀=m*Na/M; Найдем количество молекул H₂O в 1 литре воды(1 литр-1 кг, т.к. плотность воды 1000 кг/м³)
В каждой молекуле H₂O содержится два атома H, значит масса H₂ будет равна m=m₀(H₂)*N(H₂O);
m(H₂)=1/9≈0.1 кг
Ответ:m(H₂)≈0.1 кг