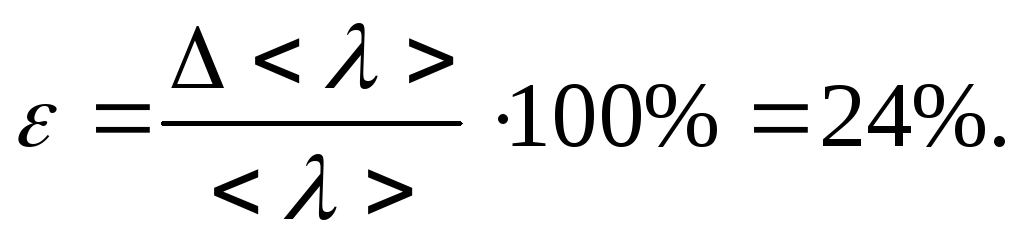Формула воздуха
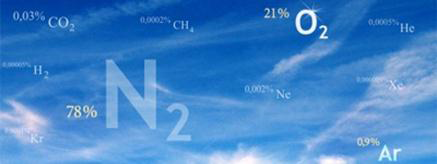
Газовый состав воздуха
От уровня моря до высоты около 11000 м (слой тропосферы) газовый состав воздуха практически не изменяется и выглядит следующим образом:
| Вещество | Формула | Объемная доля, % | Массовая доля, % |
|---|---|---|---|
|
Азот |
N2 |
78,08 |
75,5 |
|
Кислород |
O2 |
20,95 |
23,1 |
|
Аргон |
Ar |
0,93 |
1,29 |
|
Углекислый газ |
CO2 |
0,034 |
0,046 |
|
Неон |
Ne |
0,0018 |
0,0014 |
|
Гелий |
He |
0,000524 |
0,000073 |
|
Метан |
CH4 |
0,0002 |
0,000084 |
|
Криптон |
Kr |
0,0001 |
0,003 |
|
Водород |
H2 |
0,00005 |
0,00008 |
|
Ксенон |
Xe |
0,000008 |
0,00004 |
Средняя молярная масса воздуха: 29,16 г/моль
Воздух в тропосфере практически всегда содержит некоторое количество водяного пара. Влажность воздуха зависит от его температуры и высоты над уровнем моря.
Состав воздуха может незначительно меняться в зависимости от географического положения, времени года, времени суток. В крупных городах обычно повышенное содержание углекислого газа. В горах наблюдается более низкое содержание кислорода, из-за того, что кислород тяжелее азота, поэтому его плотность с высотой уменьшается быстрее.
В нижних слоях атмосферы могут содержаться во взвешенном состоянии некоторые количества мелких частиц пыли и золы, которые образуются в процессе горения различных видов топлива или в результате извержения вулканов. С присутствием в воздухе этих высокодисперсных частиц связана окраска солнечных восходов и закатов, обусловленная рассеянием на них солнечных лучей.
Примеры решения задач по теме «формула воздуха»
| Понравился сайт? Расскажи друзьям! | |
Как выглядит химическое соединение — воздух ?
формула воздуха
Вы нигде не сможете отыскать какую-то химическую формулу воздуха. Всё дело в том, что воздух в своём составе имеет огромнейшее количество различных примесей газов, поэтому вам можно только предоставить перечень этих примесей с примерным процентным содержанием, а вот и этот перечень:
автор вопроса выбрал этот ответ лучшим
Smiledimasik
[32.1K]
6 лет назад
Много людей иногда задается вопросом с чего состоит воздух и какая у него формула. Воздух — это смесь газов, которая окутывает нашу Землю в атмосфере. Так вот основным составляющим является азот и кислород, остальные это газы которые просто немного добавляют воздух
Вили Борисович
[26.5K]
6 лет назад
Воздух это смесь газов. Состав воздуха не является постоянной величиной и меняется в зависимости от местности, региона и даже количества людей находящихся рядом с вами. В основном воздух состоит из Азота примерно на 78% и кислорода на 21%, остальное это примеси различных соединений.
Владимир! Как таковой химической формулы воздуха не существует..
воздух-ЭТО СМЕСЬ различных газов- кислорода ,окиси углерода,азота и других газов..
точную пропорцию этих газов в атмосфере назвать трудно…
Воздух нельзя назвать химическим соединением, ведь он состоит из смеси разнообразных газов, которая постоянно меняет свой состав. Причем, это изменение носит как качественный, так и количественный характер. Так, если до высоты в 13 километров, состав атмосферы меняется мало, то выше появляется озоновый слой, то есть в атмосфере возникает большое количество трехатомного кислорода. Напротив у поверхности на состав атмосферы оказывают большое влияние загрязнения как техногенного (выбросы предприятий, автомобилей), так и природного характера (вулканическая деятельность). Химическое же соединение как правило постоянно, атомы элементов в нем связаны различными связями и находятся в строгих пропорциях.
Вот состав атмосферы у поверхности:
А вот какие изменения происходят в атмосфере с высотой:
кудрявцев владимир семенович
[104K]
8 лет назад
Со школьной программы помню что атмосферный воздух это смесь газов в котором основные это — азот и кислород на их долю приходится 99% этой смеси сам состав атмосферного воздуха примерно такой:
азот — 78%.
кислород — 21%.
аргон — 1%.
углекислый газ — 0,03%.
далее процент настолько мал но видимо без них мы дышать возможно и сможем но могут возникнуть нарушения:
неон — 0,002%.
метан — 0,0002%.
гелий — 0,0005%.
криптон — 0,0001%.
водород — 0,00005%.
ксенон — 0,000009%.
Но хочу добавить что процент газов на планете Земля не везде одинаков.
Помощни к
[57K]
7 лет назад
Невозможно составить единую цельную формулу для атмосферы Земли. Но можно определить какие газы есть в воздухе:
- Азот N2 — 78.084 %.
- Оксиген (которым мы дышим) О2 — 20.9476 %.
- Аргон Ar — 0.934 %.
- Углекислый газ CO2 — 0.0314%.
- Неон Ne — 0.001818%.
- Метан CH4 — 0.0002%.
- Гелий He — 0.000524%.
- Криптон Kr — 0.000114%.
- Гидроген H2 — 0.00005%.
- Ксенон Xe — 0.0000087%.
- Озон O3 — 0.000007%.
- Нитроген диоксид NO2 — 0.000002%.
- Йод I2 — 0.000001%.
- Количество карбона моноксида CO и аммония NH3 ничтожно мало.
Наверное не совсем корректно говорить о воздухе как о химическом соединении. Скорее это смесь газов в которой присутствуют пары воды. Основной состав воздуха это азот-кислород в объемном соотношении 78-21%. Остальное принадлежит водороду, углекислому газу, аргону, гелию и пр. Состав воздуха может меняться в зависимости от географии места (город, лес, горы, море) в пределах 2% для каждого газа.
Воздух по существу представляет собой смесь азота (около 80%) и кислорода (около 20%), другие газы составляют около 1% или меньше. Как таковой химической формулы воздуха не существует, так как это смесь различных соединений в различном процентном соотношении.
МарияСС
[47.3K]
6 лет назад
Воздух — это не химическое соединение. Воздух представляет собой смесь газов, причем его состав не постоянен и зависит непосредственно от места, в котором мы будем анализировать состав воздуха, наличия тех или иных загрязнений.
98-99% состава воздуха приходится на азот и кислород. Также в состав воздуха входят
Знаете ответ?
Формула воздуха
ОПРЕДЕЛЕНИЕ
Воздух — это естественная смесь газов (главным образом азота и кислорода), которая образует атмосферу земли.
Газовый состав воздуха
От уровня моря до высоты около 11 000 м (слой тропосферы) газовый состав воздуха остается практически неизменным и выглядит следующим образом:
(
begin{array}{|c|c|c|c|}
hline
Вещество& Формула&Объемная,доля&Массовая,доля\ hline
Азот&mathrm{N}_{2}&78,08&75,5\ hline
Кислород&mathrm{O}_{2}&20,95&23,1\ hline
Аргон&text { Ar }&0,93&1,29\ hline
Углекислый, газ&mathrm{CO}_{2}&0,034&0,046\ hline
Неон&text { Ne }&0,0018&0,0014\ hline
Гелий&text { He }&0,000524&0,000073\ hline
Метан&mathrm{CH}_{4}&0,0002&0,000084\ hline
Криптон&mathrm{Kr}&0,0001&0,003\ hline
Водород&mathrm{H}_{2}&0,00005&0,00008\ hline
Ксенон&text { Xe }&0,000008&0,00004\ hline
end{array}
)
Средняя молярная масса воздуха: 29,16 г / моль
Воздух в тропосфере почти всегда содержит несколько водяных паров. Влажность воздуха зависит от его температуры и высоты над уровнем моря.
Состав воздуха может незначительно варьироваться в зависимости от географического положения, времени года, времени суток. В крупных городах, как правило, высокий уровень углекислого газа. В горах наблюдается более низкое содержание кислорода из-за того, что кислород тяжелее азота, поэтому его плотность уменьшается с высотой быстрее.
В нижних слоях атмосферы могут быть приостановлены определенные количества мелких частиц пыли и золы, которые образуются в процессе сжигания различных видов топлива или в результате вулканических извержений. Присутствие этих мелких частиц в воздухе связано с цветом восходов и закатов из-за рассеяния солнечного света на них.
Примеры решения задач по «воздушной формуле»
ПРИМЕР 1
Плотность некоторого газа в воздухе равна 2. Какова масса этого газа с объемом 5,6 литра (ну)?
Раствор Молекулярная масса воздуха составляет 29 г / моль.
Рассчитайте молекулярную массу этого газа:
(
M(газ) = M(воздух)cdot D(газ) =29 cdot 2=58 г/моль
)
Согласно результату закона Авогадро молярный объем газа в нормальных условиях составляет 22,4 л.
Составьте пропорцию и рассчитайте массу 5,6 литров газа:
58 г газа занимает 22,4 литра
xg-газ занимает 5,6 литров
Отсюда
(
x=58 cdot 5,6 / 22,4=14,5g
)
Масса 5,6 литров газа будет равна 14,5 г.
ПРИМЕР 2
Во время сгорания 5.36 г определенного гомолога бензола потреблялось 56,7 литра воздуха (NU). Определите формулу исходного соединения.
Напишите уравнение для реакции горения:
(
C_{n} H_{2 n-6}+left(frac{3 n-3}{2}right) O_{2}=n C O_{2}+(n-3) H_{2} O
)
Содержание кислорода в воздухе составляет 21%. Рассчитайте объем потребляемого в процессе сгорания кислорода:
(
Vleft(O_{2}right)=V(воздух) cdotomegaleft(O_{2}right) / 100=56,7 cdot 21 / 100=11,9л
)
Количество кислородного вещества будет равно:
(
nleft(O_{2}right)=Vleft(O_{2}right) / V_{M}=11,9 / 22,4=0,531моль
)
Согласно уравнению реакции
(
1моль mathrm{CnH} 2 mathrm{n}-6-(3 mathrm{n}-3) / 2 моль O2
)
(
x моль mathrm{CnH} 2 mathrm{n}-6-0.531 моль O2
)
Следовательно, количество вещества бензольного гомолога, входящего в реакцию, будет равно:
(
x=nleft(C_{n} H_{2 pi-6}right)=frac{2 cdot 0,531}{3 n-3}
)
Молярная масса (
mathrm{CnH} 2 mathrm{n}-6
) равна:
(
Mleft(C_{n} H_{2 n-6}right)=12 n+2 n-6=14 n-6
)
(
nleft(C_{n} H_{2 n-6}right)=frac{mleft(C_{n} H_{2 n-6}right)}{Mleft(C_{n} H_{2 n-6}right)}=frac{5,36}{14 n-6}=frac{2 cdot 0,531}{3 n-3}
)
(
1,062(14 n-6)=5,36(3 n-3)
)
(
1,212 n=9,708
)
(
n=8
)
Следовательно, формула вещества (
mathrm{C} 8 mathrm{H} 10
)
составная формула — (
mathrm{C} 8 mathrm{H} 10
)
Воздух, свойства и химический состав.
Воздух – смесь газов главным образом из азота и кислорода – 98-99 % в сумме, а также аргона, углекислого газа, водорода, образующая земную атмосферу.
Воздух, роль и значение воздуха
Свойства воздуха
Химический состав воздуха. Из чего состоит воздух? Компоненты воздуха
Физические свойства воздуха
Воздух, роль и значение воздуха:
Воздух – смесь газов главным образом из азота и кислорода – 98-99 % в сумме, а также аргона, углекислого газа, водорода, образующая земную атмосферу.
В России действует Федеральный закон от 04.05.1999 № 96-ФЗ «Об охране атмосферного воздуха», которым дано понятие атмосферного воздуха.
Атмосферный воздух – жизненно важный компонент окружающей среды, представляющий собой естественную смесь газов атмосферы, находящуюся за пределами жилых, производственных и иных помещений. Атмосферный воздух является жизненно важным компонентом окружающей среды, неотъемлемой частью среды обитания человека, растений и животных.
Воздух окружает планету Земля, образуя атмосферу планеты. Он удерживается гравитацией Земли. Атмосфера Земли защищает жизнь на земле, создавая давление, позволяющее жидкой воде существовать на поверхности Земли, поглощая вредное ультрафиолетовое солнечное излучение, нагревая поверхность за счет удержания тепла (парниковый эффект) и уменьшая перепады температур между днем и ночью (суточное изменение температуры).
Воздух необходим для нормального существования на Земле живых организмов. Без воздуха невозможна жизнь человека. Для человека жизненно важной составной частью воздуха является кислород. Кислород, содержащийся в воздухе, в процессе дыхания поступает в клетки организма и используется в процессе окисления, в результате которого происходит выделение необходимой для жизни энергии (метаболизм, аэробы).
Если без еды человек может продержаться несколько недель, без воды – несколько дней, то без воздуха – только несколько минут (1 минуту – обычный человек и 5 минут – тренированные ныряльщики).
Общая масса воздуха на Земле составляет 5,13․1015 т и оказывает на поверхность Земли давление, равное на уровне моря в среднем 1,0333 кг на 1 см3.
Свойства воздуха:
Воздух не имеет цвета, вкуса и запаха. Полностью прозрачен.
Воздух сжимаем и упруг.
Теплый воздух легче холодного. Воздух сжимается при охлаждении и расширяется при нагревании.
Воздух сохраняет тепло и практически не пропускает его.
Он всегда заполняет весь объём и содержится везде, где есть пустое пространство.
Воздух необходим для процессов горения.
Химический состав воздуха. Из чего состоит воздух? Компоненты воздуха:
То, что воздух является смесью газов, а не простым веществом, было впервые экспериментально доказано в 1754 году Джозефом Блэком.
| Химическое вещество | Обозначение вещества | По объему*, % | По массе*,% |
| Азот | N2 | 78,084 | 75,5 |
| Кислород | O2 | 20,9476 | 23,15 |
| Аргон | Ar | 0,934 | 1,292 |
| Углекислый газ | CO2 | 0,0314 | 0,046 |
| Неон | Ne | 0,001818 | 0,0014 |
| Метан | CH4 | 0,0002 | 0,000084 |
| Гелий | He | 0,000524 | 0,000073 |
| Криптон | Kr | 0,000114 | 0,003 |
| Водород | H2 | 0,00005 | 0,00008 |
| Ксенон | Xe | 0,0000087 | 0,00004 |
| Водяной пар** | H2O | от 0,0001 до 5 | 0,25*** |
Примечание:
* в пересчете на сухой воздух (без водяного пара).
** концентрация водяного пара значительно варьируется от примерно 0,0001 % по объему в самых холодных частях атмосферы до 5% по объему в горячих, влажных воздушных массах (в пересчете на сухой воздух).
*** водяной пар составляет около 0,25% по массе от массы всей атмосферы.
Многие вещества природного происхождения также могут присутствовать в воздухе в локально и сезонно изменяющихся малых количествах в виде аэрозолей. К ним относятся пыль, состоящая из различных минеральных и органических веществ (например, серы и сернистых соединений: сероводорода, диоксида серы и пр.), пыльца и споры, морские брызги и вулканический пепел.
Кроме того, различные промышленные загрязнители (сера, хлор и их соединения, пр.) могут присутствовать в воздухе в виде газов или аэрозолей.
Состав воздуха может меняться в небольших пределах: в крупных городах содержание углекислого газа немного выше, чем в лесах; в высокогорье и на больших высотах концентрация кислорода немного ниже вследствие того, что молекулы кислорода тяжелее молекул азота, и поэтому концентрация кислорода с высотой уменьшается быстрее.
Азот – основной компонент воздуха (78,084 % по объему и 75,5 % по массе) и один из самых распространённых элементов на Земле.
Азот является химическим элементом, необходимым для существования животных и растений, он входит в состав белков (16-18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле – около 2,5 % (четвёртое место после водорода, углерода и кислорода).
Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха. Химически весьма инертен.
Разделяя воздух на составные компоненты, получают промышленный азот. Более ¾ промышленного азота идёт на синтез аммиака, а остальная ¼ применяется в промышленности как инертная среда для множества технологических процессов. Жидкий азот используется как хладагент.
Кислород – второй по распространенности после азота компонент воздуха. В воздухе его содержится 20,9476 % по объему и 23,15 % по массе. Вместе с азотом эти два газа образуют порядка 99% всего атмосферного воздуха.
С начала кембрийского периода (кембрия) – 540 миллионов лет назад – содержание кислорода в воздухе колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
В дальнейшем содержание кислорода в воздухе уменьшилось до современных объемов и стабилизировалось.
Кроме того, кислород – это также самый распространённый в земной коре элемент, на его долю (в составе более 1500 соединений различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода – 85,82 % (по массе).
Кислород – химически активный неметалл. Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (химическая формула O2).
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. Он входит в состав белков, жиров, углеводов, аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. По числу атомов в живых клетках он составляет около 25 %, по массовой доле – около 65 %.
Биологическая роль кислорода заключается в том, что большинство живых организмов дышат кислородом. Молекулярный кислород используется живыми организмами для процессов синтеза энергии.
Переход кислорода из атмосферного воздуха в кровь и из крови в ткани зависит от разницы в его парциальном давлении, поэтому биологическое значение имеет парциальное давление кислорода, а не процентное содержание его в воздухе. На уровне моря парциальное давление кислорода равно 160 мм. При снижении его до 140 мм у человека появляются первые признаки гипоксии. Снижение парциального давления до 50-60 мм опасно для жизни.
Кислород постоянно пополняется в атмосфере Земли путем его фотосинтеза растениями, цианобактериями и зелеными водорослями. По некоторым оценкам, зеленые водоросли и цианобактерии в морской среде обеспечивают около 70% свободного кислорода, вырабатываемого на Земле, а остальная часть производится наземными растениями и деревьями.
Аргон – третий по распространенности после азота и кислорода компонент воздуха. В воздухе его содержится 0,934 % по объему и 1,292 % по массе.
Простое вещество аргон – инертный одноатомный газ без цвета, вкуса и запаха. Химически инертен.
Аргон не играет никакой заметной биологической роли. Вместе с тем вдыхание аргона может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Углекислый газ (диоксид углерода, двуокись углерода) – бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом – запахом газированной воды). Концентрация углекислого газа в атмосфере 0,0314 % по объему и 0,046 % по массе. Тяжелее воздуха приблизительно в 1,5 раза.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Углекислый газ образуется в качестве одного из конечных продуктов метаболизма в клетках тканей живых организмов. Далее углекислый газ переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ участвует в процессах фотосинтеза. Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль – повышается.
Углекислый газ нетоксичен. Но при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам. По ГОСТу 8050-85 углекислота относится к 4-му классу опасности.
Углекислый газ – возбудитель дыхательного центра. При его концентрации в воздухе 0,5% и выше отмечается увеличение легочной вентиляции. Незначительные повышения концентрации, вплоть до 2-4 %, в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7-10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа. При вдыхании воздуха с очень высокими концентрациями углекислого газа, несмотря на большую концентрацию кислорода в воздухе, смерть наступает очень быстро от удушья, вызванного гипоксией.
Неон – инертный одноатомный газ без цвета и запаха. Концентрация неона в воздухе 0,001818 % по объему и 0,0014 % по массе.
Заметной биологической роли не играет. Вместе с тем вдыхание неона может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Неон наряду с гелием в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Метан – простейший по составу предельный углеводород, при нормальных условиях бесцветный газ без вкуса и запаха.
Концентрация метана в воздухе 0,0002 % по объему и 0,000084 % по массе. Метан почти в два раза легче воздуха.
Метан в смеси с воздухом или кислородом горюч и взрывоопасен.
Метан является парниковым газом, более сильным в этом отношении, чем углекислый газ. Его вклад в парниковый эффект составляет 4-9 %. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность того же молярного объёма метана составит 21-25 единиц.
Метан по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Гелий – инертный одноатомный газ без цвета, вкуса и запаха.
Концентрация гелия в воздухе 0,000524 % по объему и 0,000073 % по массе.
Гелий не несёт какой-либо биологической функции. Вместе с тем вдыхание гелия может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Криптон – инертный одноатомный газ без цвета, вкуса и запаха.
Концентрация криптона в воздухе 0,000114 % по объему и 0,0003 % по массе.
Криптон не несёт какой-либо биологической функции. Вместе с тем вдыхание криптона может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Водород – самый лёгкий из элементов периодической таблицы химических элементов Д.И. Менделеева. Концентрация водорода в воздухе 0,00005 % по объему и 0,00008 % по массе.
При стандартных температуре и давлении водород – бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и взрывоопасен.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений. Лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере.
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %.
Поэтому значение водорода в химических процессах, происходящих на Земле и в живых организмах, почти так же велико, как и кислорода.
Будучи компонентом воздуха водород (как компонент воздуха) заметной биологической роли не играет.Ксенон – инертный одноатомный газ без цвета, вкуса и запаха.
Концентрация ксенона в воздухе 0,0000087 % по объему и 0,00004 % по массе.
Ксенон не несёт какой-либо биологической функции. Вместе с тем вдыхание ксенона может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Водяной пар – один из компонентов воздуха. Его концентрация значительно варьируется от примерно 0,0001 % по объему в самых холодных частях атмосферы до 5% по объему в горячих, влажных воздушных массах (в пересчете на сухой воздух). Водяной пар составляет около 0,25% по массе от массы всей атмосферы.
Концентрация водяного пара в воздухе зависит от температуры, влажности, времени года и климата. Так, при температуре 0 °C 1 м³ воздуха может содержать максимально 5 г воды, а при температуре +10 °C – уже 10 г.
Вода (оксид водорода) – это бинарное неорганическое соединение с химической формулой H2O. Молекула воды состоит из двух атомов водорода и одного – кислорода, которые соединены между собой ковалентной связью. При нормальных условиях вода представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии вода называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном – водяным паром.
Физические свойства воздуха:
| Наименование параметра | Значение |
| Цвет | бесцветный |
| Вкус | без вкуса |
| Запах | без запаха |
| Прозрачность | полностью прозрачен |
| Средняя молярная масса (средняя масса одного моля вещества), г/моль | 28,98 |
| Плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 0 °C , кг/м3 | 1,292 |
| Плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 0 °C , г/см3 | 0,001292 |
| Плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 20 °C , кг/м3 | 1,2041 |
| Плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 20 °C , г/см3 | 0,0012041 |
| Температура кипения воздуха при нормальном атмосферном давлении, оС | -192 |
| Температура плавления воздуха при нормальном атмосферном давлении, оС | -213 |
| Средняя удельная теплоемкость при постоянном давлении (101 325 Па или 1 атм.), кДж / (кг·К) | 1,006 |
| Средняя удельная теплоемкость при постоянном объеме (при нормальном атмосферном давлении), кДж/(кг·К) | 0,717 |
| Показатель адиабаты воздуха (отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме) (при нормальном атмосферном давлении) | 1,40 |
| Теплопроводность воздуха при 0 ℃ и нормальном атмосферном давлении, Вт / (м·К) | 0,0243 |
| Скорость звука в воздухе при нормальных условиях, м/с (км/ч) | 331 (1193) |
| Средний коэффициент теплового расширения воздуха в интервале температур 0-100°C (изменение объема при постепенном увеличении температуры при постоянном нормальном атмосферном давлении), 1/К | 3,67·10−3 |
| Коэффициент динамической вязкости воздуха при нормальных условиях и нормальном атмосферном давлении (динамическая вязкость – внутреннее сопротивление молекул движению внутри вещества согласно закону Ньютона), мкПа·с | 17,2 |
| Растворимость воздуха в воде, см3/л | 29,18 |
| Показатель преломления воздуха при нормальных условиях и нормальном атмосферном давлении (показатель преломления означает изменение угла движения световых и любых других волн в веществе) | 1,0002926 |
| Коэффициент изменения показателя преломления (при нормальных условиях и нормальном атмосферном давлении), 1/Pa | 2,8·10−9 |
| Средняя поляризуемость молекулы (при нормальных условиях и нормальном атмосферном давлении) | 1,7·10−30 |
Источник: https://ru.wikipedia.org/wiki/Воздух
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
9 990
Министерство
образования Российской Федерации
ТОМСКИЙ
ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Наименование
факультета -ЕНМФ
Наименование
учебной дисциплины — Физика
Лабораторная
работа № 1-26
Наименование
работы – Определение средней длинны
свободного пробега и эффективного
диаметра молекул воздуха.
Исполнитель:
Студент, группы
13А62 ( ) Василевская Е.О.
подпись
(_______)
дата
Руководитель,
профессор (_______) Крючков Ю.Ю.
Должность, ученая степень,
звание подпись
(_______)
дата
Томск –2007
ЦЕЛЬ
РАБОТЫ: Проверка применимости
модели идеального газа для воздуха при
комнатной температуре и атмосферном
давлении.
ПРИБОРЫ
И ПРЕНАДЛЕЖНОСТИ: сосуд с
пробиркой, в которую вставлен капилляр,
мерный сосуд для сбора вытекающей
жидкости; измерительная линейка для
определения высоты жидкости, микроскоп
с прозрачной градуировочной линейкой
и срез капилляра для определения его
радиуса.
КРАТКОЕ
ТЕОРИТИЧЕСКОЕ ВВЕДЕНИЕ.
Идеальным газом
называют систему материальных точек,
потенциальная энергия взаимодействиякоторых
пренебрежимо мала по сравнению с их
кинетической энергией.
Обмен энергией
между частицами происходит только в
момент удара. При этом, в большинстве
случаев, полагают удар двух частиц
абсолютно упругим, без перехода части
кинетической энергии в потенциальную
энергию возбужденной молекулы или
атома.
Подобная
модель является приближенной и хорошо
отвечает наблюдаемым свойствам газов
при выполнении условия D
<< <>,
где D – эффективный
диаметр частиц газа, а <>
— средняя длина свободного пробега
частиц между соударениями.
В данной работе
вычисляется средняя длина свободного
пробега по коэффициенту внутреннего
трения (вязкости).
Из
молекулярно-кинетической теории вытекает
формула, связывающая вязкость со средней
длиной свободного пробега молекулы.
Эта формула имеет вид
,
(1)
где—
коэффициент внутреннего трения
(вязкости);
—
плотность газа;
— средняя длина свободного пробега;
— средняя арифметическая скорость
теплового движения молекул. С учетом
максвелловского распределения молекул
по скоростям
.
(2)
Плотность
газа
при давлении P , температуре
T и молярной массе
.
(3)
Величину
внутреннего трения газа ()
можно определить, используя закон
Пуазейля, согласно которому объем газа,
протекающего по трубке радиусом r
, длиной
за время t выражается
следующим образом:
.
(4)
Комбинируя
(1) и (4) с учетом (2) и (3), получаем рабочую
формулу для расчета средней длины
пробега молекул
.
(5)
Учитывая, что
R = 8.31 Дж/К*моль,
= 0.029 кг/моль, рассчитываем коэффициент
пропорциональности в формуле (5)

Таким образом,
формула (5) примет следующий вид:
,
(6)
где r
– радиус капилляра;
— длина капилляра; P, T
– давление и температура воздуха в
помещении; V – объем
воздуха, вошедшего в сосуд за время t;
— разность давлений на концах капилляра.
Средняя длина свободного пробега
и эффективный диаметр молекулы D
связаны между собой соотношением
,
(7)
где n
– концентрация молекул газа пи давлении
(P) и температуре (T)
,
(8)
где
= 00С = 273 К; P0 =
760 мм рт.ст.
105
Па; n0 = 2.7 * 1025
— число Лошмидта, т.е. концентрация
молекул при нормальных условиях ().
Эффективный
диаметр молекулы воздуха (D)
можно вычислить из формулы (7), выражающей
его связь с длиной свободного пробега
().
С учетом соотношения (8), получим

(9)
Методика
измерения и описания экспериментальной
установки.
Фактически
задача определения <>
сводится к определению коэффициента
внутреннего терния
воздуха. Сосуд заполнен водой и закрыт
пробкой, через которую проходит
капиллярная трубка. При закрытом кране
давление воздуха над жидкостью равно
атмосферному давлению, т.к. сосуд
сообщается с атмосферой через капилляр.
Как только кран открывается, начинается
истечение жидкости непрерывной струей
до тех пор, пока сумма давлений воздуха
над жидкостью (P1) и
гидростатического давления жидкости
внутри сосуда на уровне отверстия ()
не станет равным атмосферному (),
то есть
(4)
С этого
момента жидкость будет выливаться
отдельными каплями. В капилляр будет
засасываться воздух, так как концы
капилляра будут находиться под разным
давлением Разность давлений на концах
капилляра с учетом (4)
(5)
Так как площадь
сечения сосуда велика, а объем вытекшей
жидкости будет незначительным, поэтому
в качестве
можно взять среднюю разность давления
на концах капилляра в начале и в конце
истечения жидкости
(6)
где
=103
кг/м3 – плотность воды, h1,h2
– высота уровня жидкости. Радиус
капилляра измеряют микроскопом.
Температура и атмосферное давление
воздуха измеряют термометром и барометром,
установленным в помещении лаборатории.
Объем воздуха, вошедший в сосуд, равен
объему вытекшей жидкости и определяется
мерным сосудом.
Результаты
проделанных измерений занес в таблицу
№1, предварительно выразив их в единицах
СИ.
Зависимость
высоты h от давления
Р
Таблица 1
|
№ изм. |
h1,м |
h2,м |
|
t,с |
r, м |
V,м3 |
T,K |
P,Па |
L,см |
Примечание |
|
1 |
0,302 |
0,277 |
2,895 |
180 |
0.15*10-3 |
50*10-6 |
292 |
98,05*10-3 |
0,07 |
Увеличение: |
|
2 |
0,301 |
0,278 |
2,895 |
177 |
0.15*10-3 |
50*10-6 |
292 |
98,05*10-3 |
0,07 |
Цена дел.-0,025 |
|
3 |
0,302 |
0,277 |
2,895 |
179 |
0.15*10-3 |
50*10-6 |
292 |
98,05*10-3 |
0,07 |
Рассчитываем
<λ> по формуле:
<λ>=
м
Рассчитываем
D по формуле:
D=
Рассчитаем
погрешность прямых измерений по формулам:
 ,
,
,
где

.

.
И запишем в
конечном виде.
r0=(0,150,025)·10-3м.
8%.
t0=(178,616,3)с.
6,4%.
∆Р0=(2,89546,1)Па.
2,8%.
Оценим погрешность
измерения <λ>:
Погрешность
косвенных измерений:
Окончательный
результат:
<λ>0=(1,6·10-6±0,8·10-6)м.
Относительная
погрешность результатов измерений <λ>:
ε=24%.
Окончательный
результат:
D0=(7±2)·10—8м.
ε=24%.
Вывод:
В ходе лабораторной
работы мы проверили применимость модели
идеального газа для воздуха при комнатной
температуре и давлении. Определили
среднюю длину свободного пробега
<λ>=1,63·10-6м. Эффективный диаметр
молекул воздуха получили равным
D=7,45·10—8м.
Так как длина свободного пробега
<λ>больше эффективного диаметра на
три порядка, то можно сделать вывод, что
взаимодействием молекул между собой
можно пренебречь. А так же рассчитана
погрешность косвенных измерений ε=24%
для длины свободного пробега и D.
Сведения
об авторах:
Составители:
студенты группы 13А61
Гайнутдинова
Юлия Идрисовна
Василевская
Екатерина Олеговна
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
29.05.2015676.35 Кб391.doc
- #
29.05.201594.21 Кб321.doc