Атомы и молекулы
Любые тела и предметы состоят из молекул — мелких частиц, на которые можно раздробить вещество физическими методами (например, растворением). Из этого вытекает определение молекулы: это самая мелкая частица вещества, сохраняющая его химические свойства.
Атомы — это мельчайшие частицы, сохраняющие свойства химического элемента, из них составляются молекулы. Атомы выделяются из молекул химическими методами.
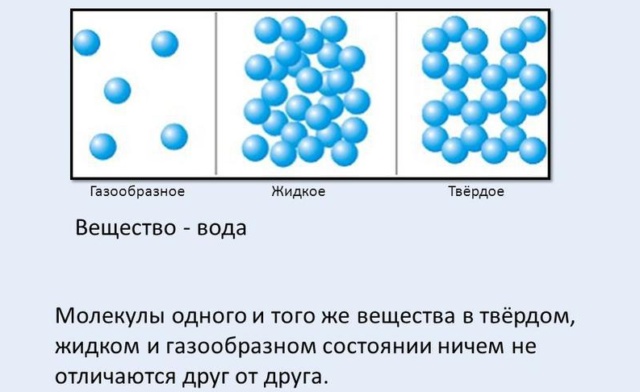
Химические вещества могут быть газообразными, жидкими и твердыми. Частицы твердых веществ расположены ближе, а газов — дальше друг от друга, и они находятся в постоянном движении. Чем выше температура тела, тем быстрее движение молекул и атомов в нем, называемое броуновским, и тем больше расстояние между частицами. Внутри этого «бульона» постоянно действуют силы взаимного притяжения и отталкивания частиц, которые выражены тем сильнее, чем меньше разделяющее их расстояние.
Виды веществ
Вещества определяются как молекулярные и немолекулярные, в зависимости от того, из каких частиц они состоят. Разные типы частиц создают разные виды взаимосвязей, и это определяет физические и химические свойства соединений.
Имеющие молекулярное строение
Здесь связи между отдельными молекулами относительно слабые, поэтому легко разрываются при нагреве, причем тем легче, чем меньше молекулярная масса. Поэтому такие вещества плавятся при низких температурах и в нормальных условиях многие из них находятся в жидком или газообразном состоянии.
Это могут быть простые вещества: сера (S8), азот (N2), кислород (O2) и сложные, например, оксиды азота с разной валентностью (N2O, NO, N2O5, NO3), углекислый газ (CO2), серная кислота (H2SO4).
Самый известный пример такого рода — вода. Человеческое тело содержит около 65% воды. Даже шкала Цельсия привязана к ее плавлению (0°С) и кипению (100°С). В нормальных условиях это жидкость, но в природе встречается во всех трех агрегатных состояниях в виде снега или льда, воды и пара.
Электрическая полярность молекулы задает воде интересные особенности. Например, ее удельная теплоемкость настолько велика, что это делает ее одним из главных регуляторов климата Земли. Интересно, что наибольшей плотности она достигает не в виде льда, а в жидком состоянии, при 4 °C. Поэтому возле дна скапливается самая тяжелая вода, не достигающая замерзания, а более легкий твердый лед выталкивается наверх.
Еще один пример — йод. В нормальных условиях он имеет форму кристаллов, а при нагревании сразу переходит в газообразное состояние, что называется возгонкой.
Строящиеся из немолекулярных частиц
Целые классы соединений состоят не из молекул, а из атомов или ионов. Поскольку электрические связи разнозаряженных ионов или ковалентные атомные связи крепче, чем межмолекулярные, они разрушаются при нагреве гораздо труднее. Поэтому такие вещества, как правило, имеют твердую форму и высокие температуры плавления и кипения. Их определяют как вещества немолекулярного строения.
Примеры:
- Атомные вещества.
- Металлы: натрий (Na), железо (Fe), медь (Cu).
- Неметаллы: бор (B), кремний (Si), углерод © в аллотропных формах графита и алмаза.
- Ионные.
- Соли: поваренная соль (NaCl), сульфат натрия (Na2SO4).
- Гидриды: лития (LiH).
- Оксиды: кальция (CaO), магния (MgO).
- Основания: натрия (NaOH), калия (KOH).
Таблица молекулярного и немолекулярного строения вещества:
| Строение вещества | Молекулярное | Немолекулярное |
| Мельчайшие структурные единицы | Молекулы | Ионы и атомы |
| Агрегатное состояние | Газообразное, жидкое, твердое | В основном, твердое |
| Температуры плавления и кипения | Низкие | Высокие |
Аморфные и кристаллические вещества
Твердые вещества могут быть аморфными или кристаллическими.
Кристаллические отличаются тем, что их структурные единицы располагаются в повторяющемся порядке, образуя кристаллические решетки.
Аморфные соединения имеют в своем составе длинные тяжелые молекулы, которые не помещаются в правильные структуры кристаллических решеток, и поэтому переход из твердого состояния в жидкое у них совершается постепенно, без четкой границы. То есть аморфные вещества не имеют точно определенной температуры плавления. Очень знакомый пример такого типа — пластилин, который используется в мягком, а не твердом или жидком состоянии. Также это различные пластмассы, смолы, стекло.
Пластичность и мягкость разогретого стекла дает возможность лепить из него, как из пластилина, только не руками, а инструментами. Стеклянная посуда, лампочки, трубки, оконное стекло — все это было бы невозможно сделать из кристаллических веществ. А как выручают человека полиэтиленовые бутылки и фасовочные пакетики!
Еще один близкий пример — сахарная карамель. Она при нагревании становится тягучей, мягкой, как и все аморфные вещества. А если дать карамели залежаться в сухом помещении несколько месяцев, ее поверхность покроется белым налетом маленьких кристаллов сахара. То есть некоторые аморфные вещества способны переходить в кристаллическую форму.
Типы кристаллических решеток
Разные виды частиц образуют разные кристаллические решетки. Существует 4 их типа:
- ионные;
- атомные;
- молекулярные;
- металлические.
Ионный тип кристалла
Это вид решетки, образуемый ионами — частицами, несущими на себе разноименные электрические заряды, чередующиеся в узлах решетки. Электроотрицательность анионов притягивает к себе положительно заряженные катионы, что придает решетке твердость. Поэтому такие соединения тугоплавки, зато хрупки, обладают хорошей растворимостью в воде и электропроводностью. Это основания, основные оксиды, органические и неорганические соли.
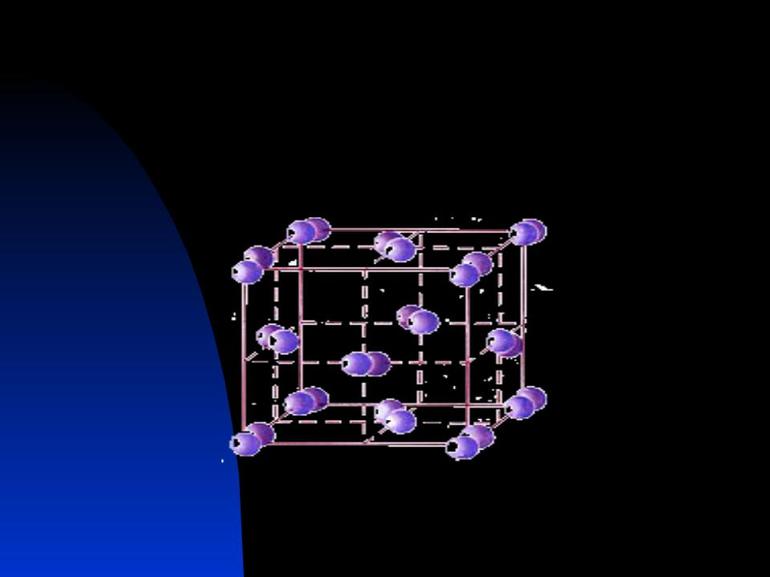
Пример такого кристалла — обычная поваренная соль, хлорид натрия. Его кубическая решетка сформирована катионами Na+ и анионами Cl-.
Атомная решетка
Этот вид кристаллов сформирован атомами, образующими между собой полярные и неполярные ковалентные связи. Такие связи очень прочны, поэтому эти вещества обладают высокой твердостью, тугоплавки и не растворяются в воде. В природе они мало распространены.
Характерный пример — углерод, имеющий две аллотропных формы, и обе — атомного типа.
Кристалл графита имеет слоистую структуру, атомы в слоях расположены по углам шестиугольника, расстояние между слоями значительно больше и межатомные связи слабее, чем внутри слоя. Поэтому кристалл хрупкий, легко расслаивается и крошится. Благодаря этому свойству, графит используется в карандашах или в виде графитовой смазки.
Алмаз — очень плотный кристалл кубической формы, среди природных минералов имеет наивысшую твердость. Образуется такая форма углерода из графита при очень высоких температуре и давлении.
Другие примеры: бор (B), германий (Ge), кремний (Si), оксид кремния (SiO2), карбид (B4C) и нитрид (BN) бора.
Состоящая из молекул
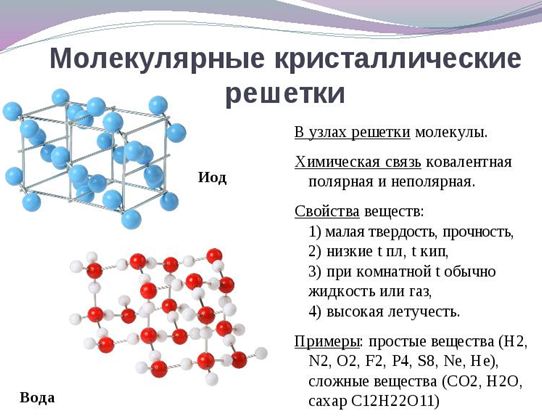
Такая решетка имеет в узлах молекулы. Силы межмолекулярного притяжения относительно слабее, и это определяет свойства веществ с молекулярной кристаллической решеткой — их кристаллы непрочные, плавятся при низких температурах, не электропроводны.
Примеры веществ с молекулярной кристаллической решеткой: полярной ковалентной связью обладает вода (H2O); а соединения неполярной ковалентной связью — твердый оксид углерода (CO2), сера (S8).
Очень интересно, что сера образует два вида кристаллов. В нормальных условиях кристаллы серы имеют интересную усечённо-ромбическую форму, а при 96 °C и выше вырастают длинные игольчатые кристаллы.
Также молекулярные кристаллы образуют многие из твердых органических соединений с достаточно сложной формулой: сахар, глюкоза.
Металлическая решетка
Эта решетка выделяется из общего ряда необычностью строения. Атомы металла, расположенные в узлах решетки, легко расстаются с внешними электронами, что превращает атом в катион, а свободно блуждающие электроны создают делокализованное электронное облако. Эта необычность определяет характерные особенности металлов: ковкость, пластичность, металлический блеск, электро- и теплопроводность.
Ионы более химически активны, чем электронейтральные атомы, этим объясняется способность металлов к поверхностному окислению. Окислы некоторых металлов, например, алюминия, образуют пленку, защищающую поверхность от контакта с кислородом воздуха. Такая особенность даже используется для защиты металлических изделий. Металлы, окислы которых образуют рыхлую структуру (например, железо), подвержены коррозии в гораздо большей степени. Примеры: железо (Fe), серебро (Ag), медь (Cu), алюминий (Al).
Вещества молекулярного строения

4.4
Средняя оценка: 4.4
Всего получено оценок: 543.
4.4
Средняя оценка: 4.4
Всего получено оценок: 543.
Все вещества состоят из атомов, которые объединяются в определенные структуры с помощью различных устойчивых связей. При этом структурная решетка физического тела может состоять, либо из отдельных однотипных групп атомов — молекул, либо из отдельных атомов. По типу связей различают вещества молекулярного и немолекулярного строения. Рассмотрим примеры веществ с молекулярным типом строения.
Строение вещества
Агрегатное состояние вещества (твердое, жидкое или газообразное) и особенности его строения определяются взаимодействием атомов и молекул, из которых состоят все вещества. Теория о молекулярном устройстве всех физических объектов подтвердилась многочисленными экспериментами. Современные приборы (электронные микроскопы) позволяют даже увидеть и сфотографировать отдельные молекулы и их расположение (структуру).
Перечислим базовые положения о молекулярном устройстве веществ:
- Все физические тела состоят из молекул — мелких частиц, каждая из которых имеет все основные химические и физические свойства, присущие всему веществу;
- Молекулы состоят из атомов;
- Атомы состоят из отрицательно заряженных электронов и ядра, включающего в себя положительно заряженные протоны и нейтроны, не имеющие зарядов;
- Молекулы вещества находятся в непрерывном, хаотическом движении;
- Взаимодействие частиц имеет электромагнитную природу: при сближении происходит отталкивание, а при удалении друг от друга возобновляется притяжение. В равновесном состоянии силы притяжения и отталкивания уравновешивают друг другу.
Древнегреческий философ Демокрит, живший более 2000 лет назад считается первым мыслителем, создавшим учение (теорию) о том, что весь наш мир построен из мельчайших. невидимых частичек — атомов. Слово атом имеет греческое происхождение (“атомос” — неделимый, неразрезаемый). Эта замечательная идея позднее была надолго забыта. Более тысячи лет безраздельно господствовало учение другого философа — Аристотеля, который отрицал существование атомов. Аристотель утверждал, что все вещества могут взаимно превращаться друг в друга, и любое тело можно делить до бесконечности. И Демокрит, и Аристотель строили свои предположения на основе общих, теоретических рассуждений. Только в начале ХIХ века на основе многочисленных опытов и экспериментов ученые (Гассенди, Ломоносов, Бойль, Мариотт, Дальтон и др.) окончательно пришли к общему мнению о реальности существования атомов и молекул.
Свойства веществ молекулярного строения
Для описания веществ со схожими свойствами выделяют два основных вида: вещества немолекулярного строения и вещества молекулярного строения. Вещества, состоящие из однотипных молекул, имеющих в своем составе один и тот же набор атомов, называются веществами молекулярного строения. Общими для этих веществ являются следующие свойства:
- Слабые связи между молекулами, которые при небольшом повышении температуры начинают разрываться — сначала происходит переход в жидкое состояние, а затем в газовую фазу;
- Низкие температуры плавления и кипения.
Примеры веществ молекулярного строения
К молекулярным веществам относятся:
- Большинство простых веществ-неметаллов: кислород (O2), сера (S2), фосфор (P4), водород (H2), азот (N2), хлор (Cl2), фтор (F2), бром (Br2), йод (I2);
- Соединения веществ-неметаллов друг с другом: аммиак (NH3), углекислый газ (CO2), серная кислота (HSO4), оксид азота (N2O5);
- Сахар;
- Нафталин.
Молекулярная кристаллическая решетка образована молекулами, которые соединены между собой слабыми силами межмолекулярного притяжения. Поэтому эти вещества летучи (их можно обнаружить по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Чаще всего молекулярные вещества при нормальных условиях находятся в жидком или газообразном агрегатном состоянии. Некоторые молекулярные вещества могут быть в твердом виде, но их отличительными свойствами являются: легкоплавкость и растворимость в воде (если в узлах полярные молекулы). Примерами таких веществ могут служить: сахар, глюкоза, нафталин, CO2 (“сухой лед”).
Атомов в составе молекулы может быть от 2 штук до бесконечности. Одно из первых мест по количеству атомов занимает молекула ДНК (дезоксирибонуклеиновая — кислота). В одной молекуле ДНК содержится атомов:
- углерода — 5750;
- водорода — 7227;
- кислорода — 4131;
- азота — 2215;
- фосфора — 590.
Что мы узнали?
Итак, мы узнали, что к веществам с молекулярным строением относятся газообразные, жидкие и твердые вещества, молекулярная кристаллическая решетка которых образована молекулами, соединенными между собой слабыми силами межмолекулярного притяжения. Такие вещества летучи (обнаруживаются по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Muhammad Gasanov
5/5
-
Александр Котков
5/5
-
Айша Алиева
5/5
-
Наталья Андрейко
4/5
Оценка доклада
4.4
Средняя оценка: 4.4
Всего получено оценок: 543.
А какая ваша оценка?
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещество при заданных условиях может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Свойства вещества зависят также от характера химической связи между образующими его частицами — молекулами, атомами или ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой ($C, Si, Li, Na, K, Cu, Fe, W$), среди них есть металлы и неметаллы.
Рассмотрим физические свойства щелочных металлов. Относительно малая прочность связи между атомами обуславливает низкую механическую прочность: щелочные металлы мягкие, легко режутся ножом.
Большие размеры атомов приводят к малой плотности щелочных металлов: литий, натрий и калий даже легче воды. В группе щелочных металлов температуры кипения и плавления понижаются с увеличением порядкового номера элемента, т.к. размеры атомов увеличиваются, и ослабевают связи.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли ($NaCl, K_2SO_4$), некоторые гидриды ($LiH$) и оксиды ($CaO, MgO, FeO$), основания ($NaOH, KOH$). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Вещество, как известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Твердые вещества: аморфные и кристаллические.
Рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки.
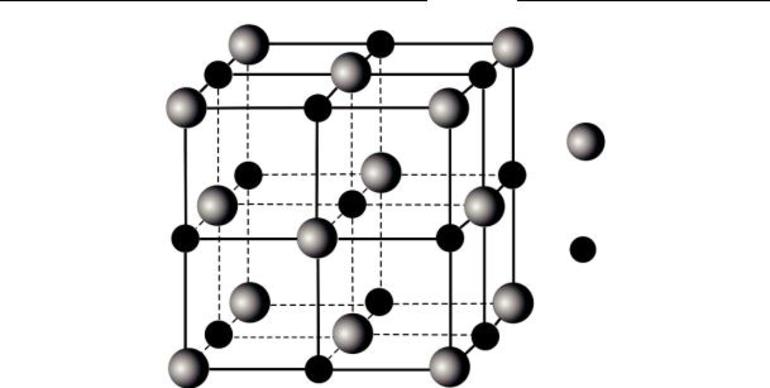
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы $Na^{+}, Cl^{–}$, так и сложные $SO_4^{2−}, ОН^–$. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия состоит из чередующихся положительных ионов $Na^+$ и отрицательных $Cl^–$, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки.
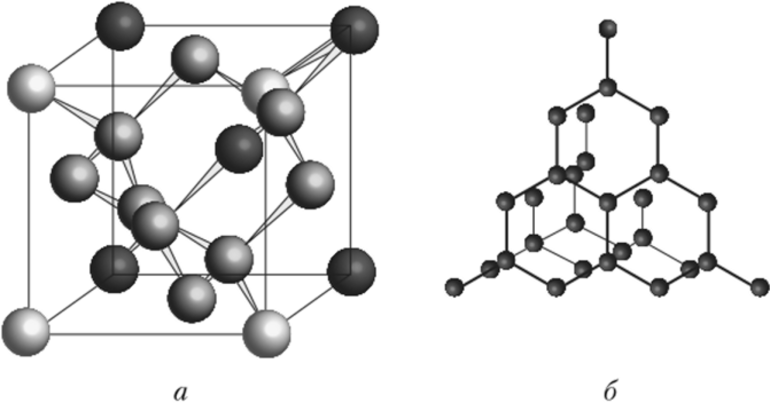
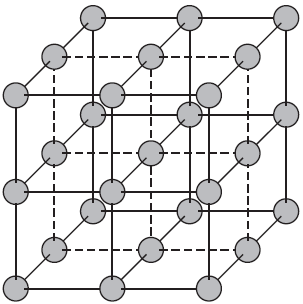
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она выше $3500°С$), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными ($HCl, H_2O$), и неполярными ($N_2, O_2$). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки.
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Молекулярное и немолекулярное строение
16-Май-2013 | Нет комментариев | Лолита Окольнова
Задание А6 ЕГЭ по химии —
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Темы, которые нужно знать:
- Закономерности изменения химических свойств элементов и их соединений
- Виды химической связи
Давайте определим свойства веществ молекулярного строения и немолекулярного.
| Вещества молекулярного строения | Вещества немолекулярного строения |
|
|
Типы кристаллических решеток
- Ионная кристаллическая решетка — характерна для соединений с ионной связью, в узлах решетки находятся, соответственно, ионы. Связи очень прочные, поэтому и температуры плавления высокие. Ее образуют неорганические соли, основания, основные оксиды, органические соли.
- Атомная кристаллическая решетка — связь — ковалентная, очень прочная. Примером может служить алмаз — вещество, имеющее максимальный показатель твердости, очень низкая растворимость, малореакционноспособны.
Характерна для B, Si, Ge, силициды (Si4- ), карбиды и нитриды бора, SiO2
- Молекулярная кристаллическая решетка — состоит из молекул, которые удерживаются между собой межмолекулярными связями, поэтому они непрочные — низкие температуры плавления, неэлектропроводны. Молекулярную кристаллическую решетку имеют все твердые вещества с полярной или неполярной ковалентной связью: J2, S2, твердый CO2 («сухой лед»), твердые органические вещества (кроме солей) и т.д.
- Металлическая кристаллическая решетка — в узлах содержит атомы и ионы металлов. Очень прочная металлическая связь со всеми характерными свойствами: делокализованное электронное облако, электро- и теплопроводность, металлический блеск, пластичность, ковкость.
Получается, что металлическая и атомарная кристаллические решетки схожи, но есть основное отличие — вещества с металлической решеткой проводят электрический ток и пластичны.
Для определения типа кристаллической решетки необходимо сначала определить — имеет вещество молекулярное или немолекулярное строение, затем уже определить вид химической связи и по нему уже выбирать вариант решетки.
Обсуждение: «Молекулярное и немолекулярное строение»
(Правила комментирования)
Существуют вещества с молекулярным и немолекулярным строением.
Между молекулами возникают силы взаимного притяжения и отталкивания. Наиболее выражены эти силы в твёрдых веществах, а наименее — в газах.
Силы взаимодействия между молекулами слабые, поэтому молекулярные вещества летучи, имеют низкие температуры плавления и кипения. Все газообразные и жидкие при обычных условиях вещества состоят из молекул. Молекулярные вещества могут быть и твёрдыми, но узнать их можно по легкоплавкости.
Обрати внимание!
Газы, жидкости и легкоплавкие твёрдые вещества имеют молекулярное строение.
Все вещества, имеющие запах, имеют молекулярное строение.
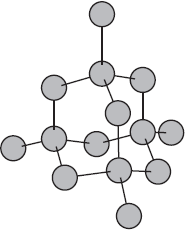
Атомы могут соединяться друг с другом и другим способом. Так, в кристаллах алмаза, графита, песка все атомы соединены в единое целое, и молекулу выделить в них невозможно.
Рис. (1). Строение алмаза
Подобное строение имеют железо, медь, цинк, алюминий и другие металлы.
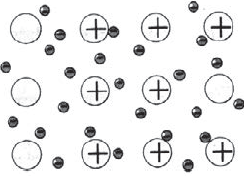
В некоторых сложных веществах атомы превращаются в заряженные частицы — ионы — и тоже молекул не образуют. Противоположно заряженные ионы притягиваются друг к другу и образуют твёрдое тугоплавкое вещество. Такое строение имеют поваренная соль, мел, питьевая сода, медный купорос, щёлочь.
Рис. (2). Строение поваренной соли
Такие вещества называют немолекулярными. В их кристаллах связи между частицами прочные, поэтому все немолекулярные вещества твёрдые, нелетучие, тугоплавкие.
Источники:
Рис. 1. Строение алмаза https://image.shutterstock.com/image-vector/illustration-chemical-carbon-has-several-600w-1717122967.jpg
Рис. 2. Строение поваренной соли https://upload.wikimedia.org/wikipedia/commons/e/e9/Sodium-chloride-3D-ionic.png