Метод определения простейшей формулы эфира
Некоторые задачи в тестах ЕГЭ представляют собой комбинацию двух более простых задач. Рассмотрим такой пример.
Задача 2.8.
При взаимодействии одноатомного спирта, содержащего 37,5% углерода и 50% кислорода, с органической кислотой образуется вещество, плотность паров которого по аргону равна 2,15. Определите молекулярную формулу образующегося вещества.
Дано:
массовая доля углерода в спирте: 
массовая доля кислорода в спирте: 
относительная плотность паров эфира по аргону: D(Аr) = 2,15.
Найти: молекулярную формулу эфира.
Решение:
Данная задача представляет собой комбинацию двух более простых задач. В первой из них требуется узнать формулу спирта по значениям массовых долей элементов в нем. Во второй части требуется выявить формулу эфира по его молярной массе. Рассмотрим ход решения более подробно.
Шаг 1. Очевидно, что при взаимодействии одноатомного спирта с органической кислотой образуется сложный эфир. Если предположить, что в реакции участвовала карбоновая кислота, то в состав образовавшегося сложного эфира входят углерод, водород и кислород.
Шаг 2. Для составления уравнения реакции необходимо определить формулы спирта и кислоты. В условии указано, что спирт был одноатомным, следовательно, в его состав входил лишь один атом кислорода. Соотношение атомов углерода и водорода в углеводородном радикале нам неизвестно. Поэтому формулу спирта обозначим как СxHyOH.
В отношении карбоновой кислоты в условии нет никакой информации, но небольшое значение молярной массы эфира, рассчитанное по относительной плотности его паров позволяет утверждать, что она была одноосновная. Обозначим ее формулу как СzHkCOOH.
Запишем реакцию этерификации:
Шаг 3. По значениям массовых долей элементов определим соотношение атомов в молекуле спирта.
Сначала определим массовую долю водорода. Так как в состав спирта входит только углерод, кислород и водород, сумма их массовых долей составит 100% :






Теперь необходимо произвольно выбрать некоторый образец, в котором мы будем определять соотношение количеств веществ элементов. В условии указана информация о массовой доле, поэтому удобно выбрать образец массой 100 г. В этом случае числовые значения массовой доли каждого элемента совпадут с его массой в этом стограммовом образце.
Итак, в 100 г искомого вещества содержится 37,5 г углерода, 12,5 г водорода и 50 г кислорода.
Далее вычислим соотношение количеств вещества (n) углерода, водорода и кислорода.
Шаг 4. Находим простейшую формулу.
n(С): n(H) : n(О) = 3,125 : 12,5 : 3,125
Выбираем наименьшее значение (в данном случае «3,125») и делим на него все три числа:
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: СН4О.
Шаг 5. В условии есть указание на одноатомность спирта. Это значит, что его молекула содержит только один атом кислорода. Следовательно, индексы в простейшей формуле увеличивать не надо, она совпадает с истинной. Запишем истинную формулу спирта, выделив в ней гидроксильную группу: СН3ОН.
с учетом найденной формулы спирта будет иметь следующий вид:
По относительной плотности паров по аргону определяем истинную молярную массу эфира:
М(эфира) = D(Аr) . M(Аr) = 2,15 . 40 = 86 г/моль.
Определим вклад в общую молярную массу углеводородного радикала — остатка от карбоновой кислоты:
М(СzHk) = 86 – (12 + 1 . 3 + 16 . 2 + 12) = 27 г/моль.
По значениям молярных масс элементов составляем математическое уравнение с двумя неизвестными:
12 . z + 1 . k = 27
Пренебрегая вкладом массы водорода в общую массу, получаем математическое уравнение, позволяющее оценить количество атомов углерода в молекуле:
Если количество атомов углерода в углеводородном радикале равно 2, то подставляя z = 2 в математическое уравнение с двумя неизвестными получаем:
12 . 2 + 1 . k = 27
k = 8.
Следовательно, углеводородный радикал оставшейся в молекуле эфира от карбоновой кислоты имеет формулу: С2Н3.
Формула эфира для формирования ответа будет иметь вид:
A chemical formula is a way of describing the information about the chemical proportions of atoms that make up a certain chemical compound or molecule. It uses the symbols of the chemical element and numbers, and also occasionally uses other symbols such as brackets, dashes, square brackets, commas, plus (+), and minus (-) signs. There are different types of chemical formulae like empirical formula, molecular formula, structural formula, and condensed formula. Let’s discuss the molecular formula and its calculation with examples in detail in this article.
What is Molecular Formula?
The molecular formula specifies the actual number of each type of atom in a molecule. For example, the molecular formula of benzene is C6H6, i.e., it is composed of six carbon and six hydrogen atoms. The molecular formula helps in determining whether a chemical compound is a binary compound, ternary compound, quaternary compound, or has even more elements depending upon the number of elements in a molecule. A molecular formula is always a multiple of the empirical formula, where an empirical formula for a chemical compound is defined as a simple expression that represents the ratio of the elements in the compound. For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO. We need the molar mass of a compound to find the molecular formula of a compound, and it is often derived after obtaining the empirical formula. Though molecular formulae are simple and easy to understand, they lack the knowledge concerning the atomic arrangement and bonding that is presented in a molecular formula. A molecular formula gives more information about a molecule than its empirical formula, however, it is more difficult to establish.
Relation between Molecular Formula and Empirical Formula
The molecular formula specifies the actual number of each type of atom in a molecule, whereas an empirical formula for a chemical compound is a simple expression that represents the ratio of the elements in the compound. For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO. Here, the n-factor is 2. The empirical formula might be the same for different chemical compounds. For example, glucose, formaldehyde, and acetic acid have the same empirical formula, CH2O, but their molecular formulae are different. For some chemical compounds, both formulae are the same, like water (H2O), hypochlorous acid (HClO), formaldehyde (CH2O), methane (CH4), etc.
M = n × E
where,
M is the molecular formula
n is the ratio of molar mass and empirical formula mass
E is the empirical formula
How to Calculate Molecular Formula?
The molecular formula of a chemical compound can be found in the following ways:
Using Composition and Molecular Weight
Step 1: Multiply the molecular weight with the given component percentage.
Step 2: Divide each value obtained by the atomic weight of that atom.
Step 3: Round off the obtained values to the closest whole number. Finally, write the molecular formula.
Example: A compound is composed of 82.78% nitrogen and 17.22% hydrogen. If its molecular weight is 17.031 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of a compound = 17.031 g/mol
Nitrogen percentage in the given compound = 82.78%
Hydrogen percentage in the given compound = 17.22%
Step 1: Multiply the molecular weight with the given component percentage.
Nitrogen = 17.031 × (82.78/100) = 14.0982
Hydrogen = 17.031 × (17.22/100) = 2.9327
Step 2: Divide each value obtained by the atomic weight of that atom.
Nitrogen: 14.0982/14.0067 = 1.00654
Hydrogen: 2.9327/1.00794 = 2.90960
Step 3: Round off the obtained values to the closest whole number.
Nitrogen: 1
Hydrogen: 3
Thus, the molecular formula of the given compound is NH3.
Using Empirical Formula and Molecular Weight
Step 1: Calculate the empirical formula mass from the given empirical formula.
Step 2: Find the n-factor by using its formula. n = Molar Mass/Empirical Formula Mass
Step 3: Now, multiply all the subscripts in the empirical formula by n and the resultant formula is the required molecular formula.
Example: The empirical formula of a compound of carbon, hydrogen, and oxygen is HO. If its molar mass is 34.014 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = CH2O
The molar mass of the compound = 60.052 g/mol
Step 1: First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 1.00794 + 15.9994
= 2.01588 + 31.9988
= 17.007 g/mol
Step 2: Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 60.052/17.007 = 2
Step 3: Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 2 × (HO) = H2O2
Hence, the molecular formula of the compound is H2O2.
Solved Examples on Molecular Formula
Example 1: A compound is composed of 68.29% carbon, 12.02% hydrogen, and 21.69% oxygen. If its molecular weight is 86.136 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of a compound = 86.136 g/mol
Carbon percentage in the given compound = 68.29%
Hydrogen percentage in the given compound = 12.02%
Oxygen percentage in the given compound = 21.69%
Step 1: Multiply the molecular weight with the given component percentage.
Carbon = 86.136 × (68.29/100) = 58.8223
Hydrogen =86.136 × (12.02/100) = 10.3535
Oxygen = 86.136 × (21.69/100) = 18.6828
Step 2: Divide each value obtained by the atomic weight of that atom.
Carbon: 58.8223 /12.0107 = 4.8973
Hydrogen: 10.3535/1.00794 = 10.2719
Oxygen: 18.6828/15.9994 = 1.1677
Step 3: Round off the obtained values to the closest whole number.
Carbon: 5
Hydrogen: 10
Oxygen: 1
Thus, the molecular formula of the given compound is C5H10O.
Example 2: Oxalic acid is composed of 27.42% carbon, 2.33% hydrogen, and 70.25% oxygen. If its molecular weight is 90.035 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of oxalic acid = 90.035 g/mol
Carbon percentage in oxalic acid = 27.42%
Hydrogen percentage in oxalic acid = 2.33%
Oxygen percentage in oxalic acid = 70.25%
Step 1: Multiply the molecular weight with the given component percentage.
Carbon = 90.035 × (27.42/100) = 24.6875
Hydrogen = 90.035 × (2.33/100) = 2.0978
Oxygen = 90.035 × (70.25/100) = 63.2496
Step 2: Divide each value obtained by the atomic weight of that atom.
Carbon = 24.6875/12.0107 = 2.0554
Hydrogen: 10.3535/1.00794 = 2.08127
Oxygen: 63.2496/15.9994 = 3.9532
Step 3: Round off the obtained values to the closest whole number.
Carbon: 2
Hydrogen: 2
Oxygen: 4
Thus, the molecular formula of the given compound is C2H2O4.
Example 3: The empirical formula of a compound of carbon, hydrogen, and oxygen is CH2O. If its molar mass is 60.052 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = CH2O
The molar mass of the compound = 60.052 g/mol
First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 12.0107 + 2 × 1.00794 + 15.9994
= 30.026 g/mol
Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 60.052/30.026 = 2
Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 2 × (CH2O) = C2H4O2
Hence, the molecular formula of the compound is C2H4O2.
Example 4: Boric acid is composed of 21.14% boron, 4.65% hydrogen, and 74.21% oxygen. If its molecular weight is 61.83 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of boric acid = 61.83 g/mol
Boron percentage in boric acid = 27.42%
Hydrogen percentage in boric acid = 4.65%
Oxygen percentage in boric acid = 68.79%
Step 1: Multiply the molecular weight with the given component percentage.
Boron = 61.83 × (21.14/100) = 13.0709
Hydrogen = 61.83 × (4.65/100) = 2.8750
Oxygen = 61.83 × (74.21/100) = 45.8840
Step 2: Divide each value obtained by the atomic weight of that atom.
Boron: 13.6891/10.811 = 1.209
Hydrogen: 2.2568/1.00794 = 2.8524
Oxygen: 32.2320/15.9994 = 2.8679
Step 3: Round off the obtained values to the closest whole number.
Boron: 1
Hydrogen: 3
Oxygen: 3
Thus, the molecular formula of the given compound is H3BO3.
Example 5: The empirical formula of a compound that is composed of hydrogen, chlorine, and oxygen is HClO. If its molar mass is 52.46 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = HClO
The molar mass of the compound = 52.46 g/mol
First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 1.00794 + 35.453 + 15.9994
= 52.460 g/mol
Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 52.460/52.46 = 1
Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 1 × (HClO) = HClO
Here, the empirical formula and the molecular formula of the given compound are the same.
Hence, the molecular formula of the compound is HClO.
FAQs on Molecular Formula
Question 1: What is meant by a chemical formula?
Answer:
A chemical formula is a way of describing the information about the chemical proportions of atoms that make up a certain chemical compound or molecule. It uses the symbols of the chemical element and numbers, and also occasionally uses other symbols such as brackets, dashes, square brackets, commas, plus (+), and minus (-) signs. There are different types of chemical formulae like the empirical formula, molecular formula, structural formula, and condensed formula.
Question 2: Define molecular formula and give an example.
Answer:
The Molecular Formula specifies the actual number of each type of atom in a molecule. For example, the molecular formula of benzene is C6H6, i.e., it is composed of six carbon and six hydrogen atoms. We need the molar mass of a compound to find the molecular formula of a compound, and it is often derived after obtaining the empirical formula.
Question 3: What is the difference between the empirical formula and the molecular formula?
Answer:
- The molecular formula specifies the actual number of each type of atom in a molecule, whereas an empirical formula for a chemical compound is a simple expression that represents the ratio of the elements in the compound.
- For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO.
- The empirical formula might be the same for different chemical compounds. For example, glucose, formaldehyde, and acetic acid have the same empirical formula, CH2O, but their molecular formulae are different.
- For some chemical compounds, both formulae are the same, like water (H2O), hypochlorous acid (HClO), formaldehyde (CH2O), methane (CH4), etc.
Question 4: What is the relationship between the empirical formula and the molecular formula?
Answer:
A molecular formula is always a multiple of the empirical formula and the relationship between the empirical formula and the molecular formula is given as follows:
Molecular Formula = n × (Empirical formula) (where n is a positive integer)
where “n” is the ratio of molar mass and empirical formula mass.
n = Molar Mass/Empirical Formula Mass
Question 5: What are the molecular formulae of glucose, dichlorine hexoxide, and dimethyl ether?
Answer:
Molecular formula of glucose = C6H12O6
Molecular formula of dichlorine hexoxide = Cl2O6
Molecular formula of dimethyl ether = C2H6O.
Related Resources
- Molecular Weight
- Chemical Formula of Common Compounds
- Molar Mass
Формула эфира
Определение и формула эфира
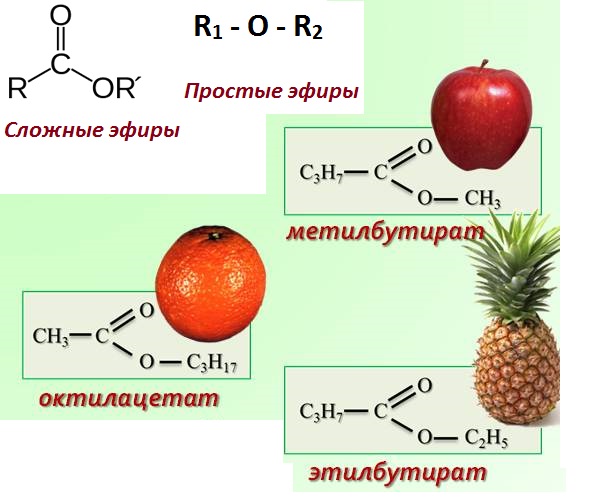
Химическая формула: простой эфир – , где
– это углеводородный радикал.
Химическая формула: сложный эфир – , где
– это углеводородный радикал.
Физические свойства простого эфира – и
являются газами, остальные подвижные легкокипящие жидкости. Эфиры плохо растворимы в воде, легче воды, имеют приятный запах.
Физические свойства сложного эфира – сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов — летучие бесцветные жидкости с характерным, зачастую фруктовым запахом. Сложные эфиры высших карбоновых кислот — бесцветные твердые вещества.
Химические свойства эфира
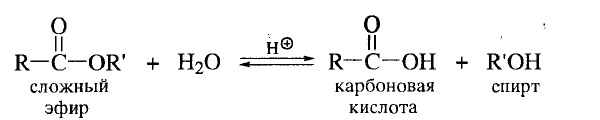
- Сложные эфиры подвергаются гидролизу:
- Они вступают в реакцию переэтерификации:
- Подвергаются восстановлению:
Применение
Эфиры широко распространены в природе и широко используются в промышленности. Природные жиры — это триэфиры, полученные из глицерина и жирных кислот. Эфиры ответственны за аромат многих фруктов, в том числе яблок, груш, бананов, ананасов, клубники. Несколько миллиардов килограммов полиэфиров производятся промышленностью ежегодно, важные продукты — полиэтилентерефталаты, акрилатные сложные эфиры, и ацетат целлюлозы.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Решение
задач на спирты
2. Предельный простой эфир массой 10 г при
нормальных условиях занимает объем 4.87 л. Выведите молекулярную
формулу эфира.
3. Относительная плотность паров
органического соединения по воздуху равна 2,552. Массовая доля углерода в этом
веществе равна 64,86%, массовая доля водорода равна 13,51%,
массовая доля кислорода равна 21,63%. Выведите молекулярную формулу этого
вещества.
4. Относительная плотность паров
органического соединения по водороду равна 65. Массовая доля углерода в этом
веществе равна 73,85%, массовая доля водорода равна 13,85%, массовая доля
кислорода равна 12,3%. Выведите молекулярную
формулу этого вещества.

Относительная плотность паров органического соединения по водороду равна 51.
При сжигании 30,6 г этого вещества образовалось 79,2 г диоксида углерода и 37,8
г воды. Выведите молекулярную формулу органического соединения.
6. Относительная плотность паров
органического соединения по кислороду равна 3,625.11ри сжигании 29 г этого
вещества образуется 39,2 л углекислого газа (н. у.) и 36 г воды. Выведите
молекулярную формулу органического соединения.
Учитель: А
кто помнит где используется фенол?
Учитель. Хорошо.
Знаете ли вы, что в результате гидролиза аспирина образуется образуется фенол? Это
должные знать те хозяйки, которые любят консервировать огурцы и помидоры и
вместо уксусной кислоты добавляют таблетки аспирина.
НООС-С6Н4-О-СО-СН3 (аспирин) + Н2О (t) =
НООС-С6Н4-ОН (гидроксибензойная к-та) + СН3СООН (уксусная к-та)
При нагревании салициловая кислота легко
декарбоксилируется с образованием фенола:
С6H4(OH)COOH=C6H5OH
+ CO2
Но фенол и его производные без труда
проникают в организм человека через кожу и желудочно-кишечный тракт, а пары
фенола – через легкие. В организме фенол легко образует соединения с другими
веществами, присутствующими в организме. Чем выше концентрация фенола в крови,
тем сильнее его неблагоприятное влияние на здоровье человека. Продукты
взаимодействия фенола с другими веществами, а также часть несвязанного фенола
выводятся с мочой.
7. Задача: Найти формулу вещества по
следующим данным: плотность вещества по водороду 31, массовые доли С – 38,7%,
кислорода – 51,6% , водорода – 9,7%
Решение задачи.
- Находим количественный состав
вещества ﻻ= - Ач(С) – 12г/моль
Ач(О) – 16г/моль
Ач(H) – 1г/моль
- Подставляем числовые данные CxHyOz
- x:y:z=
(C):
(O):
(H)=
- Простейшая формула: (CH3O)*2
M=31г/моль - М (ист) = p(H)*M(H2)=32*2=62г/моль
- Ответ: М.ф. вещества C2H6O2
1.
Относительная плотность паров предельного одноатомного спирта по кислороду
равна 2,75. Выведите молекулярную
формулу спирта.
2.
Предельный простой эфир массой 10 г при нормальных условиях занимает объем 4.87
л. Выведите молекулярную
формулу эфира.
3.
Относительная плотность паров органического соединения по воздуху равна 2,552.
Массовая доля углерода в этом
веществе равна 64,86%, массовая доля водорода равна 13,51%,
массовая доля кислорода равна 21,63%. Выведите молекулярную формулу этого
вещества.
4.
Относительная плотность паров органического соединения по водороду равна 65.
Массовая доля углерода в этом веществе равна 73,85%, массовая доля водорода
равна 13,85%, массовая доля кислорода равна 12,3%. Выведите молекулярную
формулу этого вещества.
5.
Относительная плотность паров органического соединения по водороду равна 51.
При сжигании 30,6 г этого вещества образовалось 79,2 г диоксида углерода и 37,8
г воды. Выведите молекулярную формулу органического соединения.
6.
Относительная плотность паров органического соединения по кислороду равна
3,625.11ри сжигании 29 г этого вещества образуется 39,2 л углекислого газа (н.
у.) и 36 г воды. Выведите молекулярную формулу органического соединения.
Задача:
При действии избытка натрия на
раствор фенола в метаноле выделилось 1176 мл газа (н. у.).
Для нейтрализации такого же
количества раствора потребовалось 10 мл водного раствора NaОН с концентрацией
20 мг/мл.
Чему равна массовая доля фенола в
исходном растворе?
Решение:
Для
начала давайте распишем все химические процессы в задаче:
1. Во
второй реакции проявляется то самое различие между спиртами и фенолами — из
второй реакции, в которой метанол не взаимодействует с щелочью, мы можем
найти количество моль фенола,
2. в
условии сказано, что такое же количество прореагировало с Na в первой реакции —
в этой реакции и спирт и фенол реагируют с Na одинаково.
3.
Значит, мы можем найти то количество водорода (газ), которое соответствует
фенолу,
4.
найти остаток водорода и вычислить количество моль метанола.
В
вопросе сказано найти массовую долю фенола, значит, используем стандартную
формулу для массовой доли вещества в растворе
Давайте
напишем подробное решение:
1.
Дано 10 мл водного раствора NaОН с концентрацией 20 мг/мл. Значит,
находим количество моль:
n (NaOH) = mMr=V*C(концентрация)Mr = 10 (мл) *
0,020( гмл) 40 (гмоль) = 0,005 моль
Значит, по уравнению реакции, n(фенола) = 0,005 моль
2.
Значит, количество фенола, вступившего в первую реакцию тоже 0,05 моль
3.
Водорода по уравнению реакции получается в 2 раза меньше, чем фенола:
4. При
действии избытка натрия на раствор фенола в метаноле выделилось 1176 мл газа
(н. у.). Нам нужно найти количество моль водорода.
n(H2)=V22,4 (лмоль) = 1.176 (л) 22.4
(лмоль) = 0.0525 моль
Значит,
в реакции с метанолом выделилось 0.0525 — 0.0025 = 0,05 моль
водорода
n
(метанола) = 0.1 моль
Находим массовую долю:
m(фенола) = 0,05 (моль)*94 (гмоль) = 0,47 г
m(метанола) = 0,1 (моль) * 32 (гмоль) = 3,2 г
w(фенола) = m(фенола) (m(фенола) + m(метанола)
)*100%= 0,47 (г) 3,67 (г)*100% = 12,8%
Содержание
- Метод определения простейшей формулы эфира
- Относительная плотность паров предельного простого эфира по гелию 15
- Решение задач на вывод химических формул
Метод определения простейшей формулы эфира
Некоторые задачи в тестах ЕГЭ представляют собой комбинацию двух более простых задач. Рассмотрим такой пример.
Задача 2.8.
При взаимодействии одноатомного спирта, содержащего 37,5% углерода и 50% кислорода, с органической кислотой образуется вещество, плотность паров которого по аргону равна 2,15. Определите молекулярную формулу образующегося вещества.
Дано:
массовая доля углерода в спирте: 
массовая доля кислорода в спирте: 
относительная плотность паров эфира по аргону: D(Аr) = 2,15.
Найти: молекулярную формулу эфира.
Решение:
Данная задача представляет собой комбинацию двух более простых задач. В первой из них требуется узнать формулу спирта по значениям массовых долей элементов в нем. Во второй части требуется выявить формулу эфира по его молярной массе. Рассмотрим ход решения более подробно.
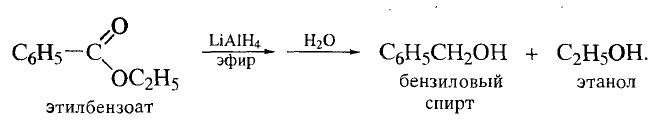
Шаг 1. Очевидно, что при взаимодействии одноатомного спирта с органической кислотой образуется сложный эфир. Если предположить, что в реакции участвовала карбоновая кислота, то в состав образовавшегося сложного эфира входят углерод, водород и кислород.
Шаг 2. Для составления уравнения реакции необходимо определить формулы спирта и кислоты. В условии указано, что спирт был одноатомным, следовательно, в его состав входил лишь один атом кислорода. Соотношение атомов углерода и водорода в углеводородном радикале нам неизвестно. Поэтому формулу спирта обозначим как СxHyOH.
В отношении карбоновой кислоты в условии нет никакой информации, но небольшое значение молярной массы эфира, рассчитанное по относительной плотности его паров позволяет утверждать, что она была одноосновная. Обозначим ее формулу как СzHkCOOH.
Запишем реакцию этерификации:
Шаг 3. По значениям массовых долей элементов определим соотношение атомов в молекуле спирта.
Сначала определим массовую долю водорода. Так как в состав спирта входит только углерод, кислород и водород, сумма их массовых долей составит 100% :






Теперь необходимо произвольно выбрать некоторый образец, в котором мы будем определять соотношение количеств веществ элементов. В условии указана информация о массовой доле, поэтому удобно выбрать образец массой 100 г. В этом случае числовые значения массовой доли каждого элемента совпадут с его массой в этом стограммовом образце.
Итак, в 100 г искомого вещества содержится 37,5 г углерода, 12,5 г водорода и 50 г кислорода.
Далее вычислим соотношение количеств вещества (n) углерода, водорода и кислорода.
Шаг 4. Находим простейшую формулу.
n(С): n(H) : n(О) = 3,125 : 12,5 : 3,125
Выбираем наименьшее значение (в данном случае «3,125») и делим на него все три числа:
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: СН4О.
Шаг 5. В условии есть указание на одноатомность спирта. Это значит, что его молекула содержит только один атом кислорода. Следовательно, индексы в простейшей формуле увеличивать не надо, она совпадает с истинной. Запишем истинную формулу спирта, выделив в ней гидроксильную группу: СН3ОН.
с учетом найденной формулы спирта будет иметь следующий вид:
По относительной плотности паров по аргону определяем истинную молярную массу эфира:
М(эфира) = D(Аr) . M(Аr) = 2,15 . 40 = 86 г/моль.
Определим вклад в общую молярную массу углеводородного радикала — остатка от карбоновой кислоты:
М(СzHk) = 86 – (12 + 1 . 3 + 16 . 2 + 12) = 27 г/моль.
По значениям молярных масс элементов составляем математическое уравнение с двумя неизвестными:
Пренебрегая вкладом массы водорода в общую массу, получаем математическое уравнение, позволяющее оценить количество атомов углерода в молекуле:
Если количество атомов углерода в углеводородном радикале равно 2, то подставляя z = 2 в математическое уравнение с двумя неизвестными получаем:
Следовательно, углеводородный радикал оставшейся в молекуле эфира от карбоновой кислоты имеет формулу: С2Н3.
Формула эфира для формирования ответа будет иметь вид:
Источник
Относительная плотность паров предельного простого эфира по гелию 15
1.1 г алкина при нормальных условиях занимает объем
0,56 л. Выведите молекулярную формулу алкина.
2. Относительная плотность паров алкина по кислороду
равна 2,125. Выведите молекулярную формулу алкина.
3. Относительная плотность паров углеводорода по кислороду равна 3. Массовая доля водорода в нем равна 12,5%.
Выведите молекулярную формулу углеводорода.
4. Относительная плотность паров углеводорода по водороду равна 55. Массовая доля углерода в нем равна 87,27%.
Выведите молекулярную формулу углеводорода.
5. 13,5 г органического вещества при нормальных условиях занимают объем 5,6 л. При сжигании 10,8 г этого вещества образуется 17,92 л углекислого газа (н.у.) и 10, 8 г воды.
Выведите молекулярную формулу органического вещества.
6. Плотность паров органического соединения по гелию
равна 20,5. При сжигании 4,1 г этого вещества образуется 13,2 г диоксида углерода и 4,5 г воды. Выведите молекулярную формулу органического вещества.
Источник
Решение задач на вывод химических формул



С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
| Вывод химической формулы вещества: | Вычисление молярной массы вещества | Задачи для самостоятельного решения |
| — на основании массовых долей (%) атомов элементов | M 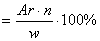 , где n — число атомов , где n — число атомов |
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
| — на основании массовых долей (%) атомов элементов и относительной плотности соединения | М (CхНу) = D(Н2) · М (Н2) | Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
| — по относительной плотности вещества и общей формуле класса | М (CхНу) = D(Н2) ·М (Н2) | Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
| — на основании массовых долей (%) атомов элементов и плотности в газообразном состоянии | М находится по М (в-ва) = Vm·ρ | Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. Ответ: C3Н8 |
| — по массе или объёму исходного вещества и продуктам горения |  М (CхНу) = D(Н2) · М (Н2) М (CхНу) = D(Н2) · М (Н2) |
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О |
1) Определите молекулярную формулу предельного углеводорода, если:
а) относительная плотность по водороду равна 43;
б) относительная плотность по кислороду равна 4,44.
Дано: Решение:
СnH2n+2 М CxHу = D(CxHу)Н2 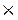
2. Найдём количество атомов, составив уравнение
СnH2n+2 = 86 (Вместо С и Н подставим числовые значения их относительных атомных масс и придём к математическому уравнению)
12n + 2n + 2 = 86; 14n = 86 – 2; 14n = 84; n = 6 => C6H14
2) Вывести химическую формулу алкена, если его плотность равна 3,125 г/л.
3) Вывести химическую формулу алкина, если 1 литр его весит 3,04г.
4) Вывести химическую формулу альдегида, если его относительная плотность по воздуху равна 2.
5) Вывести химическую формулу карбоновой одноосновной кислоты, если плотность паров равна 3,93 г/л.
6) Вывести химическую формулу однозамещённого хлорпроизводного предельного углеводорода, если его относительная плотность по воздуху равна 2,224.
8-7. Какой газообразный алкан имеет при нормальных условиях плотность 1,339 г/л?
8-8. Алкан имеет плотность паров по воздуху 4,414. Определить формулу алкана.
8-9. Молекула алкана содержит 26 электронов. Установите его формулу.
8-24. При бромировании углеводорода было получено бромпроизводное, имеющее относительную плотность по кислороду, равную 5,094. Определите возможное строение углеводорода, предложите способ его получения из неорганических реагентов.
8-26. Приведите структурные формулы циклоалканов, в молекулах которых находится по 40 электронов.
8-27. Алкен имеет молекулярную массу – 84. Определите его молекулярную формулу.
8-28. В молекуле циклоалкена число атомов углерода и водорода различается на 4. Приведите структурные формулы этого соединения и его изомера, не относящегося к циклическим углеводородам.
8-29. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название одного изомера исходного алкена.
15-43. Относительная плотность паров хлоралкана по алкену, из которого он получен, равна 1,87. Установите строение алкена.
15-2. Молекулярная масса алкина – 96. Что это за алкин?
15-1. Определить формулу ароматического углеводорода с относительной молекулярной массой 92.
15-7. Приведите структурную формулу ароматического углеводорода, имеющего в молекуле 50 электронов
1.18 (3) Относительная плотность паров алкана по водороду равна 57. Выведите молекулярную формулу алкана.
1.19 (3) Относительная плотность паров алкана по азоту равна 5,07. Выведите молекулярную формулу алкана.
2.7 (3) Относительная плотность паров циклоалкана по кислороду равна 3,5. Выведите молекулярную формулу циклоалкана.
2.8 (3) Плотность циклоалкана при нормальных условиях равна 1,875 г/л. Выведите молекулярную формулу циклоалкана.
2.13 (3) Углеводород имеет относительную плотность по азоту 2,5. Он не обесцвечивает бромную воду. Предположите возможную структуру углеводорода. Дайте название.
2.14 (3) Углеводород имеет относительную плотность по углекислому газу 1,9. Он не обесцвечивает холодный раствор перманганата калия. Предположите возможную структуру углеводорода. Дайте название.
3.12 (3) Относительная плотность паров алкена по водороду равна 42. Выведите молекулярную формулу алкена.
3.13 (3) Плотность алкена при н. у. равна 2,5 г/л. Выведите молекулярную формулу алкена.
4.11 (3) 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
4.12 (3) Относительная плотность паров алкадиена по кислороду равна 3. Выведите молекулярную формулу алкадиена.
4.13 (3) Относительная плотность углеводорода по воздуху равна 2,345. Массовая доля углерода в нем равна 88,24%. Выведите молекулярную формулу углеводорода.
5.13 (3) 1 г алкина при н. у. занимает объем 0,86 л. Выведите молекулярную формулу алкина.
5.14 (3) Относительная плотность паров алкина по воздуху равна 2,83. Выведите молекулярную формулу алкина.
6.15 (3) Относительная плотность по гелию паров углеводорода ряда бензола равна 23. Выведите его молекулярную формулу.
6.16 (3) Пары арена имеют относительную плотность по воздуху 4,14. Выведите его молекулярную формулу.
7.17 (3) Относительная плотность паров предельного одноатомного спирта по водороду равна 37. Выведите молекулярную формулу спирта.
7.18 (3) Относительная плотность паров предельного простого эфира по гелию равна 15. Выведите молекулярную формулу эфира.
8.8 (3) Относительная плотность паров предельного двухатомного спирта по кислороду равна 3,25. Выведите молекулярную формулу спирта.
8.9 (3) Относительная плотность паров предельного трехатомного спирта по метану равна 5,75. Выведите молекулярную формулу спирта.
10.13 (3) Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида.
10.14 (3) Относительная плотность паров предельного альдегида по неону равна 5. Выведите молекулярную формулу альдегида.
10.15 (3) Относительная плотность паров органического соединения по водороду равна 36. Массовая доля углерода в этом веществе равна 66,67%, массовая доля водорода равна 11,11%, а остальное приходится на кислород. Выведите молекулярную формулу органического соединения и предложите структуру, если известно, что это вещество: а) не дает реакции «серебряного зеркала»; б) дает реакцию «серебряного зеркала».
11.15 (3) Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
13.12 (3) Относительная плотность паров предельного амина по кислороду равна 1,844. Выведите молекулярную формулу амина.
13.13 (3) Относительная плотность паров ароматического амина по метану равна 6,75. Выведите его молекулярную формулу.
7) Углеводород (относительная плотность по водороду равна 39) содержит 92,31 % углерода и 7,69% водорода. Найдите его молекулярную формулу.
Дано: Решение:
W% (С) = 92, 31 1. Найдём молекулярную массу.
W% (Н) = 7, 69 Мr (CxHу) = 39 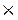
D (CxHу)Н2 = 39 2. Найдём количество атомов, т.е. отношение.
х : у = ? γ = т/Аr; х : у = 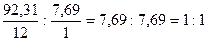
3. Убедимся, истинная это формула или простейшая. Для этого найдём молекулярную массу (СН); Мr(СН) = 12 + 1 = 13, а у нас 78 => нашли простейшую формулу. Чтобы вывести истинную формулу вещества нужно узнать сколько раз 13 уложится в 78,. именно на столько нужно будет увеличить количество атомов в простейшей формуле.
Mr (С6Н6) = 12 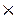
Или: m(С)= 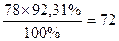
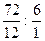

Задача № 9. Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
| Дано: w (С) = 85,7 % w (Н) = 14,3 % D Н2 (CхНу) = 21 | Решение:
m (Н) = 42г. /100% · 14,3 % = 6 г. Находим количество вещества атомов углерода и водорода n (С) = 36г :12 г/моль = 3 моль n (Н) = 6г.: 1 г/моль = 6 моль Ответ: истинная формула вещества C3Н6. |
| Вывести формулу соединения CхНу- ? |
Задача № 10 Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
Источник

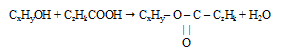
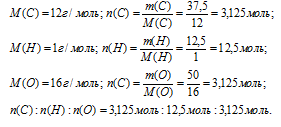
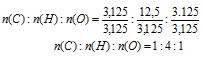
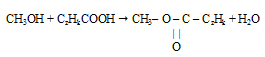
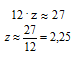
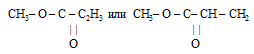























 М (CхНу) = 21 · 2 = 42
М (CхНу) = 21 · 2 = 42