← Молярная и молекулярная масса
- Относительная молекулярная масса Br: 79.904
- Молярная масса Br: 79.904 г/моль (0.0799 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Br (бром) | 1 | 79.904 | 79.904 |
| 79.904 |
Расчёт молярной и относительной молекулярной массы Br
- Mr[Br] = Ar[Br] = 79.904 = 79.904
- Молярная масса (в кг/моль) = Mr[Br] : 1000 = 79.904 : 1000 = 0.0799 кг/моль
Электронная конфигурация атома брома
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
C5H9KOS2 [188.35266]
ClKO [90.5507]
Калькулятор молекулярной массы

Молярная масса брома
Молярная масса брома
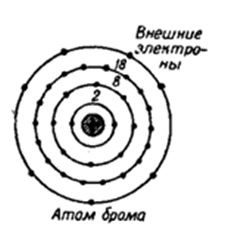
Порядковый номер – 35. Строение атома показано на рис. 1. Неметалл p-семейства.
Рис. 1. Схема строения атома брома.
В обычных условиях бром представляет собой жидкость красно-бурого цвета, обладающую резким неприятным запахом. Ядовит. Плотность 3,19 г/см3 (при t0 = 0oC). При кипении (t0 = 58,6oC) бром из жидкого состояния переходит в газообразное – образует буро-коричневый пар.
Относительная атомная масса атомарного брома равна 79,904 а.е.м. Его относительная молекулярная масса будет равна 79,904, а молярная масса:
M(Br2) = Mr (Br2) × 1 моль = 79,904 г/моль.
Известно, что молекула брома двухатомна – Br2, тогда, относительная атомная масса молекулы брома будет равна:
Ar(Br2) = 79,904× 2 = 159,808 а.е.м.
Относительная молекулярная масса молекулы брома будет равна 159,808, а молярная масса:
M(Br2) = Mr (Br2) × 1 моль = 159,808 г/моль или просто 160 г/моль.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Molar mass of Br = 79.904 g/mol
Convert grams bromine to moles
or
moles bromine to grams
Percent composition by element
Element: Bromine
Symbol: Br
Atomic Mass: 79.904
# of Atoms: 1
Mass Percent: 100.000%
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
| Бром | |
|---|---|
| Красно-бурая жидкость с сильным неприятным «тяжёлым» запахом | |
 |
|
| Название, символ, номер | Бром / Bromum (Br), 35 |
| Атомная масса (молярная масса) |
[79,901; 79,907][комм 1][1]. а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p5 |
| Ковалентный радиус | 114 пм |
| Радиус иона | (+5e)47 (-1e)196 пм |
| Электроотрицательность | 2,96 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | +7, +5, +3, +1, 0, −1 |
| Энергия ионизации (первый электрон) |
1142,0 (11,84) кДж/моль (эВ) |
| Плотность (при н. у.) | 3,102 (25 °C) г/см³ |
| Температура плавления | 265,9 К (−7,25 °C) |
| Температура кипения | 331,9 К (58,6 °C) |
| Уд. теплота плавления | (Br—Br) 10,57 кДж/моль |
| Уд. теплота испарения | (Br—Br) 29,56 кДж/моль |
| Молярная теплоёмкость | 75,69 Дж/(K·моль) |
| Молярный объём | 23,5 см³/моль |
| Структура решётки | орторомбическая |
| Параметры решётки | a = 6,67, b = 4,48, c = 8,72 Å |
| Теплопроводность | (300 K) 0,005 Вт/(м·К) |
| Номер CAS | 7726-95-6 |
Бром (от др.-греч. βρῶμος — «вонючка», «вонючий») — химический элемент с атомным номером 35. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в четвёртом периоде таблицы. Атомная масса элемента 79,901…79,907 а. е. м.. Обозначается символом Br (от лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром при нормальных условиях является тяжёлой едкой жидкостью красно-бурого цвета с сильным неприятным «тяжёлым» запахом, отдалённо напоминающим запах одновременно йода и хлора. Летуч, ядовит. Молекула брома двухатомна (формула Br2).
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 5 Физические свойства
- 5.1 Изотопы
- 6 Химические свойства
- 6.1 Бромсодержащие кислоты
- 7 Применение
- 7.1 В химии
- 7.2 Промышленное применение
- 7.3 В медицине
- 7.4 В производстве оружия
- 8 Физиологическое действие
- 9 Биологическое значение
- 10 Особенности работы
- 11 Мифы, легенды, заблуждения и их опровержения
История
Бром был независимо открыт двумя химиками: Карлом Якобом Лёвихом (нем. Carl Jacob Löwig) в 1825 году, и Антуаном Жеромом Баларом в 1826 году. Открытие Балара, молодого преподавателя колледжа города Монпелье, сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что, огорчённый тем, что в открытии брома никому не известный Антуан Балар опередил самого Юстуса фон Либиха, последний воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это утверждение неточно: фраза принадлежала не фон Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Парижском университете занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Происхождение названия
Название элемента происходит от др.-греч. βρῶμος — «дурной запах, зловоние».
Нахождение в природе
Ампула с бромом внутри акрилового куба
Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно. Почти все соединения брома растворимы в воде и поэтому легко выщелачиваются из горных пород. Как примесь он есть в сотнях минералов. Но имеется лишь небольшое количество нерастворимых в воде минералов — галогенидов серебра и меди. Самый известный из них — бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br). Собственных минералов брома мало ещё и потому, что его ионный радиус очень большой и ион брома не может надёжно закрепиться в кристаллической решетке других элементов, вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли. В море сосредоточена большая часть брома. Есть он и в воде солёных озёр, и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
В качестве исходного сырья для производства брома служат:
- морская вода (65 мг/л),
- рассолы соляных озёр,
- щёлок калийных производств,
- подземные воды нефтяных и газовых месторождений.
Получение
Австралийский эмболит — Ag(Cl, Br)
Бром получают химическим путём из природных рассолов и других растворов, содержащих ион Br−, окисляя его газообразным хлором:
- Cl2 + 2 Br− ⟶ 2Cl− + Br2
Затем элементный бром выделяют из раствора потоком водяного пара или воздуха и конденсируют.
Физические свойства
При обычных условиях бром — красно-бурая летучая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Бром — одно из двух простых веществ (и единственное из неметаллов), наряду со ртутью, которое при комнатной температуре является жидким. Плотность при 0 °C — 3,19 г/см³. Температура плавления брома равна −7,2 °C. Температура кипения составляет +58,6 °C, при кипении бром превращается из жидкости в буро-коричневые пары, при вдыхании раздражающие дыхательные пути. Стандартный электродный потенциал Br2/Br− в водном растворе равен +1,065 В.
Твёрдый бром образует молекулярные (состоящие из молекул Br2) кристаллы ромбической сингонии, параметры ячейки a = 0,667 нм, b = 0,448 нм, c = 0,872 нм.
Изотопы
Природный бром состоит из двух стабильных изотопов 79Br (50,56 %) и 81Br (49,44 %). Искусственно получены многочисленные радиоактивные изотопы брома.
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г на 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
- Br2 + H2O ⟶ HBr + HBrO
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и йодом. При реакции брома с растворами йодидов выделяется свободный йод:
- Br2 + 2KI ⟶ I2↓ + 2KBr
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
- Cl2 + 2KBr ⟶ Br2 + 2KCl
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag+ светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с йодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Жидкий бром легко взаимодействует с золотом, образуя трибромид золота AuBr3:
- 2Au + 3Br2 ⟶ 2AuBr3
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
- C2H4 + Br2 ⟶ C2H4Br2
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через неё газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
- 3Br2 + 3Na2CO3 ⟶ 5NaBr + NaBrO3 + 3CO2
Реагирует с родановодородом:
- HSCN + Br2 ⟶ BrCN + HBr + S↓
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Применение
В химии
- Вещества на основе брома широко применяются в органическом синтезе.
- «Бромная вода» (водный раствор брома) применяется как реагент для качественного определения непредельных органических соединений.
Промышленное применение
Значительная часть элементарного брома до начала 1980-х использовалась для производства 1,2-дибромэтана, входившего в состав этиловой жидкости — антидетонирующей добавки в бензины, содержащей тетраэтилсвинец; дибромэтан в этом случае служил источником брома для образования относительно летучего дибромида свинца для предотвращения осаждения твёрдых оксидов свинца на деталях двигателя. Бром также используется в синтезе антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
- Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
- Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива.
- Растворы бромидов используются в нефтедобыче.
- Растворы бромидов тяжёлых металлов используются как «тяжёлые жидкости» при обогащении полезных ископаемых методом флотации.
- Многие броморганические соединения применяются как инсектициды и пестициды.
В медицине
- В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
В производстве оружия
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Бром и его пары токсичны. Уже при содержании брома в воздухе в концентрации около 0,001 % (по объёму) наблюдается раздражение слизистых оболочек, головокружение, носовые кровотечения, а при более высоких концентрациях — спазмы дыхательных путей, удушье. ПДК паров брома — 0,5 мг/м³. ЛД50 при пероральном введении для крыс составляет 1700 мг/кг. Для человека смертельная доза перорально составляет 14 мг/кг. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух (как можно в более ранней стадии показаны ингаляции кислорода); для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Рекомендуются ингаляции тиосульфата натрия в виде 2 % водного раствора, обильное питьё теплого молока с минеральной водой или содой, кофе. Особенно опасно отравление парами брома людей, страдающих астмой и заболеваниями лёгких, так как при вдыхании паров брома очень высока вероятность отёка лёгких. Жидкий бром при попадании на кожу вызывает болезненные и долго не заживающие ожоги.
Биологическое значение
2-Октил-4-бром-3-оксобутаноат, соединение органотромина, обнаруженное в спинномозговой жидкости млекопитающих
В 2014 году исследование показало, что бром (в форме бромид-иона) является необходимым кофактором в ходе биосинтеза коллагена IV, делая элемент существенным в архитектуре базальной мембраны и развитии тканей у животных. Тем не менее, не было отмечено никаких чётких симптомов или синдромов дефицита при полном удалении брома из пищи. В других биологических функциях бром может не быть необходимым, но всё же приносить пользу, особенно когда он заменяет хлор. Например, в присутствии перекиси водорода H2O2 синтезируемая эозинофилами с ионами хлорида или бромида эозинофильная пероксидаза обеспечивает мощный механизм, с помощью которого эозинофилы убивают многоклеточных паразитов (таких, как, например, нематодные черви, участвующие в филяриозе) и некоторые бактерии, такие как бактерии туберкулёза). Эозинофильная пероксидаза — это галопероксидаза, которая более эффективно использует бром, а не хлор для этой цели, производя гипобромит (бромводородную кислоту), хотя использование хлорид-иона также возможно. Хотя α-галоэфиры, как правило, считаются высокореактивными и, следовательно, токсичными промежуточными продуктами в биоорганическом синтезе, млекопитающие, включая людей, кошек и крыс, по-видимому, биосинтезируют следы α-бромэфира, 2-октил-4-бром-3-оксобутаноата, которые присутствуют в их спинномозговой жидкости и, вероятно, играют пока неясную роль в возникновении быстрого сна.
Морские организмы являются основным источником броморганических соединений, и именно в этих организмах роль брома могла бы быть намного более высокой. Более 1600 таких броморганических соединений были идентифицированы к 1999 году. Наиболее распространённым является метилбромид (CH3Br), около 56 000 тонн которого синтезируется за год морскими водорослями. Эфирное масло гавайской водоросли Asparagopsis taxiformis состоит из 80 % бромоформа. Большинство таких броморганических соединений в море синтезируется водорослями под действием уникального фермента, ванадийбромпероксидазы.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно закупоренной толстостенной посуде. Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Проливы брома целесообразно посыпать карбонатом натрия:
- 3Br2 + 3Na2CO3 ⟶ 5NaBr + NaBrO3 + 3CO2↑
либо влажной пищевой содой:
- 6NaHCO3 + 3Br2 ⟶ 5NaBr + NaBrO3 + 6CO2↑ + 3H2O
Однако реакция элементарного брома с содой носит сильно экзотермический характер, что ведёт к увеличению испарения брома, к тому же выделяющаяся углекислота также способствует испарению, поэтому пользоваться вышеописанными методами не рекомендуется. Лучше всего для дегазации брома подходит водный раствор тиосульфата натрия Na2S2O3. Для локализации больших проливов брома можно использовать раствор тиосульфата натрия с добавками пенообразующих веществ и аэросила. Этот же раствор (3—5-процентный тиосульфат натрия) используется для смачивания ватно-марлевых повязок, которые помогают защитить органы дыхания от паров брома.
Мифы, легенды, заблуждения и их опровержения
Существует широко распространённая городская легенда, будто бы в армии, местах лишения свободы и психиатрических больницах добавляют соединения брома в еду для снижения полового влечения. Происхождение этого мифа доподлинно неизвестно.
Препараты брома имеют солёный вкус и оказывают седативный (успокаивающий) и снотворный эффект.
Ни в коем случае не следует путать «аптечный бром» (водные растворы бромида калия или натрия), который применяют при расстройствах нервной системы, и элементарный бром, который является весьма токсичным веществом с раздражающим действием. Принимать элементарный бром внутрь ни в коем случае не следует — это сильнейший яд.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения брома |
|---|
|