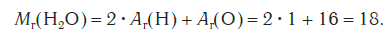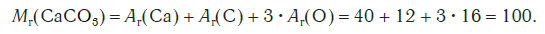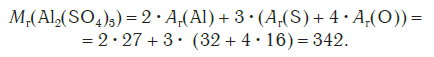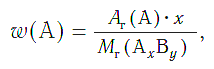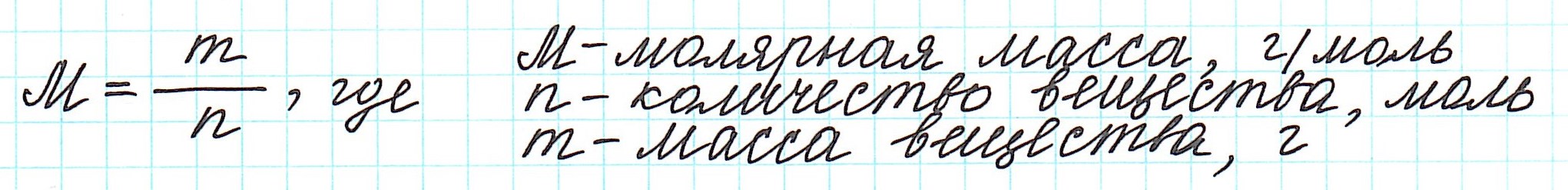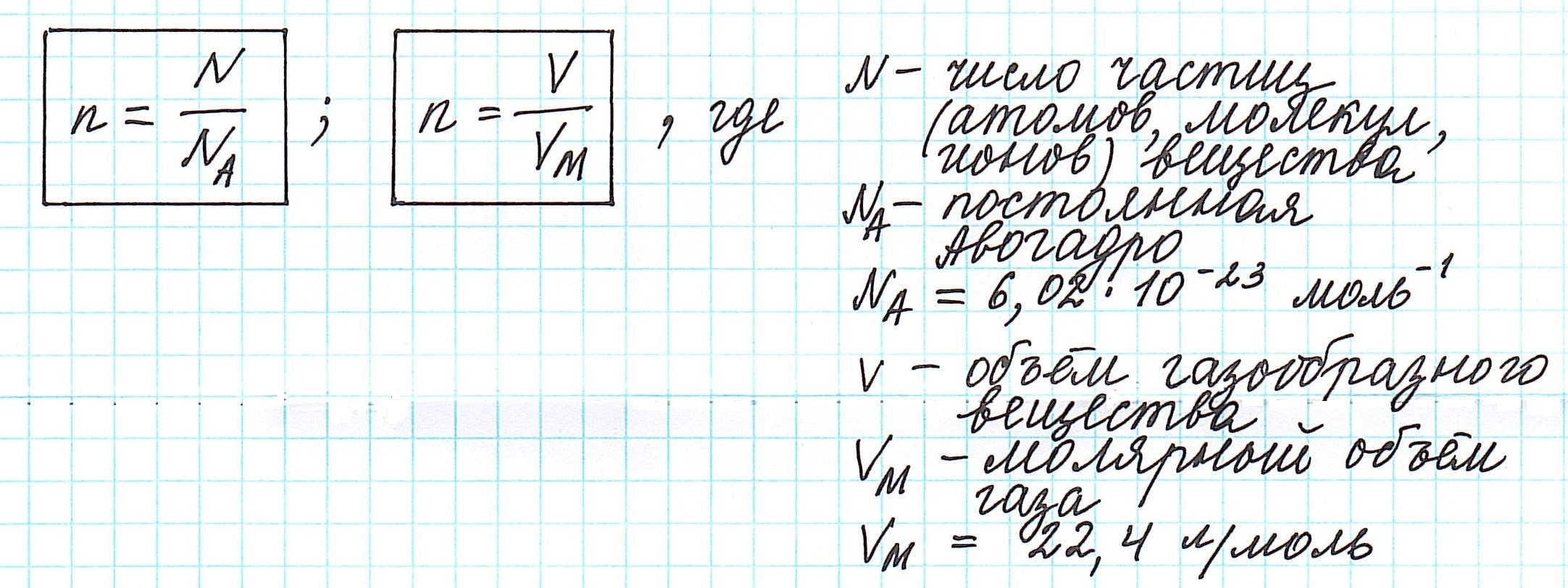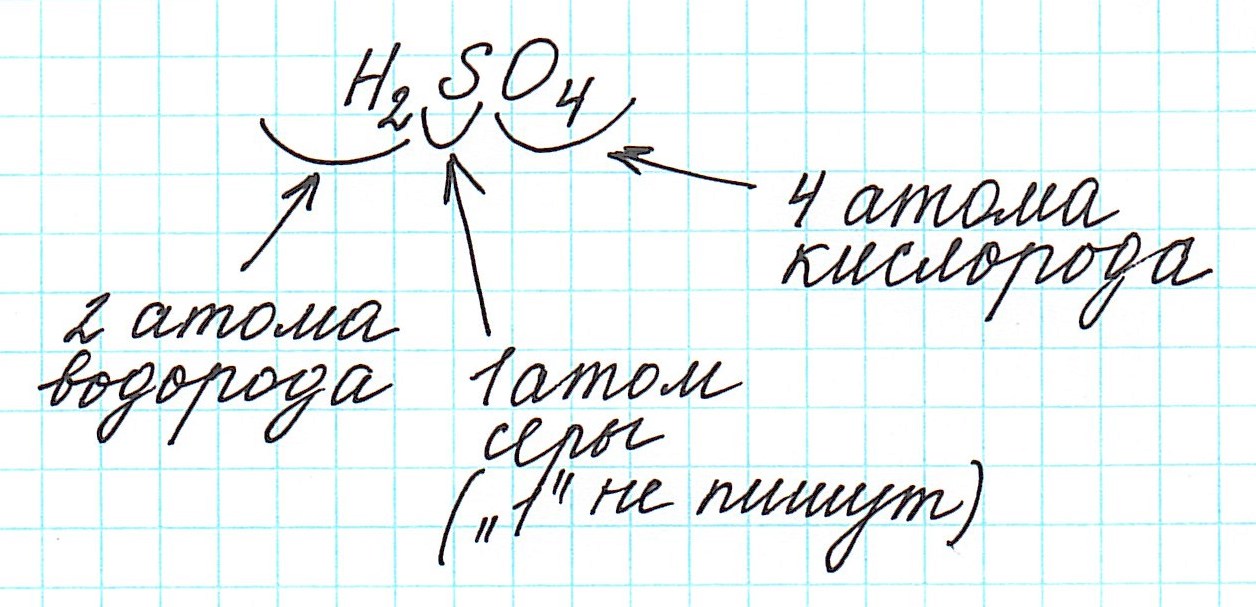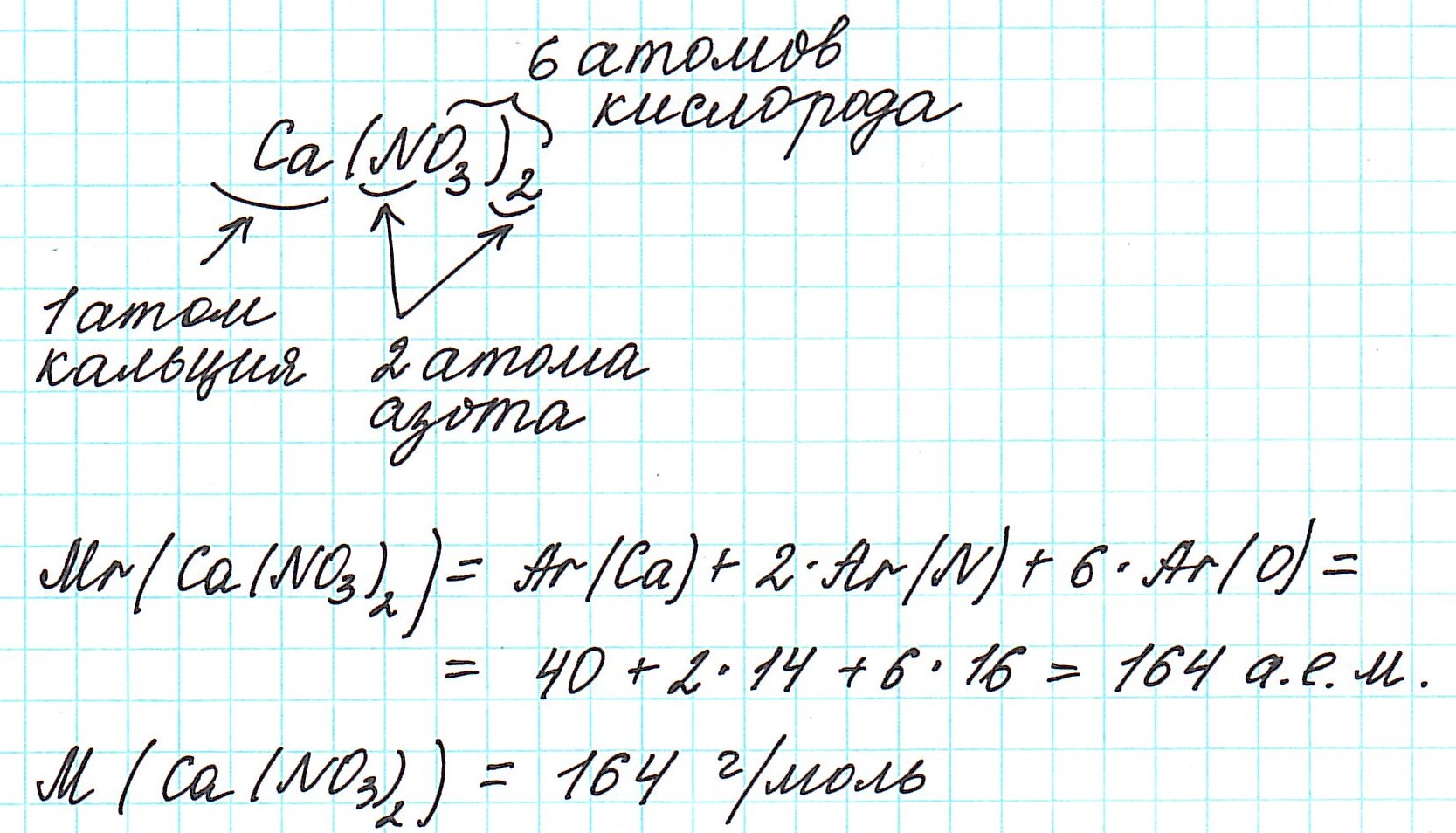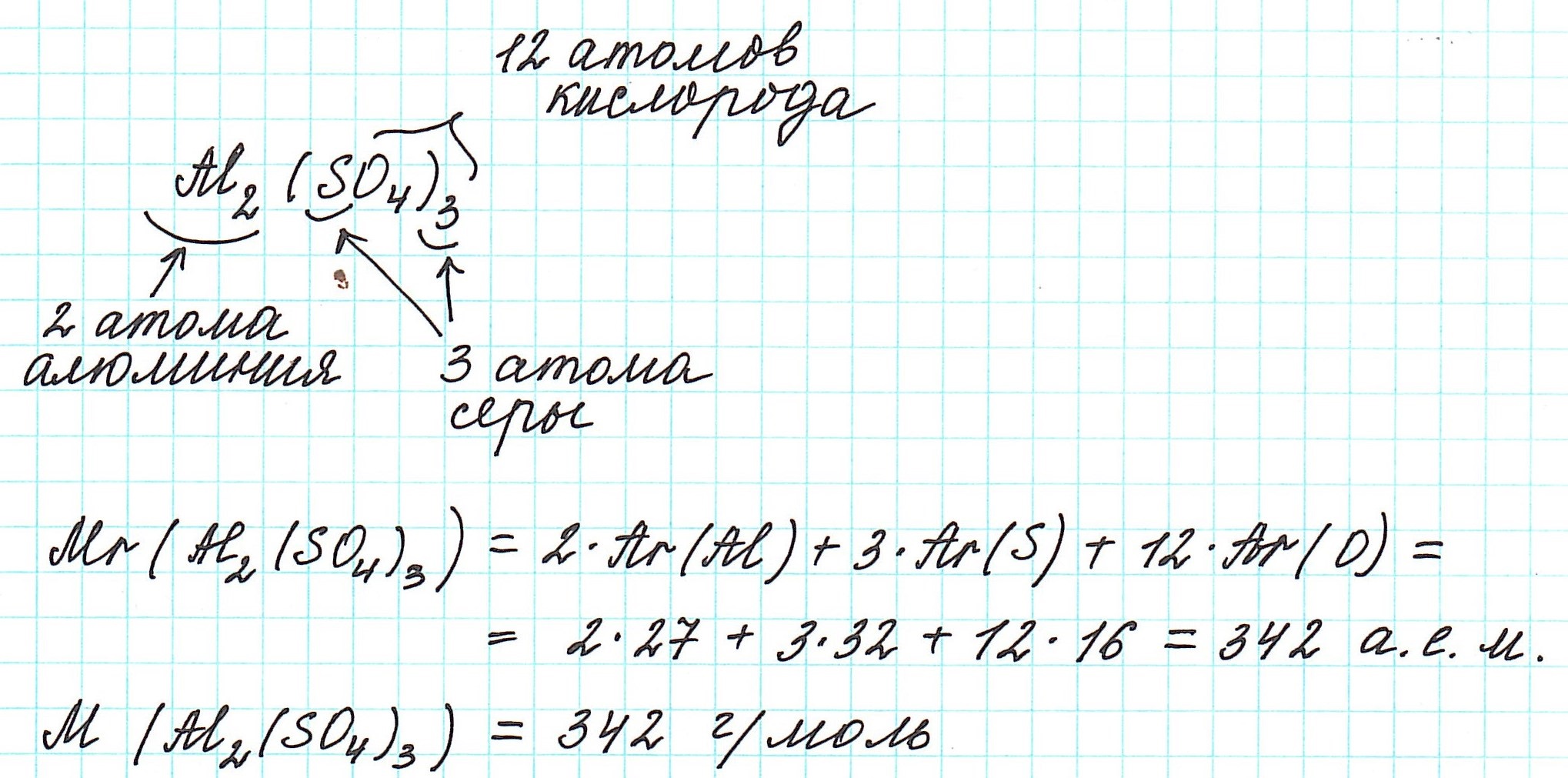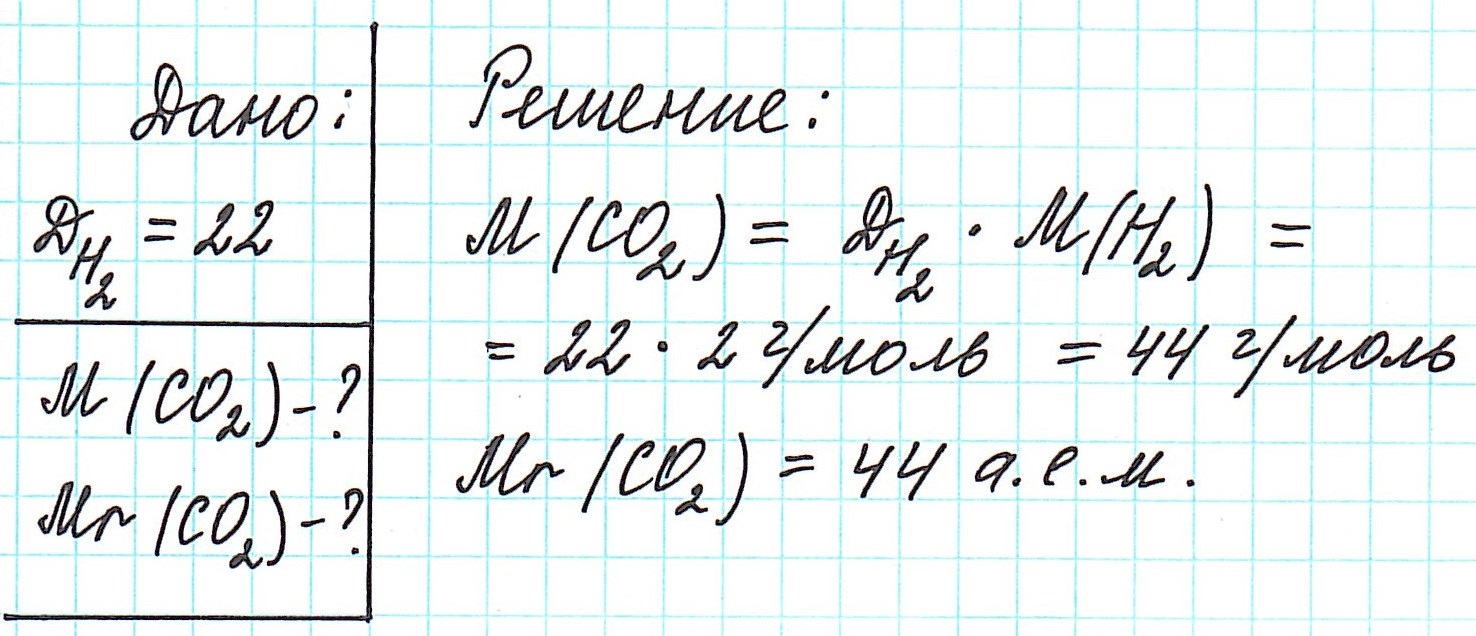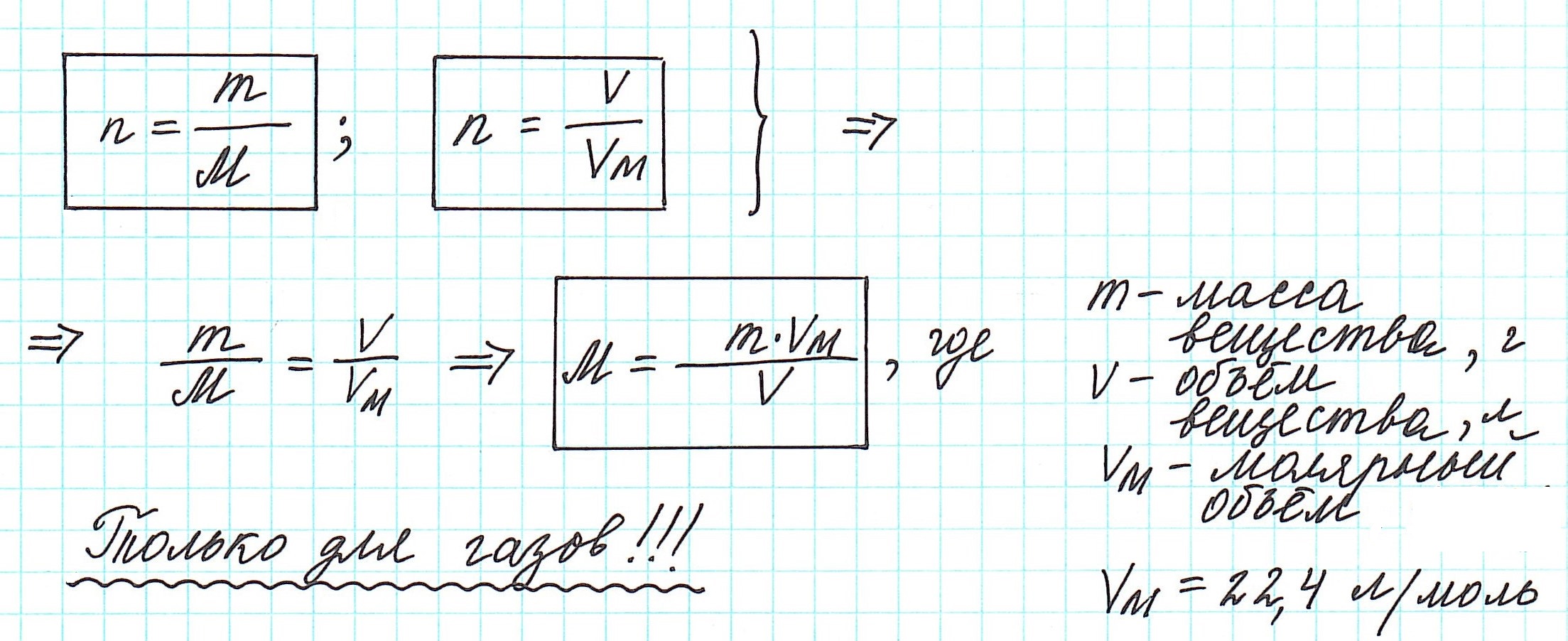В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Как определить молекулярную массу
Определения молекулярной массы вещества – это довольно специфическое, но важное умение, которое требуется для качественного изучения курса химии или физики. Данная тема относится к одному из базовых школьных разделов, на которых строится умения решать расчетные задачи, причем как на контрольной или на самостоятельной работе, так и во время практических занятий. И даже если уже не придется заниматься собственным образованием, то полученные знания могут пригодиться для ответов на вопросы своих пытливых детей.
Вам понадобится
- Таблица Д.И. Менделеева, ручка, калькулятор
Инструкция
Если внимательно рассмотреть таблицу химических элементов Дмитрия Ивановича Менделеева, то можно увидеть, что она имеет вид многоквартирного многоэтажного дома, в котором находятся «жильцы» – химические элементы. Каждый из них имеет фамилию (название) и химический символ. Причем каждый из элементов живет в своей собственной квартире, а потому имеет порядковый номер. Эта информация представлена во всех клеточках таблицы.
Однако там стоит еще одна цифра, на первый взгляд совсем непонятная. Мало того, она указана с несколькими значениями после запятой, что делается для большей точности. Именно на это число и нужно обратить внимание, потому что это и есть относительная атомная масса. Причем эта характеристика – величина постоянная, которую не требуется запоминать и можно найти по таблице. Кстати даже на ЕГЭ по химии таблица Д.И. Менделеева является справочным материалом, доступным для использования, и у каждого лежит в индивидуальном пакете – КИМе.
Молекулярная масса, а точнее относительная молекулярная масса вещества обозначается буквами (Mr) складывается из относительных атомных масс (Ar), образующих молекулу, элементов. Относительная атомная масса – это как раз та, загадочная цифра, которая стоит в каждой клеточке таблицы. Для расчетов необходимо эти значения округлять до целого числа. Исключением является только атом хлора, у которого относительная атомная масса составляет 35,5. Единиц измерения эта характеристика не имеет.
Пример 1. Найдите молекулярную массу гидроксида калия (KOH)
Молекула гидроксида калия состоит из одного атома калия (К), одного атома кислорода (О) и одного атома водорода (Н). Следовательно, находим:
Mr (KOH) = Ar (К) + Ar (О) + Ar (Н)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (KOH) = 39 + 16 + 1 = 56
Пример 2. Найдите молекулярную массу серной кислоты (H2SO4 аш-два-эс-о-четыре)
Молекула серной кислоты состоит из двух атомов водорода (Н), одного атома серы (S) и четырех атомов кислорода (О). Следовательно, находим:
Mr (H2SO4) = 2Ar (H) + Ar (S) + 4Ar (O)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (H2SO4) = 2 х 2 + 32 + 4 х 16 = 98
Видео по теме
Обратите внимание
При расчетах сначала выполняется умножение или деление, а только потом сложение или вычитание
Полезный совет
При определении относительной атомной массы округляйте значения, которые находятся в таблице Д.И. Менделеева до целого числа
Источники:
- как вычислить молекулярную массу
- Молекулярной массы определение
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Масса атома обозначается символом
ma
и может выражаться в единицах массы: килограммах или граммах.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24г
, а масса атома углерода —
ma(C)=19,94⋅10−24г
. Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
В качестве атомной единицы массы (а. е. м.) выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u) (от английского «unit» — единица):
.
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
Пример:
в Периодической таблице приведено значение относительной атомной массы магния — (24,305). Округлённое значение — (24). Значение атомной массы углерода — (12,011), а её округлённое значение — (12).
Исключение — относительная атомная масса хлора:
Ar(Cl)=
(35,5).
Значения относительных атомных масс некоторых элементов
| Элемент | H | He | Li | C | N | O | F | Ne | Na | Mg | Al | P | S | Cl | Ar | Ca | Fe | Cu | Zn |
|
Ar |
1 |
4 |
7 |
12 |
14 |
16 |
19 |
20 |
23 |
24 |
27 |
31 |
32 |
35,5 |
40 |
40 |
56 |
64 |
65 |
Относительная молекулярная масса
Mr
— это отношение массы молекулы или формульной единицы к атомной единице массы.
,
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Пример:
относительная молекулярная масса углекислого газа:
.
Относительная молекулярная масса фосфата натрия:
.
Относительная молекулярная масса сульфата алюминия:
.
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Содержание:
1.Относительная атомная масса
2.Почему атомная масса дробная?
3.Относительная молекулярная масса
4.Количество вещества и молярная масса
5.Как вычислить молярную массу вещества
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,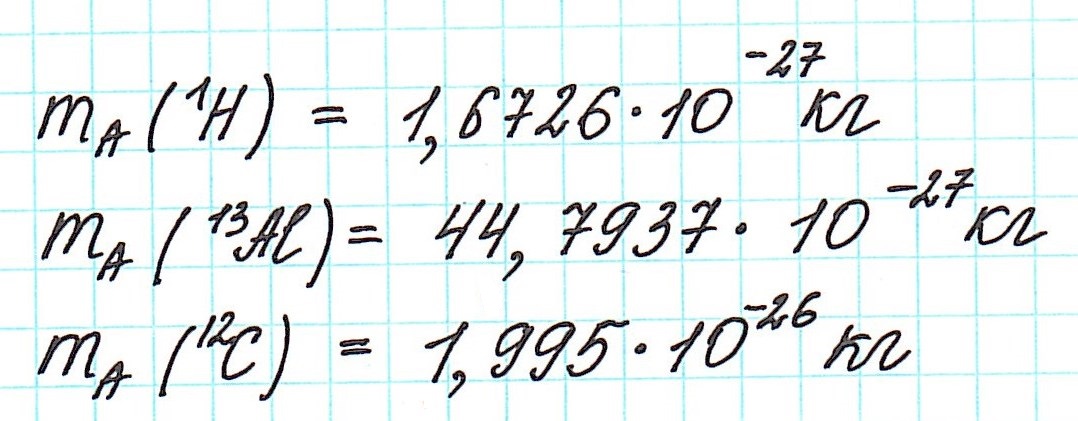
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
В настоящее время (с 1961 года) общепринятой является углеродная единица, так называемая атомная единица массы (сокращенно а.е.м.). Она равна 1/12 части массы атома углерода (изотопа 12С).
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12С и 13С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.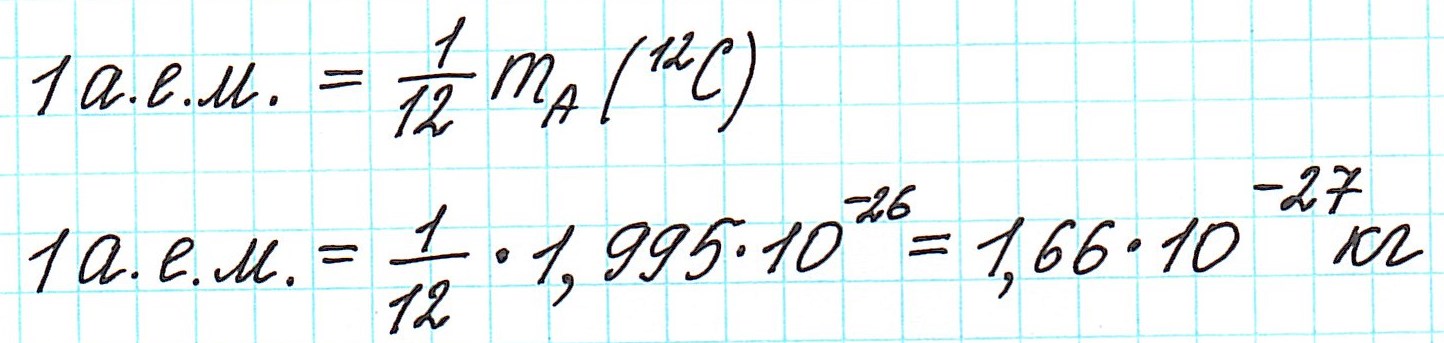
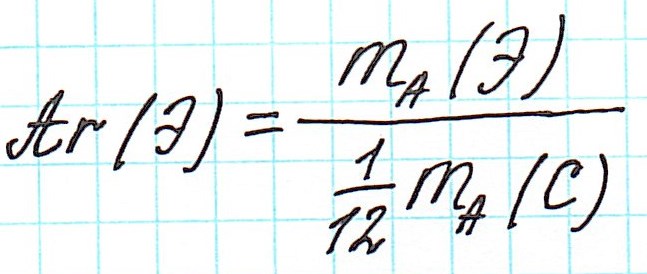
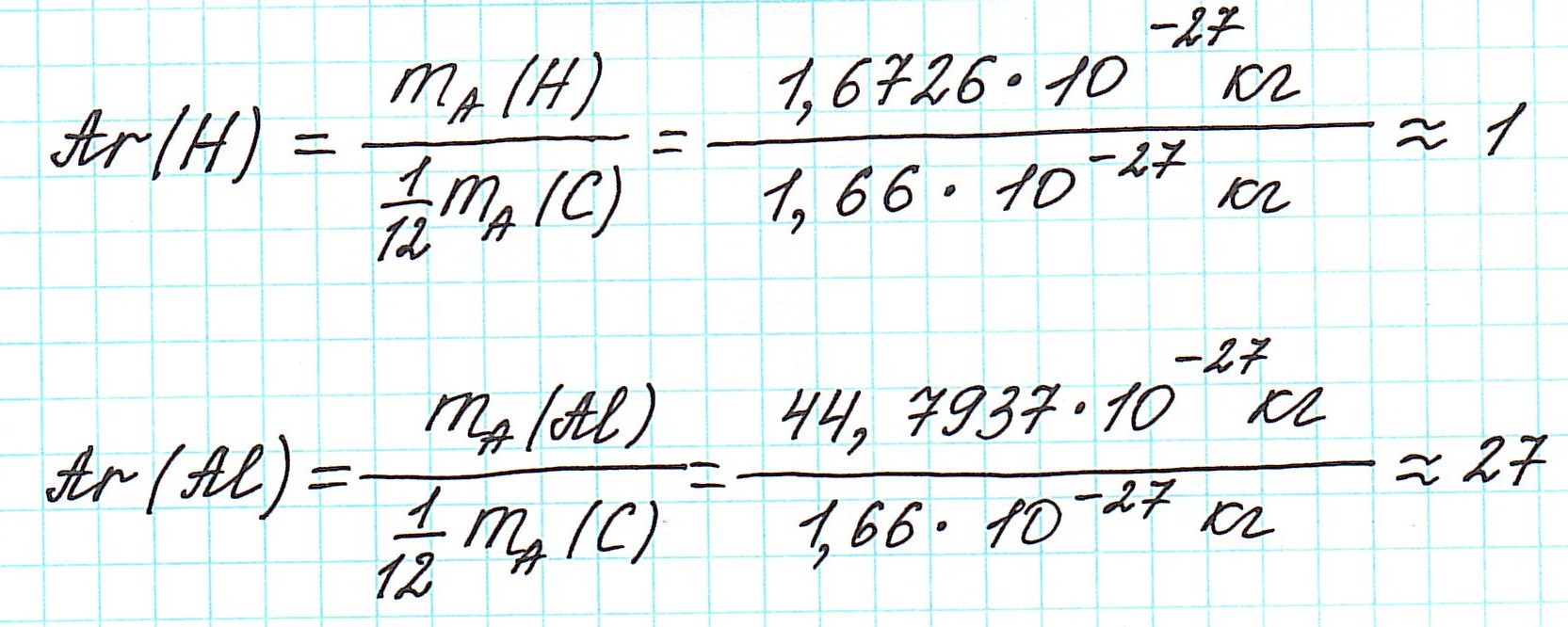
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.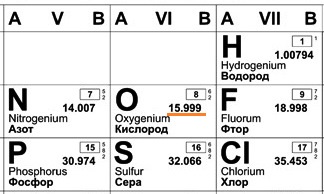
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16О, на 0,04% из изотопа 17О и на 0,20% из изотопа 18О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Здесь не все так просто. Понятие «относительная молекулярная масса» не всегда применяется корректно. Правильнее было бы говорить о «формульной массе».
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: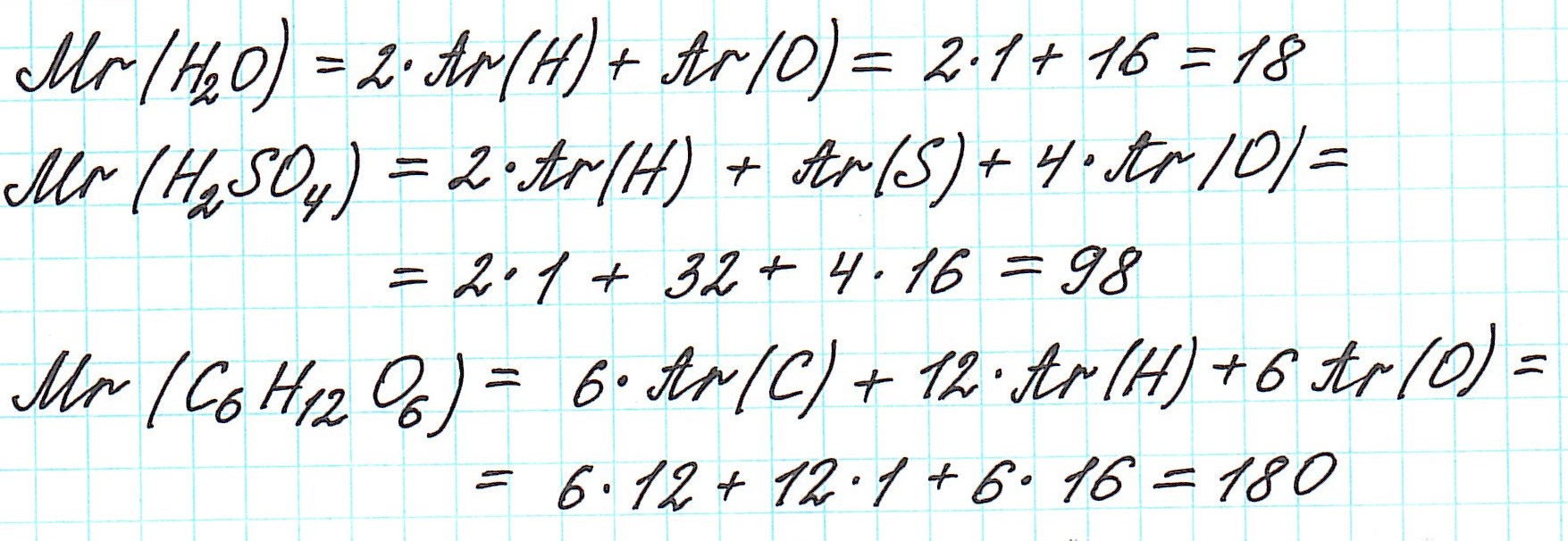
Например, формула NaCl показывает, что в кристалле хлорида натрия на один ион натрия Na+ приходится один ион хлора Cl—. На самом деле формула хлорида натрия должна выглядеть так: Na∞Cl∞. Поэтому запомним, что к ионным соединениям термины «молекула» и «молекулярная масса» не применимы.
В связи с этим для подобных веществ вычисляется формульная масса. А вычисляется она все по тому же принципу, что и молекулярная масса. Обозначается так же — Mr. Например, для хлорида натрия:
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Введена новая и тоже относительная величина – моль.
Точно было посчитано, что определенное количество атомов изотопа углерода 12С, а именно 6,02·1023, имеют массу ровно 12 г. Обратите внимание, что относительная молекулярная масса для этого же изотопа равна 12, но не грамм!
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·1023 его частиц (постоянная Авогадро).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.
Таким образом, молярная масса и количество вещества связаны соотношением:
Можно также определить и такие отношения, связанные с количеством вещества:
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:
Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия:
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.
Рассмотрим еще примеры:
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Определить молекулярную (а значит и молярную) массу газообразного вещества можно, используя закон Авогадро. Он гласит, что в равных объемах газов, взятых при одинаковой температуре, а также одинаковом давлении, содержится равное число молекул.
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс:


Запомните, что средняя молярная масса воздуха равна 29 г/моль.
Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
Итак, подведем итог:
- Относительная молекулярная масса (Mr) показывает отношение массы молекулы к 1/12 части массы атома изотопа углерода 12С.
- Молярная масса (М) – масса одного моля вещества, равная отношению массы вещества к его количеству и выраженная в г/моль.
- Относительная молекулярная и молярная массы численно равны.
- Вычислить молярную массу вещества (и относительную молекулярную также) можно, используя значения относительных атомных масс, записанных в периодической системе.
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Как найти молекулярную массу (молекулярный вес)
На чтение 2 мин. Просмотров 478 Опубликовано 05.06.2021
Молекулярная масса или молекулярная масса – это общая масса соединения. Он равен сумме индивидуальных атомных масс каждого атома в молекуле. Определить молекулярную массу соединения легко, выполнив следующие действия:
- Определите молекулярную формулу молекулы.
- Используйте периодическую таблицу для определения атомной массы каждого элемента в молекуле.
- Умножьте атомную массу каждого элемента на количество атомов этого элемента в молекуле. Это число представлено нижним индексом рядом с символом элемента в молекулярной формуле.
- Сложите эти значения вместе для каждого отдельного атома в молекуле.
Итоговой будет молекулярная масса соединения.
Содержание
- Пример простого расчета молекулярной массы
- Пример расчета комплексной молекулярной массы
- Советы для достижения успеха
Пример простого расчета молекулярной массы
Например, чтобы найти молекулярную массу NH 3 , первым делом нужно найти атомные массы азота (N) и водорода (H).
H = 1,00794
N = 14,0067
Затем умножьте атомную массу каждый атом числом атомов в соединении. Имеется один атом азота (для одного атома индекс не дается). Есть три атома водорода, как указано в нижнем индексе.
молекулярная масса = (1 x 14,0067) + (3 x 1,00794)
молекулярная масса. mass = 14.0067 + 3.02382
молекулярная масса = 17.0305
Обратите внимание, что калькулятор даст ответ 17.03052, но полученный ответ содержит меньше значащих цифр. потому что в расчетах используется шесть значащих цифр в значениях атомной массы.
Пример расчета комплексной молекулярной массы
Вот более сложный пример: найдите молекулярную массу (молекулярную массу) Ca 3 (PO 4 ) 2 .
Из периодической таблицы атомные массы каждого элемента равны:
Ca = 40.078
P = 30.973761
O = 15.9994
Сложная часть состоит в том, чтобы выяснить, сколько каждого атома присутствует в сложный. Есть три атома кальция, два атома фосфора и восемь атомов кислорода. Как ты это получил? Если часть соединения указана в круглых скобках, умножьте нижний индекс, следующий сразу за символом элемента, на нижний индекс, закрывающий круглые скобки.
молекулярная масса = (40,078 x 3 ) + (30,97361 x 2) + (15,9994 x 
молекулярная масса = 120,234 + 61,94722 + 127,9952
молекулярная масса = 310,17642 (из калькулятора)
молекулярная масса = 310,18
В окончательном ответе используется правильное количество значащих цифр. В данном случае это пять цифр (от атомной массы кальция).
Советы для достижения успеха
- Помните, что если после символа элемента не указан нижний индекс, это означает, что имеется один атом.
- Нижний индекс применяется к символу атома, за которым он следует. Умножьте нижний индекс на атомный вес атома.
- Сообщите свой ответ, указав правильное количество значащих цифр. Это будет наименьшее количество значащих цифр в значениях атомных масс. Следите за правилами округления и усечения, которые зависят от ситуации.