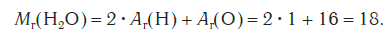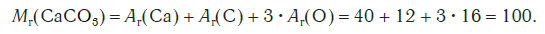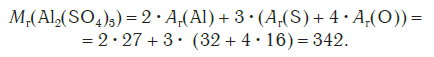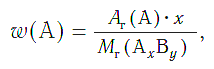Как определить молекулярную массу
Определения молекулярной массы вещества – это довольно специфическое, но важное умение, которое требуется для качественного изучения курса химии или физики. Данная тема относится к одному из базовых школьных разделов, на которых строится умения решать расчетные задачи, причем как на контрольной или на самостоятельной работе, так и во время практических занятий. И даже если уже не придется заниматься собственным образованием, то полученные знания могут пригодиться для ответов на вопросы своих пытливых детей.
Вам понадобится
- Таблица Д.И. Менделеева, ручка, калькулятор
Инструкция
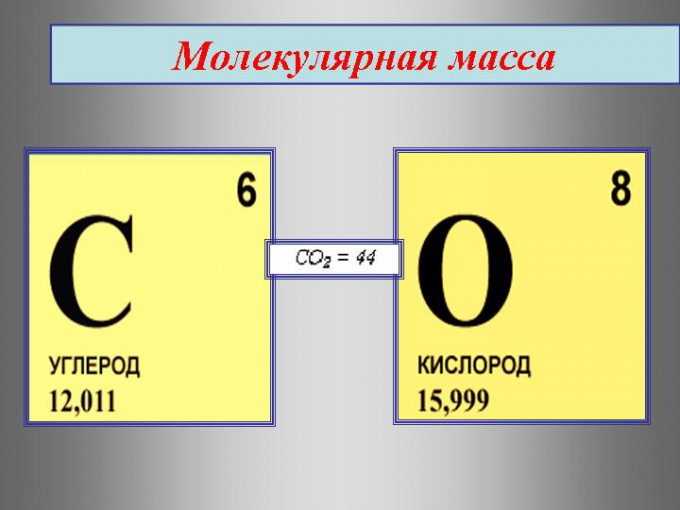
Если внимательно рассмотреть таблицу химических элементов Дмитрия Ивановича Менделеева, то можно увидеть, что она имеет вид многоквартирного многоэтажного дома, в котором находятся «жильцы» – химические элементы. Каждый из них имеет фамилию (название) и химический символ. Причем каждый из элементов живет в своей собственной квартире, а потому имеет порядковый номер. Эта информация представлена во всех клеточках таблицы.
Однако там стоит еще одна цифра, на первый взгляд совсем непонятная. Мало того, она указана с несколькими значениями после запятой, что делается для большей точности. Именно на это число и нужно обратить внимание, потому что это и есть относительная атомная масса. Причем эта характеристика – величина постоянная, которую не требуется запоминать и можно найти по таблице. Кстати даже на ЕГЭ по химии таблица Д.И. Менделеева является справочным материалом, доступным для использования, и у каждого лежит в индивидуальном пакете – КИМе.
Молекулярная масса, а точнее относительная молекулярная масса вещества обозначается буквами (Mr) складывается из относительных атомных масс (Ar), образующих молекулу, элементов. Относительная атомная масса – это как раз та, загадочная цифра, которая стоит в каждой клеточке таблицы. Для расчетов необходимо эти значения округлять до целого числа. Исключением является только атом хлора, у которого относительная атомная масса составляет 35,5. Единиц измерения эта характеристика не имеет.
Пример 1. Найдите молекулярную массу гидроксида калия (KOH)
Молекула гидроксида калия состоит из одного атома калия (К), одного атома кислорода (О) и одного атома водорода (Н). Следовательно, находим:
Mr (KOH) = Ar (К) + Ar (О) + Ar (Н)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (KOH) = 39 + 16 + 1 = 56
Пример 2. Найдите молекулярную массу серной кислоты (H2SO4 аш-два-эс-о-четыре)
Молекула серной кислоты состоит из двух атомов водорода (Н), одного атома серы (S) и четырех атомов кислорода (О). Следовательно, находим:
Mr (H2SO4) = 2Ar (H) + Ar (S) + 4Ar (O)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (H2SO4) = 2 х 2 + 32 + 4 х 16 = 98
Видео по теме
Обратите внимание
При расчетах сначала выполняется умножение или деление, а только потом сложение или вычитание
Полезный совет
При определении относительной атомной массы округляйте значения, которые находятся в таблице Д.И. Менделеева до целого числа
Источники:
- как вычислить молекулярную массу
- Молекулярной массы определение
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Калькулятор молекулярной массы предназначен для расчёта относительной молекулярной массы химических соединений. Для этого достаточно ввести химическую формулу
вещества в соответствующее
поле. При вводе формулы следует соблюдать правильное написание элементов, принятых в химии — то есть первая буква химического элемента долна быть заглавной.
В противном случае могут возникнуть разночтения. Например, если написать формулу как hf, то будет невозможно понять, что
это — HF (фтороводород) или Hf (гафний). При написании формул допускается использование круглых скобок.
Онлайн-калькулятор молекулярной массы
Молекулярные массы некоторых веществ
| Химическое соединение | Относительная молекулярная масса |
|---|---|
| Вода (H2O) | 18.01528 |
| Серная кислота (H2SO4) | 98.07848 |
| Оксид железа(III) (Fe2O3) | 159.6882 |
| Оксид железа(II) (FeO) | 71.8444 |
| Оксид фосфора(V) (P2O5) | 141.944524 |
| Оксид фосфора(III) (P2O3) | 109.945724 |
| Оксид углерода(II) (CO) | 28.0101 |
| Оксид углерода(IV) (CO2) | 44.0095 |
| Кислород (O2) | 31.9988 |
| Этиловый спирт (C2H5OH) | 46.06844 |
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Для того чтобы разобраться с понятием «молярная масса», необходимо вспомнить важный химический термин «моль». Моль тесно связан с химической константой – числом Авогадро и химическим элементом углерод (С), который взят за основу при определении количества вещества, равного 1 молю. Помнить наизусть его значение необязательно, любой электронный или бумажный справочник легко напомнит нам, что число Авогадро (оно обозначается NА) составляет 6,02х1023. Это число частиц вещества (количество молекул или атомов), которое содержится в одном его моле. Принято считать, что в 1 моле любого химического соединения содержится такое количество вещества, которое содержат 12 г атома углерода.
Простыми словами молярную массу можно идентифицировать как «вес 1 моля химического вещества».
В международной системе единиц СИ в соответствии с принятыми стандартами молярную массу определяют в граммах на моль (г/моль). В определенных случаях ее также указывают в кг/моль, если так удобнее производить расчеты. В процессе решения задач по химии молярную массу обозначают большой буквой «М».
Молярную массу не надо путать с весом молекулы, атома и иона, эти понятия отнюдь не тождественны, хотя их числовые величины могут и совпадать. Далеко не для всех химических веществ молярная масса и молекулярный вес равны друг другу. Молярная и молекулярная массы соединений имеют одинаковые значения для химических веществ, состоящих из атомов.
Не путайте молярную массу с весом молекулы!
Рассмотрим это на примере галогена из 7-й группы таблицы Менделеева – хлора (CL):
• атом хлора Cl «весит» 35,5;
• ион хлора Cl— – 35,5;
• молекула хлора Cl2 – 71.
Отличаются между собой эти значения и для другого газа – азота (N2):
• молекула азота, состоящая из 2 атомов, имеет массу 28;
• атом элемента N – 14.
Вывод напрашивается сам по себе – молярные массы элемента, иона и вещества могут существенно различаться.
Как вычислить молярную массу
Чтобы рассчитать значение молярной массы химического вещества, целесообразно придерживаться следующего алгоритма:
- Подготовить таблицу Менделеева (она может понадобиться для определения валентности и атомных масс химических элементов).
- Правильно составить химическую формулу вещества, пользуясь знаниями об основных классах неорганических соединений и их свойствах и сведениями, почерпнутыми из таблицы Менделеева, например:
- углекислый газ – СО2;
- серная кислота – Н2SO4;
- хлорид кальция CaCL2;
- гидроксид алюминия Al(OH)3.
Прежде всего при составлении формул соединений необходимо помнить о валентности элементов, из которых они состоят.
- Определяем молекулярный вес и молярную массу каждого из вышеуказанных химических соединений (вес атомов опять берем в ячейке химического элемента в таблице Менделеева):
- СО2 – 1 атом углерода (12) + 2 атома кислорода (32) = 44;
- Н2SO4 – 2 атома водорода (2) + 1 атом серы (32) + 4 атома кислорода (64) = 98;
- CaCL2 – 1 атом кальция (40) + 2 атома хлора (71) = 111;
- Al(OH)3 – 1 атом алюминия (27) + 3 атома водорода (3) + 3 атома кислорода (48) = 78.
Как видно из приведенных примеров, для выполнения необходимых вычислений достаточно сложить значения атомных масс элементов, находящихся в составе сложных веществ. Для простых веществ следует взять этот показатель, относящийся к соответствующему элементу, из таблицы Менделеева, принимая во внимание количество атомов в одной молекуле вещества (индекс в его формуле).
- Определяем массу одной молекулы каждого из этих неорганических соединений с помощью числа Авогадро:
- m(СО2) = Мr(СО2) : NA= 44:6,02·1023 = 7,3·1023 г;
- m(H2SO4) = Мr(H2SO4) : NA= 98:6,02·1023 = 16,28·1023 г;
- m(CaCL2) = Мr(CaCL2) : NA= 111:6,02·1023 = 18,5·1023 г;
- m(Al(OH)3) = Мr(Al(OH)3) : NA= 78:6,02·1023 = 13,0·1023 г.
Практическое значение молярной массы вещества
Термин «молярная масса» широко используется в таких научных дисциплинах, как химия и физика. Значения молярных масс соединений часто требуется вычислять в химической промышленности при разработке полимерных комплексов и в ряде других ситуаций. Современную фармакологию также трудно представить без проведения расчетов этой величины.
Молярная масса – одно из ключевых понятий при проведении биохимических исследований.
Таким образом, молярную массу необходимо уметь вычислять не только ученым-химикам и сотрудникам химических лабораторий, но и специалистам из ряда других областей науки, фармакологам и работникам ряда отраслей промышленного производства.
Тест по теме “Молярная масса”
Содержание
- Что такое молярная масса
- Как найти молярную массу
- Какова важность знания молярной массы вещества
Молярная масса является физическим свойством веществ. Это очень полезно при анализе, сравнении и прогнозировании других физических и химических свойств, таких как плотность, температура плавления, температура кипения и количество вещества, которое реагирует с другим веществом в системе. Существует более одного метода для расчета молярной массы. Некоторые из этих методов включают использование прямого уравнения, добавление атомных масс различных элементов в соединении и использование повышения точки кипения или понижения точки замерзания. Некоторые из этих основных методов будут кратко обсуждаться в этой статье.
Ключевые области покрыты
1. Что такое молярная масса
— определение, уравнение для расчета, объяснение
2. Как найти молярную массу
— Методы определения молярной массы
3.Какова важность знания молярной массы вещества
— Применение молярной массы
Ключевые термины: число Авогадро, точка кипения, калузиус-клапейрон, криоскопическая константа, эбуллиоскопическая константа, точка замерзания, точка плавления, молярность, молярная масса, молекулярная масса, осмотическое давление, относительная атомная масса
Что такое молярная масса
Молярная масса — это масса моля определенного вещества. Наиболее распространенной единицей измерения молярной массы вещества является гмоль-1, Однако единица СИ для молярной массы составляет кгмоль-1 (или кг / моль). Молярная масса может быть рассчитана с использованием следующего уравнения.
Молярная масса = масса вещества (кг) / количество вещества (моль)
Моль или моль — это единица измерения количества вещества. Один моль вещества равен очень большому числу, 6,023 x 1023 атомов (или молекул), из которых состоит вещество. Этот номер называется номером Авогадро. Это константа, потому что независимо от типа атома, один моль его равен этому количеству атомов (или молекул). Следовательно, молярной массе можно дать новое определение, то есть молярная масса представляет собой общую массу 6,023 х 10.23 атомы (или молекулы) конкретного вещества. Чтобы избежать путаницы, взгляните на следующий пример.
- Соединение А состоит из молекул А.
- Соединение B состоит из молекул B.
- Один моль соединения А состоит из 6,023 х 1023 молекул.
- Один моль соединения B состоит из 6,023 х 1023 молекул B.
- Молярная масса соединения А представляет собой сумму масс 6,023 х 10.23 Молекулы.
- Молярная масса соединения B представляет собой сумму масс 6,023 х 10.23 Молекулы В.
Теперь мы можем применить это для реальных веществ. Один моль Н2О состоит из 6,023 х 1023 ЧАС2О молекулы. Общая масса 6,023 х 1023 ЧАС2Молекулы O — около 18 г. Следовательно, молярная масса Н2О составляет 18 г / моль.
Как найти молярную массу
Молярная масса вещества может быть рассчитана с использованием нескольких методов, таких как;
- Используя атомные массы
- Используя уравнение для расчета молярной массы
- От точки кипения
- От замерзания депрессии
- От осмотического давления
Эти методы подробно обсуждаются ниже.
Использование атомных масс
Молярная масса молекулы может быть определена с использованием атомных масс. Это может быть сделано просто путем добавления молярной массы каждого присутствующего атома. Молярная масса элемента приведена ниже.
Молярная масса элемента = Относительная атомная масса х постоянная молярной массы (г / моль)
Относительная атомная масса — это масса атома относительно массы атома углерода-12, и она не имеет единиц измерения. Это соотношение может быть дано следующим образом.
Молекулярный вес A = масса одной молекулы A / [масса одного атома углерода-12 x (1/12)]
Давайте рассмотрим следующие примеры, чтобы понять эту технику. Далее приведены расчеты для соединений с одним и тем же атомом, комбинации нескольких разных атомов и комбинации большого количества атомов.
• Молярная масса Н2
o Типы присутствующих атомов = два атома Н
o Относительные атомные массы = 1,00794 (H)
o Молярная масса каждого атома = 1,00794 г / моль (Н)
o Молярная масса соединения = (2 х 1,00794) г / моль
= 2,01588 г / моль
• Молярная масса HCl
o Типы присутствующих атомов = один атом Н и один атом Cl
o Относительные атомные массы = 1,00794 (H) + 35,453 (Cl)
o Молярная масса каждого атома = 1,00794 г / моль (H) + 35,453 г / моль (Cl)
o Молярная масса соединения = (1 х 1,00794) + (1 х 35,453) г / моль
= 36,46094 г / моль
• Молярная масса С6ЧАС12О6
o Типы присутствующих атомов = 6 атомов C, 12 атомов H и 6 O атома Cl
o Относительные атомные массы = 12.0107 (C) + 1.00794 (H) + 15.999 (O)
o Молярная масса каждого атома = 12,0107 г / моль + 1,00794 г / моль (H) + 15,999 г / моль (O)
o Молярная масса соединения = (6 х 12,0107) + (12 х 1,00794) + (6 х 15,999) г / моль
= 180,15348 г / моль
Использование уравнения
Молярная масса может быть рассчитана с использованием уравнения, приведенного ниже. Это уравнение используется для определения неизвестного соединения. Рассмотрим следующий пример.
Молярная масса = Масса вещества (кг) / Количество вещества (моль)
- Соединение D находится в растворе. Детали даны следующим образом.
- Соединение D является сильной основой.
- Это может выпустить один H+ ион на молекулу.
- Раствор соединения D готовили с использованием 0,599 г соединения D.
- Реагирует с HCl в соотношении 1: 1
Затем определение может быть выполнено кислотно-основным титрованием. Поскольку это сильное основание, титруйте раствор сильной кислотой (например, HCl, 1,0 моль / л) в присутствии индикатора фенолфталеина. Изменение цвета указывает на конечную точку (например, при добавлении 15,00 мл HCl) титрования, и теперь все молекулы неизвестного основания титруют добавленной кислотой. Тогда молярная масса неизвестного соединения может быть определена следующим образом.
o Количество прореагировавшей кислоты = 1,0 моль / л х 15,00 х 10-3 л
= 1,5 х 10-2 моль
o Следовательно, количество прореагировавшего основания = 1,5 х 10-2 моль
o Молярная масса соединения D = 0,599 г / 1,5 х 10-2 моль
= 39,933 г / моль
o Тогда неизвестное соединение D можно предсказать как NaOH. (Но чтобы подтвердить это, мы должны сделать дальнейший анализ).
От точки кипения
Повышение температуры кипения представляет собой явление, которое описывает, что добавление соединения к чистому растворителю увеличило бы температуру кипения этой смеси до более высокой температуры кипения, чем у чистого растворителя. Следовательно, молярная масса этого добавленного соединения может быть найдена с использованием разности температур между двумя точками кипения. Если точка кипения чистого растворителя составляет Трастворитель и точка кипения раствора (с добавленным соединением) составляет ТрешениеРазница между двумя точками кипения может быть приведена ниже.
ΔT = Tрешение — Трастворитель
Используя соотношение Клаузиуса-Клапейрона и закон Рауля, мы можем получить связь между ΔT и молярностью решения.
ΔT = Kб , M
Где Кб является эбуллиоскопической константой и зависит только от свойств растворителя и М — моляльности
Из приведенного выше уравнения мы можем получить значение для моляльности решения. Поскольку количество растворителя, используемого для приготовления этого раствора, известно, мы можем найти значение для молей добавленного соединения.
Молярность = Моль добавленного соединения (моль) / Масса чистого используемого растворителя (кг)
Теперь, когда мы знаем моли соединения в растворе и массу добавленного соединения, мы можем определить молярную массу соединения.
Молярная масса = масса соединения (г) / моль соединения (моль)
Рисунок 01: Высота точки кипения и депрессия точки замерзания
От депрессии до точки замерзания
Понижение точки замерзания противоположно повышению температуры кипения. Иногда, когда соединение добавляют к растворителю, температура замерзания раствора ниже, чем у чистого растворителя. Тогда приведенные выше уравнения немного модифицируются.
ΔT = Tрешение — Трастворитель
Значение ΔT является отрицательным значением, поскольку точка кипения теперь ниже, чем начальное значение. Молярность раствора может быть получена так же, как в методе повышения температуры кипения.
ΔT = Kе , M
Здесь Кеизвестен как криоскопическая константа. Это зависит только от свойств растворителя.
Остальные расчеты такие же, как в методе повышения точки кипения. Здесь, моли добавленного соединения также могут быть рассчитаны с использованием приведенного ниже уравнения.
Молярность = Моль соединения (моль) / Масса используемого растворителя (кг)
Затем молярную массу можно рассчитать, используя значение для молей добавленного соединения и массы добавленного соединения.
Молярная масса = масса соединения (г) / моль соединения (моль)
От осмотического давления
Осмотическое давление — это давление, которое необходимо приложить, чтобы избежать попадания чистого растворителя в данный раствор посредством осмоса. Осмотическое давление может быть дано в уравнении ниже.
∏ = MRT
Где ∏ — осмотическое давление,
М — молярность раствора
R — универсальная газовая постоянная
Т — температура
Молярность решения определяется следующим уравнением.
Молярность = Моль соединения (моль) / Объем раствора (л)
Объем раствора может быть измерен, а молярность может быть рассчитана, как указано выше. Следовательно, моли соединения в растворе могут быть измерены. Тогда молярная масса может быть определена.
Молярная масса = масса соединения (г) / моль соединения (моль)
Какова важность знания молярной массы вещества
- Молярные массы различных соединений можно использовать для сравнения температур плавления и температур кипения этих соединений.
- Молярная масса используется для определения массовых процентов атомов, присутствующих в соединении.
- Молярная масса очень важна в химических реакциях для определения количества определенного реагирующего реагента или для определения количества продукта, который можно получить.
- Знание молярных масс очень важно, прежде чем будет разработана экспериментальная установка.
Резюме
Существует несколько методов для расчета молярной массы данного соединения. Самый простой способ среди них — это добавление молярных масс элементов, присутствующих в этом соединении.
Рекомендации:
1. «Крот». Энциклопедия Британника. Encyclopædia Britannica, inc., 24 апреля 2017 года. Интернет.