Жизнь на Земле невозможна без перехода воды в пар. Он присутствует в атмосфере всегда, в том или ином количестве. В некоторых ситуациях, человеку необходимо знать количество пара, содержащегося в воздухе, в текущий момент.
Чтобы это сделать, нужно знать массу водяного пара. Формула расчета, понятие о молярной и молекулярной массе, ее зависимость от давления и температуры, обо всем этом рассказывается в статье.
Содержание
- Что это такое?
- Молекулярная
- Молярная
- Удельная
- Какие факторы влияют на параметр?
- Как зависит от давления и температуры?
- Как найти массу паров воды в воздухе?
- Пример расчета
- Где в быту используются знания?
- Заключение
Что это такое?
Масса водного пара, находящегося в одном кубометре воздуха, носит название абсолютной влажности воздуха. В физике различают молярную и молекулярную массы веществ.
Молекулярная

Вода является составным веществом, одна её молекула содержит две молекулы водорода и одну молекулу воды.
Различают относительную молекулярную и абсолютную молекулярную массу. Относительная молекулярная масса – это единица, не имеющая размерности, и отображающая отношение массы атома или молекулы к 112 массы атома углерода (¹²С).
Абсолютная молекулярная – это значение атома или молекулы вещества, выраженная в атомных единицах массы (а.е.м.). Значение а.е.м, принимаемое для расчетов, берут из периодической таблицы Менделеева.
Рассчитывают молекулярную массу пара следующим образом:
- Ar (воды) = 2 x Ar (водорода) + Ar (кислорода).
- Возьмем из таблицы Менделеева значения атомных величин водорода и кислорода, округлим их до целых чисел, и подставив значения в формулу, получим:
- Ar (пара) = Ar (воды) = 2 x Ar (1,0) + Ar (16,0) = 18,0.
- Итог: абсолютная молярная масса водяного пара равна 18,0 (а.е.м).
Молярная
Молярная масса воды – это молекулярный вес её 1 моль. Учитывая, что пар – одно из состояний воды, значит его молярная величина, равна молярной массе воды. Этот вид физических измерений не зависит от каких-либо других факторов и является величиной постоянной.
Рассчитывается величина путем деления молекулярной величины вещества на единицу его количества.
Молярная масса вещества, состоящего из различных атомов других веществ, может незначительно отличаться от молекулярной величины, если какой-либо из элементов, входящих в его состав имеет нестабильное состояние.
Зная молекулярную массу, довольно легко определить его молярное значение: Mr (пара) = Ar (пара) : 1000 = 0,018 Кгмоль.
Удельная

Удельное отношение показывает содержание весовых единиц в единице объема, поэтому такого понятия, как «удельная масса вещества» в физике не существует, однако есть понятие удельного веса.
Удельный вес вещества – величина, указывающая, сколько его килограммов содержится в одном кубометре объема. По-другому, удельный вес называется плотностью, и измеряется в КДжКг.
Какие факторы влияют на параметр?
На этот параметр оказывает влияние только один фактор – суммарная атомная масса двух молекул водорода и одной кислорода. На удельный вес водяного пара значительно влияют его температура и давление, под которым он находится в единице объема.
Как зависит от давления и температуры?
Учитывая молекулярную сущность термина «масса пара», можно сказать, что ни от давления, ни от температуры она не зависит. От указанных параметров зависит только его удельный вес.
При повышении давления, удельный вес возрастает:
- при давлении в 6 Бар, 1 м³ будет весить 3170 г.;
- 10 Бар – вес 5150 г.;
- 25 Бар – уже 12500 г.
Похожие изменения происходят с удельным весом пара воды и при повышении температуры – он становится больше.
Существует небольшая таблица зависимости веса пара от давления и температуры:
| Давление пара, Кгссм² | Температура, ˚С | Вес 1 м³ пара, Кг |
| 1,0 | 99,1 | 0,580 |
| 1,2 | 104,2 | 0,688 |
| 1,6 | 112,7 | 0,901 |
| 2,0 | 119,6 | 1,11 |
| 3,0 | 132,8 | 1,62 |
| 4,0 | 151,0 | 2,12 |
Как найти массу паров воды в воздухе?

Шаг 1. Переведем формулу для поиска массы: m = РV*M/R*T.
Шаг 2. Для определения давления пара Р, применяется формула вычисления относительной влажности воздуха φ: φ = P/Pн. Давление будет: P = Pн*φ.
Шаг 3. Для получения корректных значений, необходимо все используемые значения перевести в одну систему единиц – температуру в значения по шкале Кельвина, а проценты относительной влажности в единичные доли.
Шаг 4. Выражение из шага №2, необходимо подставить в формулу из шага №1: m = Pн*φ*V*M/R*T. Проведя математические действия, получают искомое значение в килограммах.
Пример расчета
Определить вес водяного пара в 1 кубометре воздуха при нормальном атмосферном давлении, температуре 26˚С и относительной влажности 61%. Давление пара при 26˚С, составляет 3168 Па:
- Выпишем данные: V = 1 м³; T = 26˚С; φ = 61%; Pн = 3168 Па; m — ?
- Переведем величины: 26˚С = 299 К, и 61% = 0,61.
- Подставим данные в формулу из шага №4 инструкции: m = Pн*φ*V*M/R*T = 0,61*3168*1*0,018 8,31*299 = 0,0138 Кг.
Получаем ответ: Вес водяного пара в 1 кубометре воздуха при нормальном атмосферном давлении, температуре 26˚С, и относительной влажности 61%, составляет 0,0138 кг.
Определение массы водяных паров, видео-инструкция:
Где в быту используются знания?
Водяной пар широко используется в промышленности и других областях деятельности человека:
- Добыча и переработка нефти – его закачивают в скважины для повышения их продуктивности путем снижения вязкости нефти. Им прогревают трубопроводы, резервуары. На НПЗ он применяется для увеличения количества отбора светлых нефтепродуктов (бензин, керосин).
- Производство электроэнергии – применяют в ТЭЦ для вращения паровых турбин, а после отработки, в виде горячей воды закачивают в системы ГВС и отопления.
- Химическая промышленность – им разогревают гальванические ванны, используют его для ускорения процесса синтеза некоторых материалов.
- Деревообработка и производство бумаги – при его помощи разогревают дерево перед различными типами обработки: «раскрутка» ствола при производстве шпона, разделка дерева для получения целлюлозы и бумаги.
- Строительство – сушат железобетонные изделия, прогревают инертные материалы, увеличивают прочность газобетона сушкой паром в автоклавах.
- ЖКХ – разморозка трубопроводов, канализации и других конструкций в зимний период.
- Пищевая промышленность – стерилизация и пастеризация продуктов, их размораживание и варка.
- Судоходство и другие отрасли транспорта – использование в паровых турбинах и в системах парового пожаротушения.
Множественное применение нашел пар и в быту – приготовление еды в пароварках, парилки в банях, глажка одежды. Измерение его веса в быту вряд ли будет иметь место, но знание этого процесса никому не помешает.
Заключение
Подводя итог, можно сделать вывод – знание веса пара воды необходимо при расчетах паропроводов в системах энергетики, конструкций, работающих в других отраслях промышленности.
Необходимы такие знания и при расчете некоторых типов бытовых приборов. Несложные по своей сути, такие расчеты вполне по силам любому грамотному человеку.
По этой ссылке вы найдёте полный курс лекций по математике:
Определение молекулярной массы по относительной плотности другого газа: Определение молекулярной массы газа по молярному объему: Определение молекулярной массы газа по уравнению Клапейрона-Менделеева: Пример 15 Вычислите относительную молекулярную массу оксида серы (IV) по значению его относительной плотности по водороду, равной 32. Решение: , что соответствует относительной молекулярной массе, равной 64. Ответ: M(S02) = 64 г/моль.
Пример 16 Определите относительную молекулярную массу газа, если при нормальных условиях 0,824 г его занимают объем 0,260 л. Дано:Найти: М( газа) Решение: При н. у. 1 моль любого газа занимает объем 22,4 л. Вычислив массу 22,4 л данного газа, получают его молярную массу: газа занимают объем 0,260 л Следовательно, молярная масса газа равна 71,0 г/моль, а его относительная молекулярная масса— 71. Ответ: М(газа) = 71,0 г. Пример 17 Рассчитайте относительную молекулярную массу вещества, 500 мл паров которого при 87 °С и давлении 720 мм рт. ст. имеют массу 0,93 г. Найти: М(вещества)
Решение: По уравнению Клапейрона-Менделеева: Относительная молекулярная масса вещества равна 58. Ответ: М(вещества) — 58 г/моль. Вопросы и задачи для самостоятельного решения 1. Каково практическое значение закона сохранена массы вещества? 2L Сформулируйте закон объемных отношений. Укажите, какова его роль в развитии атомно-молекулярных представлений? 3. Каково значение закона Авогадро? Как можно воспользоваться этим законом для определения величин молярных масс веществ? 4. Какие газовые законы вам известны? Какие функциональные связи они вскрывают?
Возможно вам будут полезны данные страницы:
5. Укажите основные факторы, приводящие к отклонению свойств идеальных газов от предсказываемых уравнением состояния идеальных газов.
6. При разложении 12,25 г хлората калия образовалось 4,8 г кислорода. Какова масса образовавшегося при этом хлорида калия. Подтвердите расчетами выполнение закона сохранения массы веществ. Ответ: 7,45 г. 7. Какие количества кислорода и магния необходимо взять для получения 8 г оксида магния? Ответ: 8. Сколько г сульфида цинка должно получиться, если для реакции взято 8 г серы и 32,7 г цинка? 9. Определите молярную массу эквивалента металла, если его соединение с иодом содержит 94,8 % иода.
Молярная масса эквивалента иода равна 127. 10. 1 г металла соединяется с 1,78 г серы или с 8,89 г брома. Найдите молярные массы эквивалентов брома и металла, зная, что молярная масса эквивалента серы равна 16. Но Мышьяк образует два оксида, из которых один содержит 34,8%, а другой— 24,3% кислорода.
Определите молярную массу эквивалента мышьяка в том и другом оксиде. Как относятся эти величины друг к другу? 12. Олово образует два оксида, содержащих: первый 78,8 % олова, а второй — 88,12 % олова. Вычислите молярные массы эквивалентов олова, исходя из состава этих оксидов, и найдите соотношения между полученными величинами. 13. Оксид металла содержит 28,57 % кислорода, а соединение того же металла с фтором — 48,72 % фтора. Рассчитайте из этих данных молярную массу эквивалента фтора. Ответ: 18,9. 14. 1,6 г кальция и 2,615 г цинка вытесняют из кислоты одинаковые количества водорода.
Найдите молярную массу эквивалента
цинка, зная, что молярная масса эквивалента кальция равна 20. Ответ: 32,7. 15. Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,173 г одного из галогенов. Определите молярную массу эквивалента галогена. Ответ: 126,9. 16. При нейтрализации некоторой кислоты едким натром на 1,125 г кислоты расходуется 1 г едкого натра, молярная масса эквивалента которого равна 40. Вычислите молярную массу эквивалента кислоты.
Ответ: 45. 17. Определите молярную массу эквивалента хлорного железа, зная, что 1,3 г его взаимодействует без остатка с 1 г едкого натра, молярная масса эквивалента которого равна 40. Ответ: 52. 18. Отразите уравнением процесс полного сгорания метана и рассчитайте отношения между объемами участвующих в реакции газов, учитывая, что они измерены при одинаковых условиях. Ответ: СН4 : 02 = 1 : 2. 19. Один грамм воздуха при нормальных условиях занимает объем 773 мл.
Какой объем займет то же количество воздуха при 0 °С и давлении, равном 700 мм рт. ст.? Ответ: 839 мл. 20. В сосуде емкостью 1 л находится 0,05 моль газа при 0 °С. Определите давление газа в сосуде. Ответ: 1,12 атм. 21. Найдите молекулярную массу вещества, зная, что 380 мл его паров при 97 °С и давлении 740 мм рт. ст. имеют массу 1,9 г. Ответ: 156. 22. Определите молекулярную массу вещества, зная, что масса 200 мл его паров при нормальных условиях равна 0,232 г. Ответ: 26. 23. Масса 1 л озона при нормальных условиях равна 2,146 г.
Подтвердите расчетом, что значение его молекулярной массы равно 48, и найдите плотность озона по воздуху. Ответ: 1,66. 24. Плотность этилена по кислороду 0,875. Рассчитайте молекулярную массу этилена. Ответ: 28. 25. Определите давление кислорода, если 0,1 кг его находится в сосуде объемом 0,02 м3 при 20 °С. Ответ: 380 640 Па. 26. Какой объем займет 1 кг воздуха при температуре 17 °С и давлении 1 атм? Ответ: 820 л. 27. Найдите массу 1 л бромистого водорода при нормальных условиях.
Какова плотность этого газа по воздуху? Ответ: 3,62 г; 2,79. 28. На сжигание 1 г металла требуется 462 мл (н. у.) кислорода. Рассчитайте молярную массу эквивалента этого металла. Ответ: 12,12. 29. 0,2 г металла вытеснили 197 мл водорода, который был собран и измерен при 20 °С и 780 мм рт. ст. Найдите молярную массу эквивалента этого металла. Ответ: 11,90. 30. При нагревании 4,3 г оксида металла было получено 580 мл кислорода, объем которого измерен при 10 °С и 850 мм рт. ст. Найдите молярную массу эквивалента металла, если известно, что 1 л кислорода при н. у. имеет массу 1,43 г. Ответ: 30,44. 31.
Найдите плотность по воздуху газовой смеси, состоящей из 60 % оксида серы (IV) и 40 % оксида углерода (IV). Ответ: 1,93. 32. Для полного восстановления 42 г оксида металла потребовалось 9,56 л водорода, взятого при 7 °С и 730 мм рт. ст. Рассчитайте молярную массу эквивалента металла. Ответ: 32. 33. Найдите объемный состав смеси кислорода с озоном, плотность которой по воздуху равна 1,21. Ответ: 02 : 03 = 4 :1. 34. Какой объем при н. у. займут 28,2 • 1021 молекул газа? Ответ: 1,05 л. 35.
Какой объем водорода полностью сгорит в 1 л воздуха? Ответ: 0,42 л. 36. При некоторой температуре плотность паров серы по воздуху равна 8,83. Из какого количества атомов состоит молекула серы при этой температуре? Ответ: из восьми. 37. Рассчитайте объем оксида углерода (IV), образовавшегося при взрыве 17 л метана с 36 л кислорода. Ответ: 17 л. 38. Газовая смесь объемом 10,6л (н. у.), применяемая для получения аммиака, имеет массу 6,57 г. Каков состав газовой смеси? Ответ: 4,85л N2; 5,75л Н2. 39. Смесь азота с водородом объемом 1 л при температуре 0 °С и давлении 2 атм имеет массу 1 г. Определите объемный состав смеси. Ответ: 35,36% N2.
Определение молекулярной массы по плотности паров. Метод применяется обычно при исследовании легких моторных топлив и растворителей. Он основан на тех же теоретических положениях, что и метод определения плотности паров или газов. Молекулярную массу по плотности паров можно определять, либо измеряя объем паров при известном и постоянном давлении (метод Мейера), либо измеряя давление при постоянном и известном объеме (метод Дюма). [c.32]
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ ГАЗА (ПАРА) ДОМАШНЯЯ ПОДГОТОВКА [c.24]
Раньше для определения молекулярной массы растворенного вещества можно было пользоваться лишь методом определения плотности газа или пара. Это позволяло работать только с газообразными веществами или с веществами, переходящими в газообразное состояние без разложения. После работ Ф. Рауля и Я. Вант-Гоффа молекулярную массу летучих и нелетучих веществ, находящихся в растворе, можно было определять путем измерения 1) осмотического давления 2) понижения растворимости 3) понижения температуры замерзания 4) понижения давления пара 5) повышения температуры кипения. [c.308]
Молекулярная масса газа или пара равна произведению его плотности по отношению к любому другому газу на молекулярную массу последнего. При этом под плотностью понимают отношение массы определенного объема данного газа к массе такого же объема другого газа (при одинаковых температуре и давлении), молекулярная масса которого известна. [c.15]
Техника и стоимость перевода других видов топлива в газы, взаимозаменяемые с природным газом, варьируются в очень широких пределах и зависят главным образом от свойств сырья и, следовательно, простоты его газификации. Качественный заменитель можно получать практически из любого ископаемого топлива, например из угля, сырой нефти или любой углеводородной фракции этих сырьевых материалов. В то же время сложность и стоимость процесса переработки будут значительно меньше, если относительная молекулярная масса топлива будет низкой, а химический состав его простым. Легкие углеводороды, например сжиженный нефтяной газ, лигроин, газовый конденсат или реактивное топливо, в определенных условиях можно газифицировать довольно просто с помощью пара. Более тяжелые фракции реагируют в таких условиях хуже и для инициирования процесса газификации, как правило, требуют наличия свободного водорода, получаемого во вспомогательном блоке. [c.20]
К идеальным свойствам растворов и выводу на их основе свойств реальных растворов можно подойти путем проведения аналогии с предшествующим рассмотрением газов, причем в качестве критерия идеальности раствора может использоваться его соответствие закону Рауля. Таким образом, естественно перейти к рассмотрению понижения давления пара нелетучим растворенным веществом, а также остальных коллигативных свойств. Следует сделать упор на их использование для определения молекулярных масс, и в этом отношении некоторым студентам должны принести большую пользу Программные обзоры . [c.579]
Определение молекулярной массы газа (пара) 25 [c.25]
Описанными способами можно определять молекулярные массы не только газов, но и всех веществ, переходящих при нагревании (без разложения) в газообразное состояние. Для этого навеску исследуемого вещества превращают в пар и измеряют его объем, температуру и давление. Последующие вычисления производят так же, как и при определении молекулярных масс газов. [c.30]
Необходимо еще раз подчеркнуть, что в основе изложенных способов определения молекулярных масс газообразных и парообразных веществ с помощью уравнения Клапейрона — Менделеева или путем нахождения относительной плотности газа или пара лежит закон Авогадро. Сами способы отличаются друг от друга лишь методикой проведения эксперимента. [c.21]
Парциальное дав,пение газа. При определении молекулярных масс газов очень часто приходится измерять объем газа, собранного над водой и потому насыщенного водяным паром. Оп- [c.30]
Парциальное давление газа. При определении молекулярных масс газов очень часто приходится измерять объем газа, собранного над водой и потому насыщенного водяным паром. Определяя в этом случае давление газа, необходимо вводить поправку на парциальное давление водяного пара. При обычных условиях различные газы смешиваются друг с другом в любых соотношениях. При этом каждый газ, входящий в состав смеси, характеризуется своим парциальным давлением. Оно представляет собой то давление (р ), которое производило бы имеющееся в смеси количество данного газа, если бы оно одно занимало при той же температуре весь объем, занимаемый смесью. [c.24]
Если при определении молекулярной массы газа собирают газ над водой, то его давление рг всегда меньше атмосферного на величину давления пара воды рв, ибо в соответствии с законом парциальных давлений [c.50]
Определение молекулярных масс газов и паров [c.51]
II. Парциальное давление газа. При определении молекулярных масс газов очень часто приходится измерять объем газа, собранного над водой и потому насыщенного водяным паром. Определяя в этом случае давление газа, необходимо вводить поправку на парциальное давление водяного пара. [c.28]
Определение молекулярной массы веществ в газообразном или парообразном состоянии. На основе закона Авогадро был создан один из наиболее распространенных методов определения молекулярных масс газов и паров. [c.21]
Наиболее характерный для фосфора оксид — дифосфорпентоксид (фосфорный ангидрид, Р2О5) представляет собой белый порошок, не имеющий запаха и при сильном нагревании возгоняющийся. Определение его молекулярной массы в парах указывает на удвоенную формулу — Р4О10, которой отвечает приводимая на рис. 1Х-18 пространственная структура. Фосфорный ангидрид чрезвычайно энергично притягивает влагу и поэтому часто применяется в качестве осушителя газов. [c.276]
Определение молекулярных масс показало, что молекулы простых газов состоят из двух атомов (Нг, Fa, I2, О2, N2), а молекулы благородных газов — из одного атома (Не, Ne, Аг, Кг, Хе, Rn). Для благородных газов понятия молекула и атом равнозначны. Однако молекулы некоторых других простых веществ состоят из трех и более атомов, например молекулы озона О3, фосфора Р , паров серы при невысоких температурах Sj. [c.24]
Для определений, не требующих большой точности,, можно принять, что молекулярная масса газа или пара приблизительно равна его удвоенной плотности по водороду. [c.23]
ГАЗОВЫЕ ЗАКОНЫ. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНЫХ ВЕСОВ (МОЛЕКУЛЯРНЫХ МАСС) ГАЗОВ И ПАРОВ [c.13]
Простой и точный метод определения молекулярной массы высокомолекулярных соединений был предложен Жуховицким с сотр. [56[. Схема прибора включает катарометр, в камеры которого поступают потоки газа, насыщенные легким растворителем. Насыщение осуществляется в термостатируемых сосудах. Добавление в один из сосудов небольшого количества высокомоле-ку.лярного соединения вызывает депрессию упругости пара растворителя и, следовательно, разбаланс моста катарометра вследствие различия в составе потоков. Поскольку депрессия упругости пара ДР/Р соответствует мольной доле нелетучего соединения, то можно определить его молекулярную массу. Погрешность ме-тода существенно менее 1 отп. %. [c.88]
Определение молекулярных масс показало, что молекулы простых газов состоят из двух атомов, а каждая молекула благородных газов состоит из одного атома (Не, Ne, Аг, Кг, Хе, Кп). Однако молекулы некоторых простых веществ состоят из трех и более атомов, например озона О3, фосфора 4, паров серы при невысоких температурах 83. [c.21]
Горючие паровые облака воспламеняются только при определенных концентрациях компонентов смеси, пределы этих концентраций для каждого вещества свои. На рис. 7.1 показаны пределы воспламеняемости для веществ составляющих основные опасности химических производств. За исключением водорода и метана, все обозначенные на рисунке газы и пары имеют нижние пределы воспламеняемости в воздухе 1,5 — 3% (об.) эти значения приблизительно обратно пропорциональны молекулярной массе газа. Отметим, что олефины имеют более широкую область воспламенения, чем парафины. Область взрываемости несколько уже показанной на рис. 7.1 области воспламеняемости. Таким образом, опасность вопламенения связана главным образом с концентрациями, превышающими 1,5 — 3,0 10 млн». С токсичными газами дело обстоит иначе. Большое количество накопленных для них данных показывает, что летальные концентрации могут быть меньше Ю» млн 1. [c.112]
При помощи масс-спектрометра можно проводить определения молекулярного веса газов и паров. Как известно, скорость истечения газа через малое отверстие зависит от молекулярного [c.235]
В конце прошлого века Рауль, Вант-Гофф, Аррениус установили законы, связывающие концентрацию раствора нелетучего вещества с такими его свойствами, как осмос, понижение давления пара растворителя, понижение температуры замерзания и повышение температуры кипения. Эти свойства зависят только от количества частиц растворенного вещества, но не от его природы, они называются коллигативными свойствами. Растворы, подчиняющиеся законам Рауля и Вант-Гоффа, часто называются идеальными растворами. Эго — сильно разбавленные (теоретически — предельно разбавленные) растворы неэлектролитов с мольной долей 0,005. Теория идеальных растворов отличается простотой, так как молекулы компонентов раствора никак не взаимодействуют друг с другом. Изучение предельно разбавленных растворов так же необходимо, как, например, изучение идеальных газов. Свойства этих растворов используются для определения молекулярной массы растворенного вещества, активности и коэффициента активности. [c.202]
Благодаря низкой относительной молекулярной массе и простому химическому составу компонентов СНГ, его очистка, например от серы, водяных паров и т. п., осуществляется без особых трудностей, а перерабатывающее оборудование проще, чем для следующей легкой нефтяной фракции (лигроина и легкого дистиллята). Тем не менее установки ЗПГ редко предназначаются только для переработки СНГ, поскольку запасы его обычно ограничены, а хранение обходится дороже, чем хранение лигроина для хранения газ должен сжижаться в процессе сжатия или охлаждения. Поэтому перерабатывающее оборудование рассчитано и на СНГ, и на лигроин. Чаще всего СНГ используют для повышения теплоты сгорания ЗПГ. Добавка СНГ к бедным газам до получения приемлемой точки росы — один из экономически выгодных путей улучшения качества газа, изготавливаемого согласно определенным техническим условиям. [c.74]
Определение молекулярных масс показало, что молекулы ирос гых газов состоят пз двух атомов, а каждая молекула благородных газов состоит нз одного атома (Не, N6, Аг, Кг, Хе, Rп). Однако молекулы некоторых простых вещесгв состоят пз трех п более атомов, например озона Од, фосфора Р , паров серы при невысо1И1Х температурах [c.13]
Нитродиоксид представляет собой бурый газ, легко сгущающийся В жидкость, кипящую при +21 °С. При охлаждении до —11 °С эта жидкость застывает в бесцветную кристаллическую массу. Определение молекулярной массы по плотности пара дает цифры, лежащие между простым (14 + 2-16 = 46) и удвоенным (92) его значениями, причем цифры эти зависят от температуры опыта, уменьшаясь при ее повышении и увеличиваясь при понижении. [c.265]
Хроматографы Биохром-1 предназначены для применения в химии, биологии и медицине. Они укомплектованы такими же детекторами, как и хроматографы ЛХМ-80 (пламенно-ионизационный детектор — дифференциального типа). Особенностями приборов являются возможность работать со стеклянными капиллярными колонками, наличие системы программирования температуры, планшетного регистратора, эффузионной камеры для определения молекулярной массы сорбатов, пиролитических приставок различных типов. В одной из моделей предусмотрена возможность работы с парами воды в качестве элюента, а также система программирования расхода газа-носителя. Другая модель включает микронрепаративную приставку. [c.167]
Весовым методом в одном опыте можно исследовать зависимость р = ДТ), а также неограниченное число раз повторить опыт с одной и той же ампулой (если соблюдаются условия, близкие к равновесным) и тем самым повысить точность определения. В однотемпературную печь помещается ампула с исследуемым веществом, находящимся в одном ее конце (рис. 15, а). С противоположйой стороны ампулы лри-варен кварцевый шток, выходящий за пределы нагретой зоны. Конец штока подвешивается к одной из чашек аналитических весов. Вся система уравновешивается на специально изготевлениой кварцевой призме, находящейся в печи при этом на ампуле делается насечка, фиксирующая ее положение на вершине этой призмы. Пар летучего компонента при данной температуре равномерно распределяется по объему ампулы, а соответствующая потеря массы твердой фазы регистрируется на аналитических весах. Далее с учетом объема ампулы и молекулярной массы пара по уравнению состояния идеальных газов рассчитывают давление. В данной схеме «показания весов не соответствуют истинному изменению массы при диссоциации. Расчет изменения массы вещества следует вести по правилу моментов (рис. 15. б). Введем следующие обозначения Ат — истинное изменение массы при диссоциации Ат и Ат.2 — массы пара соответственно в левой и правой частях ампулы (относительно оси равновесия) Атз — изменение показаний весов /1, и /3 — плечи V — общий объем ампулы [c.29]
Определение молекулярного веса пара

Для этого некоторое количество-исследуемого вещества превращают в пар и измеряют вес, объем, температуру и давление полученного пара. Последующее вычисление молекулярного веса производится так же, как и в случае газов.
Определение молекулярного веса пара жидкостей, а также легколетучих твердых веществ удобно производить в приборе, изображенном на рис.
Прибор для определения веса пара
В этом приборе длинная стеклянная трубка 1, оканчивающаяся более широким резервуаром, помещается в стеклянный сосуд 2. В сосуд наливается жидкость, кипящая при температуре, достаточно высокой для превращения исследуемого вещества в пар. Трубка 1 закрывается вверху пробкой.
От верхней части трубки отходит изогнутая газоотводная трубка 3, конец которой опущен в воду, налитую в чашку 4. Против газоотводной трубки припаяна короткая трубочка, в которую при помощи резиновой трубки 5 вставлена стеклянная палочка 6, служащая для поддержки маленькой пробирки (ампулки) 7 с исследуемым веществом.
При нагревании жидкости в сосуде 2 до кипения воздух в трубке расширяется и выходит пузырьками через газоотводную трубку 3. Когда установится постоянная температура, о чем можно судить по прекращению выделения пузырьков воздуха, конец трубки 3 подводят под измерительный цилиндр (эвдиометр) 8, наполненный водой.
Затем, выдвигая стеклянную палочку 6, дают пробирке с точно отвешенным количеством исследуемого вещества упасть на дно трубки 1, в которую налито немного ртути для защиты дна от удара вещество испаряется, и пары его вытесняют в измерительный цилиндр некоторый объем воздуха, принимающий в цилиндре комнатную температуру.
При этом не требуется знать температуру, при которой вещество испарилось, так как отсчитанный при помощи измерительного цилиндра объем воздуха равен тому объему, который занимали бы пары исследуемого вещества при комнатной температуре, если бы его удалось превратить при этой температуре в пар.
Третья величина, определяемая из опыта, — давление воображаемого пара, равное давлению воздуха в измерительном цилиндре. Эту величину находят путем вычитания из атмосферного давления того давления, которое производит столб воды в цилиндре 8.
19 20 21
Статья на тему Определение молекулярного веса пара
Понравилась статья поделись ей
Молярная масса водяного пара
Молярная масса водяного пара
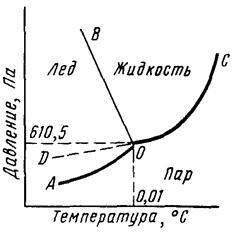
Он не имеет ни цвета, ни вкуса, ни запаха. Вода – это наиболее распространенное вещество в природе. Помимо существования в виде газа, она также может находиться в жидком или твердом (лед) состоянии, каждое из которых определяется температурой и давлением (рис. 1).
Рис. 1. Диаграмма состояния воды.
Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Брутто-формула водяного пара совпадает с брутто-формулой воды и имеет вид 2O. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(H2O) = 2×Ar(H) + Ar(O);
Mr(H2O) = 2×1 + 16 = 2 + 16 = 18.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что молярная масса водяного пара равна 18 г/моль.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |