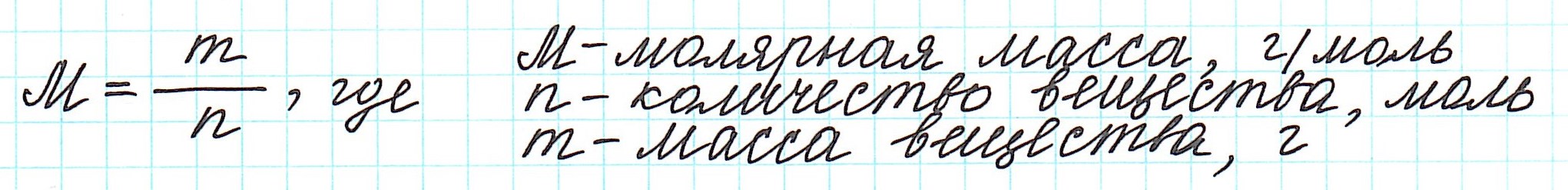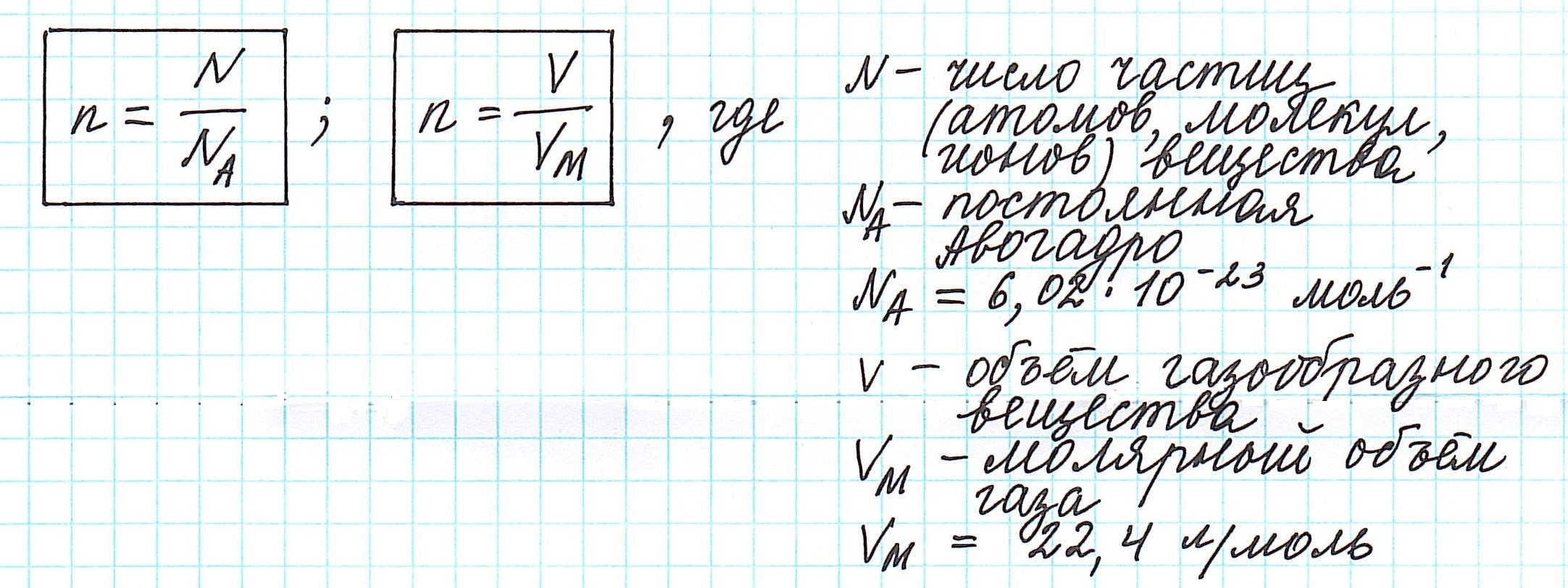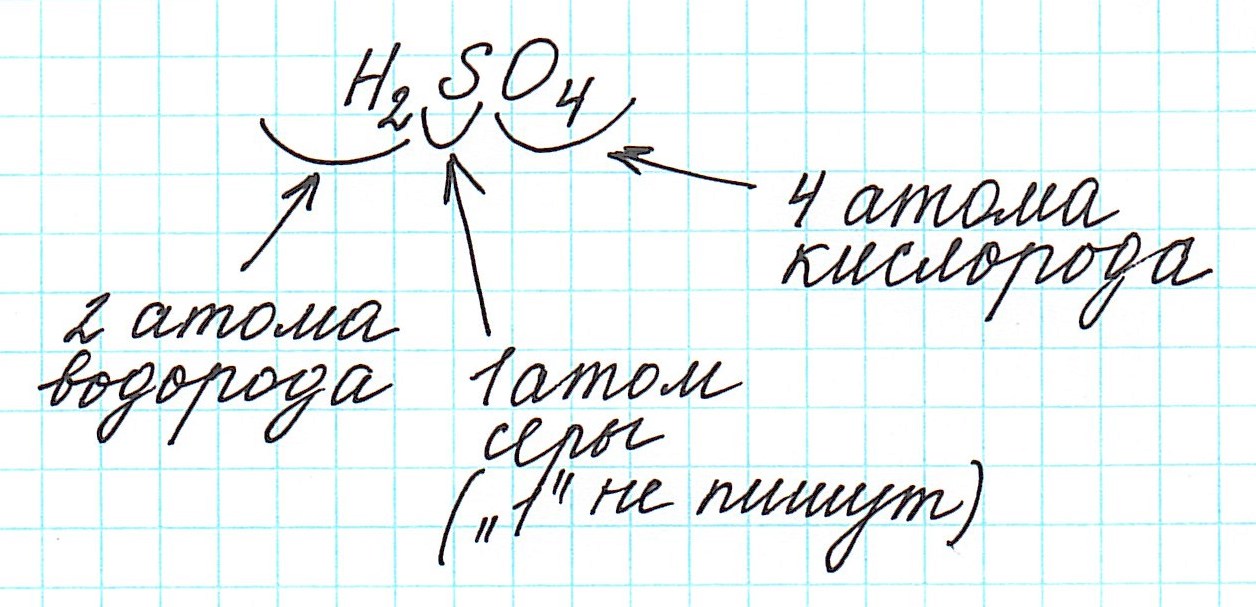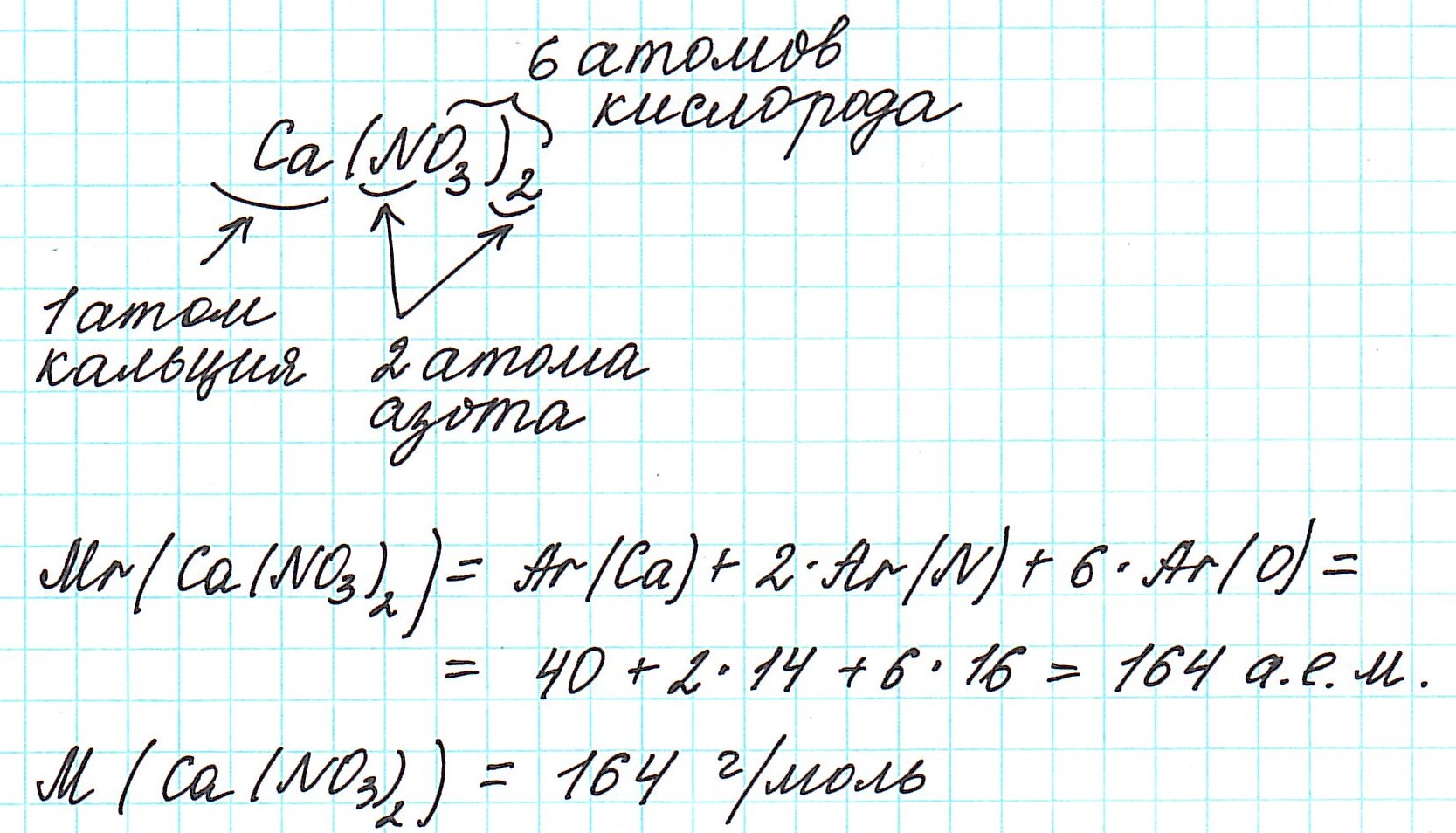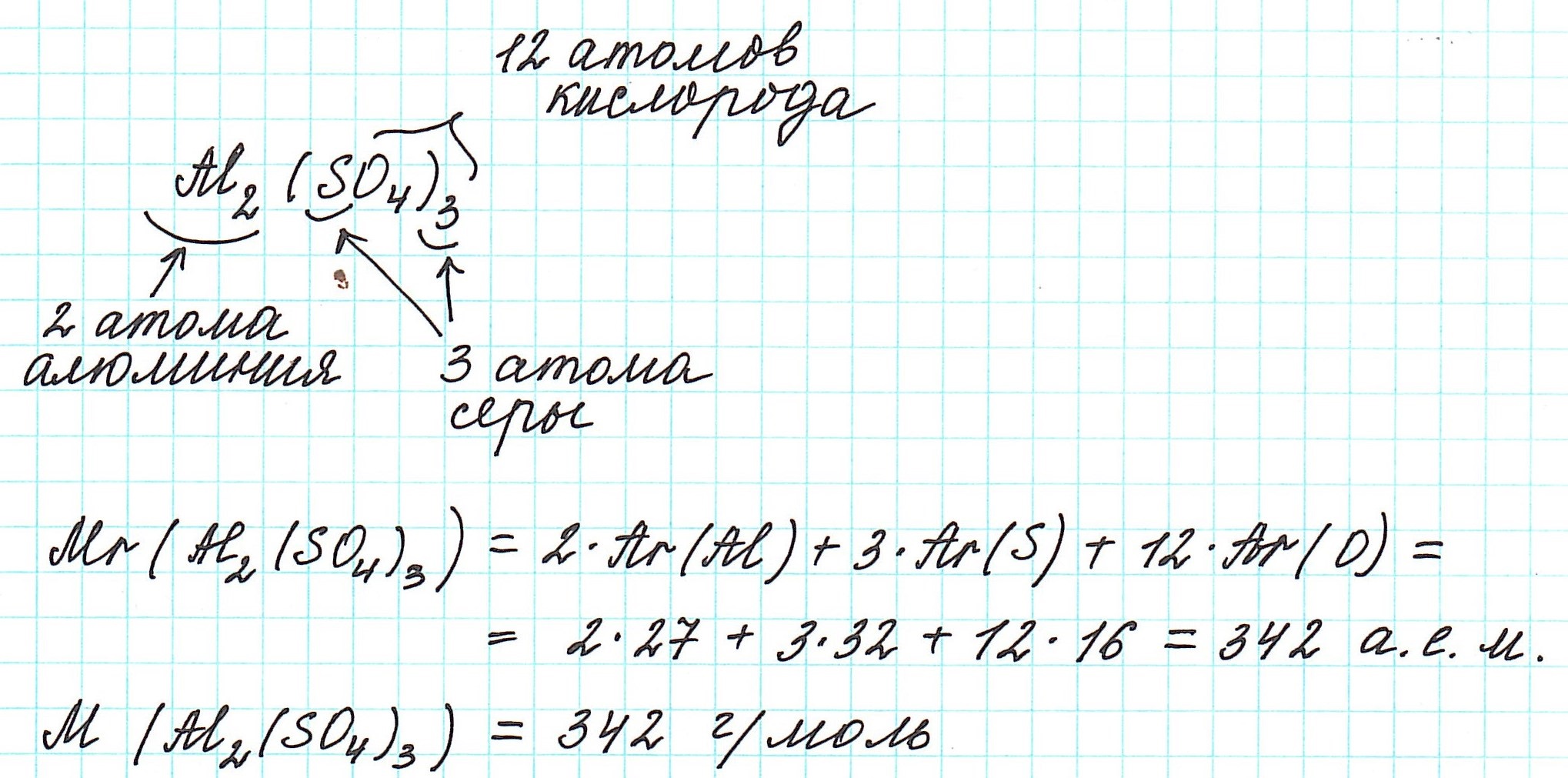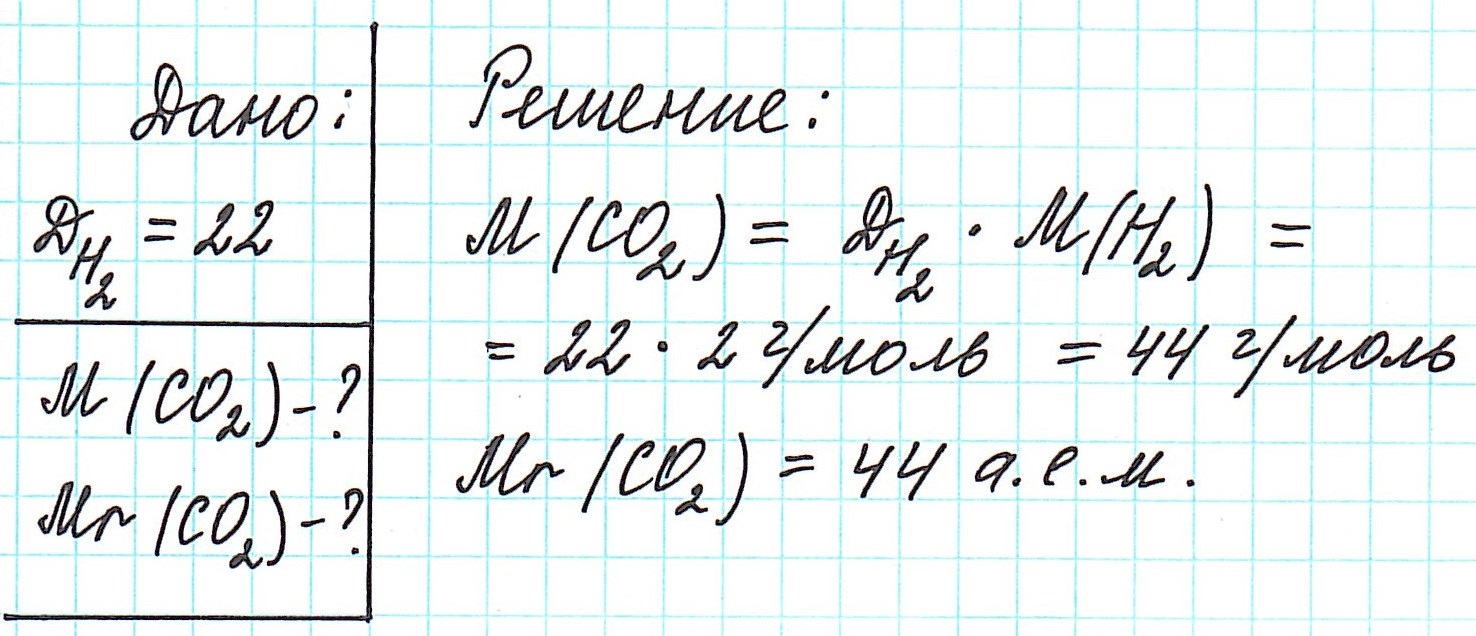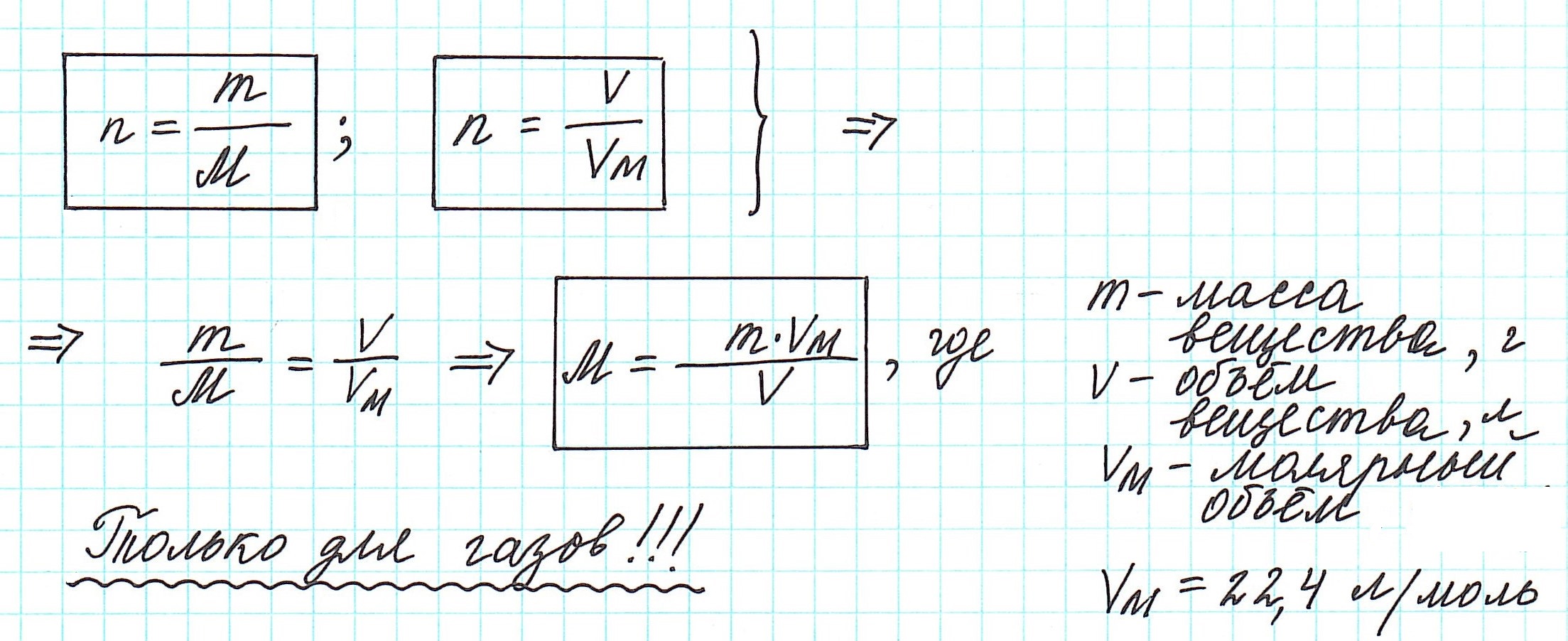Загрузить PDF
Загрузить PDF
Атомы слишком малы, чтобы измерять ими массу химических веществ. Для работы с реальными количествами материи ученые ввели понятие моля. В один моль вещества входит столько же атомов, сколько содержится в 12 граммах изотопа углерод-12, что составляет примерно 6,022 x 1023 атомов. Эта постоянная величина получила название числа Авогадро.[1]
Данная константа применима для описания количества атомов или молекул любых веществ, причем масса одного моля вещества называется его молярной массой.
-
1
Ознакомьтесь с понятием молярной массы. Молярной массой какого-либо вещества называют массу (в граммах) одного моля этого вещества.[2]
Молярную массу химического элемента можно вычислить, умножив атомную массу этого элемента на коэффициент пересчета, измеряемый в граммах на моль (г/моль). -
2
Определите относительную атомную массу элемента. Относительной атомной массой какого-либо элемента называется средняя масса всех его изотопов, выраженная в атомных единицах массы (а.е.м.).[3]
Ее можно узнать из периодической таблицы Менделеева. Найдите в таблице необходимый элемент и обратите внимание на число, приведенное под символом этого элемента. Это нецелое число, имеющее знаки после десятичной запятой.- К примеру, относительная атомная масса водорода составляет 1,007, у углерода она равна 12,0107, у кислорода − 15,9994, у хлора − 35,453.
-
3
Умножьте относительную атомную массу на коэффициент пересчета, равный 0,001 килограмма, или 1 грамм на моль. Тем самым, переведя атомные единицы массы в граммы на моль, вы определите молярную массу элемента. Для водорода у вас получится 1,007 грамма на моль, для углерода − 12,0107 грамма на моль, для кислорода − 15,9994 грамма на моль, и для хлора − 35,453 грамма на моль.
- Некоторые элементы состоят из молекул, каждая из которых образована из двух или более атомов. Для того, чтобы определить молярную массу элемента, молекулы которого состоят из двух атомов (например, водорода, кислорода или хлора), следует найти его относительную атомную массу, умножить ее на коэффициент пересчета в граммы и дополнительно умножить на 2 (число атомов в одной молекуле).
- В случае H2 находим: 1,007 x 2 = 2,014 грамма на моль; для O2 получаем: 15,9994 x 2 = 31,9988 грамма на моль; для Cl2: 35,453 x 2 = 70,096 грамма на моль.
Реклама
-
1
Определите химическую формулу вещества. В этой формуле содержится информация о количестве атомов всех элементов, входящих в состав молекулы данного вещества. Химическую формулу интересующего вас вещества можно найти в справочнике по химии. Например, хлористоводородная (соляная) кислота имеет формулу HCl, а для глюкозы формула записывается как C6H12O6. По химической формуле вещества вы сможете определить число атомов каждого элемента, входящего в его состав.
- В случае HCl молекула состоит из одного атома водорода и одного атома хлора.
- Молекула глюкозы C6H12O6 состоит из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода.
-
2
Найдите относительные атомные массы всех элементов, входящих в состав данного вещества. Пользуясь периодической таблицей Менделеева, определите относительную атомную массу каждого элемента. Эта масса указана под символом соответствующего элемента. Как и в первом методе, необходимо умножить эти относительные атомные массы на 1 грамм/моль.
- Относительные атомные массы входящих в соляную кислоту водорода и хлора составляют 1,007 г/моль и 35,453 г/моль соответственно.
- Относительные атомные массы элементов, входящих в состав глюкозы, равны 12,0107 г/моль (углерод), 1,007 г/моль (водород) и 15,9994 г/моль (кислород).
-
3
Вычислите молярную массу каждого элемента, входящего в состав химического соединения. Умножьте атомную массу элемента на количество атомов этого элемента, содержащихся в одной молекуле вещества. Таким образом вы найдете относительное количество каждого элемента, входящего в состав рассматриваемого соединения.[4]
- Молярные массы элементов, входящих в состав соляной кислоты HCl, составляют 1,007 грамма на моль (водород) и 35,453 грамма на моль (хлор).
- Для элементов, входящих в состав глюкозы C6H12O6, получаем следующие молярные массы: 12,0107 x 6 = 72,0642 г/моль (углерод); 1,007 x 12 = 12,084 г/моль (водород); 15,9994 x 6 = 95,9964 г/моль (кислород).
-
4
Сложите молярные массы всех элементов, входящих в состав химического соединения. Таким образом вы определите молярную массу данного соединения. Возьмите найденные ранее молярные массы элементов и сложите их. В результате у вас получится молярная масса интересующего вас вещества.
- Для соляной кислоты находим: 1,007 + 35,453 = 36,460 г/моль. Таким образом, масса одного моля соляной кислоты составляет 36,46 грамма.
- Молярная масса глюкозы составляет 72,0642 + 12,084 + 95,9964 = 180,1446 г/моль, то есть в одном моле глюкозы содержится приблизительно 180,14 грамма.
Реклама
Советы
- Для большинства химических элементов относительные атомные массы известны с точностью до 4 знаков после запятой. В расчетах обычно учитывается только 2 знака после запятой. Поэтому, например, в лаборатории молярную массу водорода записали бы как 36,46 г/моль, а глюкозы − как 180,14 г/моль.
Реклама
Что вам понадобится
- Справочник по химии или периодическая таблица Менделеева
- Калькулятор
Похожие статьи
Об этой статье
Эту страницу просматривали 108 916 раз.
Была ли эта статья полезной?
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Содержание:
1.Относительная атомная масса
2.Почему атомная масса дробная?
3.Относительная молекулярная масса
4.Количество вещества и молярная масса
5.Как вычислить молярную массу вещества
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,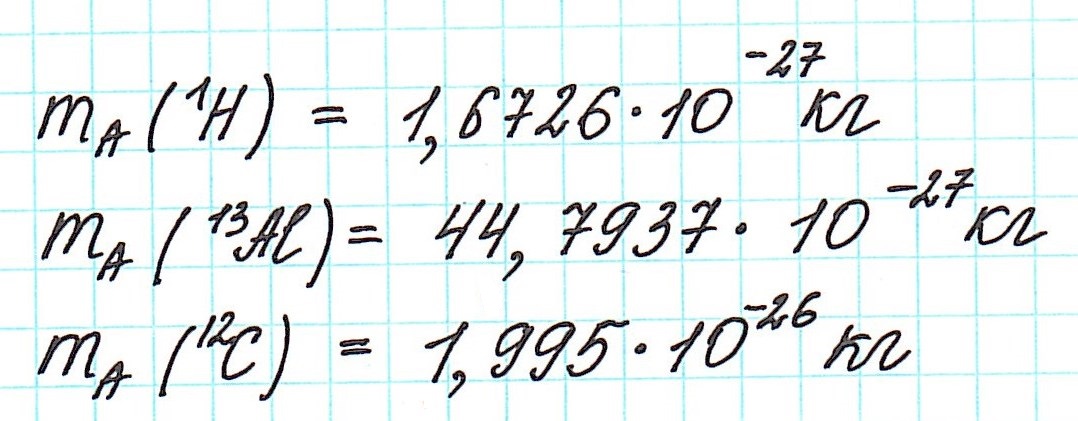
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
В настоящее время (с 1961 года) общепринятой является углеродная единица, так называемая атомная единица массы (сокращенно а.е.м.). Она равна 1/12 части массы атома углерода (изотопа 12С).
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12С и 13С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.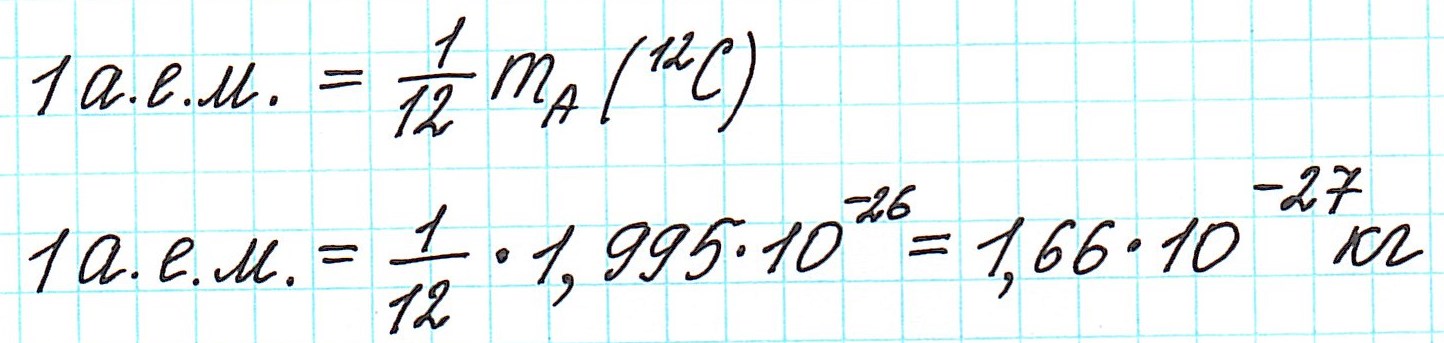
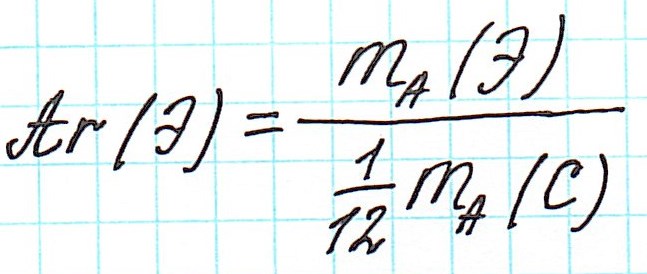
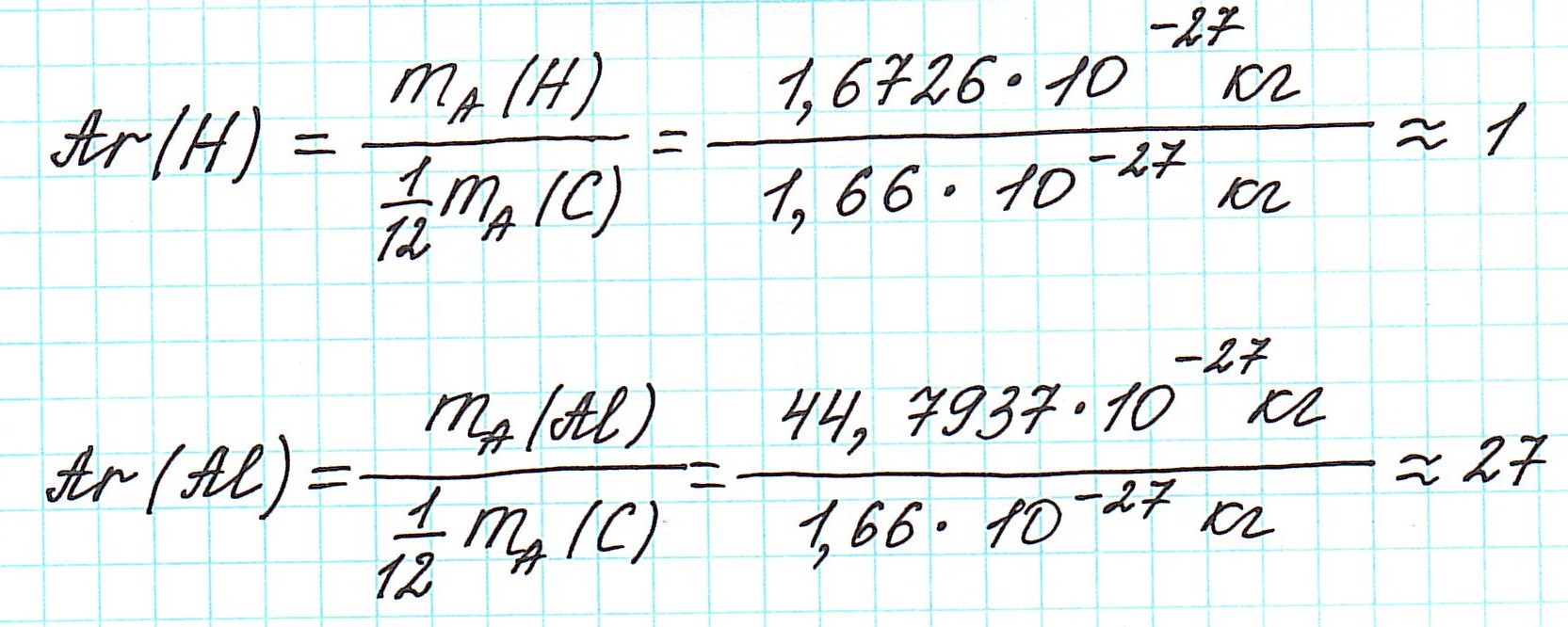
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.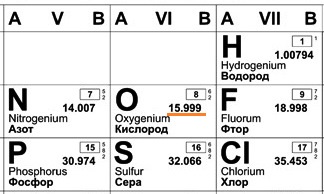
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16О, на 0,04% из изотопа 17О и на 0,20% из изотопа 18О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Здесь не все так просто. Понятие «относительная молекулярная масса» не всегда применяется корректно. Правильнее было бы говорить о «формульной массе».
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: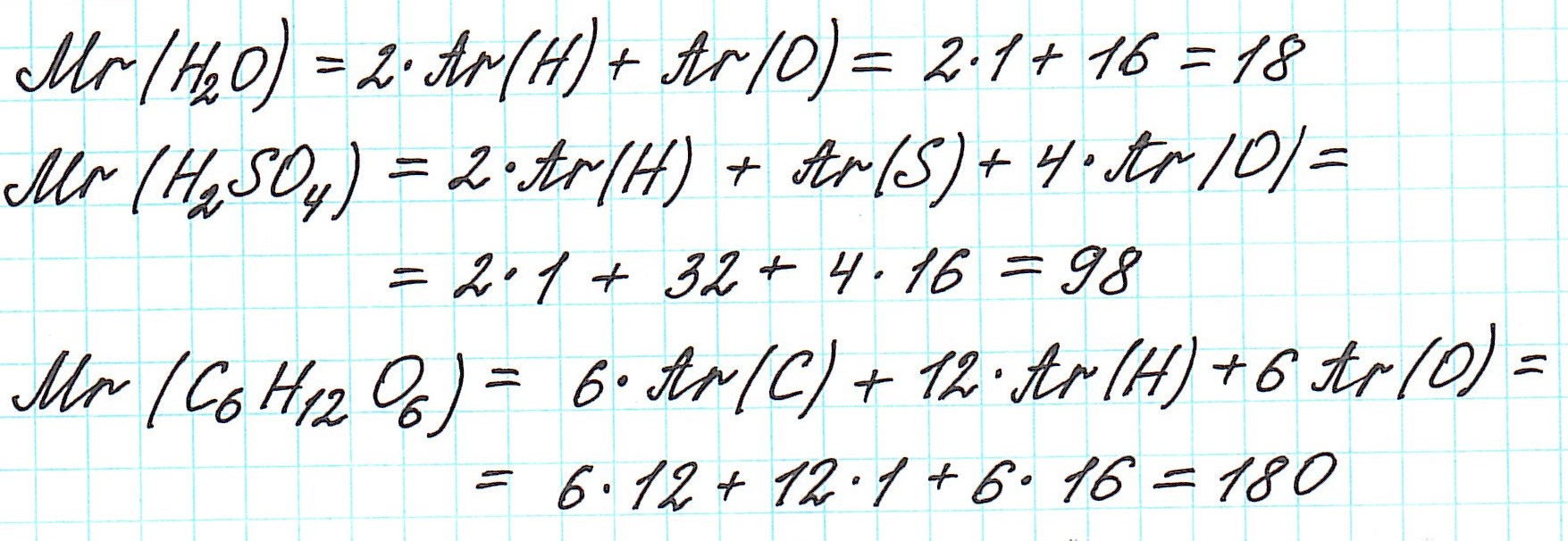
Например, формула NaCl показывает, что в кристалле хлорида натрия на один ион натрия Na+ приходится один ион хлора Cl—. На самом деле формула хлорида натрия должна выглядеть так: Na∞Cl∞. Поэтому запомним, что к ионным соединениям термины «молекула» и «молекулярная масса» не применимы.
В связи с этим для подобных веществ вычисляется формульная масса. А вычисляется она все по тому же принципу, что и молекулярная масса. Обозначается так же — Mr. Например, для хлорида натрия:
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Введена новая и тоже относительная величина – моль.
Точно было посчитано, что определенное количество атомов изотопа углерода 12С, а именно 6,02·1023, имеют массу ровно 12 г. Обратите внимание, что относительная молекулярная масса для этого же изотопа равна 12, но не грамм!
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·1023 его частиц (постоянная Авогадро).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.
Таким образом, молярная масса и количество вещества связаны соотношением:
Можно также определить и такие отношения, связанные с количеством вещества:
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:
Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия:
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.
Рассмотрим еще примеры:
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Определить молекулярную (а значит и молярную) массу газообразного вещества можно, используя закон Авогадро. Он гласит, что в равных объемах газов, взятых при одинаковой температуре, а также одинаковом давлении, содержится равное число молекул.
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс:


Запомните, что средняя молярная масса воздуха равна 29 г/моль.
Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
Итак, подведем итог:
- Относительная молекулярная масса (Mr) показывает отношение массы молекулы к 1/12 части массы атома изотопа углерода 12С.
- Молярная масса (М) – масса одного моля вещества, равная отношению массы вещества к его количеству и выраженная в г/моль.
- Относительная молекулярная и молярная массы численно равны.
- Вычислить молярную массу вещества (и относительную молекулярную также) можно, используя значения относительных атомных масс, записанных в периодической системе.
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Автор: Верзакова Ксения Михайловна
Организация: МКОУ «Саргаинская СОШ»
Населенный пункт: Красноуфимск, п. Саргая
Вычисление массовой доли вещества в растворе.
- Внимательно читаем условия задачи.
После пропускания через раствор гидроксида натрия 6,72 л оксида углерода (IV) (н.у.) получили 159 г раствора карбоната натрия. Вычислите массовую долю соли в полученном растворе.
Молярный объём 1 моля любого газа при н.у. = 22,4 л/моль
- Записываем дано.
Дано:
V (CO2) = 6,72 л
mр-ра (Na2CO3) = 159 г
w( Na2CO3) — ?
- Составляем молекулярное уравнение.
NaOH + CO2 = Na2CO3 + H2O
- Расставляем коэффициенты в уравнении.
2 NaOH + CO2 = Na2CO3 + H2O
- Подчёркиваем вещества, о которых идёт речь.
2 NaOH + CO2 = Na2CO3 + H2O
- Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.
Vm (CO2) = 22,4 л/моль
M (Na2CO3) = 23*2 + 12*1 + 16*3 = 106 г/моль
Молярная масса численно равна относительной молекулярной массе, поэтому её можно найти путём складывания относительных атомных масс элементов с учёт индексов
Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
- Подписываем молярные массы или молярные
объёмы под формулами веществ
2 NaOH + CO2 = Na2CO3 + H2O
Vm=22,4 л/моль M=106 г/моль
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти. Если по условию задачи нужно найти массовую долю, то над веществом пишем массу и находим её.
V=6,72 л m-?
2 NaOH + CO2 = Na2CO3 + H2O
Vm=22,4 л/моль M=106 г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Выводим формулу
- Подставляем данные и находим массу
m (Na2CO3) = 31,8 г.
- Находим массовую долю вещества по формуле w=m в-ваm р-ра*100
Записываем ответ: w (Na2CO3) = 20%
Вычисление массы раствора.
- Внимательно читаем условия задачи.
Массовую долю из процентов переводим в целое число, разделив на 100.
К раствору с массовой долей гидроксида калия 3% добавили избыток раствора сульфата меди(II). При этом образовался осадок массой 5,3 г. Определите массу исходного раствора щёлочи.
- Записываем дано.
Дано:
w (KOH) = 3%=0,03
m (Cu(OH)2 = 5,3 г.
m(KOH) — ?
- Составляем молекулярное уравнение.
KOH + CuSO4 = K2SO4 + Cu(OH)2↓
- Расставляем коэффициенты в уравнении.
2 KOH + CuSO4 = K2SO4 + Cu(OH)2↓
- Подчёркиваем вещества, о которых идёт речь.
2 KOH + CuSO4 = K2SO4 + Cu(OH)2↓
-
Молярную массу или молярный объём находим с учётом коэффициента перед формулой
Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём. Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
M (КOH) = 39*1+ 16*1+ 1*1= 56 г/моль*2= 112 г/моль
M (Cu(OH)2) = 64*1+ 16*1*2+ 1*1*2= 98 г/моль
- Подписываем молярные массы или
молярные объёмы под формулами веществ
2 КOH + CuSO4 = К2SO4 + Cu(OH)2↓
M=112 г/моль M=98 г/моль
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти. Если по условию задачи нужно найти массу раствора, то над веществом пишем массу и находим её.
m- ? m=5,3 г.
2 КOH + CuSO4 = К2SO4 + Cu(OH)2↓
M=112 г/моль M=98 г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Выводим формулу
- Подставляем данные и находим массу
m (KOH) = 6 г.
- Находим массу раствора по формуле
Записываем ответ: m(KOH) = 200 г.
Вычисление массы вещества или объёма.
- Внимательно читаем условия задачи.
Вычислите массу осадка, который образуется при действии раствора нитрата серебра на 117 г 30 %-ного раствора хлорида меди (II).
- Записываем дано.
Дано:
mр-рa(CuCl2) = 117 г
w( CuCl2)=30% = 0,3
m(AgCl)-?
- Составляем молекулярное уравнение.
AgNO3 + CuCl2 = Cu(NO3)2 + AgCl↓
- Расставляем коэффициенты в уравнении.
2AgNO3 + CuCl2 = Cu(NO3)2 + 2AgCl↓
- Подчёркиваем вещества, о которых идёт речь.
2AgNO3 + CuCl2 = Cu(NO3)2 + 2AgCl↓
-
Относительную атомную массу хлора принято считать равной 35,5, у остальных элементов она округляется до целого числа.
Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.
M (CuCl2) = 64*1+ 35,5*2= 135 г/моль*1= 135 г/моль
M (AgCl) = 108*1+ 35,5*1= 143,5 г/моль*2= 287 г/моль
- Подписываем молярные массы или
молярные объёмы под формулами веществ
2AgNO3 + CuCl2 = Cu(NO3)2 + 2AgCl↓
M=135г/моль М=287г/моль
- Если по условию задачи дан раствор и массовая доля, то находим массу вещества
mв-ва = ω * mр-ра
m(CuCl2) = 0,3*117 = 35,1 г.
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти.
- =35,1 г. m-?
2AgNO3 + CuCl2 = Cu(NO3)2 + 2AgCl↓
M=135г/моль М=287г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Выводим формулу
- Подставляем данные и находим ответ
- Записываем ответ
m (AgCl)=75 г.
Приложения:
- file0.docx.. 44,9 КБ
Опубликовано: 07.11.2022
- Относительная атомная и молекулярная масса
- Количество вещества. Постоянная Авогадро
- Молярная масса
- Молярный объем
- Задачи
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Атомная единица массы – внесистемная единица, равная 1/12 массы свободного покоящегося атома углерода (^{12}mathrm{C}), находящегося в основном состоянии. $$ 1 text{а. е. м}approx 1,66cdot 10^{-27} text{кг} $$
Относительная атомная масса – это физическая величина, показывающая, во сколько раз масса данного атома больше атомной единицы массы: $$ A_rapprox frac{m_{at}}{1,66cdot 10^{-27}} $$
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.
Например:
(A_r(mathrm{H})=1,00797 text{а. е. м}) – относительная атомная масса водорода
(A_r(mathrm{C})=12,01115 text{а. е. м}) – относительная атомная масса углерода
(A_r(mathrm{N})=14,0067 text{а. е. м}) – относительная атомная масса азота
(A_r(mathrm{O})=15,9994 text{а. е. м}) – относительная атомная масса кислорода
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
Например: $$ A_r(mathrm{H})=1, A_r(mathrm{C})=12, A_r(mathrm{N})=14, A_r(mathrm{O})=16 $$
Относительная молекулярная масса вещества – это физическая величина, показывающая, во сколько раз масса одной молекулы данного вещества больше атомной единицы массы: $$ M_rapprox frac{m_{mol}}{1,66cdot 10^{-27}} $$ Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, из которых состоит данное вещество: $$ M_r=sum A_r $$
Например:
Найдем относительную молекулярную массу молекулы воды (mathrm{H_2O}), которая состоит из двух атомов водорода и одного атома кислорода $$ M_r(mathrm{H_2O})=2A_r(mathrm{H})+A_r(mathrm{O})=2cdot 1+16=18 $$
Масса молекулы вещества равна произведению относительной молекулярной массы данного вещества на величину 1 а.е.м., выраженную в килограммах: $$ m_{mol}approx 1,66cdot 10^{-27}cdot M_r (text{кг}) $$
Например:
Масса молекулы водорода $$ m(mathrm{H_2O})=approx 1,66cdot 10^{-27}cdot 18approx 2,99cdot 10^{-26} (text{кг}) $$
п.2. Количество вещества. Постоянная Авогадро
Моль – количество вещества системы, содержащей столько же структурных элементов (атомов, молекул, ионов), сколько содержится атомов в углероде-12 массой 0,012 кг.
В 1 моле любого вещества содержится одинаковое количество частиц $$ N_Aapprox 6,022cdot 10^{23} $$ Число (N_A) называют постоянной Авогадро.
Количество вещества – физическая величина, равная отношению числа однотипных структурных элементов (атомов, молекул, ионов), содержащихся в веществе, к числу Авогадро: $$ nu=frac{N}{N_A} $$ Единицей измерения количества вещества в СИ является моль.
Например:
В 5 молях углерода будет содержаться (N=5cdot N_Aapprox 6,022cdot 10^{23}approx 3,01cdot 10^{24}) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет (N=5cdot N_Aapprox 3,01cdot 10^{24}) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Молярная масса – это масса 1 моля вещества.
Из определения 1 моля вещества и относительной молекулярной массы следует, что молярная масса равна $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Молярная масса воды $$ mu(mathrm{H_2O})=M_r(mathrm{H_2O})cdot 10^{-3}=18cdot 10^{-3}frac{text{кг}}{text{моль}} $$
Алгоритм определения молярной массы вещества с помощью таблицы Менделеева
Шаг 1. По таблице Менделеева найти относительные атомные массы (A_{ri}) для всех элементов, входящих в молекулу вещества.
Шаг 2. Найти относительную молекулярную массу как сумму всех относительных атомных масс $$ M_r=sum_i A_{ri} $$ Шаг 3. Записать молярную массу в виде $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Найдем молярную массу этилового спирта begin{gather*} A_r(mathrm{C})=12, A_r(mathrm{H})=1, A_r(mathrm{O})=16\ M_r(mathrm{C_2H_5OH})= 2A_r(mathrm{C})+6A_r(mathrm{H}) +A_r(mathrm{O})=2cdot 12+6cdot 1+16=46\ mu(mathrm{C_2H_5OH})=46cdot 10^{-3}frac{text{кг}}{text{моль}} end{gather*}
п.4. Молярный объем
Молярный объем – это объем 1 моля вещества.
Молярный объем равен отношению молярной массы к плотности вещества: $$ V_{mu}=frac{mu}{rho} $$
Например:
Молярный объем воды begin{gather*} V_{mu}(mathrm{H_2O})=frac{18cdot 10^{-3} text{кг/моль}}{10^3 text{кг/м}^3}=18cdot 10^{-6}frac{text{м}^3}{text{моль}}=18frac{text{cм}^3}{text{моль}}=18frac{text{мл}}{text{моль}} end{gather*} Т.е. 1 моль воды занимает объем 18 мл (столовая ложка).
При нормальных условиях (t=0°C, ρ=1 атм) молярные объемы всех идеальных газов одинаковы и равны: $$ V_{mu text{газ}}=22,4frac{text{л}}{text{моль}} $$
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы (mathrm{S_8}) содержится в этом кристалле? (Ответ округлите до двух значащих цифр).
Дано:
(m=16 text{г}=16cdot 10^{-3} text{кг})
(A_r=32)
(N_A=6,022cdot 10^{23})
__________________
(N-?)
Относительная молекулярная масса одной молекулы $$ M_r=8cdot A_r=8cdot 32=256 $$ Молярная масса $$ mu=256cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в кристалле серы: $$ nu=frac{N}{N_A}=frac{m}{mu} $$ Количество молекул в кристалле серы: $$ N=frac{m}{mu}N_A $$ $$ N=frac{1,6cdot 10^{-3}}{256cdot 10^{-3}}cdot 6,022cdot 10^{23}approx 3,8cdot 10^{22} $$ Ответ: (3,8cdot 10^{22})
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода (mathrm{O_2}). Одному космонавту по норме требуется 600 литров кислорода в сутки. Считая условия для газа приблизительно нормальными, определите, на сколько часов космонавту хватит полученного кислорода.
Дано:
(m=1,6 text{кг})
(V_t=600frac{text{л}}{text{сут}}=25frac{text{л}}{text{ч}})
(A_r=16)
(V_{mu}=22,4frac{text{л}}{text{моль}})
__________________
(t-?)
Относительная молекулярная масса молекулы кислорода $$ M_r=2cdot A_r=32 $$ Молярная масса кислорода $$ mu=32cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в полученном кислороде $$ nu=frac{m}{nu}=frac{V}{V_{mu}} $$ Объем полученного кислорода $$ V=frac{m}{mu}=V_{mu} $$ Количество часов для дыхания одного человека begin{gather*} t=frac{V}{V_t}=frac{m}{mu}frac{V_{mu}}{V_t}\[6pt] t=frac{1,6 text{кг}}{32cdot 10^{-3} text{кг/моль}}cdot frac{22,4 text{л/моль}}{25 text{л/ч}}=44,8 text{ч} end{gather*} Ответ: 44,8 ч.
|
Алгоритм расчёта Мr (относительной 1. 2. 3. Пример: Мr (H2SO4) |
Алгоритм расчёта Мr (относительной молекулярной массы) 1. 2. 3. Пример: Мr (H2SO4) |
|
Алгоритм расчёта Мr (относительной 1. 2. 3. Пример: Мr (H2SO4) |
Алгоритм расчёта Мr (относительной 1. 2. 3. Полученные значения сложить. Пример: Мr (H2SO4) |
|
Алгоритм расчёта Мr (относительной 1. 2. 3. Пример: Мr (H2SO4) |
Алгоритм расчёта Мr (относительной 1. 2. 3. Полученные значения сложить. Пример: Мr (H2SO4) |
|
Алгоритм расчёта ω%(э) (массовой доли элемента) 1. 2. 3. Аr(э) ∙ n ω%(э)= ________________ ∙ 100% 16 ∙ 4 Пример: ω%(H2SO4)= _________ ∙ 100% |
Алгоритм расчёта ω%(э) (массовой доли элемента) 1. 2. 3. Аr(э) ∙ n ω%(э)= 16 ∙ 4 Пример: ω%(H2SO4)= |
|
Алгоритм расчёта ω%(э) (массовой доли элемента) 1. 2. 3. Аr(э) ∙ n ω%(э)= 16 ∙ 4 Пример: ω%(H2SO4)= |
Алгоритм расчёта ω%(э) (массовой доли элемента) 1. 2. 3. Аr(э) ∙ n ω%(э)= 16 ∙ 4 Пример: ω%(H2SO4)= |
|
Алгоритм расчёта ω%(э) (массовой доли элемента) 1. 2. 3. Аr(э) ∙ n ω%(э)= 16 ∙ 4 Пример: ω%(H2SO4)= |
Алгоритм расчёта ω%(э) (массовой доли элемента) 1. 2. 3. Аr(э) ∙ n ω%(э)= 16 ∙ 4 Пример: ω%(H2SO4)= |
|
Алгоритм составления формулы по валентности 1. 2. 3. 4. Пример: III II |
Алгоритм составления формулы по валентности 1. 2. 3. 4. Пример: III II |
|
Алгоритм составления формулы по валентности 1. 2. 3. 4. |
Алгоритм составления формулы по валентности 1. 2. 3. 4. |
|
Алгоритм составления формулы по валентности 1. 2. 3. 4. Al2 O3 |
Алгоритм составления формулы по валентности 1. 2. 3. 4. |
|
Алгоритм определения валентности по химической формуле 1. 2. 3. 4. Пример: IV : II |
Алгоритм определения валентности по химической формуле 1. 2. 3. 4. Пример: IV : II |
|
Алгоритм определения валентности по химической формуле 1. 2. 3. 4. Пример: IV : II |
Алгоритм определения валентности по химической формуле 1. 2. 3. 4. Пример: IV : II |
|
Алгоритм определения валентности по химической формуле 1. 2. 3. 4. Пример: IV : II |
Алгоритм определения валентности по химической формуле 1. 2. 3. 4. Пример: IV : II |
|
Алгоритм расстановки
|
Алгоритм расстановки
|
|
Алгоритм расстановки
|
Алгоритм расстановки
|
|
Алгоритм расстановки
|
Алгоритм расстановки
|
Вариант 1
1.
Какое количество вещества
соответствует 306 г оксида алюминия Al2O3 ?
2.
Рассчитайте массу 4 моль
азотной кислоты HNO3.
3.
Сколько молекул содержится
в 8 граммах молекулярного кислорода О2?
4.
В какой массе воды
содержится такое же количество молекул, сколько атомов в 36 граммах магния?
Вариант 2
1.
Какое количество вещества
соответствует 1 кг карбоната кальция СаСО3?
2.
Рассчитайте массу 3 моль
оксида кремния SiO2.
3.
Сколько атомов кальция
содержится в 80 граммах кальция?
4.
Рассчитайте массу: а) 12∙1023
атомов серы; б) 3 ∙ 1023 молекул фтора F2.
Вариант 1
1.
Какое количество вещества
соответствует 306 г оксида алюминия Al2O3 ?
2.
Рассчитайте массу 4 моль
азотной кислоты HNO3.
3.
Сколько молекул содержится
в 8 граммах молекулярного кислорода О2?
4.
В какой массе воды
содержится такое же количество молекул, сколько атомов в 36 граммах магния?
Вариант 2
1.
Какое количество вещества
соответствует 1 кг карбоната кальция СаСО3?
2.
Рассчитайте массу 3 моль
оксида кремния SiO2.
3.
Сколько атомов кальция
содержится в 80 граммах кальция?
4.
Рассчитайте массу: а) 12∙1023
атомов серы; б) 3 ∙ 1023 молекул фтора F2.
Вариант 1
1.
Какое количество вещества
соответствует 306 г оксида алюминия Al2O3 ?
2.
Рассчитайте массу 4 моль
азотной кислоты HNO3.
3.
Сколько молекул содержится
в 8 граммах молекулярного кислорода О2?
4.
В какой массе воды
содержится такое же количество молекул, сколько атомов в 36 граммах магния?
Вариант 2
1.
Какое количество вещества
соответствует 1 кг карбоната кальция СаСО3?
2.
Рассчитайте массу 3 моль
оксида кремния SiO2.
3.
Сколько атомов кальция
содержится в 80 граммах кальция?
4.
Рассчитайте массу: а) 12∙1023
атомов серы; б) 3 ∙ 1023 молекул фтора F2.