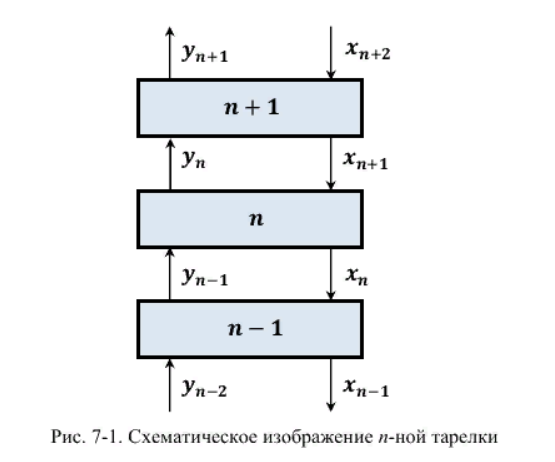
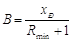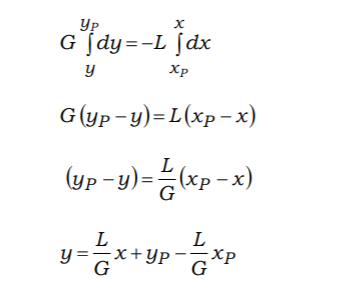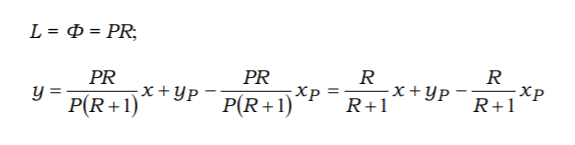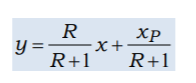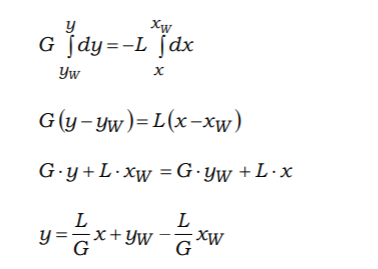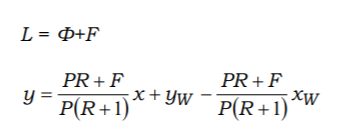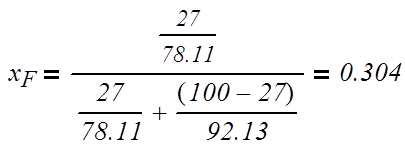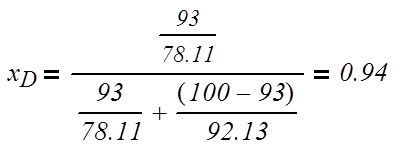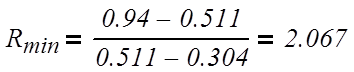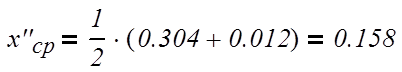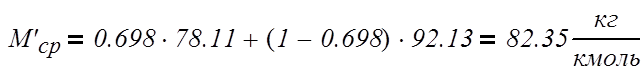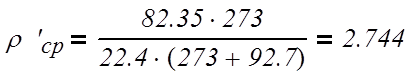P
=
=
5,8112*10-6
кг/кмоль
6. Определим мольный расход по паровой фазе:
=
P(R+1)
= 2,3245*10-5
кг/кмоль
Определим
площадь поверхности массопередачи А:
А
= a
* H
* S
= 0,6511 м2,
где
а = 750 м2/м3,
Н – высота насадки (H
= 0,18 м), S
=
,
=
0,08
м
Рассчитаем
коэффициент массопередачи:
Ky
=
= 2,7028*10-6
кмоль/м2*с
7. Определим число теоретических ступеней графическим построением между рабочей линией и равновесной в интервале xp-xf (см. Пункт 2):
NT
= 14 cтупеней
Рассчитаем
высоту теоретической ступени hT:
hT
=
= 0,0129 м
VI. Выводы
В
ходе лабораторной работы мы ознакомились
с устройством и работой ректификационной
установки; разделили жидкую бинарную
смесь этанол-вода с помощью периодической
ректификации; определили состава
дистиллята, число ступеней изменения
концентраций (число теоретических
тарелок NT
= 14) и высоты (hT
= 0,0129 м), эквивалентной теоретической
тарелке, число единиц переноса (NOy
= 13,209) и высоты единицы переноса (hOy
= 0,0136 м)
и коэффициент массопередачи
(Ky
=
2,7028*10-6
кмоль/м2*с).
Список используемой литературы
1.
Лабораторные работы по процессам и
аппаратам химической технологии // под.
ред. проф. В. М. Лекае. – М.: МХТИ им. Д. И.
Менделеева, 1980. – 47 с
2.
Касаткин А. Г. Основные процессы и
аппараты химической технологии. – М.:
Химия, 1973. – 752 с.
V. Ответы на контрольные вопросы
-
Физическая
сущность процесса ректификации
заключается в двустороннем массо- и
теплообмене между неравновесными
потоками пара и жидкости при высокой
турбулизации поверхности контактирующих
фаз. В результате массообмена пар
обогащается низкокипящими, а жидкость
– высококипящими компонентами. При
определенном числе контактов можно
получить пары, состоящие в основном из
низкокипящих, а жидкость – из высоко
кипящих компонентов.
-
Флегмовое
число — параметр работы ректификационной
колонны, определяющий эффективность
процесса разделения в концентрационной
секции колонны; Флегмовое число
представляет собой отношение количества
жидкости, стекающей с любой тарелки в
концентрационной секции колонны (от
места ввода сырья до отбора верхнего
продукта — дистиллята), к количеству
отбираемого дистиллята.
Определяем
минимальное флегмовое число:
Rmin
=
yF
— концентрация легколетучего компонента
в паре, находящегося в равновесии с
исходной смесью xF
Рабочее
флегмовое число определяется как
R=β*Rmin
где
β – коэффициент избытка флегмы (β =
1,02÷3,5)
Определяется
рабочее флегмовое число R, отрезок B,
число теоретических тарелок в колонне
nT,
путем вписывания «ступенек» между
равновесной и рабочими линиями. Рабочие
линии строятся для каждого отрезка
.
-
Число
единиц переноса – изменение рабочей
концентрации, приходящееся на единицу
движущей силы.Теоретическая тарелка
(теоретическая ступень разделения) —
теоретическая модель массообменных
процессов в двухфазных средах, основанная
на представлении массообменного
устройства (тарелки) как теоретически
идеальной, изолированной системы в
состоянии термодинамического равновесия.
Характеризует максимальную, теоретически
возможную разницу концентраций
компонентов в фазах при заданных
условиях.Высота единиц переноса
(ВЕП) соответствует высоте участка
аппарата, эквивалентного одной единице
переноса. ВЕП обратно пропорциональны
коэффициентам массоотдачи и массопередачи.
Чем больше эти коэффициенты, тем меньше
ВЕП и тем меньшую высоту Н будет иметь
аппарат, обеспечивающий требуемое
разделение веществ.Высота
эквивалентная теоретической ступени
разделения (ВЭТС) h, м – высота, равная
высоте участка колонны, на которой при
бинарной ректификации достигается
полное термодинамическое равновесие
между паром и жидкостью в выходящих с
этого участка потоках. Так как в итоге
ВЭТС определяет высоту колонны, то ее
значение при заданных условиях разделения
должно быть по возможности меньшим. -
Эффективность
ступени (тарелки) по Мерфри (КПД Мерфри)
выражают отношением изменения
концентрации данной фазы на ступени к
движущей силе на входе той же фазы в
ступень.КПД
Мерфри зависит от скорости массопереноса
(т.е. от коэффициентов массоотдачи и
числа единиц переноса), взаимного
направления движения фаз, структуры
потоков, площади поверхности контакта
фаз и других факторов.С помощью КПД
Мерфри можно графическим построением
определить число реальных тарелок.
Данный метод расчёта высоты масособменных
аппаратов со ступенчатым контактом
фаз называют методом кинетической
линии.Если
известны функции равновесной линии y* =
f(x)
и рабочей линии y =
f(x),
а также известен КПД Мерфри (как
функция Ey =
f(x)
или как константа), то кинетическая
линия может быть найдена как функция yк =
f(x) -
Допущения
принятые при ректификации1)
Разделяемая смесь следует правилу
Трутона: отношение мольной теплоты
испарения или конденсации ri
к абсолютной температуре кипения для
всех жидкостей Ti
является приближенно величиной
постоянной.2) Состав пара, выходящего
из ректификационной колонны в дефлегматор,
равен составу дистиллята, т.е. укрепляющим
действием дефлегматора можно пренебречь3)
Состав пара, выходящего из кипятильника
и поступающего в колонну, равен составу
кубовой жидкости, т.е. исчерпывающим
действием кипятильника можно пренебречь4)
Теплоты смешения компонентов разделяемой
смеси равны нулю
-
Верхняя
(укрепляющая) часть колонныЗапишем
уравнение материального баланса для
малого объема с поверхностью dА
в верхней части колонныПроинтегрируем
это уравнение с учетом того, что
концентрация в паровой фазе меняется
от y до yP, концентрация в жидкой фазе
меняется от xp
до x:Последние
уравнение связывает рабочие концентрации
в паровой y и жидкой x фазах. Для удобства
использования этого уравнения представим
его в другом виде.Уравнение
рабочей линии верхней (укрепляющей)
части ректификационной колонныНижняя
(исчерпывающая) часть колонныЗапишем
уравнение материального баланса для
малого объема с поверхностью dA в нижней
части колонны
Проинтегрируем
это уравнение с учетом того, что
концентрация в паровой фазе меняется
от yw
до y, концентрация в жидкой фазе меняется
от x до xw:
Подставим
выражения для L (расход жидкой фазы) и G
(расход паровой фазы)
В
результате преобразований получим
уравнение рабочей линии нижней
(исчерпывающей) части ректификационной
колонны
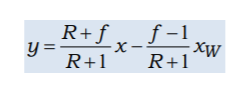
7.
Пределы изменения флегмового числа и
его влияние на положение рабочей линии
Флегмовое число представляет собой
количество кмоль флегмы, возвращаемой
в колонну в расчете на один кмоль
отводимого дистиллята, может принимать
любые значения в интервале от F min (в
режиме минимального орошения) до
бесконечности (в режиме полного орошения)
при заданном качестве дистиллята, а
также других параметрах, определяющих
процесс разделения в колонне (давление,
доля пара в сырье, поступающем в зону
питания колонны). Положение рабочей
линии укрепляющей части колонны
определяется флегмовым числом и составом
дистиллята. С ростом флегмового числа
рабочая линия располагается ближе к
диагонали, в результате уменьшается
число теоретических тарелок, необходимое
для достижения заданной степени
разделения в укрепляющей части колонны.
8.
Сравните установки периодической
ректификации и простой перегонки. В чём
их принципиальное различие?
В
стандартной ситуации процесс перегонки
отличается от ректификации наличием
многоступенчатой ректификационной
колонны с «ловушками», что позволяет
более точно разделить компоненты
дистиллируемой смеси. В процессе
перегонки задействована одна сплошная
линия, по которой пары продукта с
неконтролируемым составом поднимаются
и дистиллируются на холодильнике, для
многофазового разделения эта установка
не подходит, в отличие от ректификационной
колонны, которая позволяет не только
насыщать смесь низкокипящим компонентом
(за счёт стекания дистиллята обратным
током), но и разделить фазы более грамотно,
за счет выходов, расположенных в
нескольких местах колонны.
9.
Какие два основных режима проведения
периодической ректификации известны?
Какой метод используется для проведения
лабораторной работы?
Известны два способа проведения ректификации:
непрерывный, применяемый в промышленности,
и периодический, которым пользуются
обычно в лабораториях. При
непрерывной ректификации подогретая
до кипения смесь подается в среднюю
часть колонны. Определенные
преимущества периодической ректификации
проявляются при разделении смесей: а)
с малыми расходами — в этом случае
проведение процесса имеет смысл лишь
после их накопления; б) многокомпонентных
— периодически действующая установка
позволяет осуществлять процесс в одной
колонне, в то время как для его проведения
в непрерывной требует количества колонн
на единицу меньше числа компонентов;
в) с изменяющимся качественным и
количественным составом. Также
периодическую ректификацию проводят
при постоянном флегмовом числе, из чего
можно сделать вывод, что процесс в
лабораторной работе – периодический.
10.
Как изменяется состав дистиллята, если
ректификацию проводить при постоянном
флегмовом числе?
При
периодической ректификации при постоянном флегмовом числе R
= onst) состав получаемого дистиллята изменяется во времени.
Этот способ более широко применяется
в производственных условиях. При этом,
как правило, проводят так называемую
фракционную перегонку, когда
получаемый дистиллят собирают по
фракциям определенного состава в
отдельные сборники. Состав дистиллята
при этом возрастает и контролируется,
так как применяется фракционирование.
11.
Каково предельное значение концентрации
этанола в дистилляте при
проведении
данной лабораторной работы? Каковы
теоретические условия
его
достижения?
y
= 0,8387
Достичь ее возможно либо с помощью
подачи вакуума, что значительно уменьшит
температуру кипения этанола, либо с
помощью контроля температуры в пределах
75-80 градусов при атмосферном давлении.
12.
В каких единицах рассчитывается
коэффициент массопередачи в данной
работе? Чем обусловлен выбор этих единиц?
Коэффициент
массопередачи в данной работе
рассчитывается в кмоль/м2*с.
Он
обусловлен размерностью движущей силы,
в данном же случае она равна единице,
соответственно размерность берётся
без домножения на единицу движущей силы
в знаменателе.
16
Расчет колонны. Расчет массовых расходов дистиллята и кубового остатка
Страницы работы
Содержание работы
3.
Расчет колонны
3.1
Материальный баланс
Найдем массовые расходы дистиллята и кубового
остатка, решив систему уравнений:
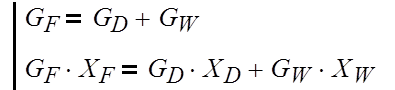
(3.1.1)
где GF,
GD, GW – соответственно массовый расход питания ,
дистиллята, кубового остатка, кг/с;
ХF, XD, XW – концентрация бензола в
массовых долях расходов питания, дистиллята и кубового остатка соответственно.
Отсюда получаем:
GD = 1,13
кг/с; GW = 2,87
кг/с;
Выразим концентрации питания, дистиллята и
кубового остатка в мольных долях:
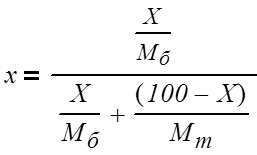
(3.1.2)
где x – концентрация в мольных долях;
X – концентрация в массовых долях;
Мб – мольная масса бензола, кг/моль;
Мт – мольная масса толуола, кг/моль;
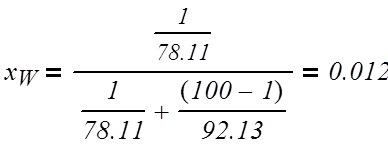 |
Найдем относительный мольный расход питания:
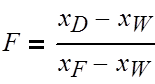
где F –
относительный мольный расход питания;
хF, хD, хW – концентрация бензола в
мольных долях расходов питания, дистиллята и кубового остатка соответственно;
На графике 1 определим по мольным концентрациям
жидкости равновесные концентрации пара бензола:
y*F
= 0,511.
Вычислим минимальное число флегмы по следующей
формуле:
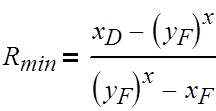
(3.1.4)
где Rmin
– минимальное число флегмы;
хF, хD – концентрация в смеси бензола в мольных
долях расходов питания, дистиллята соответственно;
yF*,
–равновесная концентрация в паре бензола в мольных долях;
Рабочее флегмовое число найдем по следующей формуле:
,
(3.1.5)
где R –
число флегмы;
b — коэффициент избытка флегмы;
Задаваясь коэффициентом избытка флегмы, найдем
рабочее число флегмы, с помощью которого построим рабочие линии для укрепляющей
и исчерпывающей части колонны по следующим формулам:
Верхняя часть:
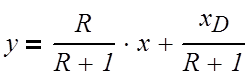
(3.1.6)
Нижняя часть:
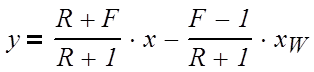
(3.1.7)
Графически определяем число теоретических ступеней (N) – график 1.
Чтобы определить оптимальное флегмовое число на
графике 2 построим зависимость N(R+1) = f(R),
где точка минимума этой кривой укажет на Rопт.
Результаты вычислений при нахождении флегмового
числа представим в таблице 1:
Таблица 1
|
b |
1,161 |
1,308 |
1,356 |
1,528 |
1,629 |
2,396 |
3,027 |
|
R |
2,4 |
2,73 |
2,83 |
3,188 |
3,4 |
5 |
6,318 |
|
N |
25 |
18 |
17 |
15 |
15 |
12 |
11 |
|
N(R+1) |
85 |
67,14 |
65,11 |
62,82 |
66 |
72 |
80,498 |
Rопт
= 3,188 при
N = 15
Уравнения рабочей линии:
укрепляющая часть:
исчерпывающая часть:
3.2 Определение скорости
пара и диаметра колонны
Найдем средние концентрации жидкости:
верхняя часть:
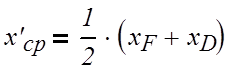
(3.2.1)
где х`ср, хF, хD – соответственно средняя концентрация верхней части колонны и
концентрация бензола в мольных долях питания и дистиллята;
 |
нижняя часть:
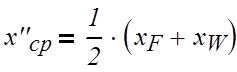
(3.2.2)
где х«ср, хF, хW – соответственно средняя концентрация нижней части колонны и
концентрация бензола в мольных долях питания и кубового остатка;
Средние концентрации пара вычислим по уравнению
рабочей линии:
верхняя часть:
нижняя часть:
Определим средние температуры пара по диаграмме
(график 3):
укрепляющая часть:
приy`ср =
0,698 t`ср = 92,7°C
исчерпывающая часть:
приy«ср = 0,246 t«ср
= 104,4 °C
Средние мольные массы и
плотности пара:
верхняя часть:
,
(3.2.3)
где М`ср – средняя мольная масса пара верхней части колонны, кг/моль;
y`ср – средняя концентрация пара верхней части колонны;
Мб – мольная масса бензола, кг/моль;
Мт – мольная масса толуола, кг/моль;
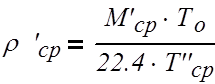
(3.2.4)
где r`ср – средняя плотность пара
в верхней части колонны, кг/м3;
Т0 —
температура при нормальных условиях, К;
Т`ср
— температура пара в верхней части колонны, К;
нижняя часть:
,
(3.2.5)
Похожие материалы
- Расчет ректификационной колонны
- Расчет теплообменного аппарата для нагрева 4 кг/с 27 % раствора бензола в толуоле от 18 до 97,9 градусов
- Расчёт и подбор теплообменной аппаратуры для подогревания 5.5 кг/с 28%-го раствора ацетона в воде от 20 до 69 градусов
Информация о работе
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание — внизу страницы.
Random converter
Конвертер молярного расхода
Подробнее о молярном расходе
Моль
Молярный, массовый и объемный расход
Измерение молярного расхода
Моль
Моль — единица измерения количества вещества, соответствующая массе вещества, содержащей 6,02214076 × 10²³ структурных единиц этого вещества. Структурными единицами могут быть атомы, молекулы, ионы, электроны или формульные единицы.
С понятием моля связано понятие молярной массы элемента или вещества. Молярная масса элемента — это его атомная масса, выраженная в граммах. На практике, она равна средней массе одного моля атомов этого элемента. Например, молярная кислорода O₂ как вещества равна 32 г/моль, в то время как молярная масса кислорода как элемента равна 16 г/моль. 10 молей кислорода как вещества эквивалентны 10 моль × 32 г/моль = 320 г.
Молярная масса химического вещества рассчитывается путем умножения молярных масс каждого элемента, входящего в состав этого вещества, на число атомов в формуле соединения с последующим сложением результатов. Например, молярная масса воды H₂O равна 2 × 1 + 16 = 18 г/моль.
Молярный, массовый и объемный расход
Завод смазочных материалов Petro-Canada в Миссиссоге, в канадской провинции Онтарио
В гидродинамике и химической технологии молярный расход — это количество вещества в молях (иными словами, количество молекул), проходящее через заданную площадь поперечного сечения потока перпендикулярно к нему в единицу времени. В СИ измеряется в молях в секунду. Также часто используются производные единицы киломоль в час и миллимоль в минуту. В связи с тем, что молярный расход — это скорость потока частиц, его можно сравнить с электрическим током, который представляет собой поток электрических частиц-носителей электрического заряда. Понятие молярного расхода близко связано с понятием массового расхода, который представляет собой массу вещества, проходящую в единицу времени.
Молярный расход определяется как производная по времени количества вещества в молях n
По аналогии с массовым расходом, который обозначается ṁ, молярный расход обозначается ṅ, причем точка над буквой обозначает первую производную в нотации Ньютона. При использовании молей вместо массы появляется возможность записывать расход материалов с точки зрения стехиометрии и химических реакций. В то же время следует отметить, что в отличие от массы, которая сохраняется при химических реакциях, общее количество молей не сохраняется. Например, рассмотрим реакцию горения этана в кислороде:
В этой реакции до ее начала и после окончания имеются 12 атомов водорода, 4 атома углерода и 14 атомов кислорода. Общая масса до и после реакции одинаковая, то есть масса сохраняется. В то же время, при горении этана на каждые 11 молей продуктов горения расходуется только 9 молей исходных веществ. Следовательно, общее количество молей, входящих в реакцию веществ меньше, чем количество молей, образующееся в результате реакции.
Измерение молярного расхода
Обычно проще всего измерить объемный расход потока V̇. Его можно преобразовать в массовый расход ṁ:
где ρ — плотность вещества. Поскольку измерить непосредственно моли невозможно, массовый расход можно преобразовать в молярный расход. Конструкции устройств для измерения расхода рассматриваются в статьях к конвертерам массового расхода и объемного расхода. Многие из этих устройств измеряют даже не объем или массу, а скорость v текучей среды известной плотности и состава, которая движется через ограниченное поперечное сечение измерительного устройства. Затем эта скорость используется для расчета объемного расхода V̇ в предположении, что распределение скорости однородно:
где A — площадь поперечного сечения v — скорость потока:
где l — длина цилиндра движущейся в трубе текучей среды и t — время.
Поскольку состав жидкой и (или) газовой среды, ее плотность и площадь поперечного сечения известны, молярный расход можно рассчитать путем умножения объемного расхода V̇ на плотность и деления на молекулярную массу. Конечно, если жидкость является раствором, нужно знать молекулярную массу раствора, которую можно рассчитать по известным молекулярным массам и мольных долях отдельных компонентов раствора. В случае газовых смесей, нужно знать температуру и давление газов.
Суточный выпуск продукции завода смазочных материалов Petro-Canada в Миссиссоге составляет 15 600 баррелей (2400 куб. метров)
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Гидравлика и гидромеханика — жидкости
Гидравлика — наука о законах движения и равновесии жидкостей и способах приложения этих законов к решению задач инженерной практики. Гидравлика характеризуется особым подходом к изучению явлений течения жидкостей; она устанавливает приближённые зависимости, ограничиваясь во многих случаях рассмотрением одноразмерного движения, широко используя при этом эксперимент, как в лабораторных, так и в натурных условиях. Гидромеханика — прикладная наука (раздел механики сплошных сред) изучающая равновесие и движение жидкости. Гидромеханика подразделяется на гидростатику, изучающую жидкость в равновесии, а также гидродинамику, изучающую движение жидкости.
Конвертер молярного расхода
Молярный расход жидкости или газа — масса вещества, проходящая через заданную площадь поперечного сечения потока в единицу времени.
В Международной системе единиц (СИ) выражается в молях в секунду (моль/с).
Использование конвертера «Конвертер молярного расхода»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
- Выберите единицу, с которой выполняется преобразование, из левого списка единиц измерения.
- Выберите единицу, в которую выполняется преобразование, из правого списка единиц измерения.
- Введите число (например, «15») в поле «Исходная величина».
- Результат сразу появится в поле «Результат» и в поле «Преобразованная величина».
- Можно также ввести число в правое поле «Преобразованная величина» и считать результат преобразования в полях «Исходная величина» и «Результат».
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube
Для инженерных расчетов установки необходимо знать свойства веществ при определённых температурах. Основными диаграммами для определения этих свойств являются диаграммы: состав пара — состав жидкости, и зависимость температуры кипения от состава. В приложение 1 приведены диаграммы указанных свойств бинарной системы ацетон- уксусная кислота.
Равновесные данные
-мольная доля легколетучего компонента в жидкой фазе;
-мольная доля легколетучего компонента в паровой фазе;
-температура, .
   
0 |
0 |
118,1 |
|
0,042 |
0,108 |
112,1 |
|
0,082 |
0,225 |
109,13 |
|
0,12 |
0,289 |
106,3 |
|
0,158 |
0,356 |
104,6 |
|
0,194 |
0,433 |
101,4 |
|
0,226 |
0,564 |
94,3 |
|
0,236 |
0,58 |
92,5 |
|
0,26 |
0,617 |
90,22 |
|
0,28 |
0,642 |
88,33 |
|
0,294 |
0,66 |
87 |
|
0,32 |
0,706 |
85,5 |
|
0,36 |
0,769 |
83,2 |
|
0,4 |
0,807 |
80,9 |
|
0,44 |
0,843 |
78,6 |
|
0,538 |
0,92 |
74,2 |
|
0,668 |
0,966 |
65,6 |
|
0,761 |
0,981 |
63,6 |
|
0,935 |
0,997 |
60,7 |
|
1 |
1 |
56,1 |
Материальный баланс
Зная массовый расход исходной смеси и мольные концентрации потоков, определим массовый расход дистиллята и массовый расход кубового остатка (и ), на основании уравнений материального баланса.

(2)
(3)
где — массовая доля легколетучего компонента в исходной смеси, дистилляте и кубовом остатке соответственно;
— массовый расход исходной смеси, дистиллята и кубового остатка соответственно.
Выразим из уравнения (3) массовый расход дистиллята и кубового остатка:
(4)
(5)
Найдем молекулярные массы смесей по уравнению:
(6)
где j — F,D или W.
Затем пересчитаем мольные доли легколетучего компонента в исходной смеси, дистилляте и кубовом остатке в массовые соответственно:
(7)
Далее по формулам (4) и (5) найдем массовый расход дистиллята и кубового остатка:
Пересчитаем массовые расходы питания, дистиллята и кубового остатка в мольные расходы соответственно по формуле:

Нагрузка ректификационной колонны по пару и жидкости определяется рабочим флегмовым числом. Для его расчета используют приближенные вычисления по формуле:
(9)
где — минимальное флегмовое число.
При этом:
(10)
где — мольные доли легколетучего компонента в жидкости, а — концентрация легколетучего компонента в паре, находящаяся в равновесии с жидкостью (питанием исходной смеси).
По диаграмме «Равновесное состояние жидкости и пара» (приложение 1) находим при соответствующем значении, таким образом 0,289.
Тогда:
Определение средних физических величин потоков пара и жидкости
Для определения основных размеров колонны (аппарата), расходов греющего пара и воды требуется найти средние мольные, массовые составы, мольные, массовые и объемные расходы по жидкости и пару, а также некоторые физические величины.
Для простой полной колонны, обогреваемой глухим паром (горячей водой) или острым паром, средние составы и расходы по жидкости и пару, а также физические величины определяют отдельно для верхней и нижней части колонны.
1) Для жидкой фазы в верхней и нижней частях колонны:
— мольные составы определяют как средние арифметические:
тогда мольные составы вычисляются по формуле:
(11)
— мольные массы определяют по формуле:
(12)
где = 58,08 — мольная масса ацетона;
= 60,00 — мольная масса уксусной кислоты.
— массовые составы компонентов А и В определяют по уравнению:
(13)
где — мольная масса смеси; индекс А или В указывает на компонент.
В этой и последующих формулах индекс i относится либо к верхней, либо к нижней частям колонны.
— средние температуры определяют по диаграмме при соответствующих значениях .
— плотности определяют по уравнению:
(14)
— плотности легколетучего и труднолетучего компонентов при соответствующих температурах, ;
динамические коэффициенты вязкости рассчитывают по уравнению:
(15)
где — динамические коэффициенты вязкости легколетучего и труднолетучего компонентов при соответствующих температурах, Па • с.
Для верхней части колонны:
,
Для нижней части колонны:
,
— прежде чем рассчитывать коэффициенты диффузии, определим коэффициенты диффузии бинарной смеси при и температурные коэффициенты , а для этого нам необходимо по формулам (14) и (15) рассчитать плотности и динамические коэффициенты вязкости веществ при :
—
(16)
где — динамический коэффициент вязкости жидкости при , мПа•с; — мольные массы исходных веществ, ;
— мольные объёмы растворённого вещества и растворителя, ;
А=1,15 и В=1,27 — коэффициенты, зависящие от свойств растворённого вещества и растворителя.
(17)
где — динамический коэффициент вязкости жидкости при , мПа•с; — плотность жидкости при , .
— теперь по приближенной формуле рассчитаем коэффициенты диффузии :
(18)
где — коэффициент диффузии бинарной смеси при , .
— поверхностные натяжения определяют по уравнению:
(19)
где — поверхностные натяжения исходных веществ при соответствующих температурах, .
— мольные расходы рассчитывают по уравнениям:
где — мольные расходы питания и дистиллята, ;
— флегмовое число.
— массовые расходы рассчитывают по уравнениям:
где — массовые расходы питания и дистиллята, .
— объемные расходы рассчитывают по соотношению:
(20)
2) Для паровой фазы в верхней и нижней частях колонны:
— мольные составы определяют по уравнениям рабочих линий при подстановке в них соответственно :
— уравнение рабочей линии для верхней части (21)
колонны.
— уравнение рабочей линии для нижней (22)
части колонны.
мольные составы определим по формуле (11):
— мольные массы определяют по уравнению (12) при соответствующих значениях :
— массовые составы определяют по уравнению:
— средние температуры определяют по диаграмме при соответствующих значениях :
— плотности смесей определяют по уравнению Клапейрона:
(23)
где — плотность пара при нормальных условиях (=273 К,
), ;
— средняя температура пара, К;
— среднее давление в колонне, мм рт. ст.
— динамические коэффициенты вязкости рассчитывают по приближенной формуле:
(24)
— коэффициенты диффузии рассчитывают по приближенной формуле:
(25)
где — средняя температура пара, К; — среднее давление в колонне, мм рт. ст.
мольный расход пара, который принимается постоянным по высоте колонны, определяют по уравнению:
(26)
где — массовый расход дистиллята,
— массовые расходы определяют по уравнению:
(27)
— объемные расходы пара рассчитывают по соотношению:
(28)

First, applying your equation to your case, $n_1-(n_2+n_3) + 0 — 0 = 0$ or $n_1 = n_2+n_3$
$$n_{1,a}=n_{2,a}+n_{3,a} space (1) \
n_{1,b}=n_{2,b}+n_{3,b} space (2)\
n_{1,c}=n_{2,c}+n_{3,c} space (3)
$$
and since there’s nothing that separates/filters the components in different proportions, the output will contain exactly the same fraction as input.
$$ f n_{2,a} + (1-f) n_{3,a} = n_{1,a} space (4)\
f n_{2,b} + (1-f) n_{3,b} = n_{1,b} space (5)\
f n_{2,c} + (1-f) n_{3,c} = n_{1,c} space (6)\
$$
where $f$ is the ratio at which the streams are split into output — the same for all components.
Looking at the table, we have $n_{1,A}$ and $n_{2,a}$. From (1) we can quickly find $n_{3,a}$ : 4-1=3.
With these 3 we can find $f$ from (4): 0.25
Remainder of $n$ is trivial as we have column $1$ — multiply the $1$ column value by 0.25 for column $2$ and 0.75 for column $3$, e.g. $n_{2,b} = 10cdot0.25 = 2.5$
For totals in kg/h, simply take the units given to find the factor by which to multiply:
$$total_{c} = sum_i^{a,b,c}{MW_i cdot n_{c,i}} $$
(remembering the 1000 factor of $kmol$ vs $mol$ — multiply $n$ by 1000 first): For column $1$
(4*10 + 10*20 + 6*30)*1,000 = 40+200+180 = 420,000 kg/h.