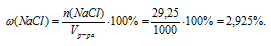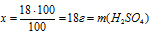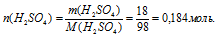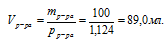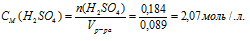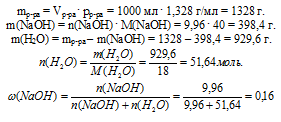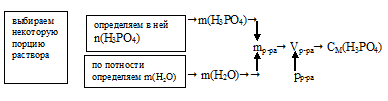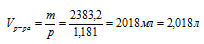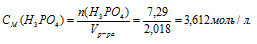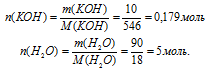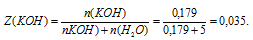Определение массовой доли, молярности и мольной доли
Задача 4.
Определите массовую долю NаС1 в 0,5 М водном растворе (плотность раствора принять равной 1,000 г/мл).
Дано:
молярная концентрация NаС1 в р-ре: См(NаС1) = 0,5 моль/л.;
плотность раствора: рр-ра = 1,000 г/мл.
Найти:
массовую долю NаС1 в растворе.
Решение:
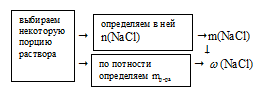
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно объем раствора, т.к. известная концентрация выражена в моль/л. Причем разумнее всего взять объем равный 1 л.
По записи концентрации (0,5 моль/л) видно, что в этом 1 л раствора содержится 0,5 моль чистой соли NаС1.
Определим массу 0,5 моль NаС1:
m(NаС1) = n(NаС1) . М(NаС1) = 0,5 . 58,5 = 29,25 г.
Определим массу раствора:
mр-ра = Vр-ра . pр-ра = 1000мл . 1 г/мл = 1000 г.
Массовую долю NаС1 в растворе определяем, пользуясь соотношением:
Ответ: 
Задача 5.
Определить молярность 18%-ного раствора Н2SО4 в воде (рр-ра = 1,124 г/мл).
Дано:
массовая доля Н2SО4 в растворе: 
плотность раствора: рр-ра = 1,124 г/мл.
Найти:
молярную концентрацию Н2SО4 в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно массу раствора, т.к. известна массовая доля. Причем разумнее всего взять массу 100 г.
1. Находим массу серной кислоты в выбранной массе раствора:
100 г составляют 100%
х г составляют 18%
в 100 г 18% -ного раствора.
2. Определяем количество вещества в 18 г Н2SО4
3. Используя плотность, находим объем 100 г раствора:
4. Объем переводим в литры, т.к. молярная концентрация измеряется в моль/л: Vр-ра = 89 мл = 0,089 л.
5. Определяем молярную концентрацию:
Ответ: СМ(Н2SО4) = 2,07 моль/л.
Задача 6.
Определите мольную долю NаОН в водном растворе, если его концентрация равна 9,96 моль/л, а плотность 1,328 г/мл.
Дано:
молярная концентрация NаОН в растворе: См(NаОН) = 9,96 моль/л;
плотность раствора: рр-ра = 1,328 г/мл.
Найти:
мольную долю NаОН в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно объем раствора, т.к. известная концентрация выражена в моль/л. Причем разумнее всего взять объем равный 1 л.
По записи концентрации (9,96 моль/л) видно, что в этом 1 л раствора содержится 9,96 моль чистого NаОН.
Для определения мольной доли NаОН еще необходимо выявить количество вещества (n, моль) воды в выбранной порции раствора (1л). Для этого определим массу раствора и вычтем из нее массу NаОН.
Ответ1: 
Задача 7.
Мольная доля водного раствора Н3РО4 в воде составляет 7,29%(мольн.) Определите молярность этого раствора, если его плотность 1,181 г/мл.
Дано:
мольная доля Н3РО4 в растворе: Z(Н3РО4) = 7,29%;
плотность раствора: рр-ра= 1,181 г/мл.
Найти:
молярную концентрацию Н3РО4 в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать такое количество раствора, в котором:
n(Н3РО4) + n(Н2О) = 100 моль.
В этой порции раствора количество вещества Н3РО4 численно совпадает с мольной долей: Z(Н3РО4) = 7,29 моль.
Для определения молярности нам осталось выявить объем выбранной порции раствора. Его можно вычислить, используя плотность раствора. Но для этого необходимо знать его массу. Массу же раствора можно рассчитать исходя из количеств веществ компонентов (Н3РО4 и Н2О) раствора.
1. Выбранная нами порция содержит суммарно 100 моль. Количество вещества Н3РO4 нам известно. Используя эти данные, находим n(Н2О).
п(Н2О) = 100 – 7,29 = 92,71 моль.
2. Определим массу 92,71 моль воды:
m(Н2О) = n(Н2О) . М(Н2О) = 92,71 . 18 = 1669 г.
3. Определим массу 7,29 моль Н3РО4:
m(Н3РO4) = n(Н3РО4) . М(Н3РО4) = 7,29 . 98 = 714,4 г.
4. Находим массу выбранной порции раствора:
mр-ра = m(Н2О) + m(Н3РО4) = 1669 + 714,4 =2383 г.
5. Используя данные о плотности раствора, находим его объем:
6. Теперь определим молярную концентрацию:
Ответ: СМ(Н3РО4) = 3,612моль/л.
Задача 8.
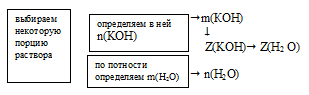
Определите мольные доли веществ в водном растворе КОН, если массовая доля гидроксида калия в нем составляет 10,00%.
Дано:
массовая доля КОН в растворе: 
Найти:
мольную долю КОН и Н2O(в растворе: Z(КОН) = ?; Z(H2O) = ?
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно массу раствора, т.к. известна массовая доля. Причем разумнее всего взять массу 100 г. В этом случае массы каждого компонента совпадут с численным значением массовой доли:
m(КОН) = 10 г, m(Н2О) = 100 – m(КОН) = 100 – 10 = 90 г.
1. Определим количество вещества (n, моль) воды и КОН.
2. Определяем мольную долю КОН
3. Определяем мольную долю воды:
Z(Н2O) = 1 – Z(КОН) = 1 – 0,035 = 0,965.
Ответ: Z(КОН) = 0,035 (доли от 1) или 3,5%(мольн.);
Задача 9.
Определите массовые доли веществ в водном растворе Н2SО4, если мольная доля серной кислоты в нем составляет 2,000%.
Дано:
мольная доля Н2SО4 в растворе: Z (Н2SО4)= 2,000%;
Найти:
массовые доли Н2SО4 и Н2О в растворе: 

Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать такое количество раствора, в котором n(Н2SО4) + n(Н2О) = 100 моль. В этой порции раствора количество вещества Н2SО4 численно совпадает с мольной долей: nН2SО4= 2 моль.
1. Находим количество вещества воды в выбранной порции
n(Н2О) = 100 моль – 2 моль = 98 моль.
2. Определяем массы Н2SО4 и Н2О по найденным значениям количеств веществ.
m (Н2SО4) = n(Н2SО4) . М(Н2SО4) = 2 . 98 = 196 г.
m(Н2О) = n(Н2О) . М(Н2О) = 98 . 18 = 1764 г.
3. По массам компонентов раствора находим их массовые доли.
Ответ: 

Комментарии;
1 Мольная доля выражена в долях от единицы.
Отношение количества
или массы вещества, содержащегося в
системе, к объему или массе этой системы
называется концентрацией.
Рассмотрим несколько
способов выражения концентрации.
Процентная
концентрация
(массовая доля растворенного вещества)
(ω) показывает, сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора. Массовая
доля – безразмерная величина, ее выражают
в долях единицы или процентах:
,
где ω – массовая
доля (%) растворенного вещества; m1
– масса растворенного вещества, г; m
– масса раствора, г.
Масса раствора
равна произведению объема раствора V
(мл) на его плотность r
(г/см3):
,
тогда
.
Молярная
концентрация (молярность)
раствора – показывает, сколько молей
растворенного вещества содержится в
1л раствора.
Молярную концентрацию
(моль на литр) выражают формулой
,
где m1
– масса растворенного вещества, г; М –
молярная масса растворенного вещества,
г/моль; V
– объем раствора, л.
Количество вещества
в молях определяется по формуле:
n
= m1
/М, тогда
Нормальная
концентрация (нормальность раствора)
показывает, сколько грамм-эквивалентов
растворенного вещества содержится в 1
л раствора (моль на литр):
,
где m1
– масса растворенного вещества, г; V
– объем раствора, л.
Э – эквивалентная
масса растворенного вещества (г/моль),
которую рассчитывают по формуле:
Э=(г/моль),
где М – мольная
масса вещества, n
– количество катионов (анионов), В
– валентность. Валентность – это
способность атомов элемента присоединять
определенное число атомов другого
элемента. Эквивалент кислоты можно
определить по формуле: Э = М (кислоты)
/ основность (число атомов водорода).
Например: Э
Н2SO4==49г/моль;
эквивалент основания по формуле: Э = М
(основания) / кислотность (число ОН—
групп), так Э
Fe(OH)3==35,6г/моль;
эквивалент соли по формуле: Э = М(соли)
/ число атомов металла * валентность
металла,
Э Al2(SO4)3==114г/моль.
Моляльность
раствора Сm
показывает
количество растворенного вещества,
находящееся в 1 кг растворителя:
,
где m2
– масса растворителя, кг; n
– количество растворенного вещества,
моль.
Пример
1.
Вычислить молярность и нормальность
40 %-го раствора фосфорной кислоты,
плотность которого 1,25 г/см3.
Объем раствора 1л.
Решение.
Для расчета молярности и нормальности
раствора найдем массу фосфорной кислоты
в 1 л (1000 мл) 40 %-го раствора:
w
= m1
· 100/V
∙ r;
.Молярная
масса Н3РO4
равна 98 г/моль, следовательно,
=
500/98 = 5,1 моль/л.
Молярная
масса эквивалента Н3РO4
равна 98/3 = 32,7 г/моль.
Тогда
СН
= 500/32,7 =
1,53 моль/л.
Пример
2.
Вычислить
массовую долю КОН в 2н. растворе, плотность
которого 1,08 г/см3.
Решение.
Поскольку
нормальность рассчитывается на 1 л
раствора, найдем массу растворенного
вещества в 1 л:
СН=
m1/Э∙V;
ЭKOH
= 56 г/моль;
mКОН=2∙56∙1=112
г.
Теперь
вычислим массовую доли КОН в растворе,
содержащем 112
г
гидроксида калия:
w=
m1∙100/V∙r=112∙100/1000∙1,08=10,4
%.
Пример 3.
На нейтрализацию 50 см3
раствора кислоты израсходовано 25 см3
0,5 н. раствора щелочи. Чему равна молярная
концентрация эквивалентов кислоты?
Решение.
Так как вещества взаимодействуют между
собой в эквивалентных соотношениях, то
растворы равной молярной концентрации
эквивалентов реагируют в равных объемах.
При разных молярных концентрациях
эквивалентов объемы растворов реагирующих
веществ обратно пропорциональны их
нормальностям, т.е.
V1:
V2
= С2
: С1
или V1∙
С1
= V2
∙
С2
50С1
= 25 • 0,5; откуда С1
= 25 • 0,5 / 50 = 0,25н.
Задание:
решить следующие задачи, принимая объем
раствора равным
1 л:
|
Вариант |
Вещество |
Концентрация |
Плотность |
Вычислить |
|
121 |
Na2CO3 |
0,30 |
1,030 |
Процентную |
|
122 |
HNO3 |
9,0 |
1,275 |
Процентную |
|
123 |
NH4Cl |
10 |
1,028 |
Молярную |
|
124 |
Al2(SO4)3 |
0,55 |
1,176 |
Процентную |
|
125 |
HNO3 |
2 |
— |
Нормальную |
|
126 |
HCl |
15,0 |
1,073 |
Нормальную |
|
127 |
H2SO4 |
13,0 |
1,680 |
Процентную |
|
128 |
H3PO4 |
44,0 |
1,285 |
Нормальную |
|
129 |
HClO4 |
9,0 |
1,150 |
Процентную |
|
130 |
H2SO4 |
2 |
— |
Нормальную |
|
131 |
CH3COOH |
34,0 |
1,043 |
Молярную |
|
132 |
BaCl2 |
2,30 |
1,203 |
Процентную |
|
133 |
K2CO3 |
4 |
— |
Нормальную |
|
134 |
CuSO4 |
14,0 |
1,155 |
Нормальную |
|
135 |
FeCl3 |
1,90 |
— |
Нормальную |
|
136 |
K2CO3 |
6,0 |
1,567 |
Процентную |
|
137 |
NaCl |
3 |
— |
Молярную |
|
138 |
NaCl |
20 |
1,148 |
Молярную |
|
139 |
HClO4 |
4,0 |
1,230 |
Процентную |
|
140 |
K2CO3 |
3 |
— |
Нормальную |
Задание: решить
следующие задачи
|
№ задачи |
|
|
141 |
На |
|
142 |
Смешали |
|
143 |
Определить |
|
144 |
Смешали |
|
145 |
Для |
|
146 |
Смешали |
|
147 |
На |
|
148 |
Смешали |
|
149 |
На |
|
150 |
Вычислить |
|
151 |
Определить |
|
152 |
Вычислить |
|
153 |
Определить |
|
154 |
Определить |
|
155 |
Вычислить |
|
156 |
Вычислить |
|
157 |
Определить |
|
158 |
Смешали |
|
159 |
Определить |
|
160 |
Вычислить |
Соседние файлы в папке му по химии
- #
- #
- #
- #
- #
- #
- #
Для перевода нужно задать формулу растворяемого вещества (формула нужна для определения молярной массы), плотность раствора, и известный показатель, то есть либо молярность (молярную концентрацию раствора), либо моляльность (моляльную концентрацию раствора). Калькулятор найдет неизвестный показатель. Формулы расчета приведены под калькулятором.
Молярность в моляльность и наоборот
Растворяемое вещество, химическая формула
Точность вычисления
Знаков после запятой: 2
Перевод молярной концентрации в моляльную и наоборот
Молярная концентрация — это количество растворенного вещества (число моль) в единице объёма раствора. Обозначается как C, чаще всего встречающиеся на практике единицы измерения — моль/л.
где n — число моль вещества и V — объем раствора
Моляльная концентрация — это количество растворенного вещества (число моль) в 1000 г растворителя. Обозначается как m, единицы измерения — моль/кг.
где n — число моль вещества и mₛ — масса растворителя, кг
Введем обозначения
mₐ — масса раствора
ρ — плотность раствора
mᵦ — масса растворенного вещества
M — молярная масса растворенного вещества
Тогда
и мы может провести такие преобразования
Из полученной формулы вычисления моляльности по молярности
можно вывести и обратную формулу вычисления молярности по моляльности
Эти формулы и использует калькулятор выше.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Основные понятия и определения
Под раствором в химии понимают твёрдую или жидкую однородную систему, состоящую из нескольких компонентов. Вещества образующие раствор разделяются на растворители и растворённые.
Например, сахар, находящийся в воде — такая смесь называется двухгомогенная. Если же в сахарную воду добавить уксус, то полученный раствор уже будет трёхгомогенный. Количество в смеси того или иного разжиженного компонента называется концентрацией. Изменяться она может в широких пределах.
Существует несколько способов выражения концентрации растворов:
- Массовый. Обозначается латинской буквой P и определяется количеством растворённого вещества в 100 граммах смеси. Для нахождения массовой концентрации используется формула: P = (n / (n + m)) * 100%, где: n — масса растворяемого вещества, m — масса растворителя, (n + m) — масса раствора. Сумма веществ выражается произведением объёма раствора на его плотность, то есть (n + m) = p * V и измеряется в граммах. Например, 25% раствор обозначает, что в 100 граммах смеси содержится 25 грамм вещества n.
- Молярный. Показывает количество моль разжиженного тела в одном кубическом дециметре. Обозначается характеристика латинскими символами Cb и находится из выражения: Cb = v моль / V дм³. То есть запись: 0,6 M NaCl будет означать, что 0,6 моль NaCl растворено в одном кубическом дециметре смеси.
- Эквивалентный. Способ ещё называется нормальным. Он так же как и молярный показывает количество растворённого вещества в дециметре кубическом, только используется моль эквивалента. Под последним понимается количество соединений с одним молем атома или замещения при прохождении реакций. Обозначается символом Cэ и находится по формуле Cэ = n / Mэкв * V дм³. Например, 0,1 HCl означает, что 0,1 моль эквивалента соляной кислоты содержится в 1 дм³ раствора.
- Моляльный. Используется, чтобы узнать, какое количество моль разжиженного вещества находится в килограмме растворителя. Моляльность рассчитывается с помощью формулы: Cm = (n*100) / (M * m).
- Титр раствора. Определяется количеством растворённого вещества, выраженного в одном сантиметре кубическом. Измеряется в граммах: Т = n / V см³.
Молярная масса и доли
Для измерения массы используются граммы, килограммы, тонны, но для обозначения количества вещества они не подходят. В химических процессах принимают участие различные частицы, такие как молекулы, атомы, ионы. Поэтому для того чтобы определить, сколько вещества содержится в той или иной смеси, ввели специальную единицу — моль. Иными словами — это множество, в котором объединены масса с числом.
Концентрация — это значение количества объёма раствора к растворенному в нём телу. Наиболее часто для измерения применяется массовая доля разжиженного вещества, молярная и нормальная концентрация. Массовая часть — это неизмеряемая величина. Складывается она из двух масс:
- растворителя — вещества способного ослаблять другие тела;
- растворимого — разжижающегося состава, поглощаемого растворителем.
Способность же вещества поглощаться другим называют растворимостью. При определении результата взаимодействия растворов находится массовая доля каждого из них.
Молярная масса показывает массу одного моль вещества и измеряется в граммах, делённых на моль. Если необходимо отмерить один моль, то нужно будет взять столько граммов вещества, сколько их содержится в относительной атомной массе или же, относительной молекулярной массе. Один моль всегда содержит постоянное число молекул, называемое константой Авогадро. Равно оно: N = 6 * 1023. Для того чтобы рассчитать число молекул в определённом веществе используют формулу:
N = Na * n, где Na — постоянная Авогадро, n — количество вещества. То есть моль — это количество в котором содержится 6 * 1023 молекул. Молярная концентрация определяет, сколько моль разжиженного вещества содержится в одном литре раствора.
Считается, что в единице объёма находится некая величина, определяемая числом молекул. Записывается это определение как n = N / V и называется концентрацией молекул. Измеряется она в м3. Важно отметить, что концентрация связана с плотностью соотношением: n = p / m0 и показывает число структурных молекул, находящихся в единице объёме. Поэтому плотность используется при нахождении массы на единицу объёма, а концентрация при вычислении количества молекул.
Массовая доля растворимого часто называется процентной концентрацией. При этом вместо процентного определения используется молярная концентрация. Другими словами, отношение количества к объёму в литрах. Зная число молей в одном литре довольно просто подобрать необходимое число молей используя специальную посуду.
Формулы перехода
Расчёт количества той или иной части концентрированной смеси, возможно, выполнить в различных единицах. Но между тем существуют формулы перехода от одних выражений к другим. При пересчёте происходит округление знака после запятой, поэтому при переходе с одной величины на другую появляется определённая погрешность.
Конвертация от массовой доли к молярной массе выполняется по формуле: Cb = (p * ɷb) / M (B), где: Cb — молярная концентрация, p — плотность, ɷb — массовая доля, M (B) — молярная масса. При этом когда плотность раствора изначально обозначается в грамм на миллилитр, а молярная в грамм на моль, то ответ необходимо умножить на 1 тыс. мл/л. Если же значение доли указано в процентах, то ответ необходимо разделить на 100%.
Для перехода от молярной к нормальной концентрации (молярной концентрации эквивалента), используется выражение: c * ((1 / z) * B) = Cb * z. Где молярность измеряется в моль на литр, а z — число эквивалентности (сопоставимое с одним молем катионов водорода в проходящей реакции). В определённых ситуациях выполняется и перевод массовой доли к титру. Выполняют это по формуле: T = p * ɷ, где p — плотность, измеряемая в граммах, делённых на миллилитры, а ɷ — массовая часть растворённого, в долях.
Перевести можно и молярность к титру. Используют для этого следующую формулу перехода: Т = Cb * M, в которой М — молярная масса разжиженного вещества. В случае же когда концентрация выражается в моль на литр, а масса в грамм на моль, ответ нужно разделить на 1 тыс. миллилитров на литр. Молярность связана с моляльностью формулой: mb = Cb / p, где р — плотность раствора, измеряемая в граммах, делённых на миллилитры.
Самый же сложный перевод происходит при конвертации моляльности к мольной доле. Для решения такой задачи используется формула для мольного элемента: Yb = mb / (mb + 1/ M (A)). В выражении mb обозначает моляльность, а M (A) — молярную массу растворителя. Чтобы ответ получился в одинаковых единицах измерения, цифра один в формуле представляется как 1000 г/кг. Это необходимо, когда моляльность подставляется в моль на килограмм, а масса в грамм на моль.
Вычисление концентрации
Чтобы получить раствор, необходимо между собой смешать растворитель и растворимое. Для того чтобы вычислить концентрацию, нужно знать или найти общий объём смеси, который будет равен сумме элементов, используемых при создании раствора. Измеряться концентрация может в различных величинах. Основные из них:
- грамм на литр (г/л) — отношение массы к объёму;
- молярность (моль) — содержание растворенных элементов к объёму раствора;
- миллионная часть (г / единица раствора) — соотношение растворённых веществ к одному миллиону единиц смеси;
- проценты (%) — ответ выражается в количестве растворённой доли в граммах к ста частям раствора.
Найти молярность, характеризуемую числом доли растворенных элементов, зная массу и формулу вещества несложно. Если количество растворённой части задано в других единицах, то их преобразуют в граммы.
Каждый элемент характеризуется молярной массой и определяется отношением массы к числу моль. Равна она атомной массе, которую можно взять из таблицы Менделеева. Для нахождения молярной величины нужно сложить все атомные числа элементов, смешанных в растворе.
Найдя молекулярное значение можно перейти к вычислению количества молей. Делается это с помощью формулы для молярной концентрации: масса растворённого вещества умножается на обратную молярную часть. Результат должен получиться в моль. На следующем этапе находится молярность. Полученное число молей делится на объём, измеряемого в литрах раствора. Обычно объёмом растворённой части пренебрегают.
По аналогии вычисляется концентрация и в процентном составе. Для этого нужно найти массу частей, составляющих раствор. На первом этапе все единицы измерения переводятся в граммы. Находится плотность, затем она умножается на объём и получается масса вещества в граммах. Вычисление концентрации в процентном составе находится как масса растворённого вещества, делённая на сумму массы растворяемого и растворителя, а после результат умножается на сто.
Так как проценты являются сотой долей, то для получения ответа в миллионной доле результат нужно умножить ещё на 10 тысяч.
Примеры расчёта
Определением молярности раствора занимается химия. В процессах участвуют различные частицы, количество которых даже в малых объёмах велико. Значение молярной концентрации определяется не только количественным, но и качественным составом. Самые простые задачи связаны с нахождением молярной массы. Например, для соединения CH4 она наводится следующим образом:
Мr (CH4) = Ar + 4Ar (H) = 12 + 4 =16
Получается, что масса метана содержит 16 г/моль или 6,02Ч * 1023 молекул. Буква «Ч» используется для обозначения части.
Теперь можно найти массу в объёмном количестве. Например, нужно определить массу метана смешанном в количестве двух моль. Так как для метана его масса составляет 16 г/моль, то ответом будет:
м (метан) = 2 * 16 = 32 г
Много задач встречается на нахождение массовой доли в растворе. Например, в 200 грамм соли добавили 80 грамм воды. Чтобы определить часть соли в полученной смеси необходимо найти первоначальную её долю в растворе: M1 = w * m = 0,14 * 200 = 28 гамм. Затем вычислить массу нового раствора: М2 = 200 + 80 = 280 грамм. И воспользовавшись формулой получить ответ: W = M1 / M2 = 28 / 280 = 0,100.
Немного сложнее задачи на расчёт грамм-эквивалента. Пусть нужно найти нормальность серной кислоты, смешанной с раствором щёлочи. При смешении образуется соединение: NaSO4. Так как при реакции серная кислота нейтрализует гидросульфат натрия только частично то можно записать: Н2SO4 + NaOH = NaHSO4 + Н2О. Серная кислота представляет основу равную единице, поэтому и фактор эквивалентности также будет составлять единицу.
Экв (H2SO4) =1 * ф = 1/1 = 1
Отсюда следует, что значение молярности эквивалента кислоты:
Мэкв (H2SO4) = M * Ф = M/1 = 98/1 = 98 г/экв
Нужно найти массовую часть и молярность эквивалента смеси, полученной при смешивании 400 мл раствора серной кислоты (p =1, 18 г/мл) и 400 мл восьмипроцентного раствора серной кислоты (p = 1,05 г/мл).
Вначале следует вычислить массу первого раствора и содержание в нём серной кислоты:
m (р-ра) = p (р-ра) * V (р-ра) = 1,18 * 400 = 720 г
m (H2SO4) = V (H2SO4) * м (H2SO4)= С (H2SO4) * V (р-ра) * М (H2SO4) = 720 * 0,2 — 98 = 46 г
Затем определить массу второго раствора и содержание в нём количества серной кислоты:
m (р-ра) = р (р-ра) * V (р-ра) = 1,05 * 400 = 420 г
m = m (р-ра) * (H2SO4)= 420 * 0,08 = 24 г
Часть полученного раствора находится по формуле:
ɷ (H2SO4) = m (H2SO4) / m (р-ра) = (46 + 24) / (720+420) = 0,146
Ответ удобнее записать в процентном соотношении — 14,6%.