Принимаем в качестве образца раствор объемом в 1 литр и определяем его массу:
m (раствора) = V (раствора) ∙ р (раствора) = 1000 ∙ 1,09 = 1090 г.
Рассчитываем, сколько в образце щелочи по массе:
m (NaOH) = (w ∙ m (раствора))/100% = (8 ∙ 1090)/100 = 87,2 г.
Молярная масса гидроксида натрия равна:
М(NaOH) = 23 + 16 + 1 = 40 г/моль.
Рассчитываем, сколько гидроксида натрия содержится в образце:
v(NaOH) = m /M = 87,2/40 = 2,18 моль.
Определяем молярную концентрацию щелочи: Cv(NaOH)=v/V = 2,18/1 = 2,18 М
Принимаем в качестве образца раствор объемом в 1 литр и определяем его массу:
m (раствора) = V (раствора) ∙ р (раствора) = 1000 ∙ 1,09 = 1090 г.
Рассчитываем, сколько в образце щелочи по массе:
m (NaOH) = (w ∙ m (раствора))/100% = (8 ∙ 1090)/100 = 87,2 г.
Эквивалентная масса гидроксида натрия равна его молярной массе:
М(NaOH) = 23 + 16 + 1 = 40 г/моль.
Определяем нормальную концентрацию щелочи:
Cv(NaOH)=m/(Э * V) = 87,2/(40 * 1) = 2,18 н.
Молярность раствора гидроксида натрия
Вычислить молярность раствора гидроксида натрия (NaOH), полученного растворением 2,00 грамм гидроксида натрия (NaOH) в мерной колбе 200 миллилитров.
Решение задачи
Напомню, что под молярностью понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
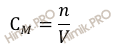
Найдем молярность раствора гидроксида натрия (NaOH), полученного растворением 2,00 г гидроксида натрия (NaOH) в мерной колбе 200 мл (0,2 л).
Для расчета будем использовать формулу нахождения молярной концентрации раствора:
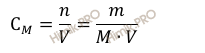
где:
CM –
молярная концентрация раствора;
n –
химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m –
масса растворенного вещества;
V – объем раствора, в л.
Зная, что молярная масса гидроксида натрия (NaOH) равна 40 г/моль (смотри таблицу Д.И. Менделеева), получаем молярность раствора гидроксида натрия (NaOH):
CM (NaOH)
= 2 / 40 ∙ 0,2 = 0,25 (моль/л).
Ответ:
молярность раствора гидроксида натрия (NaOH) равна 0,25 моль/л.
Дано:
w (раствора) = 25,5%,
Р(раствора)= 1,25 г/мл.
Найти:
С(NaOH)-?
Решение:
1) Нужно найти молярную концентрацию по формуле
Cv(NaOH)=n/V
2) Нам нужно найти количество моль n(NaOH)
n = m /M
Принимаем в качестве образца раствор объемом в 1 литр и определяем его массу:
m (раствора) = V (раствора) ∙ р (раствора) = 1000 ∙ 1,25 = 1250 грамм.
3) Рассчитываем, сколько в образце щелочи по массе:
w= m (NaOH)/ m (раствора) *100%
Из этой формуле можно найти массу щелочи по формуле
m (NaOH) = (w ∙ m (раствора))/100% = (25,5 ∙ 1250)/100 = 319 грамм.
4) Вычисляем относительную молекулярную массу гидроксида натрия:
Mr (NaOH) = 23 + 16 + 1 = 40
5) Находим молярную массу гидроксида натрия:
М ((NaOH) = 40•1 г/моль =40 г/моль
6) Рассчитываем, сколько гидроксида натрия содержится в образце:
v(NaOH) = m /M = 319/40 = 8 моль.
7)Определяем молярную концентрацию щелочи:
Cv(NaOH)= 8 моль/1литр = 8 моль/литр.
Ответ: Молярная концентрация гидроксида натрия ровна 8 л/моль
Содержание
Массовая доля растворённого вещества (ω)
Молярная концентрация (c)
Нормальность раствора
Существуют различные способы выражения состава раствора. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества (ω)
Массовая доля растворённого вещества ωB – это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
ωB = mB / m
Массовую долю растворённого вещества ωB обычно выражают в долях единицы или в процентах.
Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример:
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение:
m (Na2SO4) = ω (Na2SO4) / 100 = (5 × 300) / 100 = 15 г
где ω (Na2SO4) – массовая доля в %,
m – масса раствора в г
m (H2O) = 300 г – 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды.
Вернуться к содержанию
Молярная концентрация (c)
Молярная концентрация cB показывает, сколько моль растворённого вещества содержится в 1 литре раствора:
cB = nB / V = mB / (MB × V)
где МB – молярная масса растворенного вещества, г/моль.
Молярная концентрация измеряется в моль/л и обозначается «M». Например, 2 M NaOH – двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M (NaOH) = 40 г/моль).
Пример:
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение:
M (K2CrO4) = c (K2CrO4) × V × M (K2CrO4) = 0,1 моль/л × 1,2 л × 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Вернуться к содержанию
Нормальность раствора (нормальная концентрация, молярная концентрация эквивалента)
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Грамм-эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ – это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп;
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода;
Эсоли = Мсоли / произведение числа катионов на его заряд.
Пример:
Вычислите значение грамм-эквивалента (г-экв) серной кислоты, гидроксида кальция и сульфата алюминия.
Решение:
Э (H2SO4) = М (H2SO4) / 2 = 98 / 2 = 49 г
Э (Ca(OH)2) = М (Ca(OH)2) / 2 = 74 / 2 = 37 г
Э (Al2(SO4)3) = М (Al2(SO4)3) / (2 × 3) = 342 / 2= 57 г
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4». Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример:
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (ρ = 1,615 г/мл).
Решение:
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём:
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 × 1000 / 61,92 = 1130,49 г H2SO4. Отсюда, молярность данного раствора равна:
1130,49 / М (H2SO4) =1130,49 / 98 = 11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 = 23,06 H.
Вернуться к содержанию
14.12.2021 0:37:23 | Автор статьи: Усачёва Вера
Чтобы определить концентрацию гидроксида натрия в растворе, нужно разделить массу гидроксида натрия на массу раствора или же, в нашем случае на сумму масс гидроксида натрия и воды как растворителя.
Так как нам дан только объем воды, нужно найти его массу путем умножения его объема на его плотность.
m(H2O) = 200 мл * 1 г/мл = 200 грамм
Запишем формулу:
w(%) = m(NaOH) / (m(NaOH) + m(H2O))
w(NaOH) = 40 грамм / ( 40 грамм + 200 грамм) = 40 грамм / 240 грамм = 0,1667 = 16,67%
