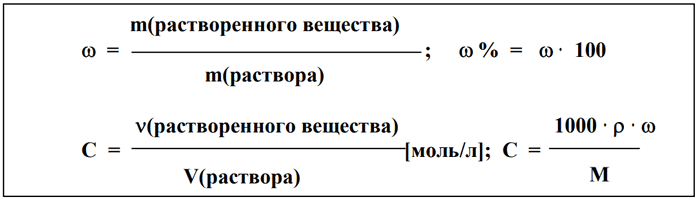
Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
ν(HNO3) = m/M(HNO3) = 6,3 г/ 63 г/моль = 0,1 моль
С(HNO3) = ν(HNO3)/Vр-ра = 0,1 моль/ 0,5 л = 0,2 моль/л
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
Вычислите молярную концентрацию, молярную концентрацию эквивалентов, моляльность и титр раствора хлорида натрия (ρ=1,148 г/мл) с массовой долей натрия хлорида 20%.
1) Расчёт молярной концентрации
С = m / M • V
Рассчитаем массу NaCl. Допустим, что объём 20% р-ра NaCl составляет 0,1л = 100 мл.
m = V • ρ = 100 мл • 1,148 г/мл = 114,8
Рассчитаем объём растворителя для приготовления 20% раствора NaCl через формулу расчёта массовой доли
W = (mв-ва / mв-ва + mра-теля) • 100%
Выразим массу растворителя:
mраст-теля = (mв-ва • 100% / W) – mв-ва = (114,8 г • 100% / 20%) – 114,8 г = 459,2 мл = 0,4592 л
С = m / M • V = 114,8 г / 58,443 г/моль • 0,4592 л = 4,28 моль/л = 4,28М
2) Расчёт молярной концентрации эквивалента
Молярная концентрация эквивалента (нормальность) численно равна произведению фактора эквивалентности на молярную концентрацию данного вещества. Учитывая, что в реакцию вступает 1 моль вещества, то фактор равен 1.
Следовательно,
См = С = 4,28 н
3) Расчёт моляльности
Моляльность — количество растворённого вещества (число молей) в 1000 г растворителя.
С = N/ m раст-теля
mраст-теля = (mв-ва • 100% / W) – mв-ва = (114,8 г • 100% / 20%) – 114,8 г = 459,2 мл = 0,4592 л = 0,4592 кг
N = m/M = 114,8 г / 58,443 г/моль = 1,96 моль
С = N/ m раст-теля = 1,96 моль / 0,4592 кг = 4,28 моль/кг
4) Расчёт титра
Т = M • M1
M – молярная концентрация эквивалента, моль/л
M1 – молярная масса растворённого вещества, г/моль
Т = M • M1 = 4,28 моль/л • 58,443 г/моль = 250,14 г/л = 0,2501 г/мл
Изменено 18 Апреля, 2012 в 06:37 пользователем docanton
Рассчитать моляльность раствора, молярность, титр 20 % раствора хлорида натрия (NaCl). Плотность раствора равна 1,152 г/мл.
Решение задачи
Напомню, что под молярностью понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Для вычисления молярности надо знать число грамм хлорида натрия (NaCl) в 1 литре раствора. Зная, что 20-процентный раствор хлорида натрия (NaCl) содержит 20 г хлорида натрия (NaCl) в 100 г раствора, найдем объем, который занимает это весовое количество раствора, по формуле, устанавливающей связь между массой и объемом:
Получаем:
V = 100 / 1,152 = 86,81 (мл).
Следовательно, в 1 л (1000 мл) раствора хлорида натрия (NaCl) содержится:
20 ⋅ 1000 / 86,81 = 230,39 (г).
Зная, что химическое количество (n) вещества равно отношению массы вещества к его молярной массе, и учитывая, что молярная масса хлорида натрия (NaCl) равна 58,5 г/моль (смотри таблицу Менделеева), по формуле рассчитаем молярность раствора хлорида натрия (NaCl):
M (NaCl) = 230,39 / 58,5 = 3,94 (моль/л).
Напомню, что под титром раствора пронимают массу растворённого вещества в 1 мл раствора.
Подставим известные значения в формулу и произведем расчет:
T (NaCl) = 230,39 / 1000 = 0,23039 (г/мл).
Напомню, что моляльность раствора показывает количество (число моль) растворенного вещества в 1 кг растворителя. Моляльную концентрацию выражают в моль/кг.
Для вычисления моляльности раствора надо знать число килограмм растворителя в растворе. Зная, что 20-процентный раствор хлорида натрия (NaCl) содержит 20 г хлорида натрия (NaCl) в 100 г раствора, найдем массу растворителя по формуле:
Получаем:
m (растворителя) = 100 – 20 = 80 (г).
Следовательно, в 1 л (1000 мл) раствора хлорида натрия (NaCl) содержится:
80 ⋅ 1000 / 86,81 = 921,55 (г) или 0,92155 кг – растворителя
Зная, что химическое количество (n) хлорида натрия (NaCl) равно 3,94 моль, рассчитаем моляльность раствора по формуле:
m (NaCl) = 3,94 / 0,92155 = 4,28 (моль/кг).
Ответ:
моляльность равна 4,28 моль/кг;
молярность равна 3,94 моль/л;
титр равен 0,23039 к/мл.
Определите молярную концентрацию и массовую долю хлорида…
Задание:
Определите молярную концентрацию и массовую долю хлорида натрия в растворе, полученном растворением 14,63 г сухой соли в 100 мл воды (плотность раствора 1,146 г/мл).
Решение:
1) Находим массу раствора:
m(раствора) = m(растворенного вещества) + m(растворителя); m(Н2О) = V · ρ = 100 · 1 = 100 г
m(раствора) = m(NaCl) + m(H2O) = 14,63 + 100 = 114,63 г
2) ω(NaCl) = m(NaCl) / m(раствора) = 14,63 / 114,63 = 0,1276 (12,76 %)
3) Находим объем раствора, и количество вещества соли:
V(раствора) = m(раствора) / ρ(раствора) = 114,63 / 1,146 = 100 мл = 0,1 л.
v(NaCl) = m(NaCl) / M(NaCl) = 14,63 / 58,5 = 0,25 моль.
4) С(NaCl) = v(NaCl) / V(раствора) = 0,25 / 0,1 = 2,5 моль/л.
Ответ: ω(NaCl) = 12,76 %; С(NaCl) = 2,5 моль/л.
Как рассчитать молярную концентрацию
Молярная концентрация – это величина, которая показывает, сколько молей вещества находится в 1-м литре раствора. Например, известно, что в литре раствора находится ровно 58,5 грамм поваренной соли – хлористого натрия. Поскольку молярная этого вещества как раз и составляет 58,5 г/моль, можно сказать, что в данном случае у вас одномолярный раствор соли. (Или, в виде записи, 1М раствор).

Вам понадобится
- — таблица растворимости веществ.
Инструкция
Решение этой задачи зависит от конкретных условий. Если вы знаете точную массу вещества и точный объем раствора, то решение очень простое. Например, 15 грамм хлористого бария содержится в 400 миллилитрах раствора. Какова его молярная концентрация?
Начните с того, что вспомните точную формулу этой соли: BaCl2. По таблице Менделеева, определите атомные массы элементов, входящих в его состав. И, с учетом индекса 2 у хлора, получите молекулярную массу: 137 + 71 = 208. Следовательно, молярная масса хлорида бария 208 г/моль.
А по условиям задачи, в растворе содержится 15 грамм этого вещества. Сколько же это в молях? Разделив 15 на 208, получите: примерно 0,072 моля.
Теперь вам надо учесть, что объем раствора на 1 литр, а всего 0,4. Разделив 0,072 на 0,4, получите ответ: 0,18. То есть, вы имеете примерно 0,18-молярный раствор хлористого бария.
Немного усложним решение задачи. Предположим, что вы начали бы растворять в 100 миллилитрах воды при комнатной температуре уже упоминавшуюся, хорошо знакомую вам, поваренную соль – хлористый натрий. Добавляли вы его маленькими порциями, тщательно размешивая и дожидаясь полного растворения. И вот наступил момент, когда очередная маленькая порция не растворилась до конца, несмотря на интенсивное перемешивание. Требуется определить, какова молярная концентрация полученного раствора.
Прежде всего, вам надо найти таблицы растворимости веществ. Они есть в большинстве химических справочников, можно также разыскать эти данные в интернете. Вы без труда определите, что при комнатной температуре предел насыщения (то есть, предел растворимости) хлористого натрия – 31,6 грамм/100 грамм воды.
По условиям задачи, вы растворяли соль в 100 миллилитрах воды, но ведь ее плотность практически равна 1. Так что делаем вывод: в полученном растворе содержится приблизительно 31,6 грамм хлористого натрия. Маленьким нерастворенным избытком, а также некоторым изменением объема при растворении соли можно пренебречь, погрешность будет небольшой.
Соответственно, в 1 литре раствора содержалось бы в 10 раз больше соли – 316 грамм. Учитывая, что молярная масса хлористого натрия, как указывалось в самом начале, составляет 58,5 г/моль, вы легко найдете ответ: 316/58,5 = 5,4-молярный раствор.
Источники:
- как вычислить молярную концентрацию
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.