Дано:
w (раствора) = 25,5%,
Р(раствора)= 1,25 г/мл.
Найти:
С(NaOH)-?
Решение:
1) Нужно найти молярную концентрацию по формуле
Cv(NaOH)=n/V
2) Нам нужно найти количество моль n(NaOH)
n = m /M
Принимаем в качестве образца раствор объемом в 1 литр и определяем его массу:
m (раствора) = V (раствора) ∙ р (раствора) = 1000 ∙ 1,25 = 1250 грамм.
3) Рассчитываем, сколько в образце щелочи по массе:
w= m (NaOH)/ m (раствора) *100%
Из этой формуле можно найти массу щелочи по формуле
m (NaOH) = (w ∙ m (раствора))/100% = (25,5 ∙ 1250)/100 = 319 грамм.
4) Вычисляем относительную молекулярную массу гидроксида натрия:
Mr (NaOH) = 23 + 16 + 1 = 40
5) Находим молярную массу гидроксида натрия:
М ((NaOH) = 40•1 г/моль =40 г/моль
6) Рассчитываем, сколько гидроксида натрия содержится в образце:
v(NaOH) = m /M = 319/40 = 8 моль.
7)Определяем молярную концентрацию щелочи:
Cv(NaOH)= 8 моль/1литр = 8 моль/литр.
Ответ: Молярная концентрация гидроксида натрия ровна 8 л/моль
Принимаем в качестве образца раствор объемом в 1 литр и определяем его массу:
m (раствора) = V (раствора) ∙ р (раствора) = 1000 ∙ 1,09 = 1090 г.
Рассчитываем, сколько в образце щелочи по массе:
m (NaOH) = (w ∙ m (раствора))/100% = (8 ∙ 1090)/100 = 87,2 г.
Молярная масса гидроксида натрия равна:
М(NaOH) = 23 + 16 + 1 = 40 г/моль.
Рассчитываем, сколько гидроксида натрия содержится в образце:
v(NaOH) = m /M = 87,2/40 = 2,18 моль.
Определяем молярную концентрацию щелочи: Cv(NaOH)=v/V = 2,18/1 = 2,18 М
Принимаем в качестве образца раствор объемом в 1 литр и определяем его массу:
m (раствора) = V (раствора) ∙ р (раствора) = 1000 ∙ 1,09 = 1090 г.
Рассчитываем, сколько в образце щелочи по массе:
m (NaOH) = (w ∙ m (раствора))/100% = (8 ∙ 1090)/100 = 87,2 г.
Эквивалентная масса гидроксида натрия равна его молярной массе:
М(NaOH) = 23 + 16 + 1 = 40 г/моль.
Определяем нормальную концентрацию щелочи:
Cv(NaOH)=m/(Э * V) = 87,2/(40 * 1) = 2,18 н.
Молярность раствора гидроксида натрия
Вычислить молярность раствора гидроксида натрия (NaOH), полученного растворением 2,00 грамм гидроксида натрия (NaOH) в мерной колбе 200 миллилитров.
Решение задачи
Напомню, что под молярностью понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
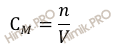
Найдем молярность раствора гидроксида натрия (NaOH), полученного растворением 2,00 г гидроксида натрия (NaOH) в мерной колбе 200 мл (0,2 л).
Для расчета будем использовать формулу нахождения молярной концентрации раствора:
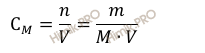
где:
CM –
молярная концентрация раствора;
n –
химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m –
масса растворенного вещества;
V – объем раствора, в л.
Зная, что молярная масса гидроксида натрия (NaOH) равна 40 г/моль (смотри таблицу Д.И. Менделеева), получаем молярность раствора гидроксида натрия (NaOH):
CM (NaOH)
= 2 / 40 ∙ 0,2 = 0,25 (моль/л).
Ответ:
молярность раствора гидроксида натрия (NaOH) равна 0,25 моль/л.
Раствор
–
гомогенная (однородная) система, состоящая
как минимум из двух компонентов, один
из которых растворитель, другой –
растворенное вещество. То есть состав
раствора = растворитель + растворенное
вещество.
Например,
водный раствор хлорида натрия состоит
из двух компонентов: воды (растворителя)
и хлорида натрия (растворенного вещества).
Существует несколько
способов выражения концентрации
растворов.
Молярная
концентрация, или молярность (СM)
–
количество вещества (ν) растворенного
компонента, содержащееся в 1 литре (дм3)
раствора:
[моль/л], (14)
Молярная
концентрация эквивалентов
(Сэкв),
(нормальная
концентрация или нормальность
N)
– количество вещества эквивалентов
(νэкв)
растворенного компонента, содержащееся
в 1 литре (дм3)
раствора:
Сэкв
(N)
= νэкв
/ V
[моль-экв/л] (15)
Моляльная
концентрация
или
моляльность
(b)
– количество вещества (ν) растворенного
компонента в 1 кг раствора:
[моль/кг], (16)
Массовая
доля
(ω)
–
отношение массы растворенного вещества
(mр.в.)
к массе раствора (mр-ра)
Ее рассчитывают, выражая в долях единицы
или в процентах. Массовая доля, выраженная
в процентах, называется процентной
концентрацией:
(17)
Процентная
концентрация показывает массу
растворенного вещества, содержащегося
в 100 г раствора. Например, ω(KOH)
= 3% означает, что в 100 г этого раствора
содержится 3 г KOH
и
97 г
H2O.
Молярная
доля (Ni)
– отношение количества вещества
растворенного компонента (в-ва)
(или растворителя, р-ля)
к суммарному количеству вещества всех
компонентов раствора. Например, в
системе, состоящей из растворителя и
одного растворенного вещества, молярная
доля растворенного вещества равна:
, (18)
Молярная доля
растворителя:
(19)
Примеры решения задач
Пример 1.
Определить молярную концентрацию
раствора NaOH
с массовой долей 10% и плотностью
=1,1 г/см3.
Р е ш е н и е. 1) Записываем выражение для молярной концентрации раствора NaOh :
2)
10%-ный раствор – это 10г NaOH
в 100г раствора. Находим количество
вещества NaOH,
содержащееся в 10 г:
,
mNaOH
= 10 г, MNaOH
= 23 + 16 +1 = 40 г/моль
,
т.е. 0,25 моль NaOH
содержится в 100 г раствора.
3)
Находим объем раствора массой 100 г:
m=V,
=
0,091 л
4)
Рассчитываем молярную концентрацию:
Ответ:
молярная концентрация раствора гидроксида
натрия с массовой долей 10% составляет
2,74 моль/л
Пример
2. Найти
молярную долю растворенного вещества
в растворе сахарозы с массовой долей
67%.
Р е ш е н и е. 1) Вспомним, что молярная доля растворенного вещества равна:
67%-ный (по массе)
раствор означает, что в 100 г раствора
содержится 67 г сахарозы и 33 г воды.
2) Определяем
количество вещества сахарозы и количество
вещества воды:
в-ва
= 67/342 = 0,196 моль,
р-ля
= 33/18 = 1,83 моль
Следовательно,
молярная доля сахарозы равна:
Ответ: молярная
доля сахарозы в растворе сахарозы с
массовой долей 67% составляет 0,097.
Пример
3.
Какой объем серной кислоты с массовой
долей 96% (плотностью 1,84 г/см3)
и какую массу воды нужно взять для
приготовления 100 мл 15%-ного (по массе)
раствора H2SO4
(
= 1,10 г/см3).
Р е ш е н и е. 1) Найдем массу 100 мл 15% раствора h2so4:
mH2SO4-р-ра
= V
= 1001,10
=110 г.
2)
Из формулы массовой доли находим массу
серной кислоты, содержащейся в этом
растворе:
;
mH2SO4
=
3)
Найдем массу 96% раствора, содержащего
16,5 г H2SO4:
4)
Находим объем 96 %-ного раствора серной
кислоты:
Ответ:
для приготовления 100мл 15%-ного раствора
H2SO4
потребуется 9,3 мл 96%-ного раствора серной
кислоты и 110 – 16,5 = 93,5 г воды.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Святослава
23 августа, 03:23
0
NaOH Na (+) + OH (-)
так как все 1:1, значит зная концетрацию ионов OH найдем молярную концентрацию раствора NaOH (они одинаковые)
Так как у нас щелочь, то надо найти рОН
рН+рОН = 14
значит рОН=14-8=6
рОН = — Lg[ (OH-) ] где [ (OH-) ] это концентрация ионов гидроксильной группы
6 = — Lg[ (OH-) ]
отсюда [ (OH-) ] = 1 * 10 ⁻⁶ значит См (NaОН) = 1 * 10 ⁻⁶ моль/л
- Комментировать
- Жалоба
- Ссылка
