Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
ν(HNO3) = m/M(HNO3) = 6,3 г/ 63 г/моль = 0,1 моль
С(HNO3) = ν(HNO3)/Vр-ра = 0,1 моль/ 0,5 л = 0,2 моль/л
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
Принимаем в качестве образца раствор объемом в 1 литр и определяем его массу:
m (раствора) = V (раствора) ∙ р (раствора) = 1000 ∙ 1,09 = 1090 г.
Рассчитываем, сколько в образце щелочи по массе:
m (NaOH) = (w ∙ m (раствора))/100% = (8 ∙ 1090)/100 = 87,2 г.
Молярная масса гидроксида натрия равна:
М(NaOH) = 23 + 16 + 1 = 40 г/моль.
Рассчитываем, сколько гидроксида натрия содержится в образце:
v(NaOH) = m /M = 87,2/40 = 2,18 моль.
Определяем молярную концентрацию щелочи: Cv(NaOH)=v/V = 2,18/1 = 2,18 М
Принимаем в качестве образца раствор объемом в 1 литр и определяем его массу:
m (раствора) = V (раствора) ∙ р (раствора) = 1000 ∙ 1,09 = 1090 г.
Рассчитываем, сколько в образце щелочи по массе:
m (NaOH) = (w ∙ m (раствора))/100% = (8 ∙ 1090)/100 = 87,2 г.
Эквивалентная масса гидроксида натрия равна его молярной массе:
М(NaOH) = 23 + 16 + 1 = 40 г/моль.
Определяем нормальную концентрацию щелочи:
Cv(NaOH)=m/(Э * V) = 87,2/(40 * 1) = 2,18 н.
- Авторы
- Файлы
Правилова С.Д.
1
Чаплинский Е.Ф.
1
Иванова Т.А.
1
1 Сургутский институт нефти и газа
Цель: определение возможности замены мерной пипетки на мерный цилиндр в студенческом лабораторном практикуме по химии для упрощения лабораторной работы по определению концентрации щелочи титрованием.
В работе использовался метод кислотно-основного титрования, основанный на применении реакции нейтрализации
2NaOH + H2SO4 = Na2SO4 + 2H2O.
К раствору определяемого вещества – гидроксида натрия – постепенно прибавляли раствор серной кислоты известной концентрации до тех пор, пока его количество не становилось эквивалентным количеству гидроксида натрия, вступившего в реакцию, т.е. до нейтрализации щёлочи. Момент нейтрализации устанавливали по изменению окраски индикатора, прибавляемого в титруемый раствор.
Молярную концентрацию эквивалента щелочи определяли из закона эквивалентов по уравнению
,
где Сн(NaOH) и Сн(H2SO4) – молярные концентрации эквивалента NaОН и H2SO4 в реагирующих растворах, моль/л; V(NaOH) и V(H2SO4) – объёмы реагирующих растворов щёлочи и кислоты, мл.
Для титрования использовалась установка, изображенная на рисунке.
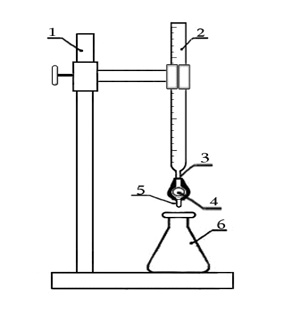
Установка для титрований: 1 – штатив; 2 – бюретка; 3 – резиновая трубка; 4 – олива; 5 – носик бюретки; 6 – колба
Провели 10 параллельных опытов. Результаты титрований занесены в табл. 1.
Таблица 1
Результаты титрования раствора гидроксида натрия
|
№ |
Объём пробы раствора щёлочи V(NaOH), мл |
Объём раствора кислоты V(H2SO4), мл |
Молярная концентрация эквивалента щёлочи Сн (NaOH), моль/л |
Среднее значение молярной концентрации эквивалента NaOH в анализируемом растворе, моль/л |
|
1 |
25 |
19,78 |
0,07912 |
0,79256 |
|
2 |
25 |
19,88 |
0,07952 |
|
|
3 |
25 |
19,77 |
0,07908 |
|
|
4 |
25 |
19,81 |
0,07924 |
|
|
5 |
25 |
19,83 |
0,07932 |
|
|
6 |
25 |
19,88 |
0,07952 |
|
|
7 |
25 |
19,79 |
0,07916 |
|
|
8 |
25 |
19,80 |
0,0792 |
|
|
9 |
25 |
19,76 |
0,07904 |
|
|
10 |
25 |
19,84 |
0,07936 |
Провели статистическую обработку результатов (табл. 2), определив значение выборочной дисперсии , среднеквадратичную ошибку (стандартное отклонение)
и доверительный интервал в виде
.
Таблица 2
Результаты статистической обработки экспериментальных данных титрования раствора гидроксида натрия. Доверительная вероятность a=0,95.
|
n |
|
|
Sx |
|
|
10 |
0,079256 |
0,0000025 |
0,00158 |
0,002 |
Доверительный интервал является достаточно узким, что показывают результаты статистической обработки. Доверительный интервал определен как
Сн(NaOH) = (0,079±0,002) моль/л; n=10; α=0,95.
В результате проведенных исследований можно сделать вывод, что замена мерной пипетки на более простой в работе мерный цилиндр является возможной.
Библиографическая ссылка
Правилова С.Д., Чаплинский Е.Ф., Иванова Т.А. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ЩЕЛОЧИ В ЛАБОРАТОРНОМ ПРАКТИКУМЕ ПО ХИМИИ // Современные наукоемкие технологии. – 2013. – № 9.
– С. 62-63;
URL: https://top-technologies.ru/ru/article/view?id=33203 (дата обращения: 25.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
1 Ответ
ответил
06 Март, 18
от
oli4ik33_zn
Специалист
(20.5k баллов)
NaOH <=> Na(+) + OH(-)
так как все 1:1, значит зная концетрацию ионов OH найдем молярную концентрацию раствора NaOH ( они одинаковые)
Так как у нас щелочь, то надо найти рОН
рН+рОН =14
значит рОН=14-8=6
рОН = -Lg[(OH-)] где [(OH-)] это концентрация ионов гидроксильной группы
6 = -Lg[(OH-)]
отсюда [(OH-)] = 1* 10 ⁻⁶ значит См(NaОН) = 1* 10 ⁻⁶ моль/л
Молярная и моляльная концентрации, несмотря на похожие названия, величины разные. Основное их отличие в том, что при определении моляльной концентрации расчёт производится не на объем раствора, как при выявлении молярности, а на массу растворителя.
Общие сведения о растворах и растворимости
Истинным раствором называется однородная система, которая включает в свой состав некоторое число компонентов, независимых друг от друга. Один из них считается растворителем, а остальные являются растворенными в нем веществами. Растворителем считается то вещество, которого в растворе больше всего.
Растворимость – способность вещества образовывать с другими веществами однородные системы – растворы, в которых оно находится в виде отдельных атомов, ионов, молекул или частиц. А концентрация – это мера растворимости.
Следовательно, растворимость является способностью веществ распределяться равномерно в виде элементарных частиц по всему объему растворителя.
Истинные растворы классифицируются следующим образом:
- по виду растворителя – неводные и водные;
- по виду растворенного вещества – растворы газов, кислот, щелочей, солей и т.д.;
- по взаимодействию с электрическим током – электролиты (вещества, которые обладают электропроводностью) и неэлектролиты (вещества, не способные к электропроводности);
- по концентрации – разбавленные и концентрированные.
Концентрация и способы ее выражения
Концентрацией называют содержание (весовое) вещества, растворенного в определенном количестве (весовом или объемном) растворителя или же в определенном объеме всего раствора. Она бывает следующих видов:
1. Концентрация процентная (выражается в %) – она говорит о том, сколько содержится граммов растворенного вещества в 100 граммах раствора.
2. Концентрация молярная – это число грамм-молей, приходящихся на 1 литр раствора. Показывает, сколько содержится грамм-молекул в 1 литре раствора вещества.
3. Концентрация нормальная – это число грамм-эквивалентов, приходящихся на 1 литр раствора. Показывает, сколько содержится грамм-эквивалентов растворенного вещества в 1 литре раствора.
4. Концентрация моляльная показывает, сколько растворенного вещества в молях приходится на 1 килограмм растворителя.
5. Титр определяет содержание (в граммах) вещества, которое растворено в 1 миллилитре раствора.
Молярная и моляльная концентрация отличаются друг от друга. Рассмотрим их индивидуальные особенности.
Молярная концентрация
Формула для ее определения:
Cv=(v/V), где
v – количество вещества растворенного, моль;
V – общий объем раствора, литр или м3.
Например, запись «0,1 М раствор Н2SO4″ говорит о том, что в 1 литре такого раствора присутствует 0,1 моль (9,8 граммов) серной кислоты.
Моляльная концентрация
Всегда следует принимать во внимание то, что моляльная и молярная концентрации имеют абсолютно разное значение.
Что же такое моляльная концентрация раствора? Формула для ее определения такова:
Cm=(v/m), где
v – количество вещества растворенного, моль;
m – масса растворителя, кг.
Например, запись 0,2 M раствор NaOH означает, что в 1 килограмме воды (в данном случае она является растворителем) растворено 0,2 моля NaOH.
Дополнительные формулы, необходимые для расчетов
Много вспомогательных сведений может потребоваться для того, чтобы была рассчитана моляльная концентрация. Формулы, которые могут пригодиться для решения основных задач, представлены ниже.
Под количеством вещества ν понимают определенное число атомов, электронов, молекул, ионов или других его частиц.
v=m/M=N/NA=V/Vm, где:
- m – масса соединения, г или кг;
- M – масса молярная, г (или кг)/моль;
- N – число структурных единиц;
- NA – число структурных единиц в 1 моле вещества, постоянная Авогадро: 6,02 . 1023 моль— 1;
- V – общий объем, л или м3;
- Vm – объем молярный, л/моль или м3/моль.
Последний вычисляется по формуле:
Vm=RT/P, где
- R – постоянная, 8,314 Дж/(моль . К);
- T – температура газа, К;
- P – давление газа, Па.
Примеры задач на молярность и моляльность. Задача №1
Определить молярную концентрацию калия гидроксида в растворе объемом 500 мл. Масса КОН в растворе равна 20 грамм.
Определение
Молярная масса калия гидроксида равна:
МКОН = 39 + 16 + 1 = 56 г/моль.
Рассчитываем, сколько гидроксида калия содержится в растворе:
ν(КОН) = m/M = 20/56 = 0,36 моль.
Учитываем, что объем раствора должен быть выражен в литрах:
500 мл = 500/1000 = 0,5 литра.
Определяем молярную концентрацию калия гидроксида:
Cv(KOH) = v(KOH)/V(KOH) = 0,36/0,5 = 0,72 моль/литр.
Задача №2
Сколько окисла серы (IV) при нормальных условиях (т.е. когда Р = 101325 Па, а Т = 273 К) нужно взять для того, чтобы приготовить раствор сернистой кислоты с концентрацией 2,5 моль/литр объемом 5 литров?
Определение
Определим, сколько сернистой кислоты содержится в растворе:
ν(H2SO3) = Cv(H2SO3)∙ V(раствора) = 2,5 ∙ 5 = 12,5 моль.
Уравнение получения сернистой кислоты имеет следующий вид:
SO2 + H2O = H2SO3
Согласно этому:
ν(SO2) = ν(H2SO3);
ν(SO2) = 12,5 моль.
Помня о том, что при нормальных условиях 1 моль газа имеет объем 22,4 литра, рассчитываем объем окисла серы:
V(SO2) = ν(SO2) ∙ 22,4 = 12,5 ∙ 22,4 = 280 литров.
Задача №3
Определить молярную концентрацию NaOH в растворе при его массовой доле, равной 25,5%, и плотности 1,25 г/мл.
Определение
Принимаем в качестве образца раствор объемом в 1 литр и определяем его массу:
m (раствора) = V (раствора) ∙ р (раствора) = 1000 ∙ 1,25 = 1250 грамм.
Рассчитываем, сколько в образце щелочи по массе:
m (NaOH) = (w ∙ m (раствора))/100% = (25,5 ∙ 1250)/100 = 319 грамм.
Молярная масса гидроксида натрия равна:
МNaOH = 23 + 16 + 1 = 40 г/моль.
Рассчитываем, сколько гидроксида натрия содержится в образце:
v(NaOH) = m /M = 319/40 = 8 моль.
Определяем молярную концентрацию щелочи:
Cv(NaOH)=v/V = 8/1 = 8 моль/литр.
Задача №4
В воде (100 граммах) растворили 10 грамм соли NaCl. Установить концентрацию раствора (моляльную).
Определение
Молярная масса NaCl равна:
МNaCl = 23 + 35 = 58 г/моль.
Количество NaCl, содержащееся в растворе:
ν(NaCl) = m/M = 10/58 = 0,17 моль.
В данном случае растворителем является вода:
100 грамм воды = 100/1000 = 0,1 кг Н2О в этом растворе.
Моляльная концентрация раствора будет равна:
Cm(NaCl) = v(NaCl)/m(воды) = 0,17/0,1 = 1,7 моль/кг.
Задача №5
Определить моляльную концентрацию 15%-ного раствора щелочи NaOH.
Определение
15%-ный раствор щелочи означает, что в каждых 100 граммах раствора содержится 15 грамм NaOH и 85 грамм воды. Или что в каждых 100 килограммах раствора имеется 15 килограмм NaOH и 85 килограмм воды. Для того чтобы его приготовить, необходимо в 85 граммах (килограммах) Н2О растворить 15 грамм (килограмм) щелочи.
Молярная масса гидроксида натрия равна:
МNaOH = 23 + 16 + 1 = 40 г/моль.
Теперь находим количество гидроксида натрия в растворе:
ν=m/M=15/40=0,375 моль.
Масса растворителя (воды) в килограммах:
85 грамм Н2О = 85/1000 = 0,085 кг Н2О в этом растворе.
После этого определяется моляльная концентрация:
Cm=(ν/m)=0,375/0,085=4,41 моль/кг.
В соответствии с этими типовыми задачами можно решить и большинство других на определение моляльности и молярности.







