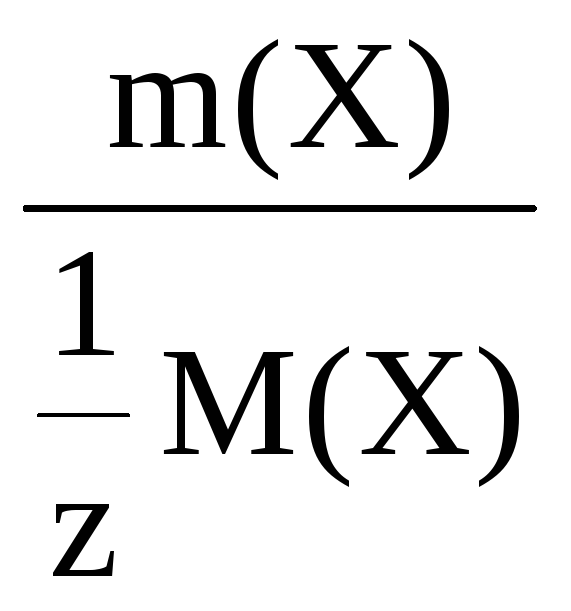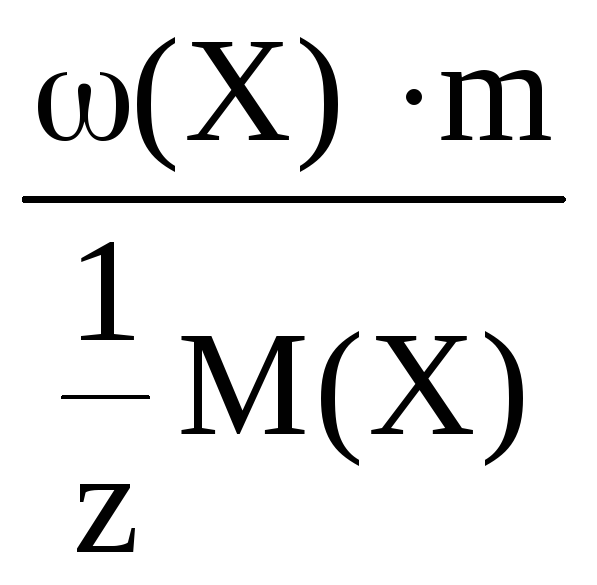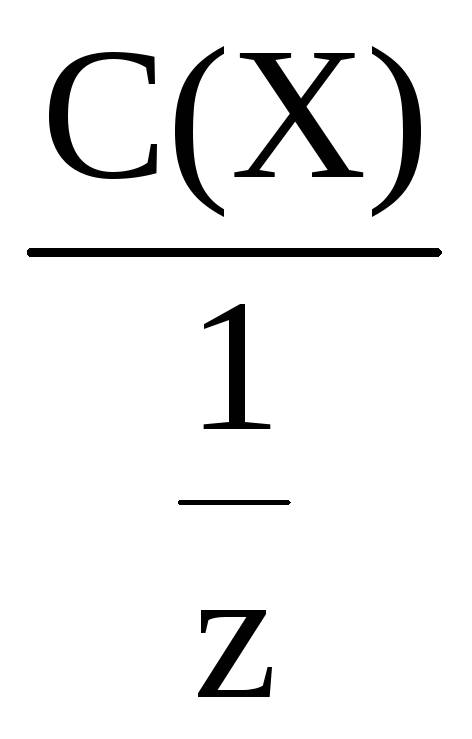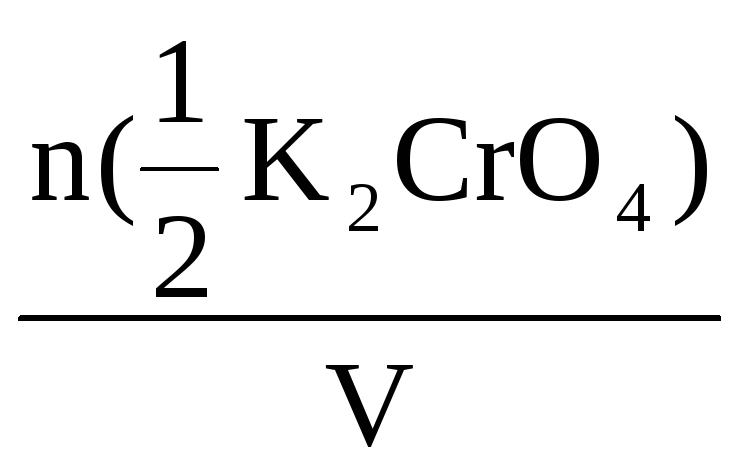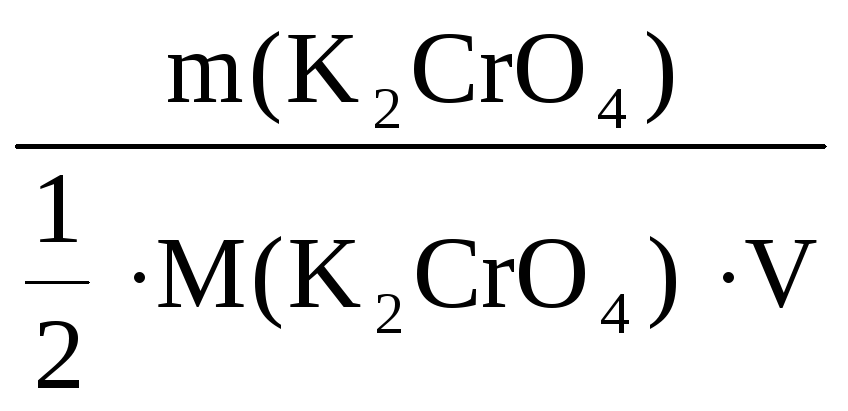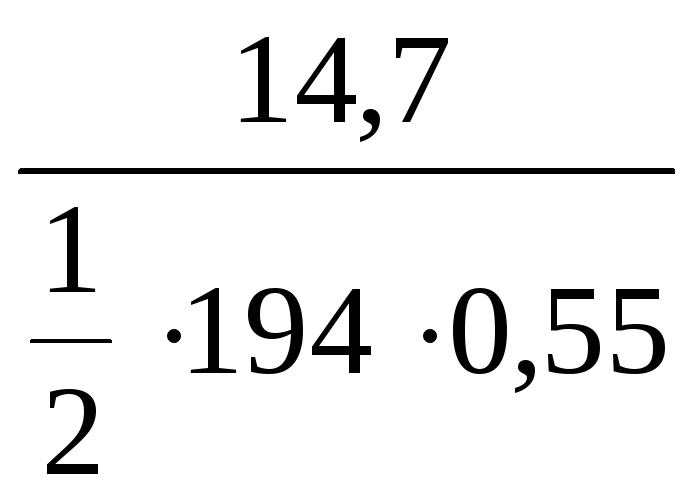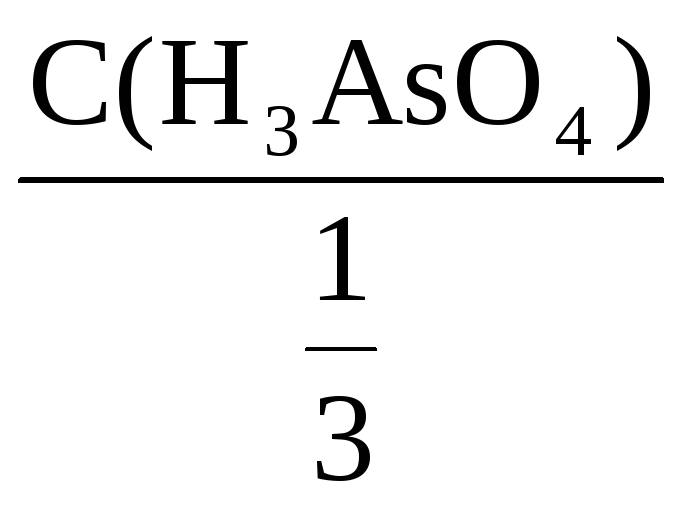Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
ν(HNO3) = m/M(HNO3) = 6,3 г/ 63 г/моль = 0,1 моль
С(HNO3) = ν(HNO3)/Vр-ра = 0,1 моль/ 0,5 л = 0,2 моль/л
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
From Wikipedia, the free encyclopedia
«Molarity» redirects here. Not to be confused with Molality or Morality.
| Molar concentration | |
|---|---|
|
Common symbols |
c |
| SI unit | mol/m3 |
|
Other units |
mol/L |
|
Derivations from |
c = n/V |
| Dimension |  |
Molar concentration (also called molarity, amount concentration or substance concentration) is a measure of the concentration of a chemical species, in particular of a solute in a solution, in terms of amount of substance per unit volume of solution. In chemistry, the most commonly used unit for molarity is the number of moles per liter, having the unit symbol mol/L or mol/dm3 in SI unit. A solution with a concentration of 1 mol/L is said to be 1 molar, commonly designated as 1 M.
Definition[edit]
Molar concentration or molarity is most commonly expressed in units of moles of solute per litre of solution.[1] For use in broader applications, it is defined as amount of substance of solute per unit volume of solution, or per unit volume available to the species, represented by lowercase 
Here, 





In thermodynamics the use of molar concentration is often not convenient because the volume of most solutions slightly depends on temperature due to thermal expansion. This problem is usually resolved by introducing temperature correction factors, or by using a temperature-independent measure of concentration such as molality.[3]
The reciprocal quantity represents the dilution (volume) which can appear in Ostwald’s law of dilution.
- Formality or analytical concentration
If a molecular entity dissociates in solution, the concentration refers to the original chemical formula in solution, the molar concentration is sometimes called formal concentration or formality (FA) or analytical concentration (cA). For example, if a sodium carbonate solution (Na2CO3) has a formal concentration of c(Na2CO3) = 1 mol/L, the molar concentrations are c(Na+) = 2 mol/L and c(CO2−3) = 1 mol/L because the salt dissociates into these ions.[4]
Units[edit]
In the International System of Units (SI) the coherent unit for molar concentration is mol/m3. However, this is inconvenient for most laboratory purposes and most chemical literature traditionally uses mol/dm3, which is the same as mol/L. This traditional unit is often called a molar and denoted by the letter M, for example:
- mol/m3 = 10−3 mol/dm3 = 10−3 mol/L = 10−3 M = 1 mM = 1 mmol/L.
To avoid confusion with SI prefix mega, which has the same abbreviation, small caps ᴍ or italicized M are also used in journals and textbooks.[5]
Sub-multiples such as millimolar consist of the unit preceded by an SI prefix:
| Name | Abbreviation | Concentration | |
|---|---|---|---|
| (mol/L) | (mol/m3) | ||
| millimolar | mM | 10−3 | 100=1 |
| micromolar | μM | 10−6 | 10−3 |
| nanomolar | nM | 10−9 | 10−6 |
| picomolar | pM | 10−12 | 10−9 |
| femtomolar | fM | 10−15 | 10−12 |
| attomolar | aM | 10−18 | 10−15 |
| zeptomolar | zM | 10−21 | 10−18 |
| yoctomolar | yM | 10−24 (6 particles per 10 L) |
10−21 |
| rontomolar | rM | 10−27 | 10−24 |
| quectomolar | qM | 10−30 | 10−27 |
[edit]
Number concentration[edit]
The conversion to number concentration 
where 
Mass concentration[edit]
The conversion to mass concentration 
where 

Mole fraction[edit]
The conversion to mole fraction 
where 

A simpler relation can be obtained by considering the total molar concentration, namely, the sum of molar concentrations of all the components of the mixture:
Mass fraction[edit]
The conversion to mass fraction 
Molality[edit]
For binary mixtures, the conversion to molality 
where the solvent is substance 1, and the solute is substance 2.
For solutions with more than one solute, the conversion is
Properties[edit]
Sum of molar concentrations – normalizing relations[edit]
The sum of molar concentrations gives the total molar concentration, namely the density of the mixture divided by the molar mass of the mixture or by another name the reciprocal of the molar volume of the mixture. In an ionic solution, ionic strength is proportional to the sum of the molar concentration of salts.
Sum of products of molar concentrations and partial molar volumes[edit]
The sum of products between these quantities equals one:
Dependence on volume[edit]
The molar concentration depends on the variation of the volume of the solution due mainly to thermal expansion. On small intervals of temperature, the dependence is
where 

Examples[edit]
- 11.6 g of NaCl is dissolved in 100 g of water. The final mass concentration ρ(NaCl) is
- ρ(NaCl) = 11.6 g/11.6 g + 100 g = 0.104 g/g = 10.4 %.
The volume of such a solution is 104.3mL (volume is directly observable); its density is calculated to be 1.07 (111.6g/104.3mL)
The molar concentration of NaCl in the solution is therefore
- c(NaCl) = 11.6 g/58 g/mol / 104.3 mL = 0.00192 mol/mL = 1.92 mol/L.
Here, 58 g/mol is the molar mass of NaCl.
- A typical task in chemistry is the preparation of 100 mL (= 0.1 L) of a 2 mol/L solution of NaCl in water. The mass of salt needed is
- m(NaCl) = 2 mol/L × 0.1 L × 58 g/mol = 11.6 g.
To create the solution, 11.6 g NaCl is placed in a volumetric flask, dissolved in some water, then followed by the addition of more water until the total volume reaches 100 mL.
- The density of water is approximately 1000 g/L and its molar mass is 18.02 g/mol (or 1/18.02 = 0.055 mol/g). Therefore, the molar concentration of water is
- c(H2O) = 1000 g/L/18.02 g/mol ≈ 55.5 mol/L.
Likewise, the concentration of solid hydrogen (molar mass = 2.02 g/mol) is
- c(H2) = 88 g/L/2.02 g/mol = 43.7 mol/L.
The concentration of pure osmium tetroxide (molar mass = 254.23 g/mol) is
- c(OsO4) = 5.1 kg/L/254.23 g/mol = 20.1 mol/L.
- A typical protein in bacteria, such as E. coli, may have about 60 copies, and the volume of a bacterium is about 10−15 L. Thus, the number concentration C is
- C = 60 / (10−15 L) = 6×1016 L−1.
The molar concentration is
- c = C/NA = 6×1016 L−1/6×1023 mol−1 = 10−7 mol/L = 100 nmol/L.
- Reference ranges for blood tests, sorted by molar concentration:
See also[edit]
- Molality
- Orders of magnitude (molar concentration)
References[edit]
- ^ Tro, Nivaldo J. (6 January 2014). Introductory chemistry essentials (Fifth ed.). Boston. p. 457. ISBN 9780321919052. OCLC 857356651.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «amount concentration, c«. doi:10.1351/goldbook.A00295
- ^ a b Kaufman, Myron (2002). Principles of thermodynamics. CRC Press. p. 213. ISBN 0-8247-0692-7.
- ^ Harvey, David (2020-06-15). «2.2: Concentration». Chemistry LibreTexts. Retrieved 2021-12-15.
- ^ «Typography of unit symbols for Molar and Liter in siunitx». TeX — LaTeX Stack Exchange.
External links[edit]
- Molar Solution Concentration Calculator
- Experiment to determine the molar concentration of vinegar by titration
Молярная концентрация (молярность)
– это количество моль вещества,
содержащееся в 1 литре раствора.
С(Х) =
,
моль/л
где Х – количество вещества, моль;
V – объем раствора, л.
Объем раствора связан с массой раствора
следующим образом:
V =
,
мл,
где ρ – плотность раствора, г/мл.
Молярная концентрация эквивалента
– это количество моль вещества
эквивалента, содержащееся в 1 литре
раствора.
С(Х)
=
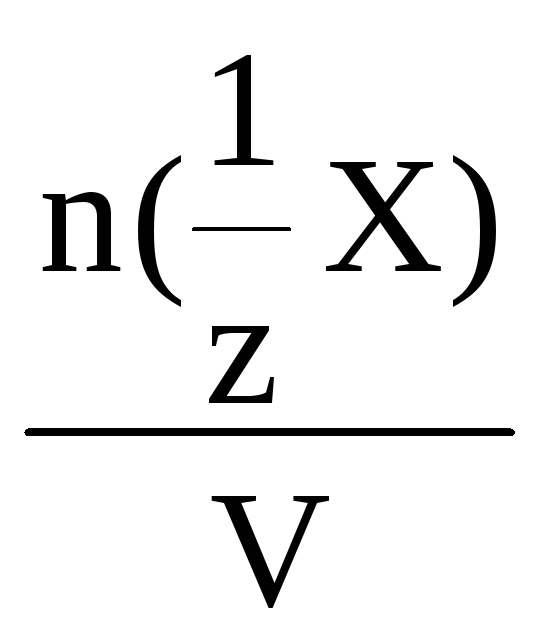
моль/л
где n(Х)
– количество вещества эквивалента,
моль;
V – объем раствора, л.
n(Х)
=
=
где m(X) –
молярная масса растворенного вещества;
m(X) – масса растворенного вещества;
m – масса раствора;
ω(Х) – массовая доля раствора.
Молярная концентрация эквивалента
всегда больше или равна молярной
концентрации. Это положение используется
при проверке полученных данных.
С(Х)
=
Молярную концентрацию эквивалента
часто называют нормальной и обозначают
1,0
н.; 0,5 н. и т.д.
Приведенные выше расчетные формулы
позволяют определять объем раствора,
количество вещества и количество
вещества эквивалента:
V =
или V
=
n(X) = C(X)·V или n(X)
= C(X)·V
2. 1. Определение молярной концентрации вещества с(х) по массе вещества и массы вещества по заданной молярной концентрации
Пример 1. Рассчитать молярную
концентрацию и молярную концентрацию
эквивалента K2CrO4, если в 0,55
л раствора растворено 14,7 г вещества
(реакции обменные).
Решение:
С(K2CrO4) =
=
=
= 0,14 моль/л
Далее определяем фактор эквивалентности
K2CrO4, он равен
.
С(K2CrO4)
=
=
=
= 0,28 моль/л
или С(K2CrO4)
= z·С(K2CrO4) = 0,14·2 = 0,28 моль/л.
Ответ: С(K2CrO4) = 0,14 моль/л;
С(K2CrO4)
= 0,28 моль/л
Пример 2. Определить массу вещества,
содержащегося в 200 мл раствора нитрата
никеля с молярной концентрацией
С(Ni(NO3)2) = 0,125 моль/л.
Решение:
m(Ni(NO3)2) = n(Ni(NO3)2)·m(Ni(NO3)2)
Объем раствора необходимо перевести в
литры: 200 мл = 0,2 л.
n(Ni(NO3)2) = C(Ni(NO3)2)·V
= 0,125·0,2 = 0,025 моль
m(Ni(NO3)2) = 0,025·183 = 4,575 г
Ответ: m(Ni(NO3)2) = 4,575 г.
Пример 3. Рассчитать молярную
концентрацию эквивалента в растворе
HCl. ω(HCl) = 25%, ρ = 1,15 г/мл.
Решение:
С(HCl) =
=
m(HCl) = ω(HCl)·m(р-ра) = ω(HCl)·V(р-ра) ρ
Если объем раствора не задан, то удобно
принимать его равным 1 л (1000 мл).
m(HCl) = 0,25·1000·1,15 = 287,5 г
С(HCl) =
= 7,877 моль/л
Фактор эквивалентности HCl = 1, поэтому
молярная концентрация и молярная
концентрация эквивалента равны.
Ответ: молярная концентрация
эквивалента С(HCl) = 7,877 моль/л.
Пример 4. В 0,6 л воды растворили
100 л бромоводорода. Рассчитать С(HBr) в
растворе, если ρ = 1,15 г/мл.
Решение:
С(HBr) =
Рассчитываем количество вещества
бромоводорода:
n(HBr) =
=
=
4,464 моль
Рассчитываем объем раствора:
V =
=
=
V =
= 836 мл = 0,836 л
Находим молярную концентрацию раствора
HBr:
С(HBr) =
= 5,34 моль/л
Ответ: С(HBr) = 5,34 моль/л
Пример 5. Рассчитать молярную и
молярную концентрацию эквивалента
раствора мышьяковой кислоты (H3AsO4).
Плотность раствора 1,08 г/мл, массовая
доля H3AsO4 9%.
Решение:
Фактор эквивалентности H3AsO4
=
С(H3AsO4) =
С(
H3AsO4)
=
= 3С(H3AsO4)
Объем раствора принимаем равным 1 л =
1000 мл.
m(H3AsO4) = V·ρ·ω(H3AsO4)
= 1000·1,08·0,09 = 97,2 г
n(H3AsO4) =
=
= 0,68 моль
С(H3AsO4) =
= 0,68 моль/л; С(H3AsO4)
= 3·0,68 = 2,04 моль/л
Ответ: С(H3AsO4) = 0,68 моль/л,
С(H3AsO4)
= 2,04 моль/л
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% — 21% — 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Для характеристики количественного состава раствора используется молярная концентрация растворённого вещества.
Молярная концентрация — это отношение количества растворённого вещества к объёму раствора:
c(в−ва)=n(в−ва)V(р−ра).
В этой формуле:
(c(в-ва)) — молярная концентрация растворённого вещества;
(n(в-ва)) — количество растворённого вещества;
(V(р-ра)) — объём раствора.
Объём раствора можно вычислить по его плотности и массе:
Молярная концентрация обычно выражается в моль/л, моль/дм³ или обозначается буквой (M). Пример:
1)c=1,5моль/л=1,5моль/дм³;2)c=1,5M.
Могут использоваться также такие единицы измерения, как ммоль/л, моль/м³ и др.
По известной молярной концентрации можно вычислить объём раствора и количество растворённого вещества:
V(р−ра)=n(в−ва)c(в−ва);
n(в−ва)=c(в−ва)⋅V(р−ра).
Если выразить количество вещества через массу и молярную массу, то формула для молярной концентрации будет выглядеть так:
c(в−ва)=m(в−ва)M(в−ва)⋅V(р−ра).