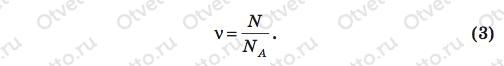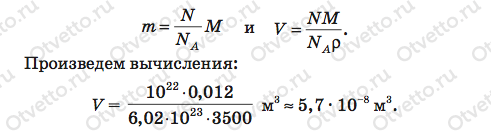Доброго времени суток, дорогие читатели. Для каждого из нас известно, что рассматриваемый драгоценный камень является углеродом, вернее его аллотропной модификацией. И в сегодняшней статье мы рассмотрим, какой же молярной массой обладает этот ценный природный минерал.
Помимо этого ценного минерала, углерод способен также существовать в виде множества других веществ и состояний. К этому относится сажа, фуллерен, карбин, кокс, конечно же графит и некоторые другие вещества. К тому же надо отметить, что графит принадлежит к гексагональной системе. Кристаллизация же алмаза возможна в гексагональной и кубической системах, что обусловлено природой его происхождения.
Браслет из серебра с бриллиантом
Строение углеродного атома вы можете наблюдать на изображении ниже:
Золотая подвеска с бриллиантом
Немного теории
Удивительным свойством алмаза является то, что у него нет газообразной формы. В газ он может превратиться только под воздействием суровых действий окружающей среды (например, 2000 градусов по Цельсию). При этом образуется углекислый газ, не являющийся формой алмаза.
По этой причине формула Менделеева-Клапейрона (или уравнение состояния идеального газа) в отношении алмаза не действует.
Подставка-органайзер для хранения украшений
Основные теоретические сведения:
- Молярная масса M – масса, каковую имеет один моль любого природного вещества. Грамм и килограмм на моль (г/моль или кг/моль) – единица измерения этой самой молярной массы.
- Относительная молекулярная масса Mr – молярная масса любого природного соединения, в отнесении к 1/12 массы молярной атома углерода-12 (12 С). Величина эта является безразмерной.
- Относительная атомная масса Ar – молярная масса атома вещества, в отнесении к 1/12 массы молярной атома углерода-12 (12 С).
- Относительная атомная масса алмаза приравнена к 12,0116 а.е.м. А вот его относительная молекулярная масса при этом будет равна 12,0116. Что же с молярной массой? M(С) = Mr (С) × 1 моль = 12,0116 г/моль.
Серьги-пусеты из серебра с бриллиантами
Примеры задач
Для большего понимания данного определения и его использования на практике, мы предлагаем вам посмотреть решения нескольких задач, подробнее о которых вы можете прочитать здесь.
Решение задачи 1. В ней вам предстоит выяснить, какой же молярной массой обладает оставшаяся масса оксида магния?
Кольцо из белого золота c бриллиантами и топазами
брошь с камнями
Во второй задаче вы узнаете о массе воды, полученной из кислорода.
бусы с камнями
Спасибо за то, что были с нами. Заходите в гости почаще и делитесь интересным материалом в социальных сетях. До новых встреч на страницах ЛюбиКамни!
Шкатулка для ювелирных украшений многоярусная
Команда ЛюбиКамни
Как вам статья?
Задача: Плотность алмаза 3500 кг/м3. Какой объем займут 1022 атомов этого вещества?
Пояснение: Обозначим ρ плотность алмаза, N — число молекул, ν — количество молей (количество вещества) алмаза в объеме V, m — масса алмаза, М — молярная масса алмаза, NA — число Авогадро.
Указание: алмаз состоит из атомов углерода, поэтому его молярная масса 0,012 кг/моль.
Массу алмаза можно найти, умножив число молей в этой массе ν на массу каждого моля, т.е. на молярную массу алмаза М:
m = ν · M. (2)
Число молей ν определим, разделив все число молекул N на число молекул в каждом моле, т.е. на число Авогадро NA:
Нам осталось подставить правую часть равенства (3) вместо ν в (2), а то, что получится после этой подстановки, — вместо массы m в формулу (1). Проделаем эти действия:
Ответ: V = 5,7 · 10–8 м3.
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
алмаз
Внешний вид:
бесцветн. кубические кристаллы
Брутто-формула (система Хилла): C
Формула в виде текста: C
Молекулярная масса (в а.е.м.): 12,01
Температура плавления (в °C): 3500
Температура разложения (в °C): 1000
Плотность:
3,515 (20°C, г/см3)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
1,828 (т)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
2,833 (т)
Стандартная энтропия образования S (298 К, Дж/моль·K):
2,368 (т)
Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
6,117 (т)
Дополнительная информация:
По физическим признакам могут быть подразделены: непрозрачные в диапазонах 7-8 мкм и 225-300 нм — тип I, прозрачные в этих областях — тип II; среди типа II обнаружены алмазы с сопротивлением 150 Ом.см (тип IIb), остальные, диэлектрики (тип IIa); тип I содержащий парамагнитный азот назван тип Ib, без него — тип Ia. Основная часть всех алмазов относится к типу Ia. Алмаз обладает голубой и зеленой люминисценцией.
Твердость по минералогической шкале = 10.
Не реагирует с кислотами и щелочами.
- «Химическая энциклопедия» т.5 М.: Советская энциклопедия, 1999 стр. 25-26
- Девяткин В.В., Ляхова Ю.М. «Химия для любознательных, или о чем не узнаешь на уроке» Ярославль:Академия Холдинг, 2000 стр. 48
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 105
- Чукова Ю.П. «Тайны алмаза» М.:Знание 1988 стр. 6-7, 18
Источники информации:
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- АЛМАЗ — химическая энциклопедия
Кусочек алмаза состоит из 10^22 атомов углерода: чему равна молярная масса вещества? Определите количество вещества, содержащегося в этом теле; найдите массу тела; какой обьем
Кусочек алмаза состоит из 10^22 атомов углерода: чему равна молярная масса вещества? Определите количество вещества, содержащегося в этом теле; найдите массу тела; какой обьем займут эти атомы, если плотность алмаза равна 3500 кг/м^3
Молярная масса углерода (M=12,0116;text{г/моль})
Молярная масса=массе одного вещества в количестве 1 моль. 1 моль любого вещества содержит количество молекул, равное числу Авогадро (N_A=6,02*10^{23})
Тогда искомое количество вещества:
(nu=frac{N}{N_A}=frac{10^{22}}{6,02*10^{23}}approx 0,0166;text{моль})
Масса: (m=nu*M=0,0166*12,0116approx 199;text{г}) (mapprox 0,2;text{кг})
Объем: (V=frac{m}{rho}=frac{0,2}{3500}approx 57*10^{-6};text{м}^3)
Невероятно дорогой минерал алмаз, что превращается в удивительно сверкающие бриллианты при огранке, обладает особыми физическими и химическими свойствами. Ученые долго разгадывали его формулу, а затем и вовсе научились получать камни синтетическим путем.
Физико-механические свойства алмаза
Алмаз – не что иное, как одна из разновидностей углерода, только самая красивая и самая дорогая. В естественных условиях он отличается невероятной стабильностью, в нем не происходит никаких изменений столетиями и тысячелетиями. Зато, если поместить алмаз в среду инертных газов, создать условия вакуума, то он превратится в графит – другую форму углерода. Этот бесцветный минерал – эталон твердости по шкале Мооса. Если сравнивать с кварцем, то плотность алмаза выше в тысячу раз и в 150 раз от корунда. Алмаз невозможно поцарапать каким-либо веществом, кроме другого алмаза. Минералу не страшны даже кислоты, способные растворять металлы.
В расплавленных щелочах алмаз начинает постепенно растворяться.
Формула и структура минерала
С точки зрения химии, формула алмаза помещается в одну букву С, обозначающую углерод. Он обладает кристаллической решеткой, причем, гранецентрированной кубической. Атомы молекул углерода связаны между собой очень прочно, поэтому минерал обладает такой твердостью. Однако при этом он хрупкий, разрушение (раскалывание) будет идти только по определенным плоскостям. Каждый из углеродных атомов занимает ровно середину тетраэдра, в вершинах которого располагается ближайшая четверка атомов. Именно строго упорядоченная структура обеспечивает самоцвету уникальные свойства. Атомное расстояние имеет одинаковую периодичность, оно равняется 0,15 нм.
В свое время алмаз считали не чем иным, как кварцем. Только в XVIII веке Лавуазье, сжигая камень, обнаружил, что тот выделяет оксид углерода. В начале XIX века ученые окончательно определили, что алмаз, уголь и графит – химически одно и то же. Сажа и графен – также ближайшие родственники алмаза. Молярная масса алмаза – 12,01. Вместе с графитом алмаз – лидеры по показателю теплопроводности, у алмаза она даже выше – до 2300 Вт/(м⋅К). За счет того, что на гранях формируются специфические пленки адсорбированных газообразных веществ, у минерала невероятно низкий коэффициент трения по металлу (в условиях воздуха) – только 0,1.
Окраска
Большинство добываемых алмазов – полностью прозрачные и совершенно бесцветные камни. Однако они могут светиться под воздействием рентгеновских, ультрафиолетовых, катодных лучей голубоватым, синим или зеленым цветом. Минерал отличается сильным блеском. Это обеспечивает дисперсия вместе с высоким показателем преломления и прозрачностью минерала.
Также в природе встречаются цветные алмазы, что бывает очень редко. Причем камень не обязательно должен быть окрашен полностью, он может быть пятнистым, иметь цветными отдельные участки.
Наиболее распространенные оттенки – коричневый и желтый, что возникает из-за дефектов в структуре минерала. Цветные камни – редкое явление, особенно если они крупные. Так, желтый алмаз под названием «Тиффани» имел вес в 57 г (равный 287 каратам), а уникальный бриллиант зеленого цвета «Дрезденский» весил 8,2 г (41 карат). Такой необычный цвет камня обусловлен его естественной радиоактивностью. Еще реже находят красные, синие или розовые алмазы.
Встречаются даже черные алмазы, именуемые карбонадо. Некоторые ученые считают, что они образовались на Земле, другие считают их пришельцами из Космоса.
Гигантский черный алмаз весом более 3 тысяч карат был обнаружен на территории Бразилии.
Вес и масса алмаза
Стандартная единица для массы – это грамм, но для алмазов, а также полученных из них бриллиантов применяют другую единицу обозначения – карат. Один карат составляет 0,2 г. Такая единица измерения массы камня была окончательно принята в мире в 1907 году.
Чем объемнее минерал, тем в разы возрастает его цена. Большинство добываемых камней довольно мелкие, порядка 0,1 карата. Алмазы крупнее 5 карат встречаются очень редко, а более 15 карат – историческое событие. Рекордсменом по весу в алмазном мире считается «Звезда Африки» или «Куллинан». Вес минерала составил практически 3107 карат (относительно граммам – это 621 г). Этот рекорд, установленный в 1905 году, побить так и не удалось. Из-за природных появлений трещин огранить этот гигант в один бриллиант было нельзя, поэтому его раскололи.
Наличие трещин – это знак, который указывает на низкое качество самоцвета.
Синтезированные алмазы
Алмаз представляет большую ценность как режущий и абразивный элемент ввиду своей исключительной твердости. Но для этих целей природные камни слишком дорогие. Поэтому еще в XVII веке ученые экспериментировали с минералом, пытались сделать из мелких камней один крупный, исследовали химическую формулу алмаза. Первые экземпляры стали получать синтетическим путем в 1953-1954 годах, а массовое производство искусственных камней стартовало с 1963 года. При помощи специального «алмазного щупа» – прибора, что замеряет теплопроводность камня, искусственный минерал можно однозначно отличить от природного самоцвета.
Чтобы получить алмаз, как сырье обычно используют графит.
Существуют три технологии получения искусственных минералов:
- Методом взрыва. За счет ударной волны, что формируется в замкнутом металлическом контейнере (трубке), получается высокая температура и давление, графит трансформируется в алмаз.
- Химический способ. В этом случае происходит осаждение графита в виде алмазов за счет того, что процесс происходит в среде метана. Этот метод также называют CVD.
- При методе HPTH создают условия, близкие к природным, в которых формируются кристаллы алмаза. Два самых важных фактора для этого – высокое давление и температура. В роли центра кристаллизации используют мельчайшие алмазы, полученные другими технологиями, которые вырастают в более крупные камни.
Искусственные алмазы для изготовления ювелирных украшений не используют, хотя они полностью повторяют химический состав природных камней.
Примеси в составе алмаза
Синтетические минералы находят применение в ядерной промышленности, для изготовления часовых механизмов и компьютерной техники. Для некоторых случаев требуются особые свойства алмаза. Их можно придать камню, если вводить определенные добавки (примеси). Это может быть бор или фосфор.
Алмаз в таблице Менделеева является углеродом.
Даже натуральные алмазы включают микроколичества алюминия, кремния, азота, бора, кальция или магния. Также в роли примесей встречается титан, марганец или железо, которое обеспечивает желтоватый отлив окрашенных алмазов. За счет присутствия примеси бора камень приобретает голубой тон. Основная «добавка» в составе природных камней – это азот. Для ювелирных целей используют лишь те самоцветы, которые состоят не более чем из 5% примесей, причем, на долю одного вещества не должно выпадать более 2%. Если количество посторонних соединений, кроме углерода, выше, то из драгоценного камня он сразу переходит в технический. Преобразить промышленный алмаз можно с помощью молекулярного преобразователя.
Драгоценные камни всегда были востребованы. Природные минералы пользуются популярностью среди ювелиров, а искусственно созданные «работают» во многих отраслях промышленности. У алмазов нет конкурентов по твердости и многим другим характеристикам. Это всего лишь углерод, но особой структуры.