← Молярная и молекулярная масса
- Относительная молекулярная масса Al: 26.9815386
- Молярная масса Al: 26.9815386 г/моль (0.02698 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Al (алюминий) | 1 | 26.9815386 | 26.9815386 |
| 26.9815386 |
Расчёт молярной и относительной молекулярной массы Al
- Mr[Al] = Ar[Al] = 26.9815386 = 26.9815386
- Молярная масса (в кг/моль) = Mr[Al] : 1000 = 26.9815386 : 1000 = 0.02698 кг/моль
Электронная конфигурация атома алюминия
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
CH2I2 [267.83552]
C11H10 [142.1971]
Калькулятор молекулярной массы


Ирина Морозли
Молярная концентрация вещества рассчитывается по формуле Cм=n/V(р-ра) , где V — объём раствора (в литрах) ,
а «n» — количество вещества (моль) .
В свою очередь, количество вещества легко рассчитать по формуле: n=m/M, где М — молярная масса сульфата алюминия Al2(SO4)3
Основные формулы молекулярной физики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
В кодификаторе ЕГЭ нет тем, непосредственно относящихся к содержанию данного листка. Однако без этого вводного материала дальнейшее изучение молекулярной физики невозможно.
Введём основные величины молекулярной физики и соотношения между ними.
— масса вещества,
— объём вещества,
— плотность вещества (масса единицы объёма). Отсюда
— число частиц вещества (атомов или молекул).
— масса частицы вещества. Тогда
— концентрация вещества (число частиц в единице объёма),
. Отсюда
Что получится, если умножить на
? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т. е. плотность. Формально:
Итак,
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка г, размер атома порядка
см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в граммах углерода. А в
граммах углерода содержится примерно
атомов. Стало быть, в одном моле вещества содержится
частиц. Это число называется постоянной Авогадро:
моль
.
Количество вещества обозначается . Это число молей данного вещества.
Что получится, если умножить на
? Число молей, умноженное на число частиц в моле, даст общее число частиц:
Масса одного моля вещества называется молярной массой этого вещества и обозначается (
= кг/моль). Ясно, что
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия
, поэтому молярная масса алюминия равна
г/моль или
кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна г/моль по определению. В то же время ядро атома углерода содержит
нуклонов. Выходит, что каждый нуклон вносит в молярную массу
г/моль. Поэтому молярная масса химического элемента с атомной массой
оказывается равной
г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа равна
г/моль
кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна г/моль, поскольку его молекула состоит из двух атомов
. То же касается часто встречающихся в задачах азота и кислорода
Вместе с тем, наиболее частый персонаж задач — гелий
— является одноатомным газом и имеет молярную массу
г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку 
Что получится, если умножить на
? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Основные формулы молекулярной физики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023

Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.

Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!

Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Молярная масса алюминия
Молярная масса алюминия
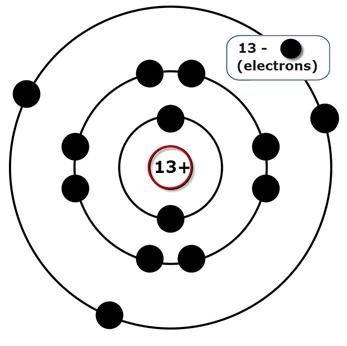
Порядковый номер – 13. Строение атома показано на рис. 1. Металл p-семейства.
Рис. 1. Схема строения атома алюминия.
В обычных условиях представляет собой вещество серебристо-белого цвета. Легко вытягивается в проволоку и прокатывается в тонкие листы. Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью. На воздухе быстро покрывается тонким слоем оксида.
Молярная масса алюминия равна 26,9815 г/моль. Эта величина представляет собой массу 1 моль алюминия и выражается в граммах на моль. Расчет молярной массы производят по формуле:
M = m / n.
Молярная масса вещества, выраженная в граммах, численно равна его молекулярной (атомной) массе, выраженной в атомных единицах массы:
M = Ar.
По причине того, что алюминий не может быть переведен в газообразное состояние, для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
МОУ
«Средняя общеобразовательная школа №5 г. Надыма»
Проект «Естественнонаучное непрерывное конвергентное
образование»
Шульгина
И.В., учитель физики
Лабораторная
работа
«ИЗМЕРЕНИЕ
МАССЫ АТОМА АЛЮМИНИЯ И КОЛИЧЕСТВА ВЕЩЕСТВА»
(Интегрированный
урок (физика, химия))
Межпредметная связь:
химия и физика.
Цели работы –
измерить:
— прямым способом —
массу алюминиевого бруска;
— косвенным способом
массу атома алюминия и количество вещества;
— закрепить понятия:
моль, количество вещества, молярная масса, относительная молекулярная (атомная)
масса и постоянная Авогадро.
Приборы и
материалы: весы с гирями, брусок (цилиндр) алюминиевый
размером 40х25х8мм, таблица Д.И. Менделеева.
Теоретическое обоснование работы
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц,
содержащихся в веществе. Под
структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в Международной
системе единиц (СИ) и в системе СГС — моль.
Эта физическая величина
используется для измерения макроскопических количеств веществ в тех случаях,
когда для численного описания изучаемых процессов необходимо принимать во
внимание микроскопическое строение вещества, например, в химии, при
изучении процессов электролиза, или
в термодинамике, при
описании уравнений состояния идеального газа.
При описании химических реакций,
количество вещества является более удобной величиной, чем масса, так
как молекулы взаимодействуют независимо от их массы в количествах, кратных целым
числам.
Например, для реакции
горения водорода (2H2 +
O2 → 2H2O) требуется в два раза большее количество
вещества водорода, чем кислорода. При
этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы
кислорода (так как атомная масса водорода
примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование
количества вещества облегчает интерпретацию уравнений реакций: соотношение
между количествами реагирующих веществ непосредственно отражается
коэффициентами в уравнениях.
Так как использовать в
расчётах непосредственно количество молекул неудобно, потому что это число в
реальных опытах слишком велико, вместо измерения количества молекул «в штуках»,
их измеряют в молях. Фактическое
количество единиц вещества в 1 моле называется числом Авогадро (NA =
6,022140857(74)·1023 моль−1).
Для вычисления
количества вещества на основании его массы пользуются
понятием молярная масса. Молярная масса — это масса, которая
приходится на один моль данного вещества. Молярная масса вещества может быть
получена произведением молекулярной массы этого
вещества на количество молекул в 1 моле — на число Авогадро.
Молярная масса (измеренная в г/моль) численно совпадает с относительной
молекулярной массой.
При нормальных условиях объём
одного моля идеального газа составляет
22,413 996(39) л. Значит, один моль кислорода
занимает объём 22,413 996(39) л (для простых расчётов 22,4 л) и имеет массу 32
г.
Порядок выполнения работы
1. Измерить массу
алюминиевого бруска с помощью весов m.
2. Из таблицы
«Периодическая система химических элементов Д.И. Менделеева» найти
относительную молекулярную (атомную) массу алюминия Мr.
3. Зная числовое
значение атомной единицы массы mос/12 = 1,995•10-26/12 кг
= 1,6625•1027 кг, вычисляют массу атома алюминия по формуле: mo=mос/12•Mr.
4. Вычислить
молярную массу алюминия по формуле: M = mo•Na.
5. Вычислить
количество вещества в алюминиевом бруске: n = mo/M.
Примечание. Вместо
алюминиевого бруска можно взять железный брусок.
Сформулируйте вывод
Контрольные
вопросы