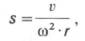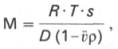Молекулярная масса и размеры белков. Методы определения молекулярной массы белков. Необходимость применения комплекса методов для точной оценки молекулярной массы белков
Белки относятся
к высокомолекулярным соединениям, в
состав которых входят сотни и даже
тысячи аминокислотных остатков,
объединенных в макромолекулярную
структуру. Молекулярная масса белков
колеблется от 6000 (нижний предел) до
1000000 и выше в зависимости от количества
отдельных полипептидных цепей в составе
единой молекулярной структуры белка.
Такие полипептидные цепи называются
субъединицами. Их молекулярная масса
варьирует в широких пределах: от 6000 до
100000 и более. Для выражения молекулярной
массы белков используют также специальную
единицу – дальтон.
Дальтон (Да) –
единица массы, практически равная массе
атома водорода (т.е. 1,0000 по шкале атомных
масс). Терминами «дальтон» и «молекулярная
масса» пользуются как взаимозаменяемыми:
например, белок в 20000 дальтон имеет
молекулярную массу 20000. Наименование
дано в честь Джона Дальтона, разработавшего
атомарную теорию строения материи.
Килодальтон (кДа) – единица массы, равная
1000 дальтон. Масса большинства белков
лежит в пределах от 10 до 100 кДа.
Аминокислотный
состав и последовательность аминокислот
выяснены для многих тысяч белков. В
связи с этим стало возможным вычисление
их молекулярной массы химическим путем
с высокой точностью. Однако для огромного
количества встречающихся в природе
белков химическое строение не выяснено,
поэтому основными методами определения
молекулярной массы все еще остаются
физико-химические методы (гравиметрические,
осмометрические, вискозиметрические,
электрофоретические, оптические и др.).
На практике чаще всего используются
методы седиментационного анализа,
гель-хроматография и гель-электрофорез.
При определении
молекулярной массы белков методами
седиментационного анализа используют
аналитические ультрацентрифуги (первая
ультрацентрифуга была сконструирована
в 1923 г. Т. Сведбергом), в которых удается
создать центробежные ускорения (g), в
200000 и более раз превышающие ускорение
земного притяжения. Обычно молекулярную
массу вычисляют по скорости седиментации
молекул белка или седиментационному
равновесию. По мере перемещения молекул
от центра к периферии образуется резкая
граница «растворитель-белок»
(регистрируется автоматически). Оптические
свойства растворителя и белка используются
при определении скорости седиментации;
которую выражают через константу
седиментации s, зависящую как от массы,
так и от формы белковой частицы:
v
S = —— ,
ω2 ∙ r
где v – скорость
перемещения границы растворитель-белок,
см/с; ω – угловая скорость ротора, рад/с;
r – расстояние от центра ротора до
середины ячейки с раствором белка, см.
Константа седиментации имеет размерность
времени (ее выражают в секундах). Величина
константы седиментации, равная 1·10–13
с, условно принята за единицу и названа
сведбергом (S). Значения констант
седиментации большинства белков лежат
в пределах 1–50 S, хотя в ряде случаев эти
значения превышают 100 S.
Для вычисления
молекулярной массы, помимо константы
седиментации, необходимы дополнительные
сведения о плотности растворителя и
белка и другие согласно уравнению
Сведберга:
RTS
M = ————
D (1- v ρ)
где R – газовая
постоянная, эрг/(моль∙гр.); Т – абсолютная
температура (по шкале Кельвина); S
– константа седиментации; ρ – плотность
растворителя; v – парциальный удельный
объем молекулы белка; D ‒ коэффициент
диффузии.
Определение
молекулярной массы белков методом
ультрацентрифугирования требует много
времени и дорогостоящей аппаратуры.
Поэтому в последние годы разработаны
простые методы (гель-хроматография и
электрофорез).
Гель-хроматографию
проводят при заполнении колонки пористым
гелем сефадекса. Через колонку пропускают
ряд белков с известной молекулярной
массой и строят график зависимости
логарифма молекулярной массы от значений
их элюционных объемов. Между логарифмом
молекулярной массы белка, имеющего
сферическую форму, и элюционным объемом
существует прямая зависимость. Легко
определить молекулярную массу исследуемого
белка, зная его объем элюции.
Второй разновидностью
этого метода является тонкослойная
гель-хроматография. Длина пробега белка
через тонкий слой сефадекса находится
в логарифмической зависимости от его
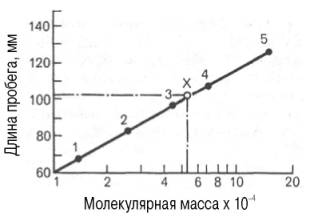
молекулярной массы (рис.7.1).
Рис.7.1. Зависимость
между длиной пробега белковых частиц
при гель-хроматографии в тонком слое
сефадекса G-150
и их молекулярными массами
При использовании
диск-электрофореза в полиакриламидном
геле строят график зависимости между
логарифмом молекулярной массы
калибровочных белков и подвижностью
белковых частиц в полиакриламидном
геле, а затем, определив подвижность
исследуемого белка, по графику находят
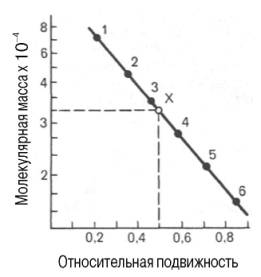
его массу (рис.7.2).
Рис.7.2. Зависимость
между молекулярной массой и относительной
подвижностью белка при диск-электрофорезе
в полиакриламидном геле. присутствии
додецилсульфата натрия
Электрофорез
проводят в присутствии детергента –
додецилсульфата натрия (SDS), т.к. только
в этом случае наблюдается прямая
пропорциональная зависимость между
логарифмом молекулярной массы и
подвижностью белков.
Додецилсульфат
натрия
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
Molar mass of PrOTeIn = 399.32505 g/mol
Convert grams PrOTeIn to moles
or
moles PrOTeIn to grams
Molecular weight calculation:
140.90765 + 15.9994 + 127.6 + 114.818
Percent composition by element
Element: Indium
Symbol: In
Atomic Mass: 114.818
# of Atoms: 1
Mass Percent: 28.753%
Element: Tellurium
Symbol: Te
Atomic Mass: 127.60
# of Atoms: 1
Mass Percent: 31.954%
Element: Praseodymium
Symbol: Pr
Atomic Mass: 140.90765
# of Atoms: 1
Mass Percent: 35.286%
Element: Oxygen
Symbol: O
Atomic Mass: 15.9994
# of Atoms: 1
Mass Percent: 4.007%
Similar chemical formulas
Note that all formulas are case-sensitive.
Did you mean to find the molecular weight of one of these similar formulas?
PrOTeIN
PrOTeIn
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
Методы нахождения молекулярной массы белка бывают химическими, физико-химическими и физическими. Самыми распространенными физико-химическими методами являются гель-хроматография (как колоночная, так и тонкослойная) и электрофорез в среде полиакриламидного геля в присутствии натрия додецилсульфата. Они не требуют сложного оборудования и больших количеств исследуемого материала.
Характеристика белков
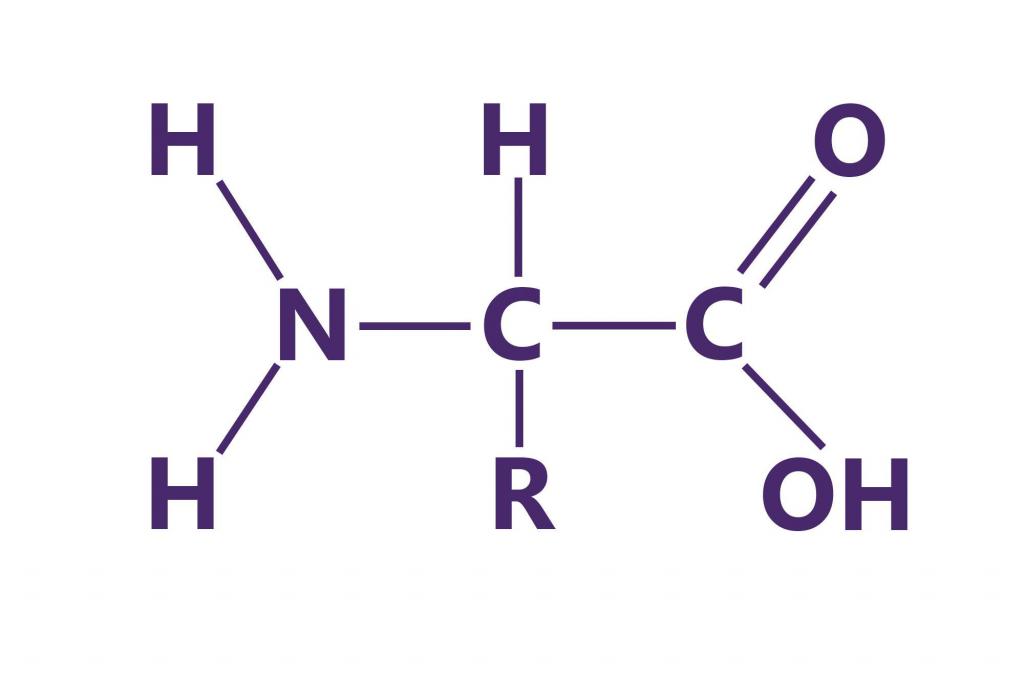
Белки представляют собой высокомолекулярные полимеры биологического происхождения. Они состоят из аминокислот, соединенных последовательно пептидными связями. Размеры белков зависят от количества этих самых аминокислот. Средние значения элементного состава белков в %:
- углерода – в интервале 50,6-54,5;
- кислорода – в пределах 21,5-23,5;
- азота – около 15,0-17,6;
- водорода –в интервале 6,5-7,3;
- серы – в пределах 0,3-2,5;
- минеральных веществ – не более 0,5.
Белки подразделяют на простые, состоящие только из остатков аминокислот, и сложные, включающие простетические группы. Небелковые компоненты могут быть углеводами, липидами, нуклеиновыми кислотами, производными витаминов, ионами металлов, гемом и др. Различают четыре структуры белков.
Аминокислотный состав белков находят путем кислотного гидролиза, сочетаемого с последующим разделением освободившихся аминокислот с помощью ионообменной хроматографии.
Количественные показатели каждой из аминокислот определяют нин-гидриновым методом. Выявление размещения аминокислот в молекуле белка осуществляют путем последовательного отщепления концевых аминокислот с помощью ферментов и их идентификацией, что позволяет определить структуру белковой молекулы. Идентификация основана на их различных физико-химических свойствах. Нередко для этого используют цветные реакции на те или иные аминокислоты и хроматографию.
Колоночная гель-хроматография
Этот метод основывается на линейной зависимости логарифма молекулярной массы многих глобулярных белков и объема элюирования с заполненной гелем (определенного размера пор). Таким образом, для определения молекулярной массы белка следует лишь найти объем его элюции с откалиброванной заранее колонки. Калибровку выполняют методом пропускания через колонку белков с заранее известными массами молекул и замеряя объемы элюции каждого из них. Если в качестве заполнителя используют сефадекс G-75, то расчет молекулярной массы ведут по найденному экспериментальным путем уравнению:
lg M = 5,624 – 0,752 · (Vэ / Vo),
где М – искомая молекулярная масса; Vэ – выходящий из колонки объем раствора с исследуемым веществом; Vo – объем свободной колонки.
Для проведения анализа понадобятся раствор голубого декстрана (1%), раствор NaCl (0,1 моль/л), сефадекс G-75 (4 г), раствор гемоглобина (1%).
Выполнение анализа
Подготовленную колонку заполняют гелем сефадекса G-75 и промывают раствором NaCl. После того как сольют раствор NaCl, поднимающийся выше уровня геля, на его поверхность аккуратно помещают 0,5 мл раствора голубого декстрана. Затем собирают выходящие из колонки жидкости в мерный цилиндр, где их сохраняют до конца эксперимента. Начинающий вытекать раствор с голубой окраской собирают по 20 капель в подготовленные заранее пробирки. Элюат из них от первого до самого интенсивно окрашенного сливают в тот же мерный цилиндр, в котором уже собраны неокрашенные фракции. Объем пробирок ослабевающей окраской раствора не учитывают.
Объем жидкости, собранной в мерный цилиндр, составляется свободным объемом колонки (Vo). Далее повторяют заполнение колонки, но вместо голубого декстрина используют раствор гемоглобина. Объем элюата в мерном цилиндре до выхода раствора с максимально розовой окраской является величиной Vэ. Найденные значения Vo и Vэ подставляют в соответствующее уравнение и вычисляют массу белка. Аминокислотный состав белков находят подобными методиками.
Тонкослойная гель-хроматография
Принцип этого метода заключается в том, что в ходе продвижения раствора белков по пластине с тончайшим слоем сефадекса, смесь их распределяется неравномерно. По расстоянию, пройденному каждым из белков от исходной стартовой линии, находят логарифмы их молекулярных масс. Для определения молекулярной массы белка методом тонкослойной гель-хроматографии строят калибровочный график, отражающий зависимость пройденных маркерными белками расстояний от логарифмов их молекулярных масс. Уже по нему находят длину пути исследуемого белка и массу его молекулы.
Для выполнения эксперимента потребуется столик с изменяющимся углом наклона, а также хроматографическая камера. Из реактивов понадобятся сефадекс G-200 или G-150, натрий-фосфатный буфер, pH 7,4 (0,1 моль/л), раствор бромфенолового синего (0,1%), раствор СН3СООН (5%), раствор CH3COONa (2 %), набор маркерных белков, хроматографическая бумага.
Выполнение эксперимента
Сначала необходимо приготовить гель сефадекса, для чего сухую его массу 4 г суспендируют в избыточном количестве натрий-фосфатного буфера, а затем оставляют для набухания в течение 3 суток при н.у. Стеклянную пластинку со сторонами 20х40 см тщательно промывают. Перед нанесением на нее сефадекса буфер над ним декантуют, а затем гель хорошо перемешивают. На горизонтально расположенную пластину его наносят фарфоровой ложечкой, а затем распределяют прокатыванием стеклянной палочки размером 1х22 см. Прокатывание повторяют до равномерного распределения слоя геля без комков и пузырьков толщиной 1 мм. Подготовленную пластинку просушивают на воздухе 15 мин., а потом помещают в хроматографическую камеру.
В крайние емкости заливают фосфатный буфер, гель соединяют с буфером хроматографической бумагой. Далее камеру закрывают и помещают на специальную подставку. Угол ее наклона устанавливают на 7-10°. Для насыщения камеру оставляют на ночь.
Растворы белков, молекулярная масса которых известна, так же, как и исследуемые образцы, наносят микропипеткой, объем каждой порции должен быть по 0,02 мл. Пластинку возвращают в горизонтальное положение и наносят порции белка в определенные точки. Расстояние между ними и от верхнего края должно быть 3 см. Затем камеру закрывают и ставят под углом 7–10°. Гель-хроматографический анализ проводят 4 ч.
По истечении отведенного времени камеру ставят горизонтально, хроматографическую бумагу удаляют. Стеклянную пластинку помещают на подставку в горизонтальном положении и снимают «реплику» на бумагу для хроматографии. Для этого ее сворачивают в трубочку и накладывают на тонкий гелевый слой, постепенно разворачивая. При этом бумага должна прилипнуть к нему, но делать это нужно аккуратно, чтобы сохранить его в целости. Бумагу оставляют на поверхности пластинки 1 мин., после этого высушивают при температуре 90 °С 20 мин. и помещают в специальную кювету для окрашивания.
Расшифровка результатов
Чтобы идентифицировать белковые зоны, «реплику» помещают в раствор бромфенолового синего на 3 минуты. Далее краситель нужно отмыть дважды раствором уксусной кислоты и закрепить ацетатом натрия. После этого хроматографическую бумагу тщательно промывают в холодной проточной воде и высушивают. Далее приступают к измерению расстояния, пройденного каждым белком от исходной точки до центра пятна.
По полученным данным выстраивают калибровочный график, путем откладывания по оси абсцисс lа/lст (где индекс а относится к анализируемому, а ст — к стандартному белку), по оси ординат – lgM. Замерив расстояние белковой области исследуемого образца от старта, по выстроенному графику определяют молекулярную массу и предполагаемую структуру белковой молекулы.
Молекулярная масса белков
Белки
относятся к высокомолекулярным соединениям, в состав которых входят сотни и
даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру.
Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше
в зависимости от количества отдельных полипептидных цепей в составе единой
молекулярной структуры белка. Такие полипептидные цепи получили название
субъединиц. Их мол. масса варьирует в широких пределах – от 6000 до 100000 и
более.
Аминокислотный
состав и последовательность аминокислот выяснены для многих тысяч белков. В
связи с этим стало возможным вычисление их молекулярной массы химическим путем
с высокой точностью. Однако для огромного количества встречающихся в природе
белков химическое строение не выяснено, поэтому основными методами определения
молекулярной массы все еще остаются физико-химические методы (гравиметрические,
осмометрические, вискозиметрические, электрофоретические, оптические и др.). На
практике наиболее часто используются методы седиментационного анализа,
гель-хроматография и гель-электрофорез. Определение молекулярной массы белков
методами седиментационного анализа проводят в ультрацентрифугах , в которых
удается создать центробежные ускорения (g), превышающие в 200000 и более раз ускорение
земного притяжения. Обычно вычисляют молекулярную массу по скорости
седиментации молекул белка или седиментационному равновесию. По мере
перемещения молекул от центра к периферии образуется резкая граница
растворитель-белок (регистрируется автоматически). Оптические свойства
растворителя и белка используются при определении скорости седиментации;
последнюю выражают через константу седиментации s, которая
зависит как от массы, так и от формы белковой частицы:
где v – скорость перемещения границы
растворитель-белок, см/с; ω – угловая скорость
ротора, рад/с; r – расстояние от центра ротора до середины
ячейки с раствором белка, см. Константа седиментации имеет размерность времени
(ее выражают в секундах). Величина константы седиментации, равная 1•10–13
с, условно принята за единицу и названа сведбергом (S). Значения
констант седиментации большинства белков лежат в пределах 1–50 S, хотя
в ряде случаев эти значения превышают 100 S.
Для
вычисления молекулярной массы (М), помимо константы седиментации, необходимы
дополнительные сведения о плотности растворителя и белка и другие согласно
уравнению Сведберга:
где R – газовая постоянная, эрг/(моль•град); Т – абсолютная температура (по шкале
Кельвина); s – константа седиментации; ρ –
плотность растворителя; v –
парциальный удельный объем молекулы белка; D — коэффициент диффузии.
Определение
молекулярной массы белков методом ультрацентрифугирования требует много времени
и сложной и дорогостоящей аппаратуры. Поэтому в последние годы разработаны два
более простых метода (гель-хроматография и электрофорез). При использовании
гель-хроматографии в первую очередь требуется откалибровать колонку. Для этого
через колонку с сефадексом пропускают несколько белков с известными
молекулярными массами и строят график, откладывая значения логарифмов
молекулярной массы против их элюционных объемов, которые находят, как показано
на рис. 1.9.
Известно, что
между логарифмом молекулярной массы белка, имеющего сферическую форму, и
элюционным объемом существует прямая зависимость. Поэтому легко определить
молекулярную массу исследуемого белка, зная его объем элюции. Второй
разновидностью этого метода является тонкослойная гель-хроматография. Длина
пробега белка (в миллиметрах) через тонкий
слой сефадекса находится в логарифмической зависимости от молекулярной массы
белка (рис. 1.10).
Рис. 1.9. Измерение
объема элюции (VЭ).
Рис. 1.10. Зависимость
между длиной пробега белковых частиц при гель-хроматографии в тонком слое
сефадекса Г-150 (сверхтонкого) и их молекулярными массами (в
полулогарифмической системе координат).
1 —
рибонуклеаза; 2 — химотрипсиноген; 3 -яичный альбумин; 4 — сывороточный
альбумин; 5 — γ-глобулин; Х — белок с неизвестной молекулярной массой.
Гель-хроматография,
кроме простоты и быстроты, имеет дополнительное преимущество: не требуется
выделять белок в чистом виде, так как примеси других белков не мешают
определению, поскольку каждый из них проходит через колонку со свойственной ему
скоростью, определяемой молекулярной массой. Это обстоятельство широко
используется в энзимологии, когда оказывается возможным определение
молекулярной массы даже очень небольшого количества фермента в присутствии
других белков, не обладающих аналогичной каталитической активностью.
При
использовании диск-электрофореза в полиакриламидном геле для определения
молекулярной массы белков также строят график зависимости между логарифмом
молекулярной массы калибровочных белков и подвижностью белковых частиц в
полиакриламидном геле, а затем, определив подвижность исследуемого белка, по
графику находят его массу (рис. 1.11). Электрофорез проводят в присутствии
детергента додецилсульфата натрия, так как только в этом случае наблюдается
прямая пропорциональная зависимость между молекулярной массой и подвижностью
белков. Белки с четвертичной структурой при этих условиях распадаются на
субъединицы, поэтому метод находит широкое применение для определения
молекулярной массы субъединиц белка.
Рис. 1.11. Зависимость
между молекулярной массой и относительной подвижностью белка при
диск-электрофорезе в полиакриламидном геле в присутствии додецилсульфата натрия
(в полулогарифмической системе координат).
1 —
сывороточный альбумин; 2 — яичный альбумин; 3 — пепсин; 4 — химотрипсиноген; 5
— мио-глобин; 6 — цитохром с; Х —
белок с неизвестной молекулярной массой.
Недавно
предложен новый масс-спектрометрический метод (так называемый лазерный
десорбционно-ионизационный метод), позволяющий определять молекулярную массу
небольших пептидов (вазопрессин, инсулин) и крупных биополимерных молекул и,
кроме того, структуру биомолекул.
Нужна помощь в написании работы?
Молекулярные массы белков колеблются от 6 тыс. до нескольких миллионов дальтон:
Белок |
Молекулярная масса |
|
Инсулин Рибонуклеаза поджелудочной железы Миоглобин Лактоальбумин b-Казеин Пепсин b-Лактоглобулин Химотрипсин Альбумин яиц Гемоглобин млекопитающих Дифтерийный .токсин Гексокиназа дрожжей Лактатдегидрогеназа Глобулины крови Цитохромоксидаза Внимание! Если вам нужна помощь в написании работы, то рекомендуем обратиться к Каталаза Коллаген РНК-полимераза Миозин Глутаминсинтетаза Глутаматдегидрогеназа печени быкаВирус табачной мозаики-рибонуклеопротеин |
573312600 17000 17400 24000 35500 38000 41000 45000 64500 74000 96000 140000 176000 200000 250000 345000 400000 493000 600000 1000000 40600000 |
Молекулярные, массы (М.м.) белков определяют специальными химическими и физическими методами. Один из химических методов основан на определении аминокислотного состава белка. Знания аминокислотного состава и первичной структуры белка позволяют с высокой точностью вычислить его М.м. (Средняя М.м. остатка аминокислоты в полипептидной цепи составляет 110).
Т.Сведберг в 1925 г. предложил гравитационный метод определения М.м., основанный на скорости седиментации (оседания) молекул белка в растворе при ультрацентрифугировании. Скорость седиментации выражают в единицах Сведберга, например: 5S, 5,8S, I8S, 40S и т.д.
В настоящее время разработаны и используются более простые и эффективные методы определения М.м. белков: хроматографический (гельфильтрационный) и электрофоретический. Определение методом гельфильтрации начинают с калибровки колонки. Для этого через колонку с сефадексом пропускают 5-6 белков с известными М.м. и строят график, откладывая значения логарифмов М.м. против их элюционных объемов (объем растворителя необходимый для извлечения конкретного белка). Пользуясь графиком, М.м. исследуемого белка определяют по величине его элюционного объема т.к. между логарифмом М.м. глобулярного белка и элюционным объемом существует прямая зависимость.
Разновидностью метода является тонкослойная гельфильтрация или тонкослойная хроматография (гель тонким слоем наносят на твердую основу). Длина пробега белка (в мм.) через тонкий слои сефадекса находится в логарифмической зависимости от М.м. белка.
Метод гельфильрации имеет преимущество в том, что не требуется предварительной очистки белка, т.к. каждый из сопутствующих белков проходит через колонку со своей скоростью, определяемой М.м..
При использовании метода диск-электрофореза в полиакриламидном геле также строят график зависимости между логарифмом М.м. калибровочных белков и величинами пробега белковых молекул, а затем, определив подвижность исследуемого белка в полиакриламидном геле, по графику находят его массу.
Современные методы позволяют определять М.м. белков с погрешностью до 5 %. Наиболее точный результат может быть получен при определении несколькими методами.
Получить выполненную работу или консультацию специалиста по вашему
учебному проекту
Узнать стоимость