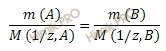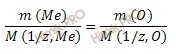Определение молярной массы эквивалента металла
Цель работы: усвоить
понятия химического эквивалента,
молярной массы эквивалента, закона
эквивалентов; ознакомиться с
экспериментальным определением молярной
массы эквивалента металла методом
вытеснения водорода из кислоты.
Теоретическая часть
Известно,
что количество вещества определяется
числом структурных единиц (атомов,
молекул, ионов) этого вещества и выражается
в молях.
Моль ()– это единица количества вещества,
содержащая столько же структурных
единиц данного вещества, сколько атомов
содержится в 0,012 кг углерода, состоящего
только из изотопа12С.
Молярная
масса (М) вещества
представляет собой отношение массы
вещества (m) к его количеству (),
а значение молярной массы численно
совпадает с относительной молекулярной
массой вещества или относительной
атомной массой элемента, но измеряется
в г/моль.
Эквивалентом
вещества (э),
вступающего в какую-либо реакцию,
называют такое его количество, которое
приходится на единицу валентности
соответствующего элемента при образовании
им соединения.
Химический
эквивалент и молярная масса эквивалента
представляют собой важнейшие характеристики
элементов, простых и сложных веществ,
учитывая то, что согласно закону
эквивалентов
все вещества взаимодействуют между
собой в эквивалентных количествах.
Единицей
химического эквивалента (э),
так же как и количества вещества является
моль,
а молярная
масса эквивалента (Мэ),
соответственно измеряется в г/моль.
Так,
водород в своих соединениях, как правило,
одновалентен, и его эквивалент равен 1
моль Н или 1/2 моль Н2,
а молярная масса его эквивалента Мэ(Н)
= 1 г/моль.
Кислород
в своих соединениях двухвалентен, тогда
его эквивалент равен 1/2 моль О или 1/4
моль О2,
а молярная масса его эквивалента Мэ(О)
= 8 г/моль.
Железо
в своих соединениях может быть и двух-,
и трехвалентным, тогда его эквивалент
в первом случае будет равен 1/2 моль Fe, а
молярная масса эквивалента Мэ(Fe) = 28
г/моль. Эквивалент железа во втором
случае будет равен 1/3 моль Fe, а молярная
масса эквивалента Мэ(Fe) = 18,6 г/моль.
Следовательно, молярную массу эквивалента
простого вещества можно рассчитать по
формуле:
, (1)
где М(эл-та)
– молярная масса элемента;
В(эл-та)
– валентность элемента.
Молярные
массы эквивалентов сложных веществ
(оксидов, кислот, оснований, солей)
рассчитываются несколько иначе.
Молярная
масса эквивалента оксида
рассчитывается отношением молярной
массы оксида к произведению числа атомов
элемента на его валентность.
,
где М(оксида)
– молярная масса оксида;
n(эл-та) –
число атомов элемента;
В(эл-та) –
валентность элемента.
Для
оксида железа (Ш), например, молярная
масса его будет равна:
Молярная масса
эквивалента кислотырассчитывается
отношением молярной массы кислоты к
числу атомов водорода в кислоте, способных
замещаться в химических реакциях.
,
где М
(кислоты) – молярная масса кислоты;
n
(H) – число замещающихся в химической
реакции атомов водорода.
Для серной
кислоты (H2SO4),
например, молярная масса эквивалента
будет равна:
Молярная
масса эквивалента основания
рассчитывается отношением молярной
массы основания к числу гидроксогрупп.
,
где
М (основания) – молярная масса основания;
n
(OH) – число гидроксогрупп.
Для
гидроксида кальция (Ca(OH)2),
например, молярная масса эквивалента
будет равна:
Молярная
масса эквивалента соли
рассчитывается отношением молярной
массы соли к произведению числа атомов
металла на их валентность.
,
где М
(соли) – молярная масса соли;
n (Ме) –
число атомов металла;
В (Ме) – валентность
металла.
Для
сульфата натрия (Na2SO4),
например, молярная масса эквивалента
будет равна:
Из
закона
эквивалентов
следует, что массы вступающих и
образующихся в результате реакции
веществ прямопропорциональны молярным
массам их эквивалентов:
, (2)
где
m(1)
и Мэ(1)
– масса и молярная масса эквивалента
первого вещества;
m(2)
и Мэ(2)
– масса и молярная масса эквивалента
второго вещества.
Из
следствия из закона Авогадро вытекает
понятие молярный
объем — объем,
который занимает 1 моль любого газа при
нормальных условиях, т.е. при р = 105
Па (1 атм или 760 мм рт. ст.) и Т = 273 К ( 0о
С). Значение
этого объема равно 22,4 л/моль (22400 мл/моль).
Отсюда можно вывести понятие и молярного
объема эквивалента
газа (или эквивалентного объема) –
объема, занимаемого при нормальных
условиях одним эквивалентом (одной
молярной массой эквивалента) газа.
Известно,
что эквивалент водорода равен 1/2 моль
Н2,
тогда молярный объем эквивалента
водорода Vэ(Н2)
= 11,2 л/моль; соответственно Vэ(О2)
= 5,6 л/моль, т.к. эквивалент кислорода
равен 1/4 моль О2.
Если
же в реакции участвуют газы и известны
их объемы, то соотношение (2) можно
представить следующим образом:
(3)
где m(1)
и Мэ(1) –
масса и молярная масса эквивалента
первого вещества;
V(2)
и Vэ(2) –
объем и молярный объем эквивалента
второго вещества.
Следует
иметь ввиду, что объемы, входящие в
соотношение (3), нужно приводить
к нормальным условиям
по формуле объединенного закона
Гей-Люссака – Бойля –Мариотта:
,
откуда(4)
где р,
V, Т –
давление, объем и температура газа при
условиях опыта;
ро,
Vо,
То
– давление, объем и температура газа
при нормальных условиях.
Известны
методы экспериментального определения
молярных масс эквивалентов: 1) метод
прямого определения – молярную массу
эквивалента определяют по данным прямого
синтеза кислородного или водородного
соединения данного элемента; 2)
аналитический метод – производится
точный анализ соединения данного
элемента с любым другим, молярная масса
эквивалента которого известна; 3) метод
вытеснения водорода — используется для
определения молярной массы эквивалента
тех металлов, которые способны вытеснить
водород из разбавленных кислот и щелочей;
4) электрохимический метод – определяется
масса металла, осаждающегося на электроде
при электролизе раствора соли этого
металла. Молярная масса эквивалента
рассчитывается по закону Фарадея: при
прохождении через раствор или расплав
электролита 965000 Кулонов электричества
на электродах выделяется по одному
эквиваленту вещества.
ЭКСПЕРИМЕНТАЛЬНАЯ
ЧАСТЬ
Сущность
экспериментального определения молярной
массы эквивалента металла заключается
в определении объема водорода (приведенного
к нормальным условиям), вытесняемого
из кислоты навеской металла, взятой на
аналитических весах.
Произведением
молярной массы эквивалента металла на
его валентность определяют молярную
массу атома металла.
По
молярной массе атома металла и его
валентности находят местоположение
металла в периодической системе элементов
Д.И.Менделеева, т.е. его название.
По
указанию преподавателя студент взвешивает
на аналитических весах навеску металла
известной валентности.
Прибор
для определения молярной массы эквивалента
изображен на рисунке.
П
еред началом работы прибор следует
проверить на герметичность. Для этого
отсоединяют пробирку А от прибора, через
воронку С заливают водой таким образом,
чтобы уровень воды в бюретке В установился
на нулевом делении или несколько ниже;
избыток воды удалить. Присоединяют
пробирку А на место. Затем поднимают
воронку C вверх и следят за уровнем воды
в бюретке В. Если уровень в последней
непрерывно повышается, то это означает,
что прибор негерметичен и следует
проверить все резиновые соединения.
Если же прибор герметичен, то повышение
уровня воды в бюретке В произойдет
незначительно только в первый момент,
а потом он будет оставаться неизменным.
Убедившись
в герметичности прибора, отсоединяют
пробирку А от прибора и, записав начальный
уровень воды в бюретке В, наливают в
пробирку А 1/4 ее объема соляной кислоты,
приготовленной для определения молярной
массы эквивалента металла соответствующей
валентности.
Держа
пробирку А в положении, близком к
горизонтальному, помещают на сухое
место у отверстия пробирки взвешенный
металл и в таком положении соединяют
пробирку А с бюреткой В, следя за тем,
чтобы металл не упал в кислоту.
Убедившись
вторично
в герметичности прибора путем поднятия
воронки С вверх, стряхивают металл в
кислоту и наблюдают за ходом реакции.
По
окончании реакции (прекращение выделения
пузырьков водорода), устанавливают
уровень воды в бюретке В и воронке С на
одной высоте, перемещая кольцо К с
воронкой С вниз по штативу, и записывают
уровень воды в бюретке В после окончания
опыта. Шкала бюретки В проградуирована
в миллилитрах (мл).
С
помощью барометра определяют величину
атмосферного давления ( ратм ),
термометра – температуру ( t ) воздуха
в помещении (соответственно и температуру
воды в приборе) в момент проведения
опыта.
С
помощью таблицы 1 определяют давление
водяного пара ( рН2Опар ),
соответствующего измеренной температуре
опыта, в мм рт.ст.
Таблица
1
Зависимость
давления водяного пара от температуры
|
t |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
рН2Опар |
12,8 |
13,6 |
14,5 |
15,5 |
16,5 |
17,5 |
18,7 |
19,8 |
21,1 |
22,4 |
23,8 |
Порядок расчета
-
Определите
объем выделившегося водорода в результате
опыта. Для этого от значения уровня
воды в бюретке В после окончания опыта
( V2
) следует вычесть значение уровня воды
в бюретке В в начале опыта ( V1
).
V(Н2)
= V2
– V1.
Переведите
значение объема выделившегося в
результате опыта водорода в кубические
дециметры, учитывая, что 1 см3
= 10 –3
дм3.
-
Приведите
экспериментальный объем выделившегося
водорода к нормальным условиям,
воспользовавшись формулой 4. Следует
учесть, что давление внутри бюретки В
складывается из давления водорода и
давления водяного пара внутри объема
бюретки при данной температуре:
ратм
= рН2
+ рН2Опар
, тогда
где ратм
– измеренное атмосферное давление во
время проведения опыта;
рН2Опар –
давление водяного пара при температуре
опыта;
V
(Н2) –
экспериментальный объем водорода;
Т
– температура проведения опыта (К),
равная (273+t);
ро,
То
– давление и температура при нормальных
условиях.
-
Вычислите
молярную массу эквивалента металла, с
точностью до 0,1 г/моль, воспользовавшись
формулой 3:
4. Воспользовавшись
формулой 1, рассчитайте молярную массу
металла и укажите какой это металл.
Результаты
эксперимента представьте в виде таблицы
2.
Таблица
2
|
масса |
pатм, мм |
t, |
V1,, |
V2, |
V(H2), |
pH2Oпар, мм |
V0(H2), |
Мэ |
М |
5. Вычислите
величины абсолютной и относительной
ошибок (Х).
Абсолютная
ошибка:
Хабс.
= М (Ме)
табличное – М
(Ме)
экпериментальное
Относительная
ошибка:
Вопросы для
самоконтроля
1. Что
называется эквивалентом вещества?
-
Что
является единицей эквивалента вещества? -
Какую
размерность имеет молярная масса
эквивалента вещества? -
Какие
значения имеют молярные массы эквивалентов
водорода и кислорода? -
Как
можно рассчитать молярную массу
эквивалента элемента? -
Что
такое молярный объем и молярный объем
эквивалента? -
Какие
значения имеют молярные объемы
эквивалентов водорода и кислорода? -
Как
формулируется закон эквивалентов? -
Почему
при выполнении расчетов в экспериментальной
части работы нужно знать давление
водяного пара? -
Какие
Вы знаете методы экспериментального
определения молярной массы эквивалента
металлов?
Задачи
-
Медь
с кислородом образует два соединения,
в которых содержится 79,9 % меди и 20,1 %
кислорода, и 88,8 % меди и 11,2 % кислорода.
Определите молярные массы эквивалентов
меди в этих соединениях и составьте
формулы этих соединений. -
При
сгорании 3 г магния образовалось 5 г
оксида магния. Рассчитайте молярную
массу эквивалента магния. -
При
взаимодействии 2,4 г углерода с кислородом
образовалось 5,6 г оксида. Определите
молярную массу эквивалента углерода
в этом соединении и напишите уравнение
реакции. -
При
взаимодействии 4 г двухвалентного
металла с кислородом образовалось 5,6
г оксида. Определите, какой это металл
и напишите уравнение реакции. -
При
растворении в соляной кислоте 5,4 г
трехвалентного металла выделилось
6,72 л водорода, измеренного при н.у.
Определите, какой это металл и напишите
уравнение реакции. -
При
взаимодействии одновалентного металла
с 0,2 г водорода образовалось 4,8 г гидрида
металла. Определите, какой это металл
и напишите уравнение этой реакции. -
При
окислении 8 г металла, проявляющего
валентность, равную I, получено 9 г
оксида. Определите, какой это металл и
напишите уравнение данной реакции. -
Рассчитайте
объем водорода, выделившегося при
растворении в соляной кислоте 18 г
металла, молярная масса эквивалента
которого равна 9 г/моль. -
При
взаимодействии 0,9 г трехвалентного
металла с серой образовалось 2,5 г
сульфида металла. Определите, какой
это металл, учитывая, что молярная масса
эквивалента серы в этом соединении 16
г/моль. Напишите уравнение соответствующей
реакции. -
При
окислении 6,4 г серы образовалось 16 г
оксида. Определите молярную массу
эквивалента серы в этом соединении и
напишите уравнение соответствующей
реакции.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Определение молярной массы эквивалента металла
Ульяна Власова
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Определение 1
Эквивалент — это частица вещества (реальная/условная), которая способна замещать/присоединять один ион водорода в кислотно-основных реакциях, а также присоединять/высвобождать один электрон в ходе окислительно-восстановительных реакций.
Молярная масса эквивалента металла
Молярная масса эквивалента ($mathrm {M_э}$ — это масса одного моля эквивалента.
Замечание 1
Моль — это количество вещества, которое содержит столько структурных единиц, сколько содержится атомов в 12 г изотопа углерода.
Рассчитывается молярная масса эквивалента следующим образом:
$mathrm {M_э = f_э cdot M_{в-ва} = frac {M_{в-ва}}{В_{в-ва}}}$
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Где:
- $mathrm {M_э}$ — молярная масса эквивалента (г/моль),
- $mathrm {f_э}$ — фактор эквивалентности (число, которое показывает, какая часть молекулы соответствует эквиваленту),
- $mathrm {M_{в-ва}}$ — молярная масса вещества,
- $mathrm {В_{в-ва}}$ — валентность вещества .
В качестве примера возьмем двухвалентное железо, тогда молярная масса эквивалента будет рассчитываться следующим образом:
$mathrm {M_{Э_{Fe}} = frac {56}{2} = 28 г/моль}$
Закон эквивалентов
Закон эквивалентов гласит, что вещества взаимодействуют в количествах, пропорциональных их эквивалентам.
Из этого следует:
$mathrm {frac{m_1}{m_2} = frac {M_Э1}{M_Э2}}$
Рассмотрим пример решения задачи:
В результате сгорания 5г Ме образовалось 9,44 г оксида этого металла. Необходимо рассчитать молярную массу эквивалента Ме.
- Составим уравнение: $mathrm {2Ме + О_2 to MeO}$.
- Найдем массу кислорода в оксида $mathrm {m_{O_2} = 9,44 — 5 = 4,44 г}$.
- Применим закон эквивалента $mathrm {frac{m_{Me}}{m_{O_2}} = frac{M_{Э_{Me}}}{M_{Э_{O_2}}}}$
Молярная масса эквивалента кислорода равна 8 г/моль ($mathrm {frac {16}{2} = 8}$)
Из этого следует, что молярная масса эквивалента Ме равна: $mathrm {frac {m_{Me}} cdot M_{Э_{О_2}}{m_{O_2}}= frac {40}{4,44} = 9г/моль}$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Дата последнего обновления статьи: 21.12.2022
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
При окислении 16,74 грамм двухвалентного металла образовалась 21,54 грамма оксида. Вычислите молярную массу эквивалента металла и его оксида. Чему равна атомная масса металла?
Решение задачи
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
По условию задачи оксид образован двухвалентным металлом, следовательно, формулу запишем так MeO.
Исходя из массы оксида металла и массы металла, определим массу кислорода по формуле:
m (O) = m (MeO) – m (Me)
Получаем:
m (O) = 21,54 – 16,74 = 4,8 (г).
Закон эквивалентов в данном случае имеет вид:
Из уравнения находим молярную массу эквивалента металла:
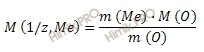
Рассчитаем молярную массу металла по формуле:
Где:
М – молярная масса,
В – валентность,
Э – эквивалентная масса
n – число атомов элемента в соединении.
Получаем:
M (Мe) = 2 ∙ 27,9 = 55,8 (г/моль).
Напомню, что молярная масса вещества, имеющего атомную или металлическую структуру, численно равна относительной атомной массе.
Следовательно, атомная масса металла равна 55,8 г/моль. А металл – железо (Fe).
Учитывая, что молярная масса оксида железа (FeO) равна 71,8 г/моль, найдем молярную массу эквивалента оксида железа (FeO) рассчитаем по формуле:
Получаем:
Э (FeO) = 71,8/2 = 35,9 (г/моль).
Ответ:
молярная масса эквивалента металла равна 27,9 г/моль;
атомная масса металла равна 55,8 г/моль;
молярная масса эквивалента оксида равна 35,9 г/моль.
Как вычислить эквивалентные массы оксида и металла
Эквивалент – такое количество химического элемента, которое либо связывает, либо замещает один моль атомов водорода. Соответственно, масса одного эквивалента называется эквивалентной массой (Мэ), и выражается в г/моль. Перед учащимися на химии часто ставят задачу определить эквивалентную массу того или иного вещества (соединения). Например, металла и образованного им оксида.

Инструкция
В первую очередь следует запомнить несколько простых правил. Если речь идет о металле, его эквивалентная масса рассчитывается по формуле: Мэ=М/В, где М – атомная масса металла, а В – его валентность. Рассмотрите это правило на конкретных примерах.
Кальций (Са). Его атомная масса 40,08. Округленно примите ее за 40. Валентность равна 2. Следовательно, Мэ(Са) = 40/2 = 20 г/моль. Алюминий (Al). Его атомная масса 26,98. (Округленно 27). Валентность равна 3. Таким образом, Мэ(Al) = 27/3 = 9 г/моль.
Перечисленные способы применимы, если речь идет о чистых металлах. А если они входят в состав какого-либо соединения, например, тех же оксидов? Тут надо запомнить другое правило: эквивалентная масса оксида вычисляется по формуле: Мэ + Мо, где Мо – эквивалентная масса кислорода. Она, соответственно, рассчитывается по уже рассмотренной формуле М/В, то есть 16/2 = 8.
Предположим, у вас есть основной оксид алюминия, Al2O3. Как посчитать его эквивалентную массу? Очень просто: 27/3 + 16/2 = 17 г/моль.
Есть ли другой способ определения эквивалентных масс металла и его оксида? Да, и весьма эффективный. Он основан на так называемом законе эквивалентов, согласно которому все вещества реагируют друг с другом в эквивалентных количествах. Например: металл массой 33,4 грамма вступил в реакцию окисления с кислородом воздуха. В результате получился оксид общей массой 43 грамма. Требуется определить эквивалентные массы самого металла и его оксида.
Сначала вычислите, сколько кислорода соединилось с металлом в ходе этой реакции: 43 – 33,4 = 9,6 грамм. Согласно закону эквивалентов, эта масса во столько же раз больше эквивалентной массы кислорода (которая, напомним, равна 8), во сколько раз эквивалентная масса металла меньше его первоначального количества. То есть 33,4/Мэ(ме) = 9,6/8. Следовательно, Мэ(ме) = 33,4*8/9,6 = 27,833 г/моль, или округленно 27,8 г/моль. Такова эквивалентная масса металла.
Эквивалентную же массу оксида найдите следующим действием: 27,8 + 8 = 35,8 г/моль.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.