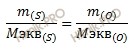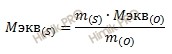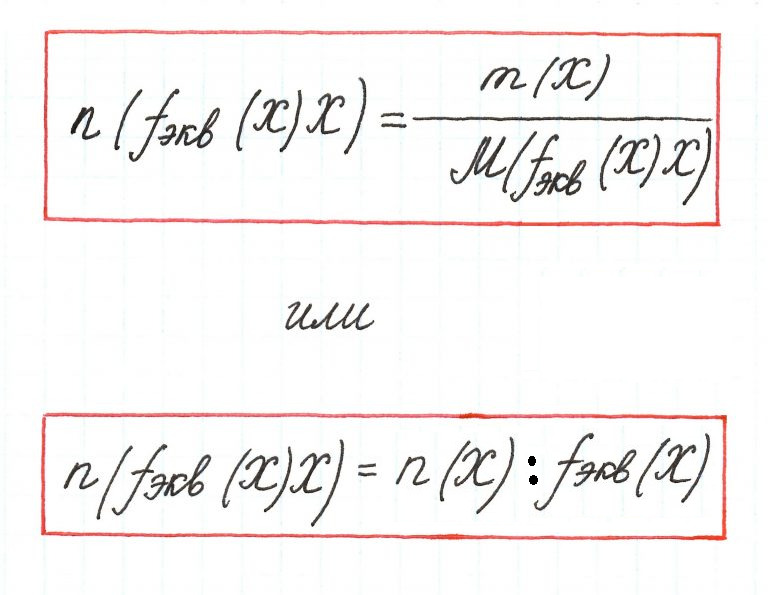Эквивалентом
называют
реальную или условную частицу, которая
может замещать, присоединять, высвобождать
или быть каким-либо другим способом
эквивалента одному иону водорода в
кислотно-основных или ионообменных
реакциях или одному электрону в
окислительно-восстановительных реакциях.
Масса
1 эквивалента вещества (элемента)
называется его молярной (атомной) массой
эквивалента (Мэкв),
выражается в г/моль∙экв. В отличие от
относительной атомной массы Аr
атомная масса эквивалента элемента Э
в его различных соединениях – величина
переменная. Рассчитать ее можно по
формуле: Мэкв
= Аr/В,
где В – валентность или степень окисления
элемента в данном соединении. Так,
молярная масса эквивалента железа в
его дихлориде и трихлориде составляет
соответственно 56/2= 28 и 56/3 ≈ 19 соответственно.
Эквивалентом
соединения
называют такое его количество, которое
взаимодействует без остатка с одним
эквивалентом водорода или вообще с
одним эквивалентом любого другого
вещества.
Фактор
эквивалентности
– число,
показывающее, какая доля реальной
частицы Х эквивалентна одному иону
водорода в данной кислотно-основной
реакции или одному электрону в данной
окислительно-восстановительной реакции,
обозначается как fэкв(Х).
Рассчитывается, как
fэкв(кислоты)=1/основность;
fэкв(основания)=1/кислотность;
fэкв(соли)=1/число
катионов∙валентность Ме;
fэкв(окислителя)=1/число
принятых ē;
fэкв(восстановителя)=1/число
отданных ē.
Молярная
масса эквивалента вещества Х равна
произведению
фактора эквивалентности вещества Х на
его молярную массу.
Мэкв(Х)=fэкв(Х)·М(f).
Значит,
Мэкв(NaOH)=1∙40
= 40 г/моль∙экв;
Мэкв(Н2SO4)=1/2·98
= 49 г/моль∙экв;
Мэкв(Al(NO3)3)=1/3∙213=
71 г/моль∙экв.
Как
для элементов, так и для сложных веществ
применим закон
эквивалентов:
«Вещества взаимодействуют друг с другом
в эквивалентных количествах», или «массы
реагирующих веществ пропорциональны
их эквивалентам или молярным массам
эквивалентов (объемов): m1/m2
= Mэкв1/Мэкв2.
Пример
1. Определите
молярные массы эквивалента серы в
сероводороде, диоксиде серы и триоксиде
серы.
Решение.
Исходя
из состава сероводорода H2S
и оксидов серы SO2
и SO3
находим, что степень окисления серы в
них равна -2, +4, +6 соответственно. Тогда
из соотношения Мэкв
= Аr/В
находим, что молярная
масса эквивалента серы равна: 32/2 = 16;
32/4 = 8; 32/6 = 5,33 соответственно.
Пример
2. На
восстановление 7,09 г оксида двухвалентного
металла требуется 2,24 л водорода,
измеренного при нормальных условиях
(н.у.). Вычислить молярные массы эквивалента
оксида и металла. Чему равна атомная
масса металла?
Решение.
Согласно
закону эквивалентов массы (объемы)
реагирующих друг с другом веществ m(А)
и m(В) пропорциональны их молярным массам
эквивалентов (объемам):
(1)
.
(2)
Если
одно из веществ находится в газообразном
состоянии, то его количество измеряется
в объемных единицах (см3,
л, м3,
мл).
Объем,
занимаемый при данных условиях молярной
или молярной массой эквивалента
газообразного вещества, называется
молярным или соответственно эквивалентным
объемом этого вещества. Молярный объем
любого газа при н.у. равен 22,4 дм3.
Отсюда эквивалентный объем водорода,
молекула которого состоит из двух
атомов, т.е. содержит два моля атомов
водорода, равен 22,4:2 = 11,2 дм3.
В формуле (2) отношение mН2/Мэкв(Н2)заменяем
равным ему отношением VH2/Vэкв(H2),
где VH2
– объем
водорода,
Vэкв(H2)
— эквивалентный объем водорода:
(3)
Из
уравнения (3) находим молярную массу
эквивалента оксида металла
Согласно
закону эквивалентов
Mэкв(MeO)
= Mэкв(Me)
+ Mэкв(O),
отсюда
Mэкв(Me)
= Mэкв(MeO)
– Mэкв(O)
= 35,45 – 8 = 27,45 г/моль·экв.
Молярная
масса металла определяется из соотношения
Мэкв(Ме)
= М(Ме)/В, где Мэкв(Ме)
– молярная масса эквивалента металла,
М(Ме) – молярная масса металла, В –
стехиометрическая валентность элемента;
М(Ме) = Мэкв(Ме)∙В
= 27,45·2 = 54,9 г/моль. Так как атомная масса
в а.е.м. численно равна молярной массе,
выражаемой в г/моль, то искомая масса
металла 54,9 а.е.м.
Пример
3. Вычислить
молярные массы эквивалентов Н2SO4
и Аl(ОН)3
в реакциях, выраженных уравнениями:
1)
Н2SO4
+ КОН = КНSO4
+ Н2О,
2)
Аl(OH)3
+ HCl
= Al(OH)2Cl
+ Н2О,
3)
Аl(OH)3
+ 3HNO3
= Al(NO3)3
+ 3H2O.
Решение.
Молярная
масса эквивалента сложного вещества,
так же как и молярная масса эквивалента
элемента, может иметь различные значения
и зависит от того, в какую реакцию обмена
вступает это вещество.
В
реакции (1) в молекуле кислоты замещается
1 ион водорода, следовательно, fэкв(Н2SO4)
= 1, поэтому Мэкв(Н2SO4)
= М(Н2SO4)
∙1 = =98·1 = 98 г/моль∙экв.
В
реакции (2) происходит замещение одной
гидроксильной группы, поэтому fэкв(Аl(OH)3)
=1, Мэкв(Аl(OH)3)
= 78·1= 78 г/моль∙экв.
В
реакции (3) происходит замещение трех
гидроксильных групп, следовательно,
fэкв(Аl(OH)3)
=1/3, а
Мэкв(Аl(OH)3)
= 78·1/3 = 26 г/моль∙экв.
Пример
4. При
восстановлении 1,6 г монооксида некоторого
металла водородом образовалось 0,36 г
воды. Определите молярную массу
эквивалента металла и формулу оксида.
Решение.
Определим
молярную массу эквивалента оксида,
используя математическое выражение
закона эквивалентов и учитывая, что
молярная масса эквивалента воды равна
сумме молярных масс эквивалентов
водорода и кислорода, т.е. 9:
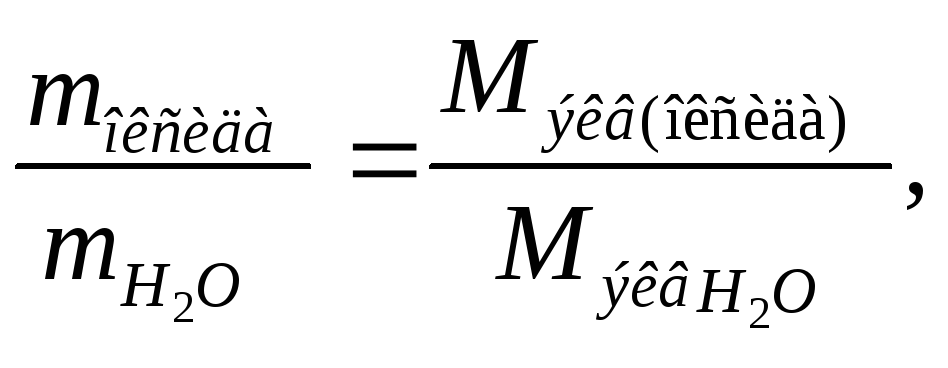
Молярная
масса эквивалента металла равна разности
между молярной массой эквивалента
оксида и молярной массой эквивалента
кислорода:
Мэкв(Ме)
= Мэкв
(оксида) –
Мэкв (О)
= 40 – 8 = 32.
Исходя
из состава оксида (МеО), степень окисления
металла в нем равна двум. Тогда из
соотношения Мэкв
= Аr/В
находим атомную массу металла:
Аr
= Мэкв
∙В = 32·2 = 64. Это – медь (АCu
= 63,5 ≈ 64).
Следовательно,
формула оксида CuO.
Соседние файлы в папке пособие общ химия
- #
- #
Какова эквивалентная масса серы (S), если 4 грамма ее окисляются 2,8 литрами кислорода (O) (нормальные условия)?
Решение задачи
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
Учитывая, что кислород – газ, вычислим массу кислорода, по формуле перерасчета, устанавливающей связь между объемом газа и массой:
Получаем:
m (O2) = 32 ∙ 2,8 / 22,4 = 4 (г).
Учитывая, что молярная масса эквивалентов кислорода (O) равна 8 г/моль, определим эквивалентную массу серы (S) по закону эквивалентов:
Откуда выразим эквивалентную массу серы (S):
Получаем:
M экв (S) = 4 ∙ 8 / 4 = 8 (г/моль).
Ответ:
эквивалентная масса серы (S) равна 8 г/ моль.
Задачи на эквивалент и закон эквивалентов
Задача №1.
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Задача №2.
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
Задача №3.
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Задача №4.
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Задача №5.
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Задача №6.
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
Задача №7.
1,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Задача №8.
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Задача №9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
Задача №10.
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, из-меренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Задача №11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Задача №12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Задача №13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Задача №14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Задача №15.
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты
Решение:
Задача №16.
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Задача №17.
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Задача №18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Вопросы для самоконтроля
Задача №19.
От чего зависит эквивалент химического элемента: а) от валентности элемента; б) всегда является постоянной величиной?
Решение:
Задача №20.
Какая формула правильно выражает закон эквивалентов:
а) ; б)
Решение:
Задача №21.
Фосфор образует два различных по составу хлорида. Эквивалент какого элемента сохраняется в этих соединениях постоянным: а) хлора; б) фосфора?
Решение:
Задача №22.
Выбрать правильные значения эквивалентных объемов кислорода и водоро-да при нормальных условиях: а) 11,2л O2 и 22,4л H2 б) 11,2л O2 и 11,2л H2 в.) 5,6л O2 и 11,2л H2.
Решение:
Задача №23.
Эквивалентная масса металла равна 12 г/моль. Чему равна эквивалентная масса его оксида: а) 24 г/моль; б) нельзя определить; в) 20 г/моль?
Решение:
Задача №24.
Эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кисло-рода. Во сколько раз масса оксида больше массы металла: а) в 1,5 раза; б) в 2 раза; в) в 3 раза?
Решение:
Задача25.
Сера образует хлориды S2Cl2 и SCl2, эквивалентная масса серы в SCl2 равна 16г/моль. Выбрать правильное значение эквивалентной массы серы в S2Cl2: а) 8 г/моль;
б) 16 г/моль; в) 32 г/моль.
Решение:
Задача26.
Одинаков ли эквивалент хрома в соединениях CrCl3 и Cr2(SO4)2: а) да; б) нет?
Решение:
Задача27.
Одинакова ли эквивалентная масса железа в соединениях FeCl2 и FeCl3: а) да; б) нет?
Решение:
Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.
Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:
Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.
В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.
А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.
Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.
Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:
Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:
Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.
Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.
Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:
В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:
И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.
В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:
В другой реакции гидроксида калия и фосфорной кислоты:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:
И в третьем случае:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:
Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:
Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.
Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?
Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?
Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:
Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.
Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:
У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:
Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:
Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:
Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:
Например:
Для оснований:
Например:
Для кислот:
Например:
Для солей:
Например:
Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.