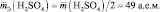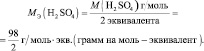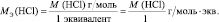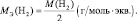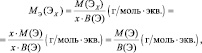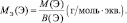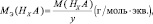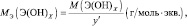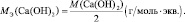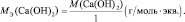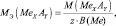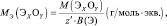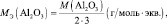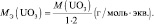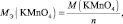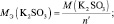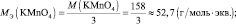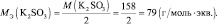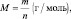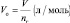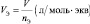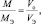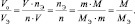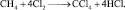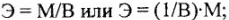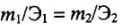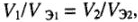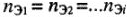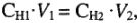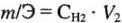Лучший ответ по мнению автора
|
|||||||||||||||
§ 2.1.2. Эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 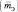
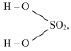
Например, если серная кислота (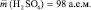
М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
взаимодействует с NaOH по реакции:
Н2SO4 + 2NaOH = Na2SO4 + 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl + NaOH = NaСl + Н2О;
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
где y – основность кислоты, т. е. количество ионов H+, принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 + NaOH = NaНSO4 + Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н+, принимающих участие в процессе.
Для оснований (Э(ОН)Х):
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 + 2НСl = СаСl2 + 2Н2О;
А для процесса:
Са(ОН)2 + НСl = СаОНСl + Н2О;
Для солей (МеХАу, где Ме – металл):
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
Для оксидов (ЭХОY):
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 + 6HCl = 2АlCl3 + 3H2O;
Э ≡ Al;
а для реакции:
UO3 + 2HCl = UO2Cl2 + H2O;
Э ≡ UO2;
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 + 3 K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH;
где n – количество электронов, получаемых перманганатом калия
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):
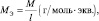
где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
из последних двух равенств вытекает соотношение
в котором все величины являются параметрами одного и того же газа.
Действительно:
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 + 3КОН = К3РО4 + 3Н2О;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4 + КОН = КН2РО4 + Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 + ВаСl2 = ВаSO4 + 2NaСl;
Na2SO4 + H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O + 2НСl = 2NaСl + Н2О;
Na2O + Н2О = 2NaOН.
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 + 3H2SO4 = Аl2(SO4)3 + 6Н2О;
Аl(OH)3 + H2SO4 = АlOHSO4 + 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«РОСТОВСКИЙ ГОСУДАРСТВЕННЫЙ СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ»
Утверждено на заседании кафедры химии 17.11.2011 г.
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ Методические указания
по дисциплине «Химия» для бакалавров по направлениям:
«Строительство», «Стандартизация и метрология», «Товароведение», «Технология художественной обработки материалов», «Техносферная безопасность», «Эксплуатация транспортно-технических машин и комплексов», «Технология транспортных процессов» всех профилей дневного и заочного отделений
2
УДК 541.2
Химический эквивалент: методические указания по дисциплине «Химия» для бакалавров.– Ростов н/Д: Рост. гос. строит. ун-т, 2012. – 16 с.
Изложены сведения по определению эквивалентных масс простых и сложных соединений. Описана методика определения эквивалентной массы магния по объему вытесненного водорода.
Предназначены для бакалавров 1-го курса, обучающихся по направлениям «Строительство», «Стандартизация и метрология», «Товароведение», «Технология художественной обработки материалов», «Техносферная безопасность», «Эксплуатация транспортно-технических машин
икомплексов», «Технология транспортных процессов» всех профилей дневного
изаочного отделений.
Электронная версия находится в библиотеке, ауд. 224.
УДК 541.2
Составитель доц. М.А. Таутиева
Редактор Н.Е. Гладких Темплан 2012 г., поз. 76
__________________________________________________________________
Подписано в печать 6.12.11
Формат 60×84/16. Бумага белая. Ризограф. Уч.-изд.л. 0,7. Тираж 100 экз. Заказ
__________________________________________________________________
Редакционно-издательский центр Ростовского государственного строительного университета
344022, Ростов-на-Дону, ул. Социалистическая, 162
© Ростовский государственный строительный университет, 2012
3
Правила техники безопасности при выполнении лабораторной работы
«Определение химического эквивалента»
Все мероприятия по технике безопасности при проведении лабораторной работы сводятся к правильной работе с химическими
реактивами.
1.Перед началом лабораторных работ каждый студент должен ознакомиться с правилами техники безопасности и строго их выполнять.
2.Без разрешения преподавателя нельзя проводить никаких опытов,
не предусмотренных планом работы.
3.Во время работы не следует набирать кислоту при помощи пипетки, для этого рекомендуется использовать мерный цилиндр на 10 мл.
4.Присоединяя пробирку к прибору, соблюдать осторожность во избежание порезов.
Правила оформления лабораторной работы
1. Отчёт о выполнении лабораторной работы записывается в специальной лабораторной тетради, объём которой должен быть достаточным для оформления всех работ, включённых в настоящий практикум по общей химии.
Запрещается вести записи на отдельных листках и черновых тетрадях.
2. В лабораторной тетради записываются следующие данные:
а) дата;
б) номер и название работы;
в) название эксперимента;
г) схема и рисунок основного прибора;
д) химические формулы и расчеты эксперимента;
ж) наблюдение в ходе проведения опыта (интенсивность процесса,
условия его проведения, сопутствующие его явления;
выделение газа и т.д.);
4
з) выводы (таблицы, итоговые обобщения).
3. Всё оформление работы проводится во время занятий, по окончании которых студент предъявляет лабораторную тетрадь преподавателю на проверку.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Химический эквивалент представляет собой одну из важнейших характеристик химического элемента. Экспериментально установлено, что различные вещества реагируют друг с другом в определенных количественных соотношениях. Так, содержание водорода в воде составляет
11,11%, кислорода – 88,89 %. Это означает, что они реагируют между
собой в массовом соотношении 1: 8, а в молярном соотношении 2 : 1. Эти количества равноценны (эквивалентны) по отношению друг к другу.
Эквивалентом элемента ( Э ) называют такое его количество,
которое соединяется с 1 молем атомов водорода или замещает то же
количество атомов водорода в химических реакциях. Например, в
соединении водорода с кислородом – воде ( Н2О) – на 1 моль атомов
|
приходится, как видно из |
формулы |
соединения, |
моля атомов |
кислорода. |
|||||||||||
|
Следовательно, эквивалент |
кислорода равен |
моля атомов кислорода. |
В |
||||||||||||
|
соединении |
водорода |
с |
азотом |
NH3 – на |
1 моль атомов |
водорода |
|||||||||
|
приходится |
моля |
атомов |
азота, следовательно, эквивалент азота в этом |
||||||||||||
|
соединении равен |
моля атомов азота. |
||||||||||||||
|
При |
определении |
эквивалента |
элемента |
необязательно исходить |
из |
его соединения с водородом. Эквивалент можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен.
При расчетах используется эквивалентная масса Мэ – масса одного

5
эквивалента. Она имеет размерность г/экв. В приведенных выше
соединениях (Н2О, NH3) эквивалентные массы будут
|
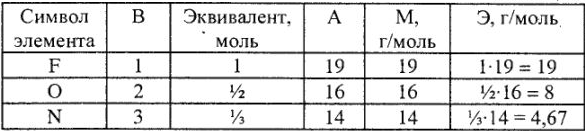
Мэ (Н) = 1 г/экв, Мэ (О) = 16 : 2 = 8 г/экв, |
Мэ (N) = 14 : 3 = 4,67 г/экв. |
||||||
|
Поскольку эквивалент измеряется в молях, то часто используется |
|||||||
|
размерность г/моль. |
|||||||
|
Эквивалентная масса |
элемента связана |
с мольной (атомной) массой |
|||||
|
элемента. Она |
равна мольной (атомной) массе, деленной на валентность |
||||||
|
элемента в данном химическом соединении. |
|||||||
|
Мэ (элемента) = |
. |
||||||
|
Эквивалентная масса может быть переменной величиной, так как зависит |
|||||||
|
от валентности |
элемента в различных соединениях. Например, эквивалентная |
||||||
|
масса серы в разных соединениях: |
|||||||
|
а) сероводороде H2S Мэ (S) = 32 : 2 = 16 г/экв; |
|||||||
|
б) оксиде серы (IV) SO2 |
Мэ (S) = 32 : 4 = 8 г/экв; |
||||||
|
в) оксиде серы (VI) SO3 |
Мэ (S)= 32 : 6 = 5,3 г/экв. |
Понятие об эквивалентах и эквивалентной массе распространяется и на сложные соединения (оксиды, кислоты, основания, соли). Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним
эквивалентом любого другого элемента.
Эквивалентная масса сложного вещества может иметь различные значения в зависимости от характера реакции, в которую вступает данное
вещество, и от того, какой продукт при этом образуется.
Эквивалентная масса кислоты Мэ (кислоты) равна молярной массе кислоты,
деленной на основность кислоты (число атомов водорода, замещенных в
данной реакции на металл).
Мэ (кислоты) = .

6
Например, эквивалентная масса кислоты в реакции
H2SO4 + KOH = KHSO4 + H2O;
Мэ (Н2SO4) = = 98 г/экв,
а в реакции
H2SO4 + Mg = MgSO4
эквивалентная масса той же кислоты вдвое меньше, так как в этой реакции замещено два катиона водорода:
Мэ (H2SO4) = = 49 г/экв.
Эквивалентная масса основания Мэ(основания) равна молярной массе основания, деленной на кислотность этого основания (число гидроксогрупп,
замещенных на кислотный остаток).
Мэ (основания) = .
Например, эквивалентная масса основания Mg(OH)2 в реакции Mg(OH)2
+ HСl = MgOHCl + H2O;
Мэ (Мg(OH)2) = = 58 г/экв,
а в реакции
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
эквивалентная масса того же основания в два раза меньше
Мэ (Мg(OH)2) = = 29 г/экв.
Эквивалентная масса соли Мэ(соли) равна молярной массе соли, деленной на произведение валентности металла (ВМе) на число его атомов (n).
|
Мэ(соли) = |
. |
|||
|
Например, |
||||
|
Мэ (Na2SO4) = |
= 71 г/экв. |
|||
7
Эквивалентная масса оксида равна молярной массе оксида, деленной на произведение валентности элемента ( Вэл) на число его атомов (n).
|
Мэ (оксида) = |
. |
|||
|
Например, |
||||
|
Мэ (Al2O3) = |
= 17 г/экв. |
|||
Молярную массу эквивалента любого сложного соединения можно определить по сумме эквивалентных масс составляющих его частиц. Например:
а) молярная масса гидроксида натрия равна сумме молярных масс
эквивалентов металла и гидроксогруппы, т.е.
Мэ (основания) = Мэ (металла) + Мэ (гидроксогруппы);
Мэ (NaOH) = Mэ (Na+) + Mэ (OH—) = 23 + 17 = 40 г/экв ;
б) эквивалентная масса кислоты равна сумме эквивалентных масс
водорода и кислотных остатков
Мэ (кислоты) = Мэ (Н+) + Мэ (кислотного остатка);
Мэ (H2SO4) = Мэ (Н+) + Мэ (S ) = 1 + 48 = 49 г/экв;
в) эквивалентная масса соли равна сумме эквивалентных масс металла и
кислотного остатка
|
Мэ (соли) = Мэ (металла) + Мэ (кислотного остатка); |
|||||||
|
Мэ (Al2(SO4)3) = Мэ (Al3+) + Mэ (S |
) = |
+ |
= 57 г/экв; |
||||
|
г) эквивалентная масса оксида равна сумме эквивалентных масс |
|||||||
|
кислорода и элемента |
|||||||
|
Мэ (оксида) = Мэ (элемента) + Мэ (кислорода); |
|||||||
|
Мэ (МgO) = Mэ (Mg2+) + Mэ (О2-) = |
+ |
= 20 г/экв. |
|||||

|
8 |
|
|
Закон эквивалентов |
(Рихтер, 1792 г.) |
|
Химические элементы (сложные |
соединения) соединяются или |
замещают друг друга в весовом соотношении, равном отношению их эквивалентных масс
= или = ,
где m1 и m2 – массы реагирующих веществ (г, кг, %).
Если одно из веществ находится в газообразном состоянии, закон эквивалентов записывается следующим образом:
=,
где m1 и Мэ1 – масса и эквивалентная масса твердого или жидкого вещества;
V2 и Vэ2 – объем и молярный объем эквивалента газообразного вещества;
Vэ – молярный объем эквивалента газа (эквивалентный объем) при нормальных условиях. Как известно, моль любого газа при нормальных условиях занимает объем 22,4 л. Так как масса моля водорода равна 2 г, а масса эквивалента – 1 г, то эквивалентный объем водорода будет в два раза меньше
|
молярного, т.е. |
Vэ (Н) = 22,4 : 2 = 11,2 л/экв. |
|||
|
Молярная масса кислорода |
32 г/ моль соответствует объему 22,4 л. Т.к. |
|||
|
эквивалентная масса кислорода – |
8 г/экв, то его эквивалентный объем |
|||
|
Vэ (О) = 22,4 : 4 = 5,6 л/экв; |
||||
|
Vэ = |
. |
|||
Примеры решения задач
Пример 1. Элемент образует гидрид, где его массовая доля 75%.
Определите эквивалентную массу элемента.
Решение. Эквивалентом элемента называется такое его количество,
которое соединяется с одним молем атомов водорода или замещает его в химических реакциях. Массу одного моля эквивалента элемента называют

9
молярной массой эквивалента. Эта задача решается на основе закона эквивалентов, согласно которому химические элементы (сложные вещества)
соединяются между собой или замещают друг друга в количествах,
пропорциональных их молярным массам эквивалентов.
Вычислим массовую долю водорода в гидриде
(Э) = 100% — 75% = 25%.
Согласно закону эквивалентов m(Эл) / m(H) =MЭ(Эл) / MЭ(H) . При образовании 100 г гидрида 25 г водорода соединяются с 75 г элемента. Исходя из этого
MЭ(Эл) = 1 г/моль 75 г / 25 г = 3 г/моль.
Пример 2. При сгорании 15 г металла образуется 28,32 г оксида металла.
Вычислите эквивалентную массу металла.
Решение. Эквивалентная масса кислорода MЭ (О) = 8 г/моль. Масса кислорода в оксиде m (O) = 28,32 — 15,00 = 13,32 г. Тогда согласно закону эквивалентов:
MЭ(Ме) = МЭ(О) m(Me) / m (O) = 8 г/моль 15г / 13,32 г = 9 г/моль.
Пример 3. Рассчитайте молярную массу эквивалента металла, если
1,168 г его вытеснили из кислоты 438 мл водорода, измеренного при 17оС и давлении 98642 Па.
Решение. Приведем объем вытесненного водорода к нормальным условиям, воспользовавшись объединенным газовым уравнением
=,
V0 = P V Т0 / P0 Т = 98642 438 273 / 1,013 10 5 298 = 401,5 мл.
Эквивалентный объем водорода VЭ ( H2 ) = 11,2 л/моль при нормальных условиях, поэтому
m(Me) / V (H2) = MЭ (Ме) / VЭ (H2) ;
MЭ (Me) = 1,168 г 11,2 л/моль / 0,4015 л = 32,58 г/моль.

10
Пример 4. На нейтрализацию 0,471 г фосфористой кислоты израсходовано 0,644 г KOH. Вычислите молярную массу эквивалента кислоты.
Решение. Эквивалентная масса КОН равна ее молярной массе, так как основание содержит одну гидроксогруппу и составит MЭ (КОН) =56 г/моль.
Тогда согласно закону эквивалентов:
m (кислоты) / m (КОН) = MЭ (кислоты) / MЭ (КОН) ;
MЭ (кислоты) = 56 г/моль 0,471 г / 0, 644 г = 40, 96 г/моль.
2. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ
ЭКВИВАЛЕНТНЫХ МАСС
Экспериментально эквивалентные массы соединений могут быть определены несколькими способами:
а) метод прямого определения:
4Al + 3O2 = 2Al2O3;
=;
б) аналитический метод:
– эквивалентная масса определяется по данным анализа, когда известен
количественный состав соединения данного элемента с другим элементом,
эквивалентные масса или объем которого известны.
|
Например, известно, что в хлориде |
соответствующего металла |
|
|
содержится |
20,2 % ( по массе) металла, |
эквивалентная масса хлора |
35,5 г/экв. Нужно определить эквивалентную массу металла.
=, где m (Cl) = 100 – m (Ме);
в) электрохимический метод:
– химический эквивалент определяется на основе закона Фарадея,
согласно которому 96500 Кл электричества выделяют из электролита при электролизе один эквивалент вещества. Закон Фарадея выражается следующим
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Моль — количество вещества (n), в котором содержится число структурных частиц (молекул, атомов, ионов и др.), равное постоянной Авогадро (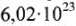
Например: 
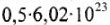
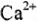
Молярная масса (М) — масса 1 моля вещества, численно равная его относительной молекулярной (атомной) массе. При использовании термина «молярная масса» также рекомендуется указывать вид частицы, молярная масса которой определяется.
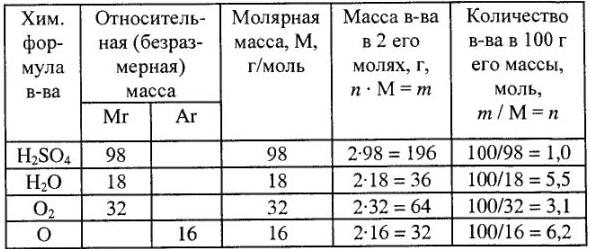
Например, 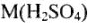
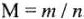
Обозначения и числовые значения некоторых терминов, а также элементарные расчеты приведены в табл. 1.
Молярная масса эквивалента (Э) — масса 1 моля эквивалента.
В химии большое практическое значение имеют такие характеристики элементов (для атомов) или веществ (для молекул), как эквиваленты, или молярная масса эквивалента.
Эквивалент — такое реальное количество вещества, которое присоединяет или замещает 1 моль атомов водорода в химических реакциях. Эквиваленты выражаются в молях, а молярная масса эквивалента — в г/моль.
Таблица 1
Различают молярные массы эквивалентов элементов, простых и сложных веществ. Молярные массы рассчитывают по формулам:
элементов:
простых и сложных веществ: 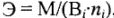
где Э — молярная масса эквивалента, г/моль; М — молярная масса, г/моль; 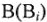
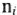
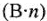
Молярная масса эквивалента элемента в соединениях определяется делением молярной массы его атомов на валентность. Молярная масса численно равна его относительной атомной массе: 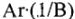
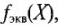
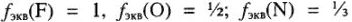
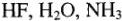
Определение эквивалента и эквивалентной массы элементов фтора, кислорода, азота в соединениях 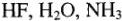
Таблица 2
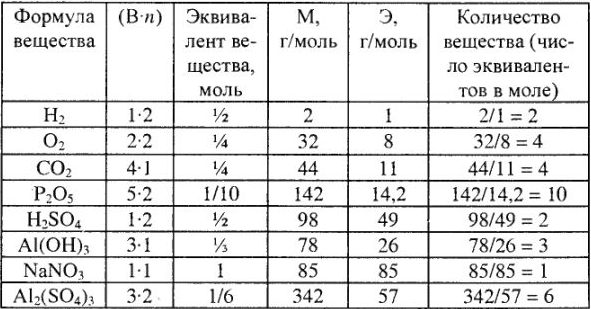
Эквивалентные массы простых веществ равны их молярной массе, деленной на суммарную валентность атомов (В-n).
Молярные массы эквивалентов кислот, оснований и солей в реакциях обмена выражаются через молярную массу, деленную на произведение абсолютного значения заряда одного из ионов на число их в соединениях. Причем молярная масса эквивалента кислоты равна ее молярной массе, деленной на ее основность в реакции (число водородных ионов, участвующих в химической реакции), а молярная масса основания — молярной массе, деленной на кислотность основания в реакции (число гидроксильных групп, принимающих участие в химической реакции).
Расчет эквивалентов, молярные массы эквивалентов и число эквивалентов в молярной массе для простых и сложных веществ приведены в табл. 3.
Таблица 3
Обратите внимание: число эквивалентов (молярная масса эквивалентов) в моле (молярной массе) вещества равно (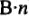
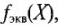
Молярный объем — объем, занимаемый молярной массой газообразного вещества. Молярный объем любого газа при нормальных условиях равен 22,4 л.
Эквивалентный объем — объем, занимаемый молярной массой эквивалента газообразного вещества. 1 моль водорода содержит 2 эквивалента. Объем молярной массы эквивалента водорода (1г/моль) — 22,4/2 = 11,2 л. 1 моль кислорода содержит 4 эквивалента. Объем молярной массы эквивалента кислорода (8г/моль) 22,4/4 = 5,6 л.
Закон эквивалентов
Отношения масс (объемов) реагирующих друг с другом веществ равны или пропорциональны их химическим эквивалентным массам (эквивалентным объемам).
Математические выражения закона эквивалентов:
а) для любых веществ с известной массой:
б) для газов с известным объемом:
где 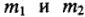
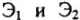
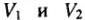
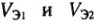
Следствие закона эквивалентов
Вещества реагируют друг с другом равным числом эквивалентов (молярных масс эквивалентов).
Математические выражения следствия закона эквивалентов:
а) для любых веществ с известным количеством эквивалентов (эквивалентных масс):
б) для растворов с известной молярной концентрацией эквивалента:
где 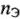
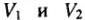
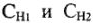
Рациональное решение задач сводиться к правильному выбору формулы из 1-4. При необходимости можно приравнять левую часть одного из приведенных уравнений к правой части любого другого.
Например, для решения реакции взаимодействия твердого вещества с раствором определенной молярной концентрации эквивалента (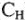
Эта теория взята со страницы подробного решения задач по всем темам химии:
Решение задач по химии
Возможно эти страницы вам помогут: