В растворе объёмом 300мл содержится бинарный электролит массой 2,55г, а его степень диссоциации в этом растворе по экспериментальным данным составляет 86%. Осмотическое давление раствора при 19 градусах Цельсия равно 3,495*10^5 Па. Найдите молекулярную массу электролита.
Какой здесь ход решения? Знаю формулу P(осмотическое )= См*R*T.(Из этого уравнения можно найти молярную концентрацию(как я понял это для электролита)). А дальше как решать?
Изменено 1 Ноября, 2015 в 13:18 пользователем sfanter
Добавил:
Io
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
Концентрация растворов
Скачиваний:
12
Добавлен:
16.06.2021
Размер:
614.58 Кб
Скачать

Т = t0C + 273 = 25 + 273 = 298K,
G0х.р. = − 71,0 − 298·(−0,021) = −64,7 кДж.
Ответ: Так как G0х.р. < 0, реакция протекает в прямом направлении.
Пример 4. При какой температуре наступит равновесие в системе:
2CH4(г) = C2H2(г) + 3H2(г)?
Решение:
В прил. 1 находим значения энтальпий образования для веществ, участвующих в реакции:
H0(CH4) = −74,9 кДж/моль;
H0(C2H2) = 226,8 кДж/моль;
H0(H2) = 0 кДж/моль (простое вещество). По следствию из закона Гесса
H0х.р. = H0(C2H2) + 3 H0(H2) − 2 H0(CH4),
H0х.р. = 226,8 + 3·0 − 2(−74,9) = 376,6 кДж.
Аналогично находим изменение энтропии, используя стандартные значения из прил. 1:
S0(CH4) = 186,2 Дж/моль · К;
S0(C2H2) = 200,8 Дж/моль · К; S0(H2) = 130,5 Дж/моль · К,
S0х.р. = S0(C2H2) + 3S0(H2) − 2S0(CH4),
S0х.р. = 200,8 + 3·130,5 − 2·186,2 = 219,9 Дж/К = 0,2199 кДж/К.
Теперь можно рассчитать температуру, при которой достигается равновесие:
|
T |
H |
х0. р. |
376,6 |
1712К . |
||
|
S |
0 |
0,2199 |
||||
|
х. р. |
||||||
Ответ: Травн = 1712 К.
21
Пример 5. Рассчитайте значение стандартной энтальпии реакции образования одного моля оксида железа (III) из простых веществ по следующим термохимическим уравнениям:
|
2Fe(т) + О2(г) = 2FeO(т); |
H0х.р. = −532 кДж, |
|
|
4FeO(т) + О2(г) = 2Fe2O3(т); |
H0х.р. = −584 кДж. |
|
|
Решение: |
||
|
Получить оксид железа (III) из простых веществ можно либо |
||
|
сразу по реакции |
||
|
2Fe + 3/2 О2 = Fe2O3; |
H0х.р.(1), |
|
|
либо в два этапа, сначала получив оксид железа (II): |
||
|
2Fe + O2 = 2FeO; |
H0х.р.(2) |
|
|
2FeO + ½ O2 = Fe2O3; |
H0х.р.(3) |
Согласно закону Гесса, тепловой эффект химической реакции зависит только от природы и состояния исходных веществ и продуктов реакции, но не зависит от пути перехода системы из начального в конечное состояние. То есть
H0х.р.(1) = H0х.р.(2) + H0х.р.(3)
Очевидно, что H0х.р.(2) равен тепловому эффекту первой из указанных в задании реакций:
H0х.р.(2) = −532 кДж.
В то же время H0х.р.(3) равен половине теплового эффекта второй из указанных в задании реакций:
H0х.р.(3) = −584/2 = −292 кДж.
Значит, тепловой эффект реакции получения одного моля оксида железа (III) из простых веществ H0х.р.(1) можно рассчитать:
H0х.р.(1) = −532 + (−292) = −824 кДж. Ответ: H0х.р.(1) = −824 кДж.
22

3. Растворы неэлектролитов и электролитов
Некоторые свойства растворов зависят только от количества частиц растворенного вещества и не зависят от его природы. К таким свойствам относятся, в первую очередь, осмотическое давление и изменение температур замерзания и кипения растворов по сравнению с соответствующими температурами чистого растворителя.
3.1. Замерзание и кипение растворов
Все растворители имеют определенные температуры замерзания (кристаллизации) и кипения. Присутствие в них растворенного вещества понижает температуру замерзания и повышает температуру кипения на некоторую величину t. Для разбавленных растворов неэлектролитов эту величину можно рассчитать по следствию из закона Рауля:
tзам = Ккр · Сm ; Δtкип = Кэб · Сm ,
где Ккр – криоскопическая постоянная; Кэб – эбуллиоскопическая постоянная;
Сm – моляльная концентрация.
Криоскопическая и эбуллиоскопическая постоянные – константы, зависящие только от природы растворителя. Значения этих констант приводятся в справочниках. Например, для воды Ккр = 1,86;
Кэб = 0,52.
Моляльная концентрация, или моляльность, показывает, сколько молей растворенного вещества приходится на 1000 граммов растворителя.
Моляльность может быть рассчитана по формуле:
|
Cm = |
m(вещества) 1000 |
, |
|
|
M (вещества) m( растворителя) |
|||
где m(вещества) – масса растворенного вещества, г; m(растворителя) – масса растворителя, г;
M(вещества) – молярная масса растворенного вещества, г/моль.
23

В растворах электролитов при равной молярной концентрации количество частиц больше, чем в растворах неэлектролитов. Это связано с диссоциацией молекул на ионы. Увеличение числа частиц за счет диссоциации молекул учитывают с помощью изотонического коэффициента (i). Этот коэффициент зависит от степени диссоциации (α) и от числа ионов (n), на которые диссоциирует одна молекула. Например:
HCl 

Al2(SO4)3 
Зависимость изотонического коэффициента от числа ионов и степени диссоциации имеет вид:
i 1 n 1 .
Формулы для расчета изменения температур замерзания и кипения для электролитов можно записать в виде:
tзам = i · Ккр · Сm ;
Δtкип = i · Кэб · Сm .
3.2. Осмотическое давление
Осмосом называется процесс односторонней диффузии молекул растворителя в раствор через полупроницаемую перегородку. Мерой интенсивности этого процесса является осмотическое давление.
Осмотическое давление растворов неэлектролитов зависит от концентрации раствора и температуры. Эта зависимость имеет вид:
Росм = СМ · R · T,
где R – универсальная газовая постоянная, R = 8,31 Дж/моль · К; Т – абсолютная температура; СМ – молярная концентрация раствора.
24

Молярная концентрация (или молярность) показывает, сколько молей растворенного вещества содержится в одном литре раствора. Она может быть рассчитана по формуле:
|
CM = |
m(вещества) |
. |
|
|
M (вещества) V ( раствора) |
|||
Для растворов электролитов при расчете осмотического давления также следует использовать изотонический коэффициент:
Росм = i · СМ · R · T.
3.3. Водородный показатель (рН)
Важнейшей характеристикой растворов электролитов является водородный показатель (рН), который определяет реакцию среды в растворе.
Водородный показатель определяется концентрацией ионов водорода в растворе:
рН = − lg[H+],
где [H+] – концентрация ионов водорода. Эту же зависимость можно записать:
[H+] = 10 pH .
Вода – слабый электролит, диссоциирующий на ионы водорода
|
и гидроксильные ионы: |
|
|
Н2О |
Н+ + ОН− |
В чистой воде концентрации ионов водорода и гидроксидионов одинаковы. При 250С концентрация этих ионов составляет 10 – 7 моль/л.
Произведение концентраций этих ионов – величина постоянная:
[H+]·[OH −] = 10–14.
Эта зависимость называется ионным произведением воды.
В нейтральных водных растворах, как и в чистой воде, [H+] = [OH −] = 10−7 моль/л. Значит, в нейтральной среде
рН = — lg(10−7) = 7.
Вкислой среде [H+] > [OH −]. Значит, рН < 7.
Вщелочной среде [H+] < [OH −] и рН > 7.
25

3.4. Примеры решения задач по теме «Растворы неэлектролитов и электролитов»
Пример 1. Температура кипения сероуглерода равна 46,20С. Раствор, содержащий 0,21 г серы в 20 г сероуглерода, кипит при 46,30С. Определите, из скольких атомов состоят молекулы серы, растворенной в сероуглероде. Эбуллиоскопическая постоянная для сероуглерода равна 2,4.
Дано:
t(р-ля) = 46,20С t(р-ра) = 46,30С
mS = 0,21 г
m(р-ля) = 20 г
Кэб = 2,4
ns = ?
Решение:
Повышение температуры кипения раствора составляет:
tкип = t(р-ра) − t(р-ля) = 46,3 – 46,2 = 0,10С.
Можно найти моляльную концентрацию раствора:
|
Δtкип = Кэб · Сm . |
||||||
|
Значит, |
Cm |
tкип |
0,1 |
0,041 моль / кг. . |
||
|
К эб |
2,4 |
|||||
Теперь можно найти молярную массу растворенного вещества:
|
Cm = |
m(вещества) 1000 |
. |
|
|
M (вещества) m( растворителя) |
|||
Следовательно,
|
M S |
mS |
1000 |
0,21 1000 |
256 г / моль . |
|
|
Сm |
mр ля |
0,041 20 |
|||
Так как атомная масса серы равна 32, значит, число атомов серы в молекуле равно
|
nS |
M S |
256 |
8 . |
||
|
AS |
32 |
||||
Ответ: Молекула серы состоит из восьми атомов.
26

Пример 2. Раствор, содержащий 0,1 моль электролита в 125 г воды, замерзает при температуре – 2,40С. Степень диссоциации электролита в этом растворе равна 0,6. На сколько ионов диссоциирует молекула электролита?
|
Дано: |
Решение: |
|
|
n(кол.в-ва) = 0,1 моль |
Для того чтобы определить количество |
|
|
m(H2O) = 125 г |
ионов, образующихся при диссоциации одной |
|
|
молекулы электролита, надо знать изотониче- |
||
|
tзам = − 2,40С |
||
|
ский коэффициент. |
||
|
α = 0,6 |
Изотонический коэффициент можно опре- |
|
|
делить, исходя из изменения температуры за- |
||
|
n(число ионов) = ? |
||
|
мерзания раствора, предварительно рассчитав |
||
|
моляльную концентрацию этого раствора. |
Найдем моляльную концентрацию раствора:
0,1 моль вещества растворяется в 125 граммах воды,
|
Х —————————————— |
1000 г |
|
X |
0,1 1000 |
0,8 |
моль, то есть Сm = 0,8 моль/кг. |
|
|
125 |
||||
Понижение температуры замерзания раствора по сравнению с температурой замерзания чистой воды составляет
tзам = tзам (Н2О) – tзам(р-ра) = 0 – (−2,4) = 2,40С.
Из зависимости
t = i · Kкр · Cm
определим изотонический коэффициент, зная, что для воды криоскопическая постоянная Ккр = 1,86:
|
i |
t |
2,4 |
1,6 . |
||
|
Ккр |
Сm |
1,86 0,8 |
|||
Теперь можно определить число ионов, образующихся при диссоциации одной молекулы растворенного вещества:
|
i |
1 |
n |
i 1 |
1 |
1,6 1 |
1 2. |
||
|
n |
1 ; |
0,6 |
||||||
Ответ: молекула диссоциирует на два иона.
27

Пример 3. Рассчитайте молярную массу гидрохинона, если раствор, содержащий 0,55 г этого вещества, при температуре 00С имеет осмотическое давление 22,7 кПа и занимает объем 500 мл.
Дано:
mв-ва = 0,55 г t = 00C
Pосм = 22,7 кПа Vр-ра = 500 мл
Мв-ва = ?
Решение:
Исходя из величины осмотического давления, можно определить молярную концентрацию раствора:
Росм = СМ · R · T,
Т = t0C + 273 = 0 + 273 = 273, R = 8,31 Дж/моль · К.
Следовательно,
|
CM |
Pосм |
22,7 |
0,01 моль / л. |
|||
|
R T |
8,31 273 |
|||||
По определению молярной концентрации
|
CM |
mв ва |
; |
||
|
М |
в ва Vр ра |
|||
Vр-ра = 500 мл = 0,5 л.
Значит,
|
M в ва |
mв ва |
0,55 |
110 г / моль. |
||
|
СM |
Vр ра |
0,01 0,5 |
|||
Ответ: молярная масса гидрохинона равна 110 г/моль.
Пример 4. Раствор, содержащий 22,4 грамма CuSO4, имеет объем 5 литров. Рассчитайте степень диссоциации сульфата меди, если при температуре 170С осмотическое давление раствора 121 кПа.
Дано:
m(в-ва) = 22,4 г
t = 170C
Pосм = 121 кПа
V(р-ра) = 5 л
α = ?
Решение:
Степень диссоциации можно определить, исходя из величины изотонического коэффициента.
Для определения изотонического коэффициента можно воспользоваться формулой для расчета осмотического давления.
Перед использованием этой формулы надо
28

рассчитать молярную концентрацию раствора.
По определению молярной концентрации, зная, что молярная масса сульфата меди равна 160 г/моль, можно записать:
|
CM |
mв |
ва |
22,4 |
0,028 моль / л. |
||
|
М в ва |
Vр ра |
160 5 |
||||
Так как
Т = t0C + 273 = 17 + 273 = 290 K, R = 8,31 Дж/моль · К и
Росм = i · СМ · R · T,
можно рассчитать величину изотонического коэффициента
|
i |
Pосм |
121 |
1,8 . |
||||||||
|
CM R T |
0,028 8,31 290 |
||||||||||
|
Сульфат меди диссоциирует на два иона |
|||||||||||
|
CuSO4 |
Cu2+ + SO42−, то есть n = 2. |
||||||||||
|
Значит, степень диссоциации |
|||||||||||
|
i |
1 |
1,8 |
1 |
0,8 . |
|||||||
|
n |
1 |
2 |
1 |
||||||||
Ответ: степень диссоциации соли 0,8 или 80%.
Пример 5. Концентрация гидроксид-ионов в растворе равна 10-5 моль/л. Определите рН этого раствора.
Дано:
[OH−] = 10−5 моль/л
рН = ?
Решение:
Используя ионное произведение воды, можно найти концентрацию ионов водорода в растворе:
[H+] · [OH−] = 10−14,
|
[H ] |
10 14 |
10 14 |
10 9 |
моль / л . |
||
|
[OH ] |
10 |
5 |
||||
Определим рН раствора:
рН = − lg[H+] = − lg(10−9) = 9.
Ответ: рН раствора равен 9.
29

Пример 6. В одном литре раствора содержится 0,56 г гидроксида калия. Определите рН этого раствора , считая диссоциацию КОН полной.
|
Дано: |
Решение: |
||||||
|
V(р-ра) = 1л |
Для того чтобы рассчитать величину рН, |
||||||
|
необходимо знать концентрацию ионов Н+. |
|||||||
|
m(КОН) = 0,56 г |
|||||||
|
В растворе |
щелочи концентрацию ионов |
||||||
|
α = 1 |
водорода можно определить, исходя из концен- |
||||||
|
трации ионов ОН−, используя ионное произве- |
|||||||
|
рН = ? |
|||||||
|
дение воды. |
|||||||
|
Зная, что молярная масса КОН равна 56, рассчитаем молярную |
|||||||
|
концентрацию раствора: |
|||||||
|
CM |
mKOH |
0,56 |
0,01 моль/ л. |
||||
|
M KOH Vр ра |
56 1 |
||||||
Так как из одного моля КОН образуется один моль ионов ОН−, при полной диссоциации щелочи
[OH−] = CM(KOH) = 0,01 = 10−2 моль/л.
Используя ионное произведение воды, найдем концентрацию
ионов водорода в растворе:
[H+] · [OH−] = 10−14,
|
[H ] |
10 14 |
10 14 |
10 12 |
моль / л . |
|
|
[OH ] |
10 |
2 |
|||
Определим рН раствора:
рН = − lg[H+] = − lg(10−12) = 12.
Ответ: рН раствора равен 12.
Пример 7. Определите рН 0,1М раствора уксусной кислоты (СН3СООН), степень диссоциации которой 1%.
Дано:
СМ(к-ты) = 0,1М
α = 1% = 0,01
рН = ?
Решение:
Уксусная кислота – одноосновная, то есть при ее диссоциации из одной молекулы кислоты образуется один ион Н+:
СН3СООН 
30
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Светило науки — 2432 ответа — 10471 помощь
1) Возьмем 100 г раствора. Если его концентрация равна 1%, значит в 100 г раствора содержится 1 г вещества, или на 99 г воды приходится 1 г вещества.
2) Повышение температуры кипения раствора по сравнению с температурой кипения воды (100°С) находят по формуле:
ΔТкип = i* К*m*1000)/m(H₂O)*M
где: ΔТкип = 0,5
где К — эбулиоскопическая константа, К = 0,52
m — масса растворенного вещества, в граммах. m = 1 г
m(H₂O) — масса воды, в граммах. m(H₂O) = 99 г
М — молярная масса растворенного вещества, г/моль.
i — постоянная Вант-Гоффа, определяется по формуле:
i = 1 + α(ν — 1)
где α — степень диссоциации, выраженная в долях единицы ; α = 0,8
ν — количество ионов, но которое диссоциирует растворенное вещество, ν = 2
i = 1 + 0,8(2 — 1) = 1,8
3) Находим из формулы молярную массу вещества:
М = i* К*m*1000)/m(H₂O)*ΔТкип = 1,8*0,52*1*1000/99*0,5 = 19 г/моль
Ответ: М = 19 г/моль
Да, что уж очень маленькая получилась молярная масса! Надеюсь, что в условии всё записано верно.
1 Найти электрохимический эквивалент натрия. Молярная масса натрия μ = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея
Решение:
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I=2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка
Решение:
3 Найти постоянную Фарадея, если при прохождении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Решение:
Согласно объединенному закону Фарадея
отсюда
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит N0=NА/z атомов или молекул.
Решение:
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.
Следовательно, элементарный заряд
5 Молярная масса серебра μ1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент . Найти электрохимический эквивалент золота k2, если молярная масса золота μ2 = 0,197 кг/моль, его валентность z2 = 3.
Решение:
По второму закону Фарадея имеем
отсюда электрохимический эквивалент золота
6 Найти массы веществ, выделившихся за время τ = 10 ч на катодах трех электролитических ванн, включенных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiSО4 и AgNО3. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см2. Электрохимические эквиваленты меди, никеля и серебра
Решение:
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
7 При никелировании изделий в течение времени τ = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля , его плотность
Решение:
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток I0=1,5А. Какую поправку надо внести в показание амперметра, если за время τ = 10 мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди .
Решение:
По первому закону Фарадея m = kIτ, где I-ток в цепи; отсюда I=m/kτ=1,6 А, т.е. в показание амперметра надо внести поправку
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время τ = 5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра .
Решение:
По первому закону Фарадея m = klτ, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kτ= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
10 Для серебрения ложек через раствор соли серебра в течение времени τ = 5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра μ = 0,108 кг/моль, его валентность z = 1 и плотность .
Решение:
Толщина слоя
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда . Молярные массы железа и хлора
.
Решение:
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
во второй ванне
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
12 При электролизе раствора серной кислоты (CuSO4) расходуется мощность N=37 Вт. Найти со-противление электролита, если за время t = 50 мин выделяется масса водорода m = 0,3 г. Молярная масса водорода μ = 0,001 кг/моль, его валентность z=1.
Решение:
13 При электролитическом способе получения никеля на единицу массы расходуется Wm= 10 кВт·ч/кг электроэнергии. Электрохимический эквивалент никеля . При каком напряжении производится электролиз?
Решение:
14 Найти массу выделившейся меди, если для ее получения электролитическим способом затрачено W= 5 кВт·ч электроэнергии. Электролиз проводится при напряжении V=10 В, к.п.д. установки η = 75%. Электрохимический эквивалент меди .
Решение:
К.п.д. установки
где q-заряд, прошедший через ванну. Масса выделившейся меди m=kq; отсюда
15 Какой заряд проходит через раствор серной кислоты (CuSO4) за время τ = 10 с, если ток за это время равномерно возрастает от I1=0 до I2 = 4А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди .
Решение: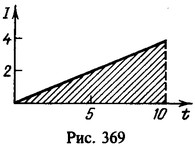
Заряд, протекший через раствор,
Нахождение заряда графическим путем показано на рис. 369. На графике зависимости тока от времени заштрихованная площадь численно равна заряду. Масса меди, выделившейся на катоде,
16 При рафинировании меди с помощью электролиза к последовательно включенным электролитическим ваннам, имеющим общее сопротивление R = 0,5 Ом, подведено напряжение V=10 В. Найти массу чистой меди, выделившейся на катодах ванны за время τ = 10 ч. Э.д.с. поляризации ε = 6 В. Электрохимический эквивалент меди .
Решение:
17 При электролизе воды через электролитическую ванну в течение времени τ = 25 мин шел ток I=20 А. Какова температура t выделившегося кислорода, если он находится в объеме V= 1 л под давлением р = 0,2 МПа? Молярная масса воды μ = 0,018 кг/моль. Электрохимический эквивалент кислорода .
Решение:
где R= 8,31 Дж/(молъ К)-газовая постоянная.
18 При электролитическом способе получения алюминия на единицу массы расходуется W1m = 50 кВт·ч/кг электроэнергии. Электролиз проводится при напряжении V1 = 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении V2 = 8,1 В?
Решение:
Загрузить PDF
Загрузить PDF
Молярность — это соотношение между молями растворенного вещества и объемом раствора.[1]
Чтобы получить подробное представление о том, как найти молярность раствора, когда даны моли, литры, граммы и/или миллилитры, читайте далее.
-
1
Запомните основную формулу для вычисления молярности. Молярность равна количеству молей вещества, поделенному на объем раствора в литрах.[2]
Следовательно, ее можно записать в следующем виде: молярность = моли растворенного вещества / литры раствора.- Пример: какова молярность раствора, содержащего 0,75 моль NaCl в 4,2 литрах?
-
2
Проанализируйте пример. Чтобы найти молярность, нужно знать количество молей и литров. Если в задаче даны оба этих значения, никаких предварительных расчетов делать не нужно.
- Пример:
- Моли = 0,75 моль NaCl
- Объем = 4,2 л
- Пример:
-
3
Разделите количество молей на количество литров. Получившееся соотношение даст вам количество молей на литр раствора, также известное как молярность.
- Пример: молярность = моли растворенного вещества / литры раствора = 0,75 моль / 4,2 л = 0,17857142
-
4
Запишите ответ. Округлите получившееся число до сотых или тысячных, в зависимости от требований вашего преподавателя. Когда вы записываете ответ, сокращайте «молярность» буквой «M» и указывайте химическую формулу растворенного вещества.
- Пример: 0,179 M NaCl
Реклама
-
1
Запомните основную формулу для вычисления молярности. Молярность выражают отношением количества молей растворенного вещества к литрам раствора, или его объему. В виде формулы молярность выражается следующим образом: молярность = моли растворенного вещества / литры раствора.[3]
- Пример: какова молярность раствора, полученного растворением 3,4 г KMnO4 в 5,2 л воды?
-
2
Проанализируйте задачу. Чтобы найти молярность, необходимо знать количество молей и количество литров. Если количество молей не дано, но известны объем раствора и масса растворенного вещества, то для того, чтобы продолжить решение, вам нужно рассчитать количество молей растворенного вещества.
- Пример:
- Масса = 3,4 г KMnO4
- Объем = 5,2 л
- Пример:
-
3
Найдите молярную массу растворенного вещества. Чтобы найти число молей, зная массу, или граммы, использованного растворенного вещества, нужно сначала определить его молярную массу.[4]
Это можно сделать, сложив отдельные молярные массы всех элементов, входящих в состав растворенного вещества. Найдите молярные массы элементов с помощью таблицы Менделеева.[5]
Сделайте это с каждым элементом.- Пример:
- Молярная масса K = 39,1 г
- Молярная масса Mn = 54,9 г
- Молярная масса O = 16,0 г
- Общая молярная масса = K + Mn + O+ O +O + O = 39,1+ 54,9 + 16,0 + 16,0 + 16,0 + 16,0 =158,0 г
- Пример:
-
4
Преобразуйте граммы в моли. Теперь, когда у вас есть молярная масса растворенного вещества, вам нужно умножить количество граммов растворенного вещества на коэффициент пересчета его формульной (молярной) массы.[6]
- Пример: граммы растворенного вещества * (1/молярная масса растворенного вещества) =3,4 г * (1 моль / 158 г) = 0,0215 моль
- Как видно в приведенном примере выше, граммы сокращаются и остаются только моли.
-
5
Разделите количество молей на количество литров. Теперь, когда у вас есть количество молей, вы можете разделить это значение на количество литров раствора для того, чтобы найти молярность.
- Пример: молярность = моли растворенного вещества / литры раствора = 0,0215 моль / 5,2 л = 0,04134615
-
6
Запишите полученный ответ. Следует округлить число до такого количества знаков после запятой, которого требует от вас ваш преподаватель. Обычно это два или три знака. Кроме того, когда вы записываете ответ, сокращайте «молярность» буквой «M» и указывайте растворенное вещество.
- Пример: 0,004 M KMnO4
Реклама
-
1
Запомните основную формулу. Чтобы найти молярность, нужно вычислить количество молей растворенного вещества в литре раствора. Миллилитры использовать нельзя. Общая формула, используемая для выражения молярности, имеет следующий вид: молярность = моли растворенного вещества / литры раствора.[7]
- Пример: какова молярность раствора, содержащего 1,2 моля CaCl2 в 2905 миллилитрах?
-
2
Проанализируйте задачу. Для вычисления молярности нужно знать количество молей и количество литров. Если объем дан в миллилитрах, а не в литрах, тогда вам придется перевести объем в литры, прежде чем продолжить расчет.
- Пример:
- Моли = 1,2 моль CaCl2
- Объем = 2905 мл
- Пример:
-
3
Переведите миллилитры в литры.[8]
Найдите количество литров, разделив количество миллилитров на 1000, так как в 1 литре содержится 1000 миллилитров. Обратите внимание, что вы также можете переместить запятую на три знака влево.- Пример: 2905 мл * (1 л / 1000 мл) = 2,905 л
-
4
Разделите количество молей на количество литров. Теперь, когда у вас есть количество литров, вы можете разделить количество молей растворенного вещества на это значение, чтобы получить молярность раствора.
- Пример: молярность = моли растворенного вещества / литры раствора = 1,2 моль CaCl2 / 2,905 л = 0,413080895
-
5
Запишите ответ. Округлите ответ в соответствии с требованиями вашего преподавателя (обычно до второго или третьего знака). Когда вы записываете ответ, сокращайте «молярность» буквой «M» и указывайте растворенное вещество.
- Пример: 0,413 M CaCl2
Реклама
-
1
Найдите молярность раствора, полученного растворением 5,2 г NaCl в 800 мл воды. Определите значения, данные в задаче: масса в граммах и объем в миллилитрах.
-
- Масса = 5,2 г NaCl
- Объем = 800 мл воды
-
-
2
Найдите молярную массу NaCl. Для этого сложите молярную массу натрия, Na, и хлора,Cl.
- Молярная масса Na = 22,99 г
- Молярная масса Cl = 35,45 г
- Молярная масса NaCl = 22,99 + 35,45 =58,44 г
-
3
Умножьте массу растворенного вещества на коэффициент пересчета его молярной массы. В данном примере молярная масса NaCl равна 58,44 г, соответственно, коэффициент пересчета будет равен 1 моль / 58,44 грамм.
- Моли NaCl = 5,2 г NaCl * (1 моль / 58,44 г) = 0,08898 моль = 0,9 моль
-
4
Разделите 800 мл воды на 1000. Поскольку в литре содержится 1000 мл, то, чтобы найти количество литров, вам нужно будет разделить количество миллилитров в этой задаче на 1000.
- Это действие также можно рассмотреть как умножение 800 мл на коэффициент пересчета 1 л / 1000 мл.
- Для ускорения процесса вы можете просто переместить десятичную запятую на три знака влево, ничего не перемножая и не деля.
- Объем = 800 л * (1 л / 1000 мл) = 800 мл / 1000 мл = 0,8 л
-
5
Разделите количество молей растворенного вещества на количество литров раствора. Чтобы найти молярность, вам необходимо разделить 0,09 моль, количество молей растворенного NaCl, на объем растворенного вещества в литрах.
- молярность = моли растворенного вещества / литры раствора = 0,09 моль / 0,8 л =0,01125 моль/л.
-
6
Приведите ответ в порядок. Округлите полученный ответ до двух или трех знаков после запятой и сократите молярность буквой «M».
- Ответ: 0,11 M NaCl
Реклама
Об этой статье
Эту страницу просматривали 112 031 раз.






















