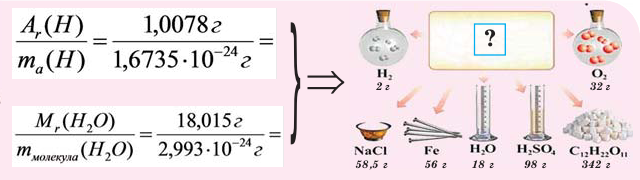
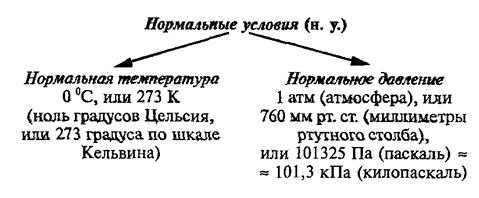
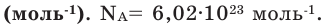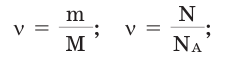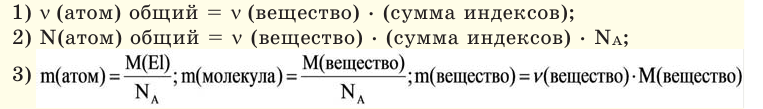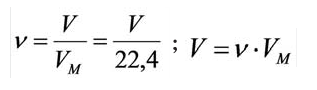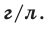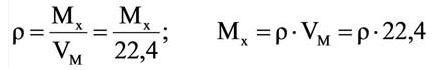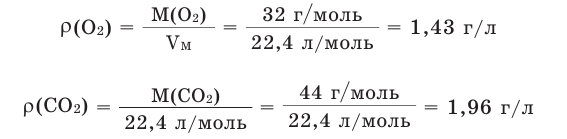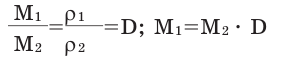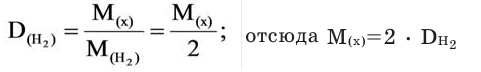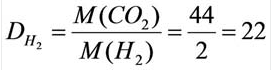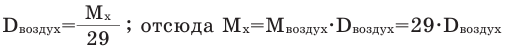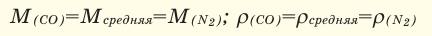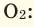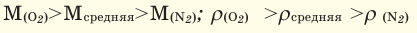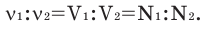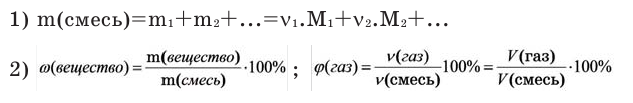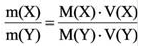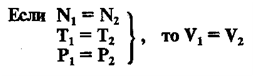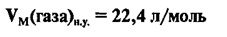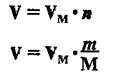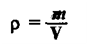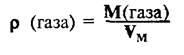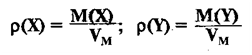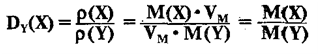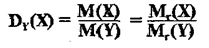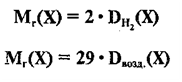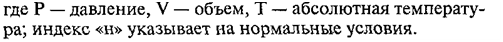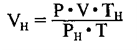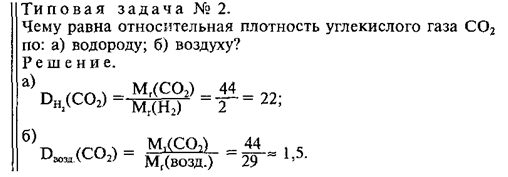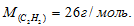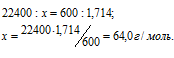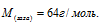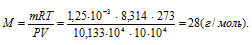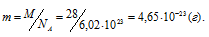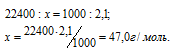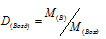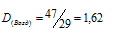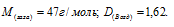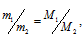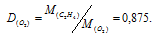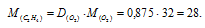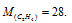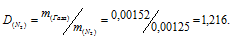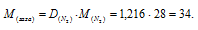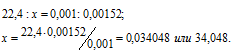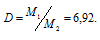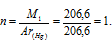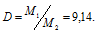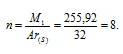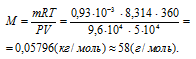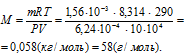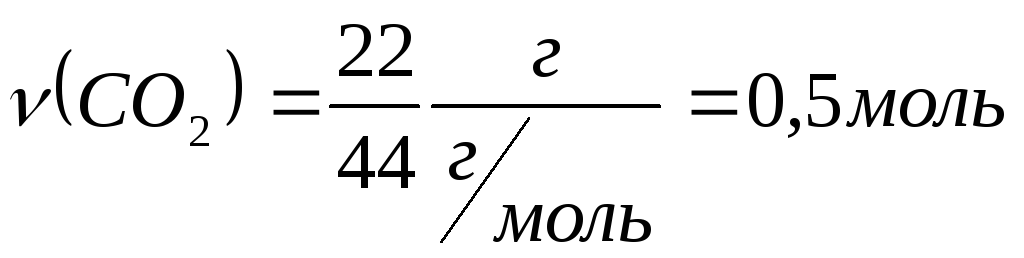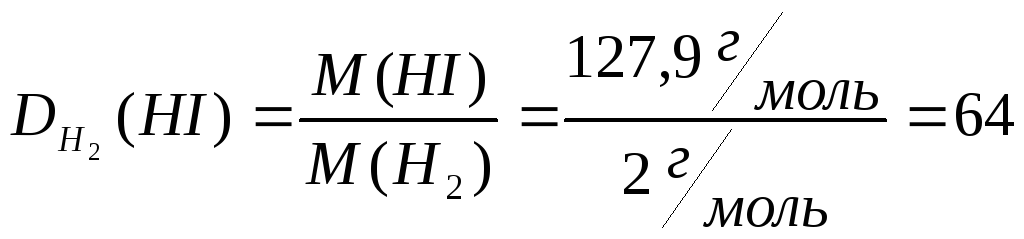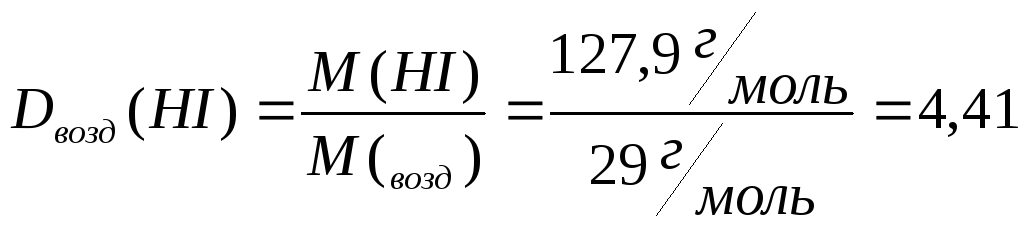В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

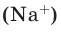

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 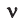
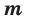
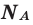
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса — измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
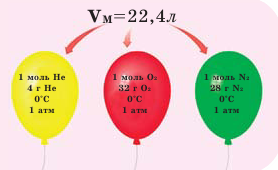
Закон Авогадро и молярный объём газов
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 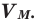
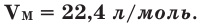
Здесь 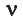
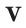
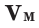
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 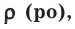
измерения —
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 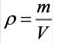
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу — водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 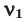
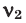
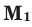
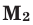

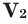
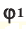
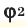
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 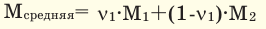
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 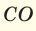
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 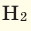
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
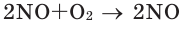
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
2.7. Закон
Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона
– Менделеева
В
газообразном состоянии расстояния между частицами вещества намного больше, чем
в жидком и твердом агрегатных состояниях. Эти расстояния намного больше
размеров молекул данного газа. Поэтому объем газа определяется не размером его
молекул, а расстояниями между ними. Эти расстояния зависят от внешних условий:
температуры и давления. При одинаковых внешних условиях расстояния между
молекулами различных газов одинаковы, поэтому:
В равных объемах
(V) различных газов при одинаковых внешних условиях (температуре Т и давлении
Р) содержится одинаковое число молекул (N) (Закон
Авогадро, 1811 г.).
Например,
при одинаковых температуре и давлении в 1 л водорода
Н2 и 1 л кислорода О2
содержится одинаковое число молекул, хотя размер молекул кислорода намного
больше размера молекул водорода.
Первое следствие из закона Авогадро
Одинаковое число
молекул различных газов при одинаковых условиях занимает одинаковый объем:
Следовательно,
объем одного моля любого газа при
определенных внешних условиях есть величина постоянная.
Объем
одного моля газа называется его молярным
объемом и обозначается VМ.
Молярный
объем газа зависит от температуры и давления.
В
химии обычно используют молярный объем газа при нормальных условиях.
Молярный объем
любого газа при н.у. равен 22,4 л/моль.
Например,
2 г водорода Н2 (1 моль) и
32 г кислорода О2 (1 моль) занимают одинаковый объем, равный
22,4 л.
Зная
молярный объем газа VМ ,
можно рассчитать объем V любого количества n и любой массы m газа:
Второе следствие из закона Авогадро
Второе
следствие используется для расчета относительных
плотностей газов.
Плотность
любого вещества p – это отношение
массы этого вещества m
к
его объему V:
Если
взять 1 моль любого газа, его масса равна молярной массе М, а объем равен молярному объему VМ.
Поэтому
плотность газа равна:
Возьмем
два газа – Х и Y – и обозначим их плотности и молярные массы соответственно p(Х), М(Х) и p(Y), М(Y).
Плотности этих газов равны:
Отношение
плотностей этих газов p(Х)/
p(Y) называется относительной плотностью газа Х по газу Y и
обозначается DY(X):
Таким
образом:
Относительная
плотность одного газа по другому газу равна отношению их молярных или
относительных молекулярных масс ( так как М и Мr численно равны):
Часто
плотности различных газов определяют по отношению к водороду, который является
самым легким из всех газов, и по отношению к воздуху.
Относительная
плотность любого газа Х по водороду равна:
Воздух
– это смесь газов, средняя относительная молекулярная масса воздуха равна 29.
Поэтому относительная плотность любого
газа Х по воздуху равна:
Относительные
плотности газов – величины безразмерные. Молекулярные (молярные) массы
неизвестных газов можно определять по относительным плотностям этих газов по
водороду или по воздуху:
В
расчетах, связанных с газами, часто приходится переходить от данных условий к
нормальным, или наоборот. При этом удобно пользоваться уравнением объединенного газового закона, выведенным французским
ученым Клапейроном и носящим его имя:
Из
этого уравнения можно рассчитать значение VН, если измерен объем газа
V при некоторых других условиях:
Соотношение
между давлением газа Р, его объемом V, количеством вещества (газа) n и
температурой Т описывается уравнением Клапейрона – Менделеева (уравнение
состояния идеального газа):
При
расчетах, связанных со смесями двух или нескольких газов, часто используют
понятие объемная доля газа в смеси,
которая обозначается буквой φ (фи):
Например,
объемные доли кислорода и азота в атмосферном воздухе равны приблизительно 21%
и 78% соответственно.
УПРАЖНЕНИЯ
1.
_____________________________________________________________
2.
_____________________________________________________________
3.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Какой
объем при нормальных условиях занимают:
а) 20 г аргона; б) 7,1 г хлора.
2.
Чему
равна масса: а) 1 л водорода; б) 1 л
кислорода.
3.
Рассчитайте
относительные плотности по водороду и по воздуху следующих газов: а) метана СН4; б)
кислорода О2.
4.
10
г некоторого газа при н.у. занимают объем 5,6 л. Определите молярную и
относительную молекулярную массу этого газа.
5.
Определите
молярную массу газа, относительная плотность которого: а) по водороду равна
32; б) по воздуху равна 2,45.
6.
Сколько
молекул содержится в 1,00 мл водорода при нормальных условиях.
7.
Какой
объем при н.у. занимают 27 * 1021 молекул газа.
8.
На
вопрос, какой объем займет 1 моль воды при нормальных условиях, получен ответ:
22,4 л. Правильный ли это ответ.
9.
Сколько
молекул углекислого газа находится в 1 л воздуха, если объемная доля СО2
составляет 0,03%.
10.
Определите объем, который занимают 0,07 кг азота N2
при 21оС и давлении 142 к Па.
|
1. При н.у. 22,4 л – это объем: |
|
|
а) 4 моль любого газа |
б) одной молекулы любого газа |
|
в) занимаемый 6,02 * 1023 |
г) занимаемый неоном, массой 40 г |
|
2. При одинаковой массе и внешних условиях для |
|
|
а) меньше значение молярной массы |
б) больше значение молярной массы |
|
в) нет верного ответа |
г) меньше объем, занимаемый газом |
|
3. Для какого из оксидов азота плотность паров по |
|
|
а) NO |
б) N2O |
|
в) NO2 |
г) N2O5 |
|
4. Для каких веществ объем 1 моль при н.у. равен 22,4 |
|
|
а) вода |
б) йод |
|
в) алюминий |
г) азот |
|
5. Чему равно число атомов в 5,6 л (н.у.) озона: |
|
|
а) 1,51 * 1023 |
б) 3,01 * 1023 |
|
в) 4,52 * 1023 |
г) 6,02 * 1023 |
|
6. Плотность паров серы по водороду при некоторых |
|
|
а) S8 |
б) S4 |
|
в) S2 |
г) S6 |
|
7. Укажите единицу молярного объема: |
|
|
а) моль/ л |
б) г/ моль |
|
в) л |
г) л/ моль |
|
8. Масса молекулы некоторого газа равна 7,304*10-23 |
|
|
а) 10 |
б) 11 |
|
в) 12 |
г) 13 |
|
9. Для какого газа плотность при н.у. составляет 1,63 г/л: |
|
|
а) оксид углерода (IV) |
б) аммиака |
|
в) хлороводорода |
г) метана |
|
10. Плотность |
|
|
а) 80 г/моль |
б) 80 а.е.м. |
|
в) 80 г |
г) 80 кг |
Ответы:
|
1 |
в |
|
2 |
а |
|
3 |
а |
|
4 |
г |
|
5 |
в |
|
6 |
в |
|
7 |
г |
|
8 |
б |
|
9 |
в |
|
10 |
б |
Определение молекулярных (мольных) масс веществ в газообразном состоянии
Задача 80.
Масса 200 мл ацетилена при нормальных условиях равна 0,232г. Определить мольную массу ацетилена.
Решение:
1 моль любого газа при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) занимает объём равный 22,4 л. Зная массу и объём ацетилена при нормальных условиях рассчитаем мольную массу его, составив пропорцию:
Ответ:
Задача 81.
Вычислить мольную массу газа, если масса 600 мл его при нормальных условиях равна 1,714г.
Решение:
1 моль любого газа при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) занимает объём равный 22,4л. Зная массу и объём ацетилена при нормальных условиях рассчитаем мольную массу его, составив пропорцию:
Ответ:
Задача 82.
Масса 0,001м3 газа (0 °С, 101,33 кПа) равна 1,25г. Вычислить: а) мольную массу газа; б) массу одной молекулы газа.
Решение:
а) Выразив данные задачи в системе единиц СИ (Р = 10,133 • 104 Па; V = 10 • 10–4 м3; m = 1,25 • 10-3 кг; Т = 273 К) и подставив их в уравнение Клапейрона- Менделеева (уравнение состояния идеального газа), находим мольную массу газа:
Здесь R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К); Т – температура газа, К; Р – давление газа, Па; V – объём газа, м3; М – мольная масса газа, г/моль.
Отсюда
б) 1 моль любого вещества содержит 6,02 . 1023 частиц (атомов, молекул), тогда масса одной молекулы рассчитывается из соотношения:
Ответ: М = 28 г/моль; m = 4,65 . 10-23 г.
Задача 83.
Масса 0,001 м3 газа при нормальных условиях равна 0,0021кг. Определить мольную массу газа и его плотность по воздуху.
Решение:
1 моль любого газа при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) занимает объём равный 22,4 л. Зная массу и объём газа при нормальных условиях рассчитаем мольную массу его, составив пропорцию:
Плотность газа по воздуху равна отношению мольной массы данного газа к мольной массе воздуха:
Здесь — плотность газа по воздуху; — мольная масса газа; — мольная масса воздуха (29 г/моль). Тогда
Ответ:
Задача 84.
Плотность этилена по кислороду равна 0,875. Определить молекулярную массу газа.
Решение:
Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы:
где m1/m2 — относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи:
Мольная масса кислорода равна 32г/моль. Тогда
Ответ:
Задача 85.
Масса 0,001 м3 некоторого газа при нормальных условиях равна 0,00152 кг, а масса 0,001 м3 азота составляет 0,00125 кг. Вычислить молекулярную массу газа, исходя: а) из его плотности относительно азота; б) из мольного объема.
Решение:
Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы:
где m1/m2 — относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи:
Мольная масса азота равна 28г/моль. Тогда
б) 1 моль любого газа при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) занимает объём равный 22,4 л. Зная массу и объём газа при нормальных условиях рассчитаем мольную массу его, составив пропорцию:
Ответ: М(Газа) = 34 г/моль.
Задача 86.
Из скольких атомов состоят в парах молекулы ртути, если плотность паров ртути по воздуху равна 6,92?
Решение:
Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы:
где m1/m2 — относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи:
Мольная масса воздуха равна 29г/моль. Тогда
M1 = D . M2 = 6,92 . 29 = 200,6 г/моль.
Зная, что Ar(Hg) = 200,6 г/моль, находим количество атомов (n), из которых состоит молекула ртути:
Таким образом, молекула ртути состоит из одного атома.
Ответ: из одного.
Задача 87.
При некоторой температуре плотность паров серы по азоту равна 9,14. Из скольких атомов состоит молекула серы при этой температуре?
Решение:
Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы:
где m1/m2 — относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи:
Мольная масса азота равна 28г/моль. Тогда мольная масса паров серы равно:
M1 = D . M2 = 9,14 . 2 = 255,92 г/моль.
Зная, что Ar(S) = 32г/моль, находим количество атомов (n), из которых состоит молекула серы:
Таким образом, молекула серы состоит из одного атома.
Ответ: из восьми.
Задача 88.
Вычислить мольную массу ацетона, если масса 500 мл его паров при 87°С и давлении 96 кПа (720мм рт. ст.) равна 0,93г
Решение:
Выразив данные задачи в системе единиц СИ (Р = 9,6 . 104 Па; V = 5 . 10–4 м3; m = 0,93 . 10-3 кг; Т = 360 К) и подставив их в уравнение Клапейрона- Менделеева (уравнение состояния идеального газа), находим мольную массу газа:
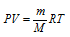
Здесь R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К); Т – температура газа, К; Р – давление газа, Па; V – объём газа, м3; М – мольная масса газа, г/моль.
Отсюда
Ответ: 58 г/моль.
Задача 89.
При 17 °С и давлении 104 кПа (780мм рт. ст.) масса 624 мл газа равна 1,56 г. Вычислить молекулярную массу газа.
Решение:
Выразив данные задачи в системе единиц СИ (Р = 10,4 • 104 Па; V = 6,24 • 10-4 м3; m = 1,56 • 10-3 кг; Т = 290 К) и подставив их в уравнение Клапейрона- Менделеева (уравнение состояния идеального газа), находим мольную массу газа:
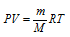
Здесь R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К); Т – температура газа, К; Р – давление газа, Па; V – объём газа, м3; М – мольная масса газа, г/моль.
Отсюда
Ответ: 58 г/моль.
В равных объемах
различных газов при одинаковых условиях
(температуре и давлении) содержится
одинаковое число молекул (атомов).
Следствия из
закона Авогадро.
1. При одинаковых
условиях 1 моль любого газа занимает
одинаковый объем.
При н.у.
один моль любого газа занимает объем,
равный 22,4 литра. Этот объем называется
молярным объемомгаза (Vm
= 22,4 л/моль)
Молярный объем
можно вычислить, если известна масса 1
л газа. При н.у., т.е. Т0=273 К и давлении
Р0=101325 Па, 1 л водорода имеет массу
0,09 г, молярная масса его равна 1,008∙2=2,016
г/моль.
Тогда объем,
занимаемый 1 моль водорода равен:
Молярный объем
(Vm) –
это отношение объема газообразного
вещества к количеству этого вещества:
V–
объем вещества , л
ν – количество
газообразного вещества, моль.
Vm= 22,4 л/моль
2. Отношение масс
равных объемов различных газов при
одинаковых условиях равно отношению
их молярных масс.
где m1,m2– массы первого
и второго газов,
М1, М2– молярные массы первого и второго
газов.
Отношение m1/m2– называетсяотносительной плотностьюи обозначается D.
Тогда:
,
а М1 = DМ2
относительную
плотность газа обычно вычисляют по
отношению к водороду или воздуху.
,
М1=2D
,
М1=29D
Задача. Какой
объем займет при нормальных условиях
оксид углерода (IV)
массой 22 г?
Дано: m(CO2)
=22г.
Найти: V(СО2).
Решение:
1.Определяем количество вещества оксида
углерода (IV):
,
2. Находим объем
СО2:
V=νVm,
V( CO2)=0,5
моль∙22,4 л/моль =11,2 л
Ответ: V(CO2)
= 11,2 л.
Задача. Определите
плотности иодоводорода по водороду и
по воздуху.
Дано: М(НI)=127,9
г/моль
М(Н2)=2
г/моль
М(возд)=29 г/моль
Найти:
Решение: определяем
относительную плотность (HI)
иодоводорода по водороду:
Находим
относительную плотность иодоводорода
по воздуху:
Ответ:
Уравнение Менделеева
– Клапейрона широко используется для
определения молярной массы не только
газов, но и всех веществ, переходящих
при нагревании (без разложения) в
газообразное состояние.
Молярные массы,
определенные этими способами не вполне
точны, потому что рассмотренные газовые
законы и уравнение Менделеева –
Клапейрона строго справедливы лишь при
очень малых давлениях и высоких
температурах.
Определение молярной массы газа.
Для определения
относительной молекулярной массы
газообразного вещества М(r)(безразмерная величина) находят численно
равную ей молярную массу М (выражается
в СИ в кг/моль или г/моль). Экспериментальное
определение молярной массы газообразного
или парообразного вещества основано
на применении закона Авогадро и следствий
из него.
1. Определение молярной массы газа по относительной плотности к другому газу.
где D– относительная плотность;
М1, М2– молярные массы газов.
Тогда
М1
= DМ2
Если второй газ
водород, М(Н2) = 2 г/моль, то формула
для расчета молярных масс принимает
вид (М(н2)=2,0158 г/моль):
М = 2D(н2)
Если второй газ
воздух (М(возд)=29 г/моль), то уравнение
для расчета молярных масс:
М
= 29Dвозд
2. Определение
молярной массы газа по молярному объёму
газа.
или
P0,V0,T0– давление, объём и температура
газа при н.
у.
P,V,T- давление,
объём и температура газа при заданных
условиях.
Зная массу
(m) газа и его объём (V0)
рассчитывают массу 22,4 л, газа равную
молярной массе.
m–V0
M– 22,4
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #