Молярную
массу растворенного нелетучего
вещества-неэлектролита находят путем
измерения повышения температуры
кипения растворителя либо понижения
температуры его замерзания, когда он
содержит растворенное вещество.
Из p-T
диаграммы чистого растворителя и
раствора (рис. 225) следует, что давление
насыщенного пара растворителя,
содержащего растворенное вещество
(кривая КЛ), всегда меньше (закон Рауля),
чем давление насыщенного пара чистого
растворителя (кривая TT-В),
что и вызывает уменьшение температуры
замерзания растворителя, когда он
содержит растворенное вещество
(ΔТпл).
Наоборот, температура кипения раствора
Ткип выше,
чем чистого растворителя для одного и
того же внешнего давления.

Рис.
225. Диаграммы р — Т чистого растворителя
и раствора (ДТТ
— кривая
плавления чистого растворителя; ПК —
кривая плавления растворителя,
содержащего растворенное вещество;
ТТ
— тройная точка; ТТ
— В — кривая испарения чистого растворителя;
Тпл
и Ткип
соответственно
температуры плавления и кипения
растворителя, содержащего растворенное
вещество; КЛ — кривая испарения растворителя
из раствора)
В
этой диаграмме Т0кип
— температура кипения, а Т0пл
— температура плавления чистого
растворителя (см рис. 87).
Рауль
Франсуа Мари (1830- 1901) — французский
физикохимик, изучал химию растворов,
ввел в 1885 г. термин «криоскопия».
Ясно,
что чем больше вещества находится в
растворе, тем ниже будет располагаться
кривая КЛ по сравнению с кривой испарения
чистого растворителя ТТ
— В и тем больше будут
значения ΔТпл
= Т0пл
— Тпл
и ΔТкип
= Т0кип
— Ткип
Для
очень разбавленных растворов, мало
отличающихся по свойствам от идеальных,
зависимость ΔТпл
от концентрации растворенного вещества
cm
определяется уравнением
ΔТпл
= MpRT2cm(B)/(1000AH°)
= KTcm(B),
(9.12)
где
ΔТпл
— понижение температуры замерзания
растворителя; Mp
– молярная масса растворителя; R
— универсальная газовая постоянная,
равная 8,314 Дж/(моль К);
Т =
Т0пл
— температура плавления чистого
растворителя.
KTcm(B)-
моляльность растворенного вещества В,
моль/кг (см. разд. 9.1); ΔH°
— изменение энтальпии при плавлении
кристаллов чистого растворителя
кДж/моль; Кт
— криоскопическая постоянная, кг •
К/моль.
Криоскопическая
постоянная
КT
= МрRT2/(1000ΔH°)
(9.13)
характеризует
только растворитель и не зависит от
природы растворенного вещества.
Если
навеска вещества В, растворенного в
1000 г растворителя, равна mB
г, а молярная масса вещества В — МB
г/моль, то
cm(В)
= mB/МB,
(9.14)
и тогда
ΔТпл
= КTmB/МB.
(9.15)
Отсюда
следует, что, измерив значение ΔТпл
для разбавленного раствора вещества
В в выбранном растворителе с известным
значением КT,
можно вычислить и значение молярной
массы МB
вещества В.
Метод
определения молярной массы растворенного
нелетучего вещества-неэлектролита по
понижению температуры замерзания
растворителя называют криоскопическим.
Криоскопическим
методом можно определить значение МB
только в том случае,
если молекулы растворенного вещества
не диссоциируют в данном растворителе
и не подвергаются ассоциации в растворе,
а концентрация вещества достаточно
мала.
В
основном этот метод применяют для
определения значения МB
органических веществ и ковалентных
неорганических соединений.
Если
при понижении температуры выпадают
одновременно кристаллы чистого
растворителя и растворенного вещества,
то получить достоверные данные о молярной
массе этого вещества нельзя даже для
сильно разбавленного раствора. В табл.
31 приведены значения КT
для наиболее часто используемых
растворителей.
Таблица
31.Криоскопические
постоянные некоторых растворителей
|
Растворитель |
Состав |
Т0пл |
Кт |
|
|
расчет |
эксперимент |
|||
|
Бензол |
С6Н6 |
5,53 |
5.069 |
5,065 |
|
Борнеол |
C10H17OH |
204-208 |
— |
35,8 |
|
Вода |
H2O |
0,000 |
1,859 |
1,853 |
|
1,2-Дибромэтан |
С2Н4Вr2 |
9,98 |
12,2 |
12,5 |
|
1,4-Диоксан |
C4Н4O2 |
13,0 |
4,71 |
4,63 |
|
Дифенил |
С12Н10 |
70,2 |
8,2 |
8,0 |
|
Инден |
C9H8 |
-1,76 |
7,35 |
7,28 |
|
Камфора |
С10Н16O |
178-179 |
37,7 |
40,0 |
|
н-Ксилол |
С6Н4(СН3)2 |
16,0 |
4,2 |
4,3 |
|
Нафталин |
C10H8 |
80,3 |
6,98 |
6,899 |
|
трет-Бутанол |
(СНз)зСОН |
25,5 |
8,44 |
12,8 |
|
Уксусная кислота |
СН3СООН |
16,75 |
3,57 |
3,9 |
|
Фенол |
С6Н5ОН |
43,0 |
7,81 |
7,27 |
|
Этилацетанилид |
CH3CONH(C2H5) |
53,0 |
8,7 |
8,58 |
|
Циклогексанол |
С6Н11ОН |
22,45 |
39,6 |
38,28 |
Перед
проведением опыта значение KT
целесообразно проверить на каком-либо
известном чистом веществе, так как
далеко не всегда можно поручиться за
чистоту имеющегося растворителя.
Значения
ΔТпл
определяют в приборе
Бекмана (рис. 226, а). Он
состоит из широкого стакана 5 с охлаждающей
смесью (см. разд. 6.11), перемешиваемой
вручную мешалкой 8. Температура охлаждающей
смеси должна быть на 3 — 5 °С ниже температуры
плавления чистого растворителя. Для
контроля температуры в стакане 5 в него
погружают обычный термометр 4. Уровень
жидкой охлаждающей смеси должен быть
выше уровня раствора в пробирке 7, которую
размещают в более широкой пустой пробирке
6 так, чтобы расстояние между их стенками
было 3-5 мм. Внутренняя пробирка 7, в
которой собственно и происходит
определение температуры замерзания
растворителя, окружена слоем воздуха.
Это обеспечивает медленный и равномерный
ход понижения температуры исследуемого
раствора.
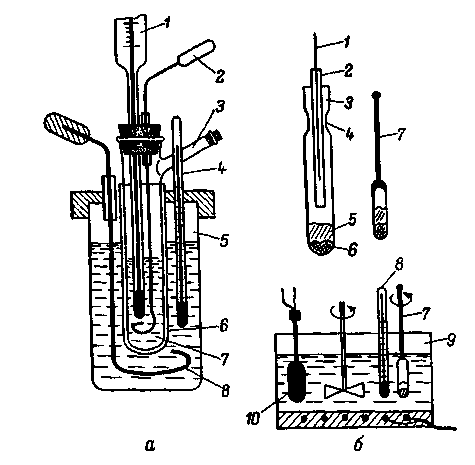
Рис. 226. Приборы для
определения молярной массы вещества:
Бекмана (а), Раста (б)
Термометр
Бекмана 1 устанавливают перед проведением
опыта на нужную температуру (см. рис.
89). Во внутреннюю пробирку 7 собранного
прибора через трубку 3 вливают определенную
массу растворителя, выжидают некоторое
время для установления равномерной
скорости охлаждения. Когда растворитель
переохладится на 0,2 — 0,3 °С ниже температуры
плавления, вызывают его кристаллизацию,
перемешивая вручную мешалкой 2 (один
ход вверх или вниз за секунду).
После
начала выпадения кристаллов растворитель
нагревается до температуры плавления,
что видно по подъему столбика ртути в
капилляре термометра Бекмана. За
температуру замерзания растворителя
принимают температуру, установившуюся
после достижения равновесия между
растворителем и его кристаллами.
На
графике температура — время температуре
плавления Тпл должна
отвечать горизонтальная площадка (см.
разд. 7.8). Температуру измеряют с точностью
до 0,001 °С. Вынув после этой операции
пробирку 7, нагревают растворитель на
1 — 2 °С выше температуры плавления и
снова помещают ее в прибор Бекмана для
повторного измерения Тпл.
Температура плавления растворителя в
последних опытах не должна различаться
более чем на 0,002 — 0,003 °С.
Для
определения температуры плавления
растворителя в присутствии растворенного
вещества В поступают следующим образом.
В высушенную пробирку 7 наливают
взвешенное с точностью до 0,01 г количество
растворителя (около 15 — 20 г) и вносят
точную навеску 0,1 — 0,2 г вещества, молярную
массу МB
которого определяют.
Навеску
вносят в форме мелкого порошка в узкой
пробирке, проходящей через боковой
тубус 3 пробирки 7 так, чтобы порошок
можно было высыпать прямо в жидкость,
а не на стенки тубуса. Пробирку с порошком
взвешивают до и после внесения в прибор.
Размешиванием
вручную мешалкой 2 добиваются полного
растворения навески, а затем поступают,
как и с чистым растворителем. Пробирку
7 переохлаждают на 0,2 — 0,5 °С, а затем
мешалкой 2 вызывают выделение кристаллов
растворителя. Размешивание раствора
мешалкой 2 должно быть достаточным лишь
для поддержания равномерного хода
температуры.
При определении
температуры надо слегка постукивать
пальцем по термометру, чтобы предупредить
задержку перемещения ртути в капилляре.
Температура
после начала кристаллизации быстро
поднимается, но не остается постоянной,
и вскоре начинает постепенно падать
в связи с тем, что раствор по мере
вымораживания растворителя концентрируется.
Отмечать при этом надо самое высокое
значение Тпл.
Разница между температурами плавления
чистого растворителя Т0пл
и раствора Тпл
и есть понижение температуры замерзания
растворителя ΔТпл,
необходимое для расчета значения МB
по уравнению (9.15). Определение значения
Тпл
для раствора проводят несколько раз с
одним и тем же раствором, вынимая в
каждой операции пробирку для плавления
кристаллов растворителя. Затем измеряют
Тпл
при различных концентрациях, получаемых
путем добавления вещества к исследуемому
раствору.
Криоскопический
метод является одним из наиболее
удобных способов определения молярной
массы вещества.
Точность
метода составляет в среднем 3%. Для
уменьшения погрешности из-за отклонения
растворов от идеального состояния
используют очень разбавленные растворы
вещества В в pacтворителях,
имеющих большое значение криоскопической
постоянной (камфора, циклогексанол)
(см. табл. 31).
Вместо
способа Бекмана можно также использовать
капиллярный метод определения значения
Тпл
(см. разд. 7.8).
Применяют
для той же цели и метод
Раста, основанный на
высокой растворимости некоторых
органических соединений в камфоре и
большом значении KT,
позволяющих определять значение МB
для малых количеств вещества (менее 1
мг).
Криоскопическая
постоянная камфоры остается неизменной
только в том случае, если концентрация
растворенного в ней вещества будет
не меньше 0,2 моль/л. У более разбавленных
растворов значение KT
выше.
В
методе Раста тонкостенную капиллярную
трубку 3 (рис. 226, б, изображение увеличено)
длиной около 40 мм с внутренним диаметром
2 — 3 мм запаивают с одной стороны, чтобы
на дне капилляра не образовалось толстой
капли стекла. Капилляр. взвешивают на
микровесах (см. разд. 3.5), после чего в
него вводят исследуемое вещество при
помощи открытого с двух сторон более
узкого капилляра 2. Для этого его погружают
в вещество и затем тщательно обтирают
снаружи от прилипших частичек и
осторожно вдвигают в запаянный капилляр
3. При помощи стеклянной нити 1 выталкивают
вещество 6 на дно этого капилляра. Если
нужно, операцию повторяют до тех пор,
пока в капилляре не будет 0,2 — 1,0 мг
вещества. После взвешивания таким же
образом вносят около 2 — 10 мг чистой
камфоры 5, стараясь капилляром 2 с камфорой
не коснуться уже внесенного вещества
6. Снова взвешивают заполненный капилляр
и заплавляют его в месте перетяжки 4,
вытягивая сплавленный конец в тонкую
нить 7 длиной 40-50 мм.
Заплавленный
капилляр 3 с веществом 6 и камфорой 5
погружают в баню 9 с силиконовым маслом
(см. разд. 6.1), нагретым до 180 °С. Затем
вращают нить 7 пальцами до полного
расплавления смеси. После этого капилляр
охлаждают, вынув его на некоторое
время из бани, и снова погружают в нее,
регулируя нагрев бани со скоростью не
более 1 град/мин при помощи термометра
8 и терморегулятора 10.
В
расплавленном состоянии чистая камфора
и ее смесь с исследуемым веществом
представляют собой бесцветные жидкости,
быстро мутнеющие при застывании. Вблизи
температуры плавления масса в капилляре
становится полупрозрачной, приобретает
вид тающего льда или мутной жидкости,
в которой через лупу можно рассмотреть
тонкий кристаллический скелет. При
дальнейшем нагревании этот скелет
постепенно исчезает. Момент расплавления
последних фрагментов кристаллического
скелета отмечают как температуру
плавления смеси.
Температуру
плавления чистой камфоры определяют
точно таким же образом. Значение МB
вычисляют по формуле (9.15).
Если
камфора плохо растворяет исследуемое
вещество или с ним взаимодействует,
то применяют другой растворитель,
например циклогексанол или борнеол
(см. табл. 31), имеющий также высокое
значение KT
.
Метод
Раста позволяет работать с более грубыми
термометрами и менее тщательно
регулировать температуру.
Определение
Тпл
камфоры и ее смеси с веществом возможно
и с применением вместо жидкостной бани
металлического блока (см. рис. 146).
Существует
еще один метод определения молярной
массы вещества, основанный на измерении
температур кипения чистого растворителя
и раствора исследуемого вещества в
этом растворителе. Метод носит название
эбулиоскопического
(от лат. ebullire
— вскипать). Вычисления проводят, используя
соотношение
ΔТкип
= ЭТ
cm(В)
/ МB,
(9.16)
те Эт
— эбулиоскопическая постоянная, г •
К/моль; cm(В)
— моляльность растворенного вещества
В; ΔТкип
= Ткип
— Т0кип
, Т0кип
— температура кипения чистого
растворителя, Ткип
— температура кипения раствора.
В табл. 32 приведены
значения Эт для наиболее часто
используемых растворителей.
Значения
температуры кипения жидкостей
определяют в приборах, рассмотренных
в разд. 8.7. Для измерения температур
кипения используют также эбулиометр
Бекмана (рис. 227).
Отросток 6 прибора служит для внесения
навесок растворителя. Скошенный конец
пальчикового холодильника 3 должен
касаться стенки этого отростка, иначе
капли конденсата, падающие на термометр,
будут вызывать колебания температуры.
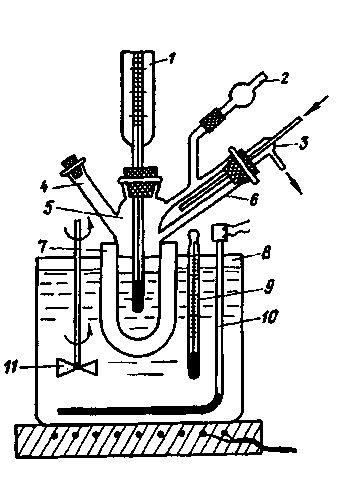
Рис. 277. Эбулиометр
Бекмана
Таблица
32. Эбулиоскопическая
постоянная некоторых растворителей
(давление 1 атм — 101325 Па)
|
Растворитель |
Состав |
Ткип |
ЭТ |
|
|
расчет |
эксперимент |
|||
|
Анилин |
C6H5NH2 |
184,4 |
3,65 |
3,69 |
|
Ацетонитрил |
CH3CN |
81,6 |
1,4 |
1,3 |
|
Бензол |
C6N6 |
80,1 |
2,62 |
2,625 |
|
Вода |
H2O |
100,00 |
0,513 |
0,521 |
|
1,4-Диоксан |
C4H8O2 |
101,75 |
3,22 |
3,20 |
|
Метанол |
СН3ОН |
64,5 |
0,86 |
0,88 |
|
Нитрометан |
CH3N02 |
101,2 |
2,42 |
1,95 |
|
н-Пентанол |
C5H11OH |
138,0 |
2,60 |
2,58 |
|
Пиридин |
C5H5N |
115,3 |
2,888 |
2,687 |
|
н-Пропанол |
С3Н7ОН |
97,2 |
1,68 |
1,73 |
|
Тетралин |
C10H12 |
207,57 |
5,78 |
5,58 |
|
Толуол |
С6Н5СН3 |
110,6 |
— |
3,33 |
|
Трихлорэтилен |
С2НС13 |
87,0 |
4,51 |
4,43 |
|
Тетрахлорид |
ССl4 |
76,75 |
5,24 |
5,29 |
|
Уксусная кислота |
СН3СООН |
118,1 |
3,14 |
3,07 |
|
Хлороформ |
СНС13 |
61,2 |
3,760 |
3,802 |
|
Этанол |
С2Н5ОН |
78,39 |
1,208 |
1,04 |
|
Циклогексан |
C6H12 |
80,74 |
2,86 |
2,79 |
При
работе с гигроскопичными растворителями
прибор защищают от влаги воздуха
хлорокальциевой трубкой 2 с натронной
известью.
Сначала
в прибор помещают столько растворителя,
чтобы ртутный резервуар термометра
Бекмана 7 (см. рис. 89) был им полностью
закрыт. Затем, осторожно нагревая в
жидкостной бане 8 (см. разд. 6.1), доводят
растворитель до кипения. Когда ртуть в
термометре 1 перестанет подниматься,
отмечают его показания, пользуясь
лупой, с точностью до 0,001 °С. После
охлаждения сосуда 5 через тубус 4 вносят
навеску порошкообразного вещества
при помощи узкой пробирки. Осторожно
взбалтывают сосуд 5 с термометром 7 и
после растворения вещества сосуд
нагревают в бане и отмечают показания
термометра. Затем вычисляют значение
молярной массы вещества по формуле
(9.16). Баня 8 оборудована термометром 9,
терморегулятором 10 и мешалкой 11.
Температуры
кипения растворителя и раствора
определяют не менее трех-четырех раз,
и в расчетах используют средние
значения.
Для
растворителей с температурой кипения
до 60 — 70 °С на сосуд 5 надевают более
широкий сосуд 7 с воздушным зазором 5-10
мм. При более высоких температурах
кипения растворителя сосуд 5 погружают
непосредственно в баню 8 с регулируемой
температурой (см. разд. 5.9).
Следует
иметь в виду, что в любом приборе,
применяемом для определения значения
молярной массы методом эбулиоскопии,
во время кипения растворителя некоторое
количество вещества находится
на стенках сосудов в виде конденсата,
а следовательно, значение cm(В)
будет несколько завышенным. Поэтому
проводят сравнительные измерения с
веществом известной молярной массы,
раствор которого подчиняется закону
Рауля, и вносят поправку в значение ЭТ.
Иначе говоря, находят «действительное»
значение ЭТ
для данного прибора. В этом случае
отпадает необходимость введения
различных поправок (поправку на
выступающий столбик ртути и др.).
Для
каждого вещества делают по несколько
определений, изменяя каждый раз
концентрацию раствора. При нанесении
значений ΔТкип
на график ΔТкип
— cm(В)
должна получиться, если нет отклонений
от закона Рауля, почти прямая горизонтальная
линия.
Когда
атмосферное давление в течение опыта
меняется, лучше подождать с измерениями
до более благоприятных условий. Поправка
на изменение атмосферного давления
может оказаться больше значения ΔТкип,
и погрешность опыта станет весьма
значительной.
Чистота
растворителя — необходимое условие
правильного определения молярной массы.
Особенно неблагоприятное воздействие
на значение ΔТкип
оказывает примесь воды, почти всегда
присутствующей в органических
растворителях
РЕКОМЕНДУЕМАЯ
ЛИТЕРАТУРА
Лабораторная
техника органической химии./Под. ред.
Б.Кейла. М.: Мир, 1966.
Вильке
К.Т.
Выращивание кристаллов. Пер. с нем. Л.:
Недра, 1977.
Брок
Т.
Мембранная фильтрация. Пер. с англ. М.:
Мир, 1987.
Парр
Н.
Зонная очистка и ее техника. М.:
Металлургиздат, 1963.
Степин
БД. и др.//Получение
и анализ веществ особой чистоты. М.:
Наука, 1978, с. 35.
Хванг
СТ., Каммермейер К.
Мембранные процессы разделения. Пер. с
англ. М.:Химия, 1981.
Управляемая
кристаллизация в трубчатом контейнере.
Под ред. А.Киргинцева. Новосибирск:
Наука, 1978.
Вигдорович
В.Н. Совершенствование
зонной перекристаллизации, М. Металлургия,
1974
Черняк
М. И.
Калибрование стеклянных оболочек. М.:
Энергия, 1973.
Степин
БД., Серебренникова Г.М., Аллахвердов
Г.Р. и др.:
Сб. Массовая кристаллизация.
М.:
ИРЕА. 1975. Вып. 1, с. 190.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Из закона Рауля следует, что:
ΔTкип= 1000•Е• g/M•G,
где Е – эбулиоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
В справочнике находим, что:
Е (воды) = 0,516
Ткип (воды) = 100С
ΔTкип= 100,6 – 100 = 0,6С
10%-ный раствор – это значит, что 10 г. неэлектролита растворили в 90 г. воды.
Подставляем все найденные данные в уравнение:
M = 1000•Е• g/ ΔTкип •G,
М = 1000•0,516•10/0,6•90 = 95,56 г/моль
Следовательно, М(неэлектролита) = 95,56 г/моль
…
Предлагаем ознакомиться с задачами к разделу Коллигативные свойства растворов.
Задача 1. Вычислить, сколько глицерина C3H5(OH)3 нужно растворить в 200 г воды, чтобы раствор замерзал при — 5°С. Криоскопическая постоянная воды 1,86 град.
Показать решение »
Решение.
Молярная масса глицерина: М = (12×3)+(16×3)+(8×1) = 92 г/моль
Воспользуемся II законом Рауля:
ΔTкрист = K·m, где
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Моляльность раствора равна:
m = n/G = g/M·G
ΔTкрист= 1000·K· g/M·G,
где g – масса растворенного вещества,
G – масса растворителя.
Температура кристаллизации Ткрист чистой воды = 0 °С.
Значит понижение температуры кристаллизации
ΔТкрист = 0 – (–5) = 5 °С.
5 = 1000·1,86·g/200·0,92
g = 49,5 г
Таким образом, масса глицерина равна 49,5 г
Задача 2. Из скольких атомов состоит молекула иода в спиртовом растворе, если раствор 6,35 г йода в 100 г этанола кипит при 78,59оС?
Показать решение »
Решение.
Из закона Рауля следует, что:
ΔTкип= 1000·Е· g/M·G,
где Е – эбулиоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
Найдем молярную массу растворенного вещества, используя справочные данные:
Е (этанола) = 1,2
Ткип (этанола) = 78,39ºС
ΔTкип = 78,59 – 78,39 = 0,2ºС
М = 1000·Е· g/G·ΔTкип
М = 1000·1,2·6,35/100·0,2 = 381 г/моль
Атомная масса йода равна 126,9,
N = 381/126,9 = 3
Следовательно, молекула иода состоит из 3 атомов
Задача 3. Сколько граммов глюкозы С6Н12О6 было растворено в 0,5л воды, если температура кипения полученного раствора составила 1020С?
Показать решение »
Решение.
Из закона Рауля следует, что:
ΔTкип= 1000·Е· g/M·G,
где Е – эбулиоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
Найдем молярную массу растворенного вещества, используя справочные данные:
Е (воды) = 0,516
Ткип (воды) = 100ºС
M(глюкоза) = 12·6+1·12+16·6 = 180 г/моль
G (воды) = V·ρ = 500 ·1= 500 г
ΔTкип = 102-100 = 2ºС
g = G·ΔTкип·M/1000·Е
g = 500·2·180/1000·0,516 = 348,8 г.
То есть масса глюкозы равна 348,8 г.
Задача 4. Чему равна температура замерзания раствора AlCl3 с молярной концентрацией эквивалента 0,3 моль/л, если его степень диссоциации равна 60%?
Показать решение »
Решение.
Из закона Рауля для сильных электролитов следует, что:
ΔTкрист = i·1000·К· g/M·G,
где i – изотонический коэффициент,
К – криоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
Используя справочные данные находим:
К (воды) = 1,86
Ткрист (воды) = 0ºС
AlCl3 ↔ Al3+ + 3Cl— n = 4 – всего 4 частицы
i = 1+α(n—1) = 1+0,6(4-1) = 2,8
M(AlCl3) = 27+35,5·3 = 133,5 г/моль
Mэ(AlCl3) = 133,5/3=44,5 г/моль
Сн = m/(Mэ·V), отсюда
m = Сн· Mэ = 0,3·44,5 = 13,35 г
G = 1000-13,35=986,65 г
g = m = 13,35 г
ΔTкрист = 2,8·1000·1,86· 13,35/133,5·986,65 = 0,528
Таким образом, Tкрист = 0-0,528= — 0,528 ºС
Задача 5. В каком количестве воды надо растворить 6,84 г глюкозы С6Н12О6, чтобы давление пара воды, равное при 65оС 250 гПа, снизилось до 248 гПа?
Показать решение »
Решение.
Согласно I закону Рауля
(p0 – p)/p0 = nв-ва/(nв-ва + nр-ля)
nв-ва = mв-ва /Mв-ва
M(глюкоза) = 12·6+1·12+16·6 = 180 г/моль
nв-ва = 6,84/342 = 0,02 моль
Подставляем известные данные в уравнение:
(250 – 248)/248 = 0,02/(0,02+nр-ля), отсюда находим
nр-ля = 2,45 моль
nр-ля = mр-ля /Mр-ля
mр-ля = nр-ля· Mр-ля
Mр-ля = 1·2+16 = 18 г/моль
mр-ля = 2,45·18 = 44,1 г.
Значит, глюкозу надо растворить в 44,1 г. воды.
Задача 6. Найдите относительную молярную массу неэлектролита, если его 10%-ный раствор кипит при 100,60С.
Показать решение »
Решение.
Из закона Рауля следует, что:
ΔTкип= 1000·Е· g/M·G,
где Е – эбулиоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
В справочнике находим, что:
Е (воды) = 0,516
Ткип (воды) = 100ºС
ΔTкип= 100,6 – 100 = 0,60С
10%-ный раствор – это значит, что 10 г. неэлектролита растворили в 90 г. воды.
Подставляем все найденные данные в уравнение:
M = 1000·Е· g/ ΔTкип ·G,
М = 1000·0,516·10/0,6·90 = 95,56 г/моль
Следовательно, М(неэлектролита) = 95,56 г/моль
Задача 7. Сколько воды надо прибавить к 2 л раствора сахара, чтобы понизить его осмотическое давление в 3 раза?
Показать решение »
Решение.
Из уравнения Вант – Гоффа следует:
π = C· R·T,
Поскольку R и T – величины постоянные, то осмотическое давление будет зависеть только от С.
При уменьшении π в з раза, С также уменьшится в 3 раза.
Предположим, что исходная молярная концентрация составляла:
С = n/V = ½ = 0,5 М
После разбавления в 3 раза концентрация составила:
С = 0,5/3 = 0,1667 М
Найдем количество воды, необходимое для получения раствора с концентрацией равной 0,1667, составив уравнение:
С = n/V; 0,1667 = 1/(2+х); х = 4
Таким образом к раствору сахара необходимо прибавить 4 л воды.
Задача 8. Рассчитайте массовую долю хлорида натрия в физиологическом растворе, осмотическое давление которого при 25оС составляет 762,7 кПа (α=1, ρ=1г/см3).
Показать решение »
Решение.
Хлорид натрия является сильным электролитом. Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
π` = i·C·R·T = i·т·R·T / М·V
m = π· V·М/ i·R·T
NaCl ↔ Na+ + Cl— n = 2 – всего 2 частицы
i = 1+α(n—1) = 1+1(2-1) = 2
M(NaCl) = 23+35,5 = 58,5 г/моль
Т = 273+25 = 298 К
m = 762,7· 1·58,5/2·8,31·298= 9 г.
m = V·ρ = 1000·1 = 1000 г.
ω = (mв-ва/mр-ра)·100%
ω = (9/1000)·100 = 0,9 %
Таким образом, массовая доля хлорида натрия в растворе равна 0,9 %
