- Относительная молекулярная масса KMnO4: 158.033945
- Молярная масса KMnO4: 158.033945 г/моль (0.15803 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| K (калий) | 1 | 39.0983 | 39.0983 |
| Mn (марганец) | 1 | 54.938045 | 54.938045 |
| O (кислород) | 4 | 15.9994 | 63.9976 |
| 158.033945 |
Расчёт молярной и относительной молекулярной массы KMnO4
- Mr[KMnO4] = Ar[K] + Ar[Mn] + Ar[O] * 4 = 39.0983 + 54.938045 + 15.9994 * 4 = 158.033945
- Молярная масса (в кг/моль) = Mr[KMnO4] : 1000 = 158.033945 : 1000 = 0.15803 кг/моль
Расчёт массовых долей элементов в KMnO4
- Массовая доля калия (K) = 39.0983 : 158.033945 * 100 = 24.74 %
- Массовая доля марганца (Mn) = 54.938045 : 158.033945 * 100 = 34.763 %
- Массовая доля кислорода (O) = 63.9976 : 158.033945 * 100 = 40.496 %
Калькулятор массы
Random converter
перманганат калия: состав и молярная масса
Химическая формула
Молярная масса KMnO4, перманганат калия 158.033949 г/моль
39,0983+54,938049+15,9994·4
Массовые доли элементов в соединении
| Элемент | Символ | Атомная масса | Число атомов | Массовая доля |
|---|---|---|---|---|
| Kalium | K | 39.0983 | 1 | 24.741% |
| Manganum | Mn | 54.938049 | 1 | 34.764% |
| Oxygenium | O | 15.9994 | 4 | 40.497% |
Использование калькулятора молярной массы
- Химические формулы нужно вводить с учетом регистра
- Индексы вводятся как обычные числа
- Точка на средней линии (знак умножения), применяемая, например, в формулах кристаллогидратов, заменяется обычной точкой.
- Пример: вместо CuSO₄·5H₂O в конвертере для удобства ввода используется написание CuSO4.5H2O.
Калькулятор молярной массы
Моль
Молярная масса
Молярная масса элементов и соединений
Молекулярная масса
Расчет молярной массы
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль
Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса
Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Использование конвертера «Вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube
Перманганат калия
Сколько грамм перманганата калия (KMnO4) потребуется для приготовления 5 литров 0,1 нормального раствора перманганата калия (KMnO4), если он предназначен для реакции восстановления до Mn+2?
Решение задачи
Напомню, что под нормальной концентрацией понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N».
Рассчитаем молярную массу перманганата калия (KMnO4):
M (KMnO4) = 39 + 55 + 4 ∙ 16 = 158 (г/моль).
Рассчитаем молярную массу эквивалента перманганата калия (KMnO4) по формуле:
Фактор эквивалентности (fэкв) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Учитывая, что по условию задачи перманганат калия (KMnO4) восстанавливается до Mn+2:
следовательно, fэкв = 1/5, рассчитаем молярную массу эквивалента перманганата калия (KMnO4):
MЭ (KMnO4) = 158 ∙ 1/5 = 31,6 (г/моль).
Из формулы нахождения нормальной концентрации раствора, выразим массу:
Получаем:
m (KMnO4) = 0,1 ∙ 31,6 ∙ 5 = 15,8 (г).
Ответ:
масса перманганата калия (KMnO4) равна 15,8 грамм.
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
| Перманганат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Перманганат калия |
| Традиционные названия | Марганцовокислый калий, марганцовка |
| Хим. формула | KMnO4 |
| Состояние | твердое (хрупкие кристаллы) |
| Молярная масса | 158,034 г/моль |
| Плотность | 2,703 г/см³ |
| Т. разл. | 240 °C |
| Мол. теплоёмк. | 119,2 Дж/(моль·К) |
| Энтальпия образования | -813,4 кДж/моль |
| Растворимость в воде | 6,38 (20 °C) |
| Рег. номер CAS | ГОСТ 5777-84 ГОСТ 20490-75 |
| Рег. номер CAS | 7722-64-7 |
| PubChem | 516875 |
| Рег. номер EINECS | 231-760-3 |
| SMILES |
[O-] [Mn](=O)(=O)=O.[K+] |
| InChI |
1S/K.Mn.4O/q+1;;;;;-1 VZJVWSHVAAUDKD-UHFFFAOYSA-N |
| Рег. номер EC | 231-760-3 |
| RTECS | SD6475000 |
| Номер ООН | 1490 |
| ChemSpider | 22810 |
| Токсичность | низкая |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Кристаллы перманганата калия под микроскопом
Перманганат калия (лат. Kalii permanganas, распространённое название в быту — марганцовка) — марганцовокислый калий, калиевая соль марганцовой кислоты. Химическая формула — KMnO4. Представляет собой тёмно-фиолетовые, почти чёрные кристаллы, при растворении в воде образующие ярко окрашенный раствор цвета фуксии.
Содержание
- 1 Физические свойства
- 1.1 Термодинамические свойства
- 2 Химические свойства
- 3 Применение
- 3.1 Медицинское применение
- 3.1.1 Фармакологическое действие
- 3.1.2 Показания
- 3.1.3 Противопоказания
- 3.1.4 Способ применения и дозы
- 3.2 Предосторожности
- 3.3 Другие сферы применения
- 3.1 Медицинское применение
- 4 Получение
- 5 Ограничение на покупку
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
|
Температура, °C |
10 |
20 |
25 |
30 |
40 |
50 |
65 |
|---|---|---|---|---|---|---|---|
|
Растворимость, г/100 г воды |
4,22 |
6,36 |
7,63 |
9 |
12,5 |
16,8 |
25 |
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Химические свойства
| Окисленная форма | Восстановленная форма | Среда | E0, В |
|---|---|---|---|
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |
Слева направо (водные растворы): Co(NO3)2 (красный); K2Cr2O7 (оранжевый); K2CrO4 (жёлтый); NiCl2 (бирюзовый); CuSO4 (голубой); KMnO4 (фиолетовый)
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
- в кислой среде:
-
- 2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O
- в нейтральной среде:
-
- 2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH
- в щелочной среде:
-
- 2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O
- Однако надо отметить, что последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
- 2KMnO4 + H2SO4 → K2SO4 + Mn2O7 + H2O
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
- KMnO4 + IF5 → KF + IOF3 + MnO3F
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
- 2KMnO4 →t K2MnO4 + MnO2 + O2
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
- 5KMnO4 →t K2MnO4 + K3MnO4 + 3MnO2 + 3O2
Реагирует с солями двухвалентного марганца, например:
- 2KMnO4 + 3MnSO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4 на MnO2 и KMnO4.
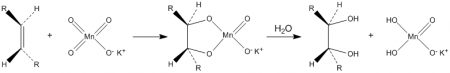
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
- 2KMnO4 + 3H2O2 → 2MnO2 + 3O2 + 2H2O + 2KOH
Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
Медицинское применение
| Другие названия | |
|---|---|
| Лекарственные формы | |
| Классификация | |
| Химическое соединение | |
| Перманганат калия | |
| Kalii permanganas | |
| ИЮПАК | Перманганат калия |
| Брутто-формула | KMnO₄ |
| CAS | 7722-64-7 |
| PubChem | 516875 |
| DrugBank | 13831 |
| Фармакол. группа | Антисептики и дезинфицирующие средства |
| АТХ | D08AX06 |
| порошок для приготовления раствора | |
| KMnO4, Калия перманганат, Марганцовка, Хамелеон минеральный, Марганцевокислый калий, Марганцовокислый калий, Калий марганцевокислый | |
| Перманганат калия |
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при отравлениях морфином, аконитином и некоторыми другими алкалоидами используют разбавленный (0,02—0,1 %) раствор перманганата калия.
Фармакологическое действие
Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счёт этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии).
Показания
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приёмом внутрь алкалоидов (морфин, аконитин, никотин), синильной кислотой, фосфором, хинином; кожи — при попадании на неё анилина; глаз — при поражении их ядовитыми насекомыми.
Противопоказания
Гиперчувствительность.
При передозировке: резкая боль в полости рта, по ходу пищевода, в животе, рвота, диарея; слизистая оболочка полости рта и глотки — отёчная, тёмно-коричневого, фиолетового цвета, возможен отёк гортани, развитие механической асфиксии, ожогового шока, двигательного возбуждения, судорог, явлений паркинсонизма, геморрагического колита, нефропатии, гепатопатии. При пониженной кислотности желудочного сока возможно развитие метгемоглобинемии с выраженным цианозом и одышкой. Смертельная доза для детей — около 3 г, для взрослых — 0,3—0,5 г/кг.
Лечение: метиленовый синий (50 мл 1 % раствора), аскорбиновая кислота (внутривенно — 30 мл 5 % раствора), цианокобаламин — до 1 мг, пиридоксин (внутримышечно — 3 мл 5 % раствора).
Способ применения и дозы
Наружно, в водных растворах для промывания ран (0,1—0,5 %), для полоскания рта и горла (0,01—0,1 %), для смазывания язвенных и ожоговых поверхностей (2—5 %), для спринцевания (0,02—0,1 %) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Предосторожности
Активно взаимодействует при нагреве и даже при комнатной температуре с большинством восстановителей, например, органическими веществами (сахарозой, танинами, глицерином и многими другими), легкоокисляющимися веществами, поэтому при смешивании происходит саморазогревание, что иногда вызывает самовоспламенение смеси (с концентрированным раствором глицерина, или безводным — всегда) и может привести к взрыву.
Очень опасно растирание сухого перманганата калия с органическими веществами и порошками активных металлов и неметаллов (кальцием, алюминием, магнием, фосфором, серой и др.) — весьма вероятен взрыв.
Другие сферы применения
- Применяется для определения перманганатной окисляемости при оценке качества воды согласно ГОСТ 2761-84 по методу Кубеля.
- Щелочной раствор перманганата калия хорошо отмывает лабораторную посуду от жиров и других органических веществ.
- Растворы (концентрации примерно 3 г/л) широко применяются при тонировании фотографий.
- В пиротехнике применяют в качестве сильного окислителя.
- Применяют в качестве катализатора разложения перекиси водорода в космических жидкостно-ракетных двигателях.
- Водный раствор перманганата калия используется для травления дерева, в качестве морилки.
- Водный раствор применяется также для выведения татуировок. Результат достигается посредством химического ожога, при котором отмирают ткани, в которых содержится красящее вещество. Данный метод немногим отличается от простого срезания кожи, обычно он менее эффективен и более неприятен, так как ожоги заживают намного дольше. Татуировка не удаляется полностью, на её месте остаются шрамы.
- Перманганат калия или бихромат натрия используются в качестве окислителя при получении мета- и парафталевых кислот из мета- и параксилолов соответственно (см. Терефталевая кислота).
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
- 2MnO2 + 3Cl2 + 8KOH → 2KMnO4 + 6KCl + 4H2O
- 2K2MnO4 + Cl2 → 2KMnO4 + 2KCl
- 3K2MnO4 + 2H2O → 2KMnO4 + MnO2 + 4KOH
- 2K2MnO4 + 2H2O → 2KMnO4 + H2↑ + 2KOH
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Ограничение на покупку
Входит в IV список прекурсоров ПККН в России (допускается исключение некоторых мер контроля).
14 июня 2013 года на Украине был признан прекурсором и внесён в список наркотических веществ.
Раствор перманганат калия
Раствор марганцовки
|
Соединения калия |
|---|
|
|
Соединения марганца |
|---|
|